一种新的广适性大白菜杂交种纯度分子鉴定方法的研究
魏小春,原玉香,赵艳艳,王志勇,杨双娟,苏贺楠,董晓冰,李 林,姚春玲,张晓伟
(1.河南省农业科学院园艺研究所 郑州 450002; 2.鄢陵县甘罗养生养老有限公司 河南鄢陵 461200)
种子纯度是种子主要的质量指标,纯度降低会导致减产甚至有可能抵消一个新品种的增产潜力[1]。在种子生产和销售过程中,由于不够重视鉴定种子的品种真实性和品种纯度,因此往往会给农业生产造成巨大的经济损失[2]。目前杂交种纯度的鉴定一般是采用田间形态学鉴定法(幼苗形态鉴定)、蛋白质电泳鉴定法和DNA 分子标记鉴定法[1]。田间形态学鉴定法检测需要完成一个营养生长期,所需时间长,生产的杂交种要等到下一个季节或者异地鉴定后才能够得到结果,而且鉴定结果容易受到当地各种环境因素的影响,其准确性难以把握[1]。鉴于形态学方法的弊端,采用一种快捷、准确度高、实用性强的室内检测方法来代替田间形态学鉴定法是必然的。
随着分子生物技术的不断进步,分子标记技术已经成为检测作物杂交种纯度真实且可靠的方法。DNA 分子标记技术不需要考虑组织的特异性,也不受外界环境的影响,鉴定准确、稳定,重复性好,已成为更有前景的方法[3]。钟开勤等[2]利用SRAP(sequence-related amplified polymorphism,相关序列扩增多态性)标记技术,建立福春1 号大白菜的DNA 指纹图谱,分子标记鉴定结果与常规田间形态学鉴定结果吻合,用于大白菜纯度鉴定快速且准确。宋顺华等[4]采用AFLP(amplified fragment length polymorphism,扩增片段长度多态性)技术,从20 对引物组合中筛选出组合E-ACA/M-CTG,能将供试的90 个大白菜品种全部区分开来;同时用该引物组合检测2 个大白菜商品种(北京新2 号,京夏王)的纯度,除1 个单株外,其AFLP 标记是非常一致的。对比田间性状调查结果,认为AFLP 技术对杂交种纯度鉴定的结果可靠。杨晓云等[5]利用SSR(simple sequence repeats,简单序列重复)共显性分子标记P3鉴定青研早9 号、青研桔15 和青研春白一号3 个大白菜杂交种的纯度,与田间性状调查结果对比发现,该标记鉴定的结果可靠。赵新等[6]应用SSR 分子标记及高分辨率溶解曲线技术(high-resolution melting,HRM)筛选出用于大白菜杂交纯度鉴定的复合SSR 位点,复合EST-SSR 标记对秋绿75、津秋78 和秋绿60 等10 份大白菜杂交种进行纯度鉴定,能够很好地进行杂交种纯度鉴定,且通过一次PCR 反应能够同时检测到3 个不同的多态性位点。张庶等[7]利用3 对EST-SSR 引物(BRE28、BRE121 和BRE131)对13 个大白菜品种(夏白1 号、夏白45 等)进行纯度鉴定,其扩增产物都表现出双亲互补带型,而且带型间的大小差异明显,能够很好地区分杂交种和亲本,可以快速、准确地鉴别大白菜杂交种纯度。薛银鸽等[8]利用InDel标记(insertion and deletion,插入/缺失)引物组合BrID90107 和BrID10667 可以将豫新四号与其亲本完全区分开来,可以有效鉴别大白菜杂交种纯度。
自交不亲和性(self-incompatibility)普遍存在于被子植物中,是防止植物近亲繁殖、保持遗传变异的一种重要的遗传机制[9]。芸薹属植物属于典型的孢子体型自交不亲和类型,其在遗传上由一个具有复等位基因的高度多态性的S 位点控制[10-11],每一个S 位点被称为一个S 单元型(S haplotype),根据S 位点基因序列的相似性,可将芸薹属自交不亲和等位基因分为两大类:I 类和II 类[12]。在花粉中,I类S 单元型对II 类S 单元型均表现为显性[13]。I 类S 单元型具有较强的自交不亲和性,而II 类S 单元型的具有一定的自交亲和性。大白菜(Brassica rapassp.pekinensis)是十字花科芸薹属异花授粉作物,充分利用杂种优势主要途径之一是自交不亲和系制种。目前大白菜杂交种主要采用自交不亲和性制种,杂种率达不到100%,且其为异花授粉作物,由于自交不亲和性也受到温度等环境因素影响,时常会出现亲本有极少量自交结实现象,因此对大白杂交种进行纯度鉴定是非常必要的[14]。
对大白菜杂交种纯度鉴定的方法,以往的经验就是将所生产的杂交种,加上2 个亲本,按照一定的数量进行穴盘基质育苗,进行表型观察。而进行分子标记纯度鉴定时,首先需要基于亲本开发相应的分子标记,有基因型依赖。利用大白菜自交不亲和系制种的亲本可以分为3 种情况,2 个亲本分别为I 类和II 类自交不亲和系,同时为I 类自交不亲和系或同时为II 类自交不亲和系。有鉴于此,笔者的研究目标是提供一种广适性的大白菜杂交种纯度鉴定的方法,将PCR 扩增和酶切筛选结合,精确度高、用时短。利用自交不亲和S 等位基因的保守性设计PCR 扩增引物,进行商品杂交种的S 单元型区分;同时,对鉴定结果为同一类型的S 单元型利用不同的限制性内切酶进行区分,进而快速准确进行纯度鉴定,整个周期只需2~3 d,快速精准。
1 材料与方法
1.1 材料
试验于2019 年12 月至2020 年11 月在河南现代农业研究开发基地开展,豫新9 号(母本Y358-10 为I 类S 单元型S9,父本Y177-28 为II 类S 单元型S40)、豫新58(母本Y195-93 为I 类S 单元型S45,父本Y66-9 为I 类S 单元型S46)及优选组合Y663-8×G90E16(母本Y663-8 为II 类S 单元型S60,父本G90E16 为II 类S 单元型S40)为河南省农业科学院园艺研究所叶类蔬菜研究室自育品种,按照株行距50 cm×60 cm 定植到田间,每个材料288 株。27 份大白菜材料由河南省农业科学院园艺研究所叶类蔬菜研究室收集保存,利用穴盘基质育苗方式进行育苗,每个材料96 株。后期试验验证时,将生产的大白菜杂交种利用培养皿进行催芽。用改良后的CTAB 法整株提取萌发种子DNA[15]。
1.2 自交不亲和复等位基因多序列比对
根据NCBI 上自交不亲和基因(S locus)的序列,进行核苷酸水平比对分析。I 类S 单元型 包 括:S61(AB298887.1)、S55(AB298885.1)、S35(AB298877.1)、S32(AB298876.1)、S54(AB219162.1)、S46(AB013718.2)、S12(D38564.2)、S22(AB054061.1)、S8(D38563.1)、S52(AB298883.1)、S38(AB298879.1)、S21(AB270775.1)、S45(AB012106.1)、SRK- f2(AB190354.1)、S53(AB298884.1)、S9(D30049.1)、S47(AB180899.1)。II 类S 单 元 型 包 括:S40(AB211197.1)、S60(AB097116.1) 、 S44 (AB211198.1) 、 S29(AB008191.1)[16]。
1.3 聚合酶链式反应(PCR)
根据I 类和II 类S 单元型序列设计引物I 类S单元型引物,上游引物BrCIF:5’-GATGARTTTATGAATGAGGTGA-3’,下 游 引 物BrCIR:5’-CTGAGCAGGTGTACTKGTTCACCG-3’;II 类S 单元型引物,上游引物BrCIIF:5’-GGAAGGTTAGTTGACGGGCAAG-3’,下游引物BrCIIR:5’-GACGCTCGGTAATATGATAGTC-3’。PCR 反应体系总体 积 为20.0 μ L,含 有PremixTaqTM(ExTaqTMVersion 2.0)10.0 μ L,上 下 游 引 物 各0.5 μ L(10 μmol·L-1),2.0 μL DNA 模板(40 ng·μL-1),7.0 μL的灭菌水,试剂购自Takara 公司。PCR 扩增程序包括:94 ℃变性2 min;35 个循环,每循环94 ℃变性30 s,58 ℃退火30 s,72 ℃延伸2 min;72 ℃延伸5 min;4 ℃保存。利用1.5%琼脂糖凝胶电泳分离(Bioweste Agarose 琼脂糖,北京)PCR 扩增产物。
1.4 限制性内切酶反应
根据PCR 扩增结果,对杂交种的纯合亲本为同一类S 单元型时,分别用限制性内切酶Hinf I(I 类S 单元型)和AluI(II 类S 单元型)进行消化[17-19]。酶切反应体系为20.0 μL,含有10.0 μL 的灭菌水,2.0 μL 的10×内切酶缓冲液,1.0 μL 的HinfI 或AluI酶(10 U)及10.0 μL 的PCR 产物,试剂购自Takara 公司。反应体系于37 ℃条件下消化16 h,3.0%琼脂糖凝胶电泳分离(购自Lonza,美国)。
1.5 大白菜商品杂交种纯度鉴定
通过各类型的鉴定方法进行纯度鉴定,根据所鉴定出的纯合体数量,计算各组合/商品种的杂合体比例,即纯度,计算公式如下:
2 结果与分析
2.1 大白菜S等位基因多样性及酶切位点分析
由图1~2 可知,I 类S 单元型中,Hinf I 为多态性酶切位点;II 类S 单元型中,AluI 为多态性酶切位点。

图1 大白菜I 类S 单元型保守性及酶切位点分析

图1(续)

图2 大白菜II 类S 单元型保守性及酶切位点分析
2.2 杂交种纯度S等位基因分子鉴定结果
以大白菜杂交种基因组DNA 为模板,分别以引物BrCI、BrCII 进行PCR 扩增获得扩增产物;在笔者的试验中,大白菜商品杂交种中的纯合亲本的扩增产物的电泳表现为:以BrCI 引物对扩增有条带,大小为1075 bp 左右;以BrCII 引物扩增有条带,大小为1190 bp 左右。
将其PCR 产物进行电泳,当分别以引物BrCI和BrCII 进行PCR 扩增均有目标条带时,则该大白菜商品杂交种中的纯合材料分别为I 类和II 类S单元型;当以引物BrCI 进行PCR 扩增有目标条带,并且以引物BrCII 进行PCR 扩增无条带时,则该大白菜商品杂交种中的纯合材料同时为I 类S 单元型;当以引物BrCI 进行PCR 扩增无条带,并且以引物BrCII 进行PCR 扩增有目标条带时,则该大白菜商品杂交种中的纯合材料同时为II 类S 单元型。当大白菜商品杂交种中的纯合材料分别为I 类S 单元和II 类S 单元型时,筛选以引物BrCI 和BrCII 分别扩增后产物中具有一个目标条带的材料(图3)。

图3 大白菜商品杂交组合(CI×CII)PCR 扩增情况
当供试大白菜商品杂交种的纯合亲本为I 类S单元型时,用限制性内切酶Hinf I 进行酶切消化获得酶切产物,将其酶切产物进行电泳,筛选酶切产物电泳条带的带型不同的材料为纯合材料(图4)。
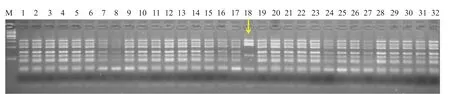
图4 大白菜商品杂交种(CI×CI)PCR 产物酶切后电泳情况
当供试大白菜商品杂交种的亲本为II 类S 单元型时,用限制性内切酶AluI 进行酶切消化获得酶切产物,将其酶切产物进行电泳,筛选酶切产物中电泳条带的带型显著不一致的材料为纯合材料(图5)。
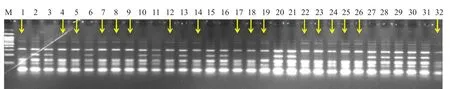
图5 大白菜商品杂交种(CII×CII)PCR 产物酶切后电泳情况
2.3 分子标记检测与田间表型鉴定纯度结果对比
基于上述分析结果,笔者的试验采用自育商品种豫新9 号(母本Y358-10 为I 类S 单元型S9,父本Y177-28 为II 类S 单元型S40),豫新58(母本Y195-93 为I 类S 单元型S45,父本Y66-9 为I 类S单元型S46)及优选组合Y663-8×G90E16(母本Y663-8 为II 类S 单元型S60,父本G90E16 为II 类S 单元型S40)进行验证。
分别将大白菜杂交种材料进行穴盘基质育苗,通过田间植株表型观察,因纯合个体材料相对于杂交种不具有杂种优势,所以植株长势、叶色、叶片数量等形态特征上有明显差异。豫新9 号杂交种植株的田间表型为高桩合抱,母本植株的田间表型为叶面光滑、合抱、高桩直筒形;父本植株的田间表型为叶片亮绿、有毛、合抱、卵圆形。通过对田间288株大白菜植株的抱合类型、叶片光毛等性状进行鉴定,有10 株因长势较弱、叶面少毛、株幅小等特点被鉴定为母本或异花粉杂株,测得纯度为96.53%。通过BrCI 与BrCII 引物分子检测对其开展纯度检测,测得纯度为97.22%。分子标记检测和田间检测吻合度为99.29%。豫新58 杂交种植株的田间表型为矮桩叠抱;母本植株的田间表型为叠抱、矮桩,中熟;父本植株的田间表型为叠抱、矮桩、早熟、叶面无毛。通过对田间288 株大白菜的抱合类型、叶片光毛等性状进行鉴定,有9 株因长势较弱、叶色深绿、株幅小等特点被鉴定为母本或异花粉杂株,测得纯度为96.88%。通过BrCI 与BrCII 引物分子检测对其开展纯度鉴定,测得纯度为97.57%。分子标记检测和田间检测吻合度为99.29%,可用于大白菜杂交种纯度快速检测。优选组合Y663-8×G90E16杂交种植株的田间表型为矮桩叠抱;母本植株的田间表型为叶面有毛、叶色浅、叠抱、矮桩、中熟;父本植株的田间表型为叶面蜡粉无毛、叶色深、叠抱、矮桩、早熟。通过对田间大白菜植株的长势、叶色和株幅等性状进行鉴定,有39 株因长势较弱、叶色浅、株幅小等特点被鉴定为母本或异花粉杂株,测得纯度为86.46%。通过BrCI 与BrCII 引物分子检测对其开展纯度鉴定,测得纯度为87.85%。分子标记检测和田间检测吻合度为98.42%。由此可知,笔者的试验能把商品杂交种中纯合个体与杂合体区分开来,从而验证大白菜商品杂交种的纯度(表1)。

表1 自交不亲和S 单元型标记与田间表型观察鉴定纯度结果对比
2.4 在商品杂交种纯度检测中的应用
对于未知父、母本类型的商品杂交种而言,利用引物BrCI、BrCII 也可以分别对27 种商品种进行纯度鉴定。对其纯合体进行统计,然后计算获得各商品种的中纯合体数量,进而得出各商品种的纯度(表2)。经纯度鉴定可知,中狮菊红心、CR 春美609 及高产状元商品种双亲均为I 类S单元型;商品种火凤凰的亲本为II 类S 单元型;其余商品种纯合材料分别为I 类S 单元和II 类S单元。
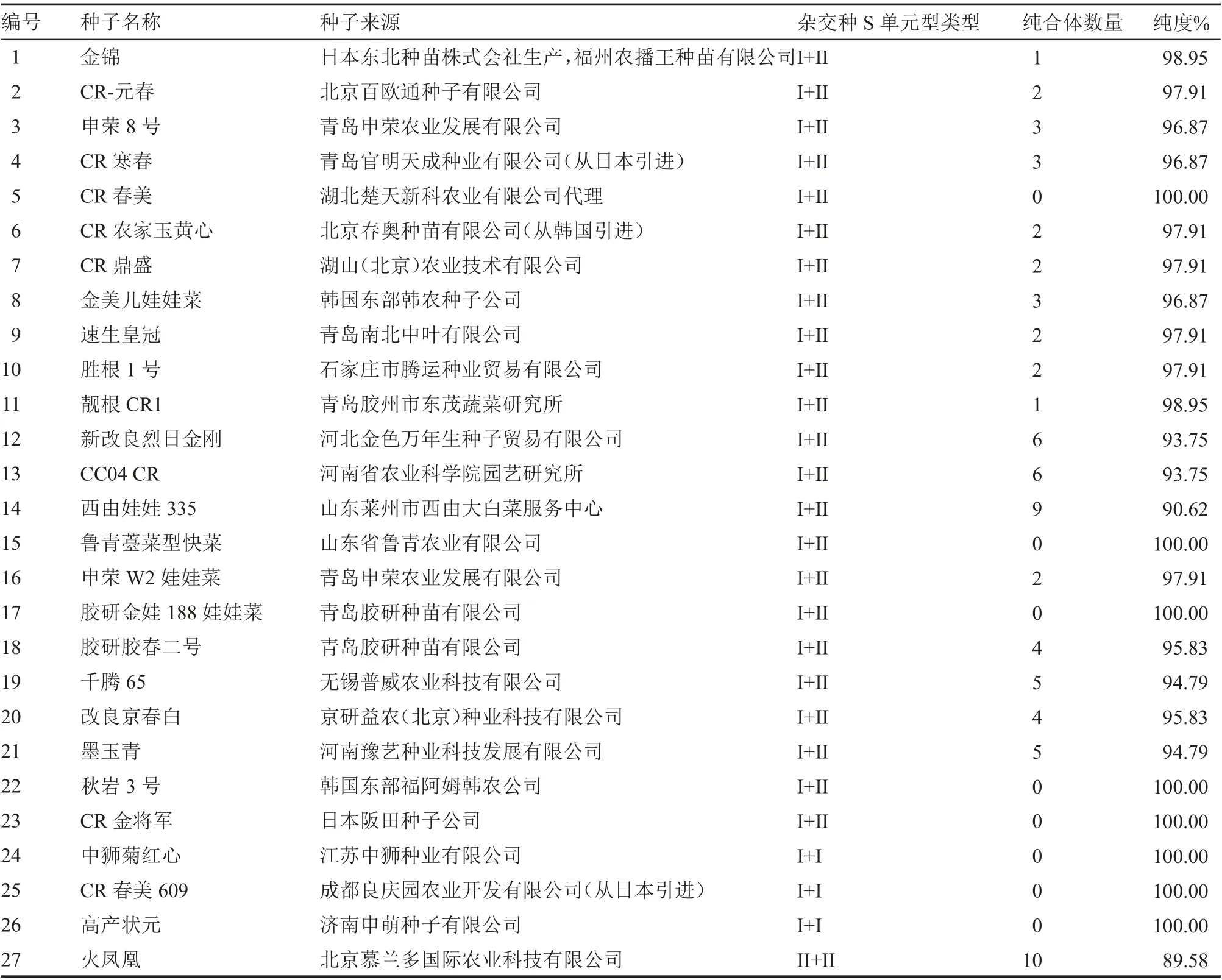
表2 各商品种的纯度鉴定结果表
3 讨论与结论
种子纯度鉴定能够保障种子优良遗传特性被充分利用,是防止良种混杂退化、提高种子质量和产品品质的手段。在生产实践中,能给农业生产带来巨大损失的主观原因往往是不重视种子品种纯度和真实性检验。若大白菜的授粉过程中出现气温过低等情况就可能出现亲本自交亲和的现象,从而导致大白菜商品杂交种的纯度降低,造成一定的经济亏损。
大白菜是十字花科芸薹属自花授粉植物,杂种优势明显,一方面大白菜优良品种大部分是利用自交不亲和系来进行杂交种生产的,而在此过程中杂交种的纯度鉴定是必不可少的,可以明确商品杂交种携带的基因型,从而配制不同的杂交种组合,获得杂交优势品种,这对加速育种进程和杂种优势育种有重要的指导意义;另一方面种子的纯度鉴定可以确保白菜的产量和品种品质,以达到相应的经济效益。
对于种子的纯度鉴定,白菜杂交种纯度鉴定的传统方法是田间形态学鉴定,但是这一方法不仅费时占地,还易受环境的影响,而且鉴定结果准确性低,且承担的经济风险较大。同工酶电泳技术也被用于杂交种鉴定,但该方法的局限性在于未能检测到近缘系的多态性[20]。随着分子生物技术的发展,分子标记技术也被充分应用于大白菜杂交种的纯度鉴定,已经应用AFLP、SRAP、RAPD、SSR 和In-Del 等分子标记鉴定各种白菜品种和亲本的纯度,且认为分子标记的种子检验对杂交种纯度鉴定结果可靠。Zhang 等[21]利用随机在大白菜10 条染色体上均匀分布的36 个SSR 标记,选取其中的1~2个SSR 标记对其大白菜杂交种进行纯度鉴定,并结合田间形态学表现验证了结果的可靠性。DNA 分子标记技术的优点在于它具有共显性、多态性高、信息量高、操作简单、稳定可靠等优点,且不受外界环境的影响,结果稳定。因此,基于DNA 分子标记技术能更加有效地鉴别不同的甚至近亲的基因型,该技术在杂交种纯度鉴定等方面具有广阔前景。
虽然分子标记是鉴定种子纯度简便、快速且精确高的方法,但目前存在一定的局限性,它具有基因依赖性,只能根据现有遗传信息和有限的参考基因组,去针对特定的样品或品种开发分子标记,所以这种方法适用范围较小,不适用于同一作物的广适性的纯度鉴定[22]。对于利用SRAP 技术鉴定大白菜杂交种纯度而言,不同基因型大白菜需要的引物组合不同,严慧玲等[23]筛选出引物组合M4+E3 对进行多抗3-31 等商品种纯度鉴定,其父、母本能够将扩增的稳定谱明显表现出来,且带型具有互补性,能够清楚地鉴别品种纯度;钟开勤等[2]筛选出的引物组合M2+E4 对福田1 号进行纯度鉴定,其结果也能够清楚的鉴别出所测试品种的纯度[1,23]。说明对于不同基因型大白菜亲本,进行杂种一代纯度鉴定时需要不同的引物组合。因此鉴定一个新的品种纯度时,必须重新筛选出与该品种所匹配的引物组合,而这个过程即费时又费力。
笔者利用大白菜自交不亲和性的S 等位基因的保守性设计引物,用于大白菜杂交种纯度的广适性鉴定。由于自交不亲和性是十字花科植物包括大白菜所共有的繁殖特性,且自交不亲和性等位基因具有保守性,相对于其他分子标记来说稳定性较高,使得它不仅适用于白菜品种的纯度鉴定,还能够以其为模型套用在大部分十字花科植物,避免了设计各个品种所特有的引物,大大简化了试验的过程,提高了试验效率,并且S 单元型的类型可以通过测序的方式得以验证,操作简单,结果可靠。笔者通过对自交不亲和性S 复等位基因的保守性设计引物BrCI 和BrCII,根据扩增产物中目标条带的有无,来判定杂交种纯度;当亲本材料同属同类S单元型时,可分别用Hinf I 和AluI 进行酶切,依据酶切结果来判定杂交种纯度。通过自育已知亲本类型商品种的纯度鉴定,结果符合商品杂交种纯合材料出现的3 种情况,并能够有效进行纯度鉴定。另外对27 个未知亲本类型的商品种进行纯度鉴定,结果表明该方法具有广适性。
笔者研究的目的在于提供一种广适性的大白菜杂交种纯度鉴定的方法,将PCR 扩增筛选和酶切筛选结合,精确度高,用时短。利用自交不亲和的S等位基因的保守性设计PCR 扩增引物,进行商品杂交种的S 单元型区分;同时,对鉴定结果为同一类型的S 单元型,利用不同的限制性内切酶进行区分,进而快速准确进行纯度鉴定;整个周期只需要2~3 d,快速精准。

