甘草多糖缓解妊娠期暴露代森锰锌致仔鼠肾脏损伤的保护作用
孙雨昕,温 冉,宫英阑,包佳鹭,张伟伟,赵俊芳,王晓丹,3*
(1.河北农业大学 中兽医学院,河北 保定 071000;2.河北象大合众生物科技有限公司,河北 正定 050800;3.河北省兽医生物技术创新中心,河北 保定 071000)
代森锰锌(mancozeb,MCZ)属于二硫代氨基甲酸乙二醇酯(EBDC)类农药,是一种乙烯-二硫代氨基甲酸锰和锌盐的混合物,因其低毒性、短期环境持久性的特点[1],自1948年以来一直在多种农作物、观赏植物上作为常用的广谱杀菌剂使用[2]。MCZ因其杀菌谱广、作用位点多、无抗药性、能为植物补充微量元素锌的特性,从而提高农作物的免疫力,改善农作物的品质,因此被广泛用于防治蔬菜和果树等作物中真菌引起的多种病害[3]。然而MCZ及其代谢产物乙撑硫脲[4]可以在对人体有致畸、致癌、影响胚胎着床[5]作用,又在土壤中持久存在,在水中迅速分解,具有高危害潜力,引起了外界的关注。
近年来,对在实验动物中产生的MCZ毒性的研究表明,MCZ的EBDC部分导致大鼠肝脏和肾脏中谷胱甘肽状态和必需金属铜稳态改变[6]。有研究发现MCZ对实验动物的毒性与生殖毒性、神经毒性、内分泌干扰[7]以及睡眠障碍[8]等有关,对人类也有一定的致癌性[9]。国内有研究表明,甘草多糖(Glycyrrhizapolysaccharide,GP)对于缓解MCZ毒性的效果较好[10],如诱导细胞生成活性氧(ROS)[11],增强鸡免疫球蛋白IgA和IgG水平[12]、减少肝脏中IL-1β和IFN-γ的升高[13]等提高毒性抵抗力。在MCZ带来的潜在危害中,农业和工业工人是发生MCZ中毒的高风险人群,对一般人群也有一定危害性。为此,本试验初步探索妊娠期暴露MCZ对其子代45日龄仔鼠肾脏损伤及GP对妊娠期暴露MCZ诱导子代小鼠肾脏损伤的影响,为人类及动物的健康成长提供相应的帮助,为中药的治疗作用提供一定的科学依据。
1 材料与方法
1.1 主要试剂MCZ(商品级Dithane-M45,80%)、GP(30%)购自西安圣青生物科技有限公司; EastepTMSuper 总RNA 提取试剂盒(LS1040)购自Promega公司;HiScript®Ⅲ RT SuperMix for qPCR (+gDNA wiper) 南京诺唯赞生物科技股份有限公司(R323-01);TB GreenTMPremix Ex TaqTMⅡ (Tli RNaseH Plus)购自 TaKaRa公司 (RR820A);总蛋白定量、总抗氧化能力(T-AOC)、丙二醛(MDA)、超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)试剂盒均购自南京建成生物工程研究所;谷胱甘肽过氧化酶4(GPX4)、铁死亡抑制蛋白 1 (FSP1)、转化生长因子β1(TGF-β1)试剂盒均购自上海酶联生物科技有限公司。
1.2 实验动物分组及处理方法分别选用50只雌性、10只雄性7周龄SPF级昆明小鼠,购自斯贝福实验动物科技有限公司,常规雌、雄分笼饲养,自由饮水,1周后合笼饲养。发现雌鼠阴栓当日定为孕0 d 并换笼单独饲养。将50只孕鼠随机分为空白对照组(K组)、MCZ对照组(M组)、GP低(D组)、中(Z组)、高(G组)剂量组,每组10只。空白对照组早晚各灌服1次0.1 mL生理盐水;MCZ对照组每天早上灌服150 mg/kg的MCZ,晚上灌服0.1 mL生理盐水;GP低(D组)、中(Z组)、高(G组)剂量组早上灌服150 mg/kg的MCZ、晚上分别灌服50,100,200 mg/kg的GP,所有孕鼠单独喂养,产后与仔鼠同窝喂养,仔鼠21 d时断奶,泌乳期不饲喂母鼠MCZ。本试验动物处理过程通过河北农业大学实验动物伦理委员会的动物伦理学审查。
1.3 指标测定
1.3.1仔鼠体质量及肾脏指数测定 称取45日龄仔鼠体质量,断颈处死后摘取肾脏组织,记录不同组仔鼠肾脏质量。肾脏指数=肾脏质量(g)/体质量(g)×100%。
1.3.2仔鼠肾脏组织形态观察 将仔鼠肾脏置于4%多聚甲醛溶液中固定,常规制备石蜡切片,厚度为5 μm,常规HE染色后于光学显微镜下观察仔鼠肾脏组织形态变化。
1.3.3仔鼠血清中尿素氮(BUN)、肌酐(Cr)含量测定 仔鼠血液3 000 r/min离心,取上清,分装,-20℃ 保存待测。取上清液分别用BUN、Cr试剂盒测定仔鼠血清中BUN和Cr含量。
1.3.4仔鼠肾脏组织匀浆中T-AOC、GSH-Px、SOD、MDA含量测定 取仔鼠肾脏按试剂盒说明书制备10%组织匀浆,提取其上清液,分装,-20℃保存待测。取组织匀浆上清液,按照说明书分别用T-AOC、GSH-Px、SOD、MDA试剂盒测定肾脏组织中T-AOC、GSH-Px、SOD、MDA含量。
1.3.5仔鼠肾脏组织匀浆中GPX4、FSP1、TGF-β1含量测定 取仔鼠肾脏按ELISA试剂盒说明书制备10%组织匀浆,提取其上清液,分装,-20℃保存待测。取10%组织匀浆上清液,按照说明书分别用ELISA试剂盒测定肾脏组织匀浆中GPX4、FSP1、TGF-β1的含量。
1.3.6仔鼠肾脏组织中GPX4、NADPH氧化酶4(NOX4)、核转录因子NF-κB(NF-κB)p65 mRNA转录水平测定 用总RNA提取试剂盒提取仔鼠肾脏中总RNA,再用反转录试剂进行逆转录合成cDNA,-20℃保存。采用实时荧光定量PCR法检测目的基因GPX4、NOX4、NF-κB p65 mRNA表达水平,引物由大连宝生物有限公司设计合成(表1)。反应条件:95℃ 30 s;95℃ 5 s,60℃ 30 s,39个循环。以β-actin为内参,用2-△△Ct表示目的基因的相对表达量。

表1 引物信息
1.4 数据分析应用Excle整合数据,SPSS进行单因素方差分析,Graphpad Prism 9.0绘图,差异比较通过One-Way ANOVA评估,*表示MCZ对照组与空白对照组相比,#代表GP组与MCZ对照组相比,*/#P<0.05表示为差异显著,**/##P<0.01表示为差异极显著。
2 结果
2.1 对45日龄仔鼠肾脏组织形态的影响HE染色结果显示,空白对照组,肾小球大小正常,周围界限清晰,肾小管上皮细胞排列整齐,管腔大小正常;MCZ组肾小囊囊腔变小,周围界限不清晰,肾小管上皮细胞部分脱落,肾小管腔里充有均质红染的不等量蛋白性物质,管腔堵塞;与MCZ组相比,GP组肾小球形状较正常,肾小囊囊腔结构较清晰,管腔大小较正常(图1)。

A.空白对照组;B.MCZ对照组;C.GP低剂量组;D.GP中剂量组;E.GP高剂量组。红色箭头.肾小囊囊腔变小,周围界限不清晰;绿色箭头.肾小管腔里充有均质红染的不等量蛋白性物质;黑色箭头.肾小管上皮细胞部分脱落
2.2 对45日龄仔鼠体质量及肾脏指数的影响如图2所示,在体质量方面,MCZ组与空白对照组相比下降,且差异极显著(P<0.01),用GP与MCZ联合处理后差异不显著;在肾脏指数方面,MCZ组与空白对照组相比上升,且差异显著(P<0.05),用GP与MCZ联合处理后均低于MCZ组,且高剂量组差异极显著(P<0.01)。

图2 GP对妊娠期暴露MCZ的45日龄仔鼠体质量和肾脏指数的影响
2.3 对45日龄仔鼠血清中Cr、BUN的影响如图3所示,在Cr方面,MCZ组与空白对照组相比上升,且差异极显著(P<0.01),用GP与MCZ联合处理后均低于MCZ组,且中、高剂量组差异极显著(P<0.01);在BUN方面,MCZ组与空白对照组相比上升,且差异显著(P<0.05),用GP与MCZ联合处理后均低于MCZ组,且低、中、高剂量组差异均极显著(P<0.01)。
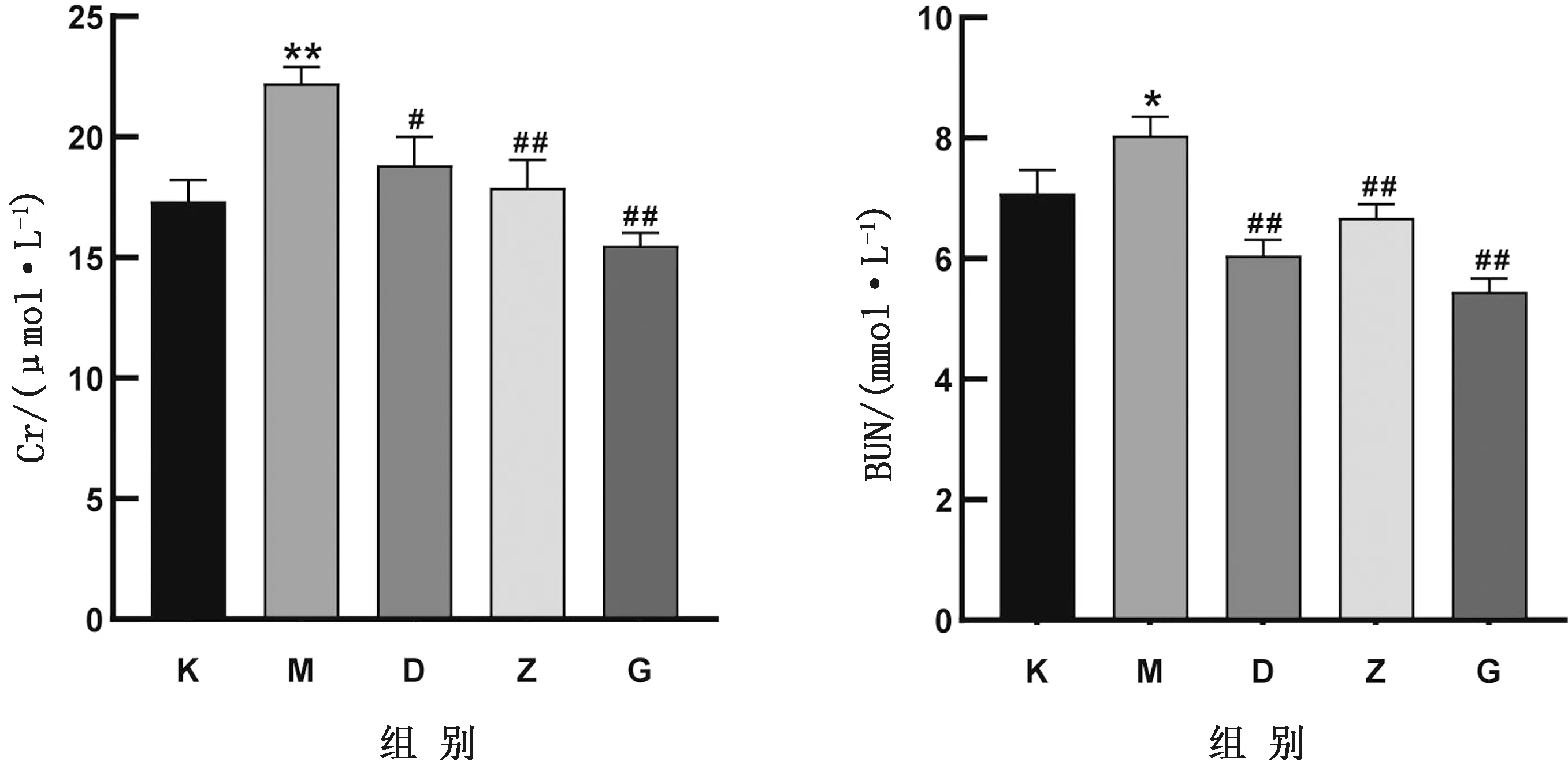
图3 GP对妊娠期暴露MCZ的45日龄仔鼠Cr和BUN的影响
2.4 对45日龄仔鼠肾脏组织中T-AOC、MDA、SOD、GSH-Px水平的影响如图4所示,在T-AOC方面,MCZ组与空白对照组相比下降,且差异显著(P<0.05),用GP与MCZ联合处理后均高于MCZ组,且高剂量组差异极显著(P<0.01);在MDA方面,MCZ组与空白对照组相比上升,且差异极显著(P<0.01),用GP与MCZ联合处理后均低于MCZ组,且中、高剂量组差异极显著(P<0.01);在SOD方面,MCZ组与空白对照组相比差异不显著,用GP与MCZ联合处理后均高于MCZ组,且高剂量组差异极显著(P<0.01);在GSH-Px方面,MCZ组与空白对照组相比差异不显著,用GP与MCZ联合处理后均高于MCZ组,且低剂量组差异显著(P<0.05)。
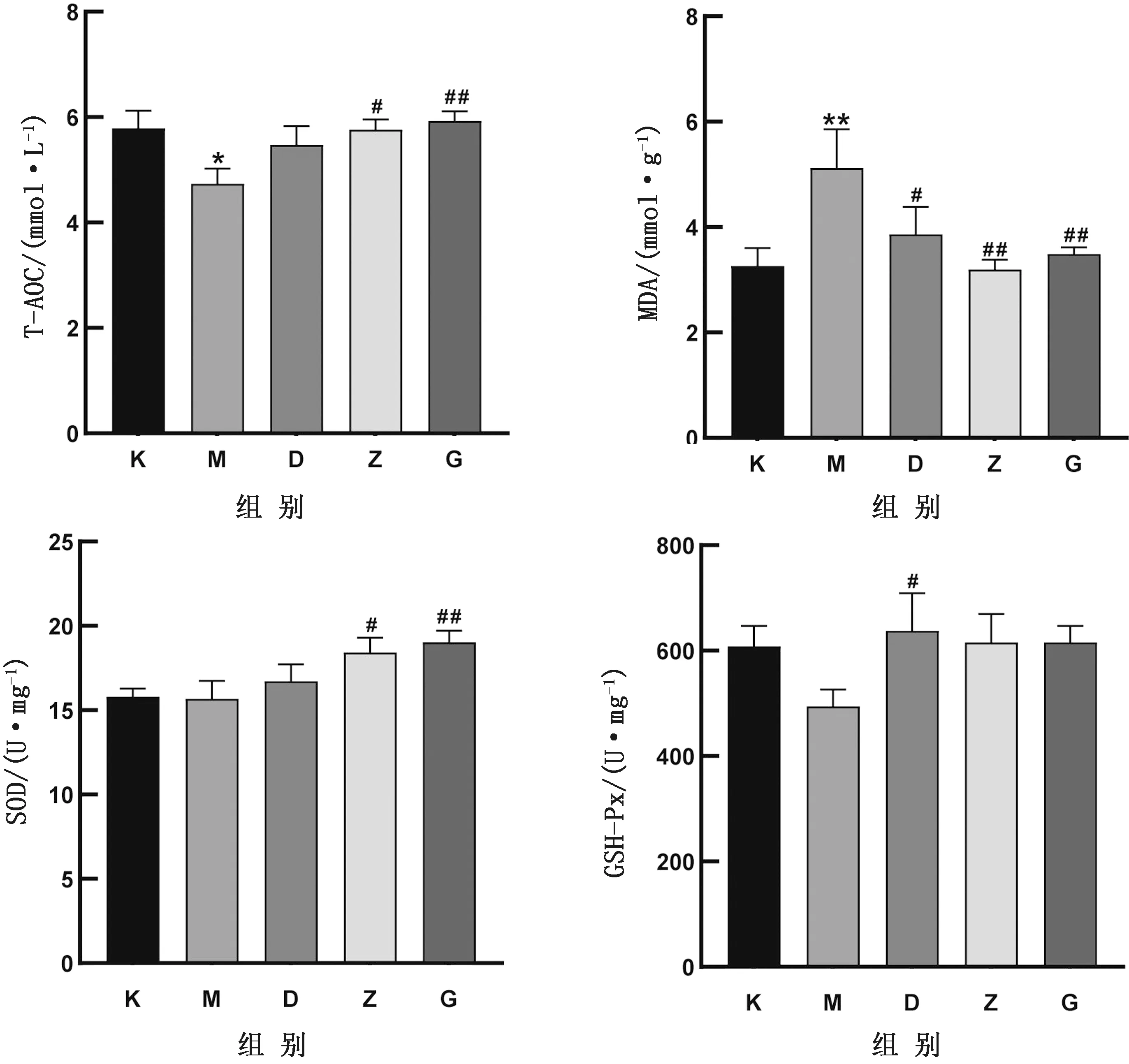
图4 GP对妊娠期暴露MCZ的45日龄仔鼠T-AOC、MDA、SOD、GSH-Px水平的影响
2.5 对45日龄仔鼠肾脏组织中GPX4、FSP1、TGF-β1的影响如图5所示,在GPX4方面,MCZ组与空白对照组相比差异不显著,用GP与MCZ联合处理后均高于MCZ组,且中剂量组差异显著(P<0.05);在FSP1方面,MCZ组与空白对照组相比下降,且差异显著(P<0.05),用GP与MCZ联合处理后均高于MCZ组,且低、中剂量组差异极显著(P<0.01);在TGF-β1方面,MCZ组与空白对照组相比上升,且差异显著(P<0.05),用GP与MCZ联合处理后均低于MCZ组,且高剂量组差异显著(P<0.05)。
2.6 对45日龄仔鼠肾组织中GPX4、NOX4、NF-κB p65 mRNA相对表达量的影响如图6所示,在GPX4 mRNA相对表达量方面,MCZ组与空白对照组相比差异不显著,用GP与MCZ联合处理后均高于MCZ组,且低、高剂量组差异极显著(P<0.01);在NF-κB p65 mRNA相对表达量方面,MCZ组与空白对照组相比差异不显著,用GP与MCZ联合处理后,中剂量组差异显著(P<0.05);在NOX4 mRNA相对表达量方面,MCZ组与空白对照组相比差异显著(P<0.05),用GP与MCZ联合处理后均低于MCZ组,且中剂量组差异极显著(P<0.01),高剂量组差异显著(P<0.05)。
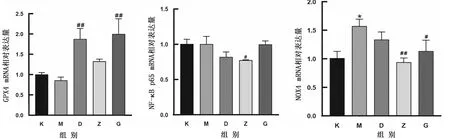
图6 GP对妊娠期暴露MCZ的45日龄仔鼠GPX4、NOX4、NF-κB p65 mRNA相对表达量的影响
3 讨论
MCZ对雌性生殖器官的特异性作用机制尚不完全清楚,但体内试验研究表明,该杀菌剂会损害小鼠胚胎发育和减数分裂纺锤体组装[14],MCZ可能在细胞水平上间接干扰或损害生殖,并应视为生殖毒物,这一点具有高度至中度的可信度[15],除影响本代接触者的健康外,MCZ还能通过血-胎盘和血-乳屏障[16]影响到子代的健康。MCZ带来的生殖毒性在卵巢功能方面表现为通过抑制颗粒细胞活力,减少卵丘扩张,抑制中期板形成,诱导颗粒细胞分泌孕酮,可能抑制排卵过程中的垂体激增过程来实现[7],在子宫方面表现为通过调节子宫内膜上皮细胞的基因表达谱和降低雌激素受体β和整合素β3的表达来减少球体附着[17],调节蜕膜化而影响胚胎着床,并需要进一步研究确切的作用模式[18],在中医理论中肾脏与生殖息息相关。本试验结果表明,GP可以抑制MCZ处理后小鼠体质量的下降和肾指数的上升。
肾脏损伤引起体内的氧化与抗氧化过程失衡造成氧化应激状态,且肾脏对氧化应激高度敏感[19]。血清里的Cr[20]、BUN水平作为高效的肾功能生物标志物,被广泛的用于肾病的诊断与评价。对于母胎,氧化应激过程中产生的脂质过氧化和DNA损伤等可能会造成自然流产[21]等,对体内的胚胎也会产生毒性,造成出生体质量降低、免疫低下等状态[22]。氧化应激状态时一方面刺激机体产生大量的ROS,引起机体的ROS积累,组织脂质过氧化程度升高,MDA水平升高[23],损伤肾脏细胞,产生细胞凋亡、肾脏纤维化、炎症[24]等;另一方面机体清除自由基的能力下降,表现为T-AOC、SOD、GSH-Px活性下降。T-AOC体现机体各种抗氧化物质和抗氧化酶等构成总抗氧化水平;SOD可以及时修复受损细胞[25],将超氧化物自由基转化成过氧化氢和氧分子达到清除自由基的效果[26],所以SOD活性可以间接体现机体清除自由基的能力;谷胱甘肽是一种主要的抗氧化剂,可以直接清除自由基,机体产生的过量的过氧化氢可以被GSH-Px代谢成水分子[27]。本试验结果表明,GP可以抑制MCZ导致的Cr、BUN和 MDA水平的升高,抑制T-AOC、SOD、GSH-Px活性的下降,降低肾脏损伤和脂质过氧化程度。
铁死亡有3种主要调节机制:脂质过氧化、铁离子蓄积和氨基酸代谢紊乱。GPX4和FSP1[28]共同构成铁死亡防御系统[29],ROS等的存在会促进铁死亡的发展。研究表明,GPX4能降解部分脂质过氧化物,从而抑制脂质过氧化过程,如果上调了GPX4的表达会使机体对铁死亡更加不敏感[30]。除此之外,诱导机体铁死亡时会导致体内ROS升高,促进脂质过氧化。本试验结果表明,GP可以抑制MCZ带来的GPX4、FSP1水平的降低,增加机体对铁死亡的耐受性。
TGF-β1参与调节细胞增殖、凋亡、组织纤维化[31]、肿瘤和免疫等过程的双向调节因子,广泛参与体内各种病理生理过程,在肿瘤细胞中,早期抑制细胞增殖从而达到抗肿瘤作用,在晚期诱导细胞凋亡以达到抗肿瘤作用[32],TGF-β1在炎性环境中发挥抗炎作用,而TGF-β1的过度生产则又会导致急性肾小管损伤;NOX4是NADPH氧化酶,其主要在肾脏组织表达,催化氧生成ROS,对ROS含量敏感[33];NF-κB作为核转录因子参与调控多种与炎症、抗凋亡和肿瘤等有关的基因表达。本试验结果表明,GP在仔鼠45日龄时抑制TGF-β1水平,另外,GP还抑制MCZ导致的NOX4、NF-κB mRNA转录水平的升高,从而降低肾脏氧化应激程度。
综上所述,GP通过提高45日龄仔鼠的抗氧化能力和对铁死亡的耐受力而减轻肾脏损伤对机体带来的影响,GP低、中、高剂量均对MCZ诱导的45日龄仔鼠的肾脏损伤有一定的抑制效果,其中以中剂量的GP(100 mg/kg)对45日龄仔鼠肾脏的保护作用最为明显。

