黄瓜茄病镰刀菌拮抗芽孢杆菌的筛选、鉴定及促生效果
杨东亚 祁瑞雪 李昭轩 林薇 马慧 张雪艳
(宁夏大学农学院,银川 750021)
长期以来,我国农业采用粗放生产模式和高投入的水肥管理,造成土壤养分比例失调和生物多样性单一,连作障碍问题日益突出,对我国设施蔬菜可持续发展造成严重威胁[1]。其中由植物病原真菌引起的土传病害是限制生产的主要因素,严重影响蔬菜产量和品质,给农业生产带来了巨大的经济损失[2]。
茄病镰刀菌(Fusarium solani)作为引发黄瓜根腐病的病原菌之一,主要侵染植株根部,导致根部出现水渍状腐烂,失去吸收水分及养分的能力,最终导致植株死亡[3],造成黄瓜产业经济损失严重。刘心刚等[4]研究表明,西藏设施西(黄)瓜根腐病原菌为茄病镰刀菌;而刘洋[5]研究也表明,茄病镰刀菌瓜类专化型(Fusarium solanif. sp.cucurbitae)会引起嫁接的黄瓜根茎腐病。因此,解决由茄病镰刀菌引起的根腐病对黄瓜生产和农业可持续发展至关重要。
目前,化学防治可有效防治土传病害,但其价格高,高毒残留严重影响人类健康和自然环境,并且病害和农药用量不断增加的恶性循环严重破坏生态平衡[6]。使用植物根际促生菌(plant growth promoting rhizobacteria, PGPR)和生物防治剂(biocontrol agents, BCAs)是防控根腐病的一种替代方法,利用有益微生物或微生物分泌的代谢产物,通过直接或间接机制抑制病原体生长,有利于促进作物健康生长[7]。芽孢杆菌属的菌株因其营养需求简单、繁殖生长快、代谢产物丰富、可产抗逆性芽孢等特点而具有显著的生防潜力,成为研发生防菌剂的理想菌株[8]。Kim 等[9]分离得到一株产多肽的解淀粉芽孢杆菌(Bacillus amyloliquefaciens)PT14-4a,对茄病镰刀菌具有显著的抑制作用;枯草芽孢杆菌(B. subtilis)SPB1 对茄病镰刀菌有较强抑菌活性[10];杨晓燕等[11]发现枯草芽孢杆菌对多种致病菌有良好的拮抗效果,其中包括茄病镰刀菌。此外,芽孢杆菌还表现出促进植株生长的效果,Anjum 等[12]发现枯草芽孢杆菌的施用增加了甜瓜植株根干重和茎重;枯草芽孢杆菌QST713 可促进黄瓜植株生长,尤其是株高和干重的增加[13];此外,解淀粉芽孢杆菌GB03 可促进木薯地上部和根系生长[14]。
本研究以黄瓜茄病镰刀菌作为靶标真菌,从设施黄瓜根际抑病土[15-16]中分离筛选对茄病镰刀菌有抑制效果的芽孢杆菌,对3 个拮抗作用显著的菌株进行形态观察、生理生化分析和分子生物学鉴定以明确其分类地位,并对3 个菌株进行了盆栽试验,探究其对黄瓜幼苗根腐病的防控效果及对植株生长特性的影响,为有效防控黄瓜根腐病发生和黄瓜产业可持续发展提供了有潜力的生防资源和理论依据。
1 材料与方法
1.1 材料
供试黄瓜品种为‘德尔99’,种子购买自天津德瑞特种业有限公司。土壤样品采集自宁夏中卫市及吴忠市日光温室设施黄瓜根际。供试黄瓜根腐病病原菌茄病镰刀菌(F. solani)由中国农业大学实验室提供。
培养基:NA 培养基用于拮抗菌的分离和培养[17];PDA 培养基用于真菌培养及拮抗细菌的筛选[17];PDB 培养基用于病原真菌液体培养;LB 肉汤培养基用于拮抗细菌的液体培养[18]。
1.2 方法
1.2.1 芽孢杆菌的分离 称取10 g 土壤样品至装有90 mL 无菌水的三角瓶中振荡使之充分悬浮,悬浮液置于80℃水浴20 min以杀死绝大部分非芽孢杆菌,将土壤悬浮液稀释至10-3、10-4,10-5浓度,吸取100 μL 至NA 平板涂布均匀,倒置于30℃恒温箱中培养2 d 后,选择具有不同形态的菌落划线纯化3 次。
1.2.2 拮抗菌株的筛选 采用平板对峙培养法[19]筛选出对黄瓜茄病镰刀菌有抑制作用的菌株。初筛:用直径为5 mm 的打孔器在茄病镰刀菌平板边缘打取病原菌菌饼接入PDA 平板中央,并在菌饼周围等距离25 mm 处点接待测的菌株。以只接种病原菌作对照,重复3 次,28℃培养7 d 后记录病原菌直径并计算抑菌率。
选择初筛抑菌率高于50%的菌株使用其培养液进行复筛。将直径为5 mm 的茄病镰刀菌菌饼接入PDA 平板中央,然后在距中心25 mm 处打孔,接入200 μL 细菌培养上清液(挑取一环纯菌接种在装有10 mL LB 液体培养基三角瓶中,30℃、200 r/min 培养24 h,10 000 r/min 离心5 min)。以空白培养基作对照,重复3 次,28℃培养7 d 后记录病原菌直径,并计算抑菌率。
抑菌率(%)=(对照病原菌菌落直径-处理病原菌菌落直径)/(对照病原菌菌落直径-病原菌菌饼的初始直径)×100%
1.2.3 拮抗菌株的鉴定
1.2.3.1 菌株的形态学和生理生化鉴定 将复筛后拮抗效果最好的3 个菌株划线在NA 平板上置于30℃恒温培养箱中培养24 h,参照《常见细菌系统鉴定手册》[20]进行菌落形态观察和生理生化等特征分析。
1.2.3.2 菌株的抗病促生特性测定 固氮能力:将待测菌株接种到阿须贝培养基,培养观察其有无菌体生长[21]。溶磷能力:将待测菌株接种于固体无机溶磷培养基平板,培养观察其有无透明溶磷圈出现[22]。解钾能力:将待测菌株接种到硅酸盐培养基上,培养观察其有无透明圈出现[23]。产铁载体:将待测菌株接种到铬天青CAS 培养基上,培养观察有无黄绿色晕圈出现[24]。ACC 脱氨酶活性:将菌株接种到ADF 液体培养基培养,将培养所得菌液涂布于ADF 固体平板,30℃培养后观察ADF 平板上有无菌落生长,有菌落生长则具有 ACC 脱氨酶活性,反之则无[23]。根据要雅倩等[25]的方法进行蛋白酶、果胶酶、几丁质酶、纤维素酶活性的检测。
1.2.3.3 菌株的分子鉴定 挑取单菌落接种于LB 肉汤培养基30℃培养24 h 后,采用DNA 提取试剂盒提取菌株的总DNA,使用细菌通用引物(27F: 5′-AGAGTTTGATCATGGCTCAG-3′ 和1492R: 5′-CTACGGCTA CCTTGTTACGA-3′)扩增各菌株的16S rDNA基因序列,PCR 反应体系(50 μL):菌落(基因组DNA)1 μL,上下游引物(27F 和1492R)各1 μL,ddH2O 22 μL,MIX(2×Phanta Max Master Mix)25 μL。PCR 扩增反应条件:95℃预变性5 min;94℃变性30 s,55℃退火30 s,68℃延伸50 s,共35 个循环;参照Cao 等[26]方法,使用特异性引物gyrA:(L- AAATCTGCCCGTATCGTCG, R- GCGTCACGGCGRATCTCAA)、rpoA:(L- CGTAGAGCCACTTGAGCG, R- CTGCCGTTACAGTTCCTT)进行基因扩增,扩增产物经1.5%琼脂糖凝胶电泳检测,PCR 产物回收后送北京擎科生物有限公司进行测序。将测得的菌株序列在NCBI 数据库中进行BLAST 对比,使用MEGA 7 软件构建系统发育树[27]。
1.2.4 菌株的促生试验 试验在中国银川市宁夏大学实训基地进行。育苗基质(河北德沃多肥料有限公司)的基本性质:pH 6.75,EC 0.91 mS/cm,有机质40.71 g/kg,全氮0.70 g/kg,速效氮27.44 mg/kg,速效磷15.43 mg/kg,速效钾66.97 mg/kg。基质连续灭菌(121℃,20 min)3 次后降至室温备用。将消毒后的黄瓜种子温汤浸种催芽,待露白后播种至72孔穴盘,于幼苗两叶一心时用20 mL 菌株培养液(108CFU/mL)灌根处理,CK1 为20 mL 清水灌根,每个处理15 株,重复3 次,接种10 d 后对植株的生长特性指标进行测定。
1.2.5 菌株的盆栽防效试验 于幼苗两叶一心时分别先用20 mL 拮抗菌培养液灌根处理,24 h 后接种茄病镰刀菌悬浮液(104CFU/mL),不同浓度的处理设置为CK2:20 mL 清水灌根、T1:原液,浓度108CFU/mL、T2:10 倍稀释液,浓度107CFU/mL、T3:100 倍稀释液,浓度106CFU/mL。每个处理15 株,重复3 次。接种10 d 后对植株的生长特性指标进行测定,调查发病情况,病情分级标准参照文献[28],并计算病情指数和防病效果。
2 结果
2.1 茄病镰刀菌抗性菌株的分离与筛选
从采集的23 份根际土壤中共分离纯化得到菌株343 株,通过与黄瓜茄病镰刀菌的对峙培养,筛选出抑菌率在60%-70%的菌株5 株(表1),50%-60%的菌株59 株,192 株菌株对茄病镰刀菌抑菌效果不佳。对抑菌率在50%以上的菌株编号并进行复筛。

表1 分离菌株对黄瓜茄病镰刀菌的抑菌情况Table 1 Bacteriostasis of isolated strains against Fusariumsolani of cucumber
复筛结果表明,菌株XY-1、XY-13、XY-53 对茄病镰刀菌生长有明显的抑制效果,抑菌率分别为65.90%、66.13%和60.83%(表2)。

表2 菌株培养上清液对黄瓜茄病镰刀菌的抑制效果Table 2 Inhibition rate of bacterial culture supernatant against Fusarium solani of cucumber
2.2 茄病镰刀菌拮抗菌株的鉴定
复筛得到的3 株拮抗效果最好的菌株在NA 平板上均长势良好。菌落形态鉴定如表3。3 株拮抗菌均为革兰氏阳性菌,菌体呈杆状,产椭圆形芽孢,如图1 所示。

图1 菌株XY-1、XY-13 及XY-53 的菌落形态(A)、革兰氏(B)以及芽孢染色(C)形态Fig. 1 Morphology(A), gram(B)and spore staining(C)of strain XY-1, XY-13 and XY-53

表3 拮抗菌的形态及特征Table 3 Morphology and characteristics of antagonistic bacteria
拮抗菌XY-1、XY-13 和XY-53 菌株的生理生化试验结果表明(表4),3 个菌株在接触酶、氧化酶、明胶液化、乙酰甲基甲醇(V-P)、葡萄糖氧化发酵试验中呈阳性,在甲基红试验中呈阴性,XY-1、XY-13 在淀粉水解试验中呈阳性,XY-53 在淀粉水解试验呈阴性;抗病促生测试结果表明(表4),3个菌株均具有溶磷、固氮和产生ACC 脱氨酶的能力,可以产生蛋白酶,均无解钾能力,不能产生铁载体、几丁质酶、果胶酶和纤维素酶。

表4 XY-1、XY-13、XY-53 的生理生化特征及抗病促生特性测试结果Table 4 Test results of physiological and biochemical and antagonistic growth-promoting characteristics of XY-1, XY-13,and XY-53
将3 株拮抗菌的基因序列用BLAST 比对后构建系统发育树(图2),构建16S rDNA 系统发育树(图2-A),结果显示XY-1 与解淀粉芽孢杆菌(登录号:ON287217.1)核苷酸序列比对相似度为99%,XY-13 与解淀粉芽孢杆菌(登录号:MK521053.1)核苷酸序列比对相似度为98%,XY-53 与枯草芽孢杆菌(登录号:641205.1)核苷酸序列比对相似度为100%;再构建gyrA、ropA 系统发育树(图2-C 和图2-D),结果显示XY-1 与解淀粉芽孢杆菌(MK789290.1)核苷酸序列比对相似度为100%,故确定菌株XY-1 为解淀粉芽孢杆菌;XY-13 与解淀粉芽孢杆菌核苷酸(AJ832121.1)序列比对相似度为98%,故确定菌株XY-13 为解淀粉芽孢杆菌;XY-53 与枯草芽孢杆菌(登录号:MW287082.1)序列比对相似度为100%,故确定菌株XY-53 为枯草芽孢杆菌。
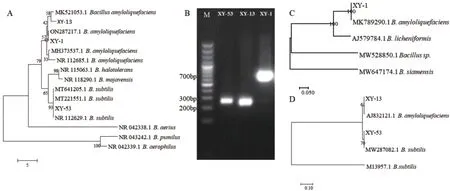
图2 菌株XY-1、XY-13 及XY-53 的系统发育树和特异性引物PCR 电泳图Fig. 2 Phylogenetic tree of strain XY-1, XY-13 and XY-53 and PCR electropherogram with specific primer
2.3 抗性菌株的促生效果
盆栽试验表明,3 株菌均可显著促进黄瓜幼苗株高、茎粗、叶绿素含量、地上部鲜重、地上部干重的增加,菌株XY-53 的促生效果最好,XY-13 次之(表5)。与对照(清水)相比,菌株XY-53 处理后幼苗株高、茎粗、叶绿素含量、地上部鲜重、地上部干重、地下部干重均显著增加,分别增加了34.94%、7.91%、43.43%、51.52%、46.27% 和37.70%。
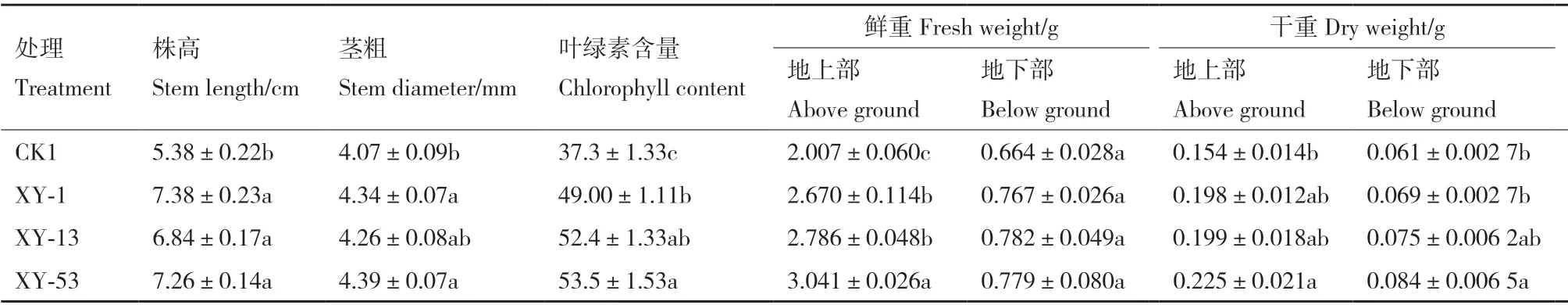
表5 菌株XY-1、XY-13、XY-53 对黄瓜幼苗生长的影响Table 5 Effects of strain XY-1, XY-13 and XY-53 on the growth of cucumber seedlings
2.4 抗性菌株的防病效果
将3 株对黄瓜茄病镰刀菌拮抗效果较好的菌株进行了盆栽防效试验。结果(表6,图3)表明,3株芽孢杆菌对黄瓜根腐病均有较好的防控效果。不同菌株发酵液中菌含量不同时,防病效果差异明显,防效随接种浓度的增加而升高。其中枯草芽孢杆菌XY-53 原液处理的防病效果最佳,为82.86%,解淀粉芽孢杆菌XY-1 和XY-13 分别为65.12%%、72.09%。

图3 菌株XY-1、XY-13、XY-53 对黄瓜根腐病的盆栽防控效果Fig. 3 Control effects of strain XY-1, XY-13 and XY-53 on cucumber root rot in pot

表6 菌株XY-1、XY-13、XY-53 对黄瓜根腐病的防治效果Table 6 Control efficiency of strain XY-1, XY-13, and XY-53 on cucumber root rot
植株生长特性测定结果表明(表7),接种XY-1、XY-13、XY-53 发酵液后再接种病原菌,黄瓜幼苗的株高、茎粗、叶绿素含量、地上部鲜重均显著高于CK2(只接种病原菌)。由此可见,施用芽孢杆菌XY-1、XY-13 及XY-53 菌种发酵液不仅能有效防控黄瓜苗期根腐病,还可以促进黄瓜幼苗生长。

表7 菌株XY-1、XY-13 和XY-53 对黄瓜的促生效果Table 7 Growth-promoting effects of strain XY-1, XY-13 and XY-53 on cucumber
植物根际存在大量的有益微生物,可以促进植株生长,提高植株抵御不良胁迫的能力。芽孢
3 讨论
杆菌属菌株已被广泛接受为对抗多种植物病原体的有效BCAs,可作为杀菌剂防治黄瓜根腐病的替代选择[29-31]。
本研究中,3 株芽孢杆菌均表现出很好的BCAs潜力和PGPR 活性。平板对峙试验中,解淀粉芽孢杆菌XY-1、XY-13 和枯草芽孢杆菌XY-53 可显著降低茄病镰刀菌的径向生长,这归因于芽孢杆菌产生的蛋白酶类物质,抑制了病原菌的增殖,这与Chen等[32]发现枯草芽孢杆菌FJAT-14262 产生的抗真菌脂肽可以抑制平板中尖孢镰刀菌菌丝的生长、解淀粉芽孢杆菌E3 分泌的脂肽类物质可以抑制茄病镰刀菌孢子萌发和菌丝生长[33],芽孢杆菌FR9 产生的蛋白酶(枯草杆菌蛋白酶A)可以抑制病原菌的生长[34],解淀粉芽孢杆菌 LZN01 分泌的抗菌物质可以抑制镰刀菌菌丝生长[35]的研究结果一致。生防菌株能否在植物根际或根部有效定殖是决定根部病害防治成功的关键一步[36]。盆栽试验中,芽孢杆菌XY-1、XY-13 和XY-53 对黄瓜根腐病的防病效果随着接种浓度的升高而增加,浓度为108CFU/mL 时防效最高,与前人[37-38]的研究结果一致,因为较高的菌液浓度使接种后位于根际的芽孢杆菌拥有较大的定殖基数,为产生更多的拮抗物质、与病原菌竞争空间营养进而有效防治根腐病奠定了物质基础,而盆栽试验中,接种病原菌后的幼苗叶片黄化,则是根腐病发病的症状之一,接种高浓度菌液的幼苗黄化程度弱于低浓度菌液,而低浓度菌液幼苗处理之间黄化差异不显著,这表明高浓度菌液对黄瓜根腐病的防效高于低浓度菌液。
PGPR 定殖在植物根际,可以促进植株生长,3株芽孢杆菌在单独施用以及病原菌侵染条件下均可以促进黄瓜幼苗的生长,这表明3 个菌株均能很好地定殖于植株根际,在根部占据有利生态位点,为防控黄瓜根腐病、促进幼苗生长提供了有利条件。在促生试验中,芽孢杆菌XY-1、XY-13 和XY-53 均可以显著促进黄瓜幼苗的生长,表现为对幼苗株高、茎粗、叶绿素含量和地上部生物量的显著促进。此外,XY-1、XY-13 和XY-53 可以在有效防控黄瓜根腐病的同时促进幼苗生长,分析其原因是菌株抗生作用和诱导植物系统抗性共同发挥作用的结果,与前人发现抗性芽孢杆菌可以防治土传病害,同时促进植株生长的结果一致[39-41]。菌株的促生效果与其具有的溶磷能力、固氮能力和ACC 脱氨酶活性有关。芽孢杆菌可以通过产生拮抗代谢物,如抗生素、降解酶、ACC 脱氨酶、挥发性化合物和铁载体等参与拮抗菌的生物控制,间接促进植物生长,或通过溶解磷酸盐、生物固氮等提高植物根际养分的可利用性,直接促进作物生长[42],王娟娟[43]的研究结果表明接种固氮、溶磷菌株可以增加土壤中速效氮、磷、钾的含量、改善土壤理化性质,促进作物的生长,王琪媛等[44]发现含有ACC 脱氨酶的根际细菌能促进植株生长,与本研究结果一致。
芽孢杆菌XY-1、XY-13 和XY-53 具有良好的防病促生效果,为黄瓜茄病镰刀菌根腐病的生物防治提供了理论依据,也为芽孢杆菌的产业化开发提供了菌种资源。但对其防病效果的广谱性、及其在根际定殖的动态规律与代谢产物的研究、发酵工艺优化有待进一步明确,以便全面的发掘XY-1、XY-13和XY-53 的防治潜力,进而研发出多功能的芽孢杆菌制剂。
4 结论
分离得到解淀粉芽孢杆菌XY-1、XY-13,枯草芽孢杆菌XY-53。接种XY-1、XY-13、XY-53 可以显著促进黄瓜幼苗的生长,对黄瓜幼苗株高、茎粗、叶绿素含量、生物量累积有显著增加效果,对黄瓜根腐病防效达65.12%、72.09%和82.86%。XY-1、XY-13 和XY-53,特别是XY-53 可作为防控黄瓜苗期茄病镰刀菌根腐病、促进黄瓜幼苗生长有潜力的生物防治资源。

