耐盐碱土曲霉SYAT-1 的分离鉴定及抑制植物病原真菌特性研究
王凤婷 王岩 孙颖 崔文婧 乔凯彬 潘洪玉 刘金亮
(吉林大学植物科学学院,长春 130062)
土壤盐渍化严重制约农业生产及资源环境的可持续发展,中国是盐碱地大国,现有盐碱土约3 600万hm2,占全国可利用土地面积的4.88%[1]。不合理开垦荒地、灌溉农业措施不当、农药化肥过度使用、设施土壤栽培等都会导致土壤次生盐渍化的形成,同时还会加剧植物病虫害的发生[2-3]。盐碱地资源可持续利用对国家生态环境建设和后备耕地资源开发具有重要的战略意义,利用生态友好且高效的途径改良盐碱地,是当前推动农业发展和生态环境恢复的重要举措[4]。
盐碱地作为具有独特土壤理化性质的极端生态系统,存在大量耐(嗜)盐微生物,这些微生物由于长期在盐碱环境中共存与进化,形成了极为特殊的生物学特性,并产生具有特殊生物活性的物质,因此具有重要的利用和开发价值[5]。目前,随着耐(嗜)盐碱微生物资源发掘,人们开始将这些嗜盐耐碱菌应用于高盐碱环境中的治理。在利用微生物改良盐碱土的过程中,为了最大化发挥可利用微生物的可持续性和环境友好性,对这些微生物进行深入研究尤为必要。大多数嗜盐真菌生活在海盐水体、海滨和高盐浓度的内陆陆地土壤中,有些耐(嗜)盐碱曲霉属(Aspergillus)及其有性态(Eurotium)真菌具有耐盐性,但目前发现的耐(嗜)盐碱曲霉还比较少[6-8]。
生物防治是植物病害防治的重要措施之一,目前已有木霉菌、解淀粉芽胞杆菌、枯草芽胞杆菌、沙雷氏菌、链霉菌等多种微生物对植物病原菌拮抗作用的相关报道[9-11]。生物菌剂可以减少或部分替代化学农药的使用,既能有效防治植物病害,又可避免化学农药的使用带来的负面效应。
土曲霉(Aspergillus terreus)是一种广泛存在于陆地环境和海洋环境中的真菌,能够产生丁内酯类、土震素类、木脂素类、杂萜类等特征代谢产物,具有耐(嗜)盐、抗肿瘤、抗氧化、抗病毒、降低胆固醇、抑制α-葡萄糖苷酶、β-淀粉酶、葡萄糖醛酸酶、乙酰胆碱酯酶等活性[12]。目前尚未发现土曲霉拮抗植物病原真菌的报道。
本研究从吉林省松原市典型苏打盐碱地分离到1 株耐盐碱土曲霉SYAT-1,通过形态特征观察和ITS-rDNA 序列分析,对该菌株分类地位进行了鉴定,并对该菌株不同pH 生长特性、耐盐性、拮抗植物病原真菌活性和潜在致病性进行研究,以期为利用微生物改良盐碱土和植物病害生物防治提供新的菌株资源和理论依据。
1 材料与方法
1.1 材料
1.1.1 土壤样品 分离菌株的土壤样品采自吉林省松原市典型苏打盐碱地(123°97′-124°02′E,44°03′-45°02′N)。选取该地高度盐碱化地块,取土壤表层2 cm 以下土壤,装入已灭菌处理的玻璃瓶,带回实验室置于4℃低温冰箱中备用。供试植物病原真菌6种,包括核盘菌(Sclerotinia sclerotiorum)、禾谷镰孢(Fusarium graminearum)、灰葡萄孢(Botrytis cinerea)、玉米小班病菌(Cochliobolus heterostrophus)、玉米大斑病菌(Setosphaeria turcica)、稻瘟病菌(Magnaporthe oryzae),均由吉林大学有害生物综合防治研究室提供。
1.1.2 培养基和主要试剂 马铃薯葡萄糖琼脂(PDA)培养基:马铃薯200 g/L,葡萄糖 20 g/L,琼脂20 g/L,121℃湿热灭菌20 min。PDA选择性培养基:PDA 培养基中加入10% NaCl(质量分数),调节pH为8.0-9.0。
真菌基因组提取试剂盒、PCR 扩增试剂盒、质粒提取试剂盒,普通DNA 产物纯化试剂盒、DL2000 DNA marker、PMD18-T 克隆载体、T4 DNA 连接酶、PCR 引物等试剂均购自上海生工生物公司。
1.2 方法
1.2.1 菌株分离及筛选 采用稀释涂布法分离菌株。分别称取10 g 盐碱土壤样品放入装有90 mL 无菌水的250 mL 锥形瓶中,180 r/min 摇床振荡1 h,静置后得到样品混合液。样品混合液分别稀释10 倍、100 倍、1 000 倍3 个梯度,取0.1 mL 稀释液均匀涂布于选择性培养基上,每梯度3 个重复。28℃恒温培养箱培养,待菌落长出后,挑取菌落形态差异明显的真菌菌落进行平板划线法纯化获得纯培养物,纯化过后的菌株转接至含10% NaCl(质量分数)的PDA 培养基斜面,4℃保存备用。
1.2.2 菌株形态学鉴定 将分离纯化得到的菌株采用点接法接种到新的PDA 培养基上,28℃培养6 d,观察菌落形态。用挑针挑取菌落表层菌丝,制成临时玻片,显微观察其产孢结构和菌丝形态。
1.2.3 菌株分子生物学鉴定 菌株基因组DNA 提取按照真菌基因组DNA 快速抽提试剂盒(上海生工生物公司)使用说明进行。利用ITS-rDNA 通用引物ITS1(5′-TCCGTAGGTGAACCTGCGG-3′)和ITS4(5′-TCCTCCGCTTATTGATATGC-3′),按 照Taq PCR Mix(上海生工生物公司)使用说明进行PCR 扩增,PCR 反应条件参考文献[13]。测序由上海生工生物公司完成,将获得的ITS-rDNA 序列与NCBI 数据库Blast 进行比对,核苷酸序列同源性比较和分析采用DNASTAR Lasergene17.0.2.1 软件,利用MEGA 7.0软件中Maximum Likelihood 法构建24 种曲霉属真菌的系统发育进化树。
1.2.4 菌株不同pH 生长特性测定 在28℃将菌株等量菌饼分别接种到pH 7.0-12.0 PDA 培养基上,培养8 d 观察菌落生长情况并测量不同pH 培养基上菌落直径。
1.2.5 菌株耐盐性测定 配制梯度NaCl 含量的PDA培养基,其盐浓度由10 mg/mL 增加到20 mg/mL,每级增加2.5 mg/mL,以不添加NaCl 的PDA 培养基为对照。将等量的菌饼接种于培养基中心位置,在28℃,最适pH 值条件下培养24 d观察菌落生长情况,并测量不同盐浓度的培养基上菌落直径。同样,配制NaHCO3浓度分别为0、2 和4 mg/mL 的PDA 培养基,在28℃最适pH 值条件下培养10 d 观察菌落生长情况,并测量不同盐浓度的培养基上菌落直径。
1.2.6 菌株拮抗植物病原真菌测试 采用平板对峙培养法测定分离菌株对核盘菌、禾谷镰孢、灰葡萄孢、玉米小班病菌、玉米大斑病菌和稻瘟病菌等植物病原真菌的拮抗作用[14]。在直径为9 cm PDA 培养基培养皿中,相距4.5 cm 两点(距离培养皿中心分别为2.25 cm)分别接种直径为0.5 cm 的分离菌株和植物病原菌株圆形菌饼,以只接种植物病原真菌的PDA 培养基为对照。每个处理设置3 次重复,于25℃恒温培养7 d,测量病原菌菌落半径,并计算抑菌率。
抑菌率(%)=[(对照组菌落半径-处理组菌落半径)/ 对照组菌落半径]×100%
1.2.7 菌株潜在致病性测试 分别将分离菌株和核盘菌菌饼接种到大豆、烟草和番茄叶片,每种植物接种3 个叶片,先保湿24 h,再于正常条件下培养3 d 后观察叶片发病症状。将分离菌株和玉米大斑病菌孢子悬浮液(孢子浓度为1×106个/mL)接种玉米叶片,以20%吐温水为对照,先保湿24 h,再于正常条件下培养3 d 后观察叶片发病症状。
2 结果
2.1 菌株SYAT-1的分离
本研究从吉林省松原市典型苏打盐碱地采集土样12 份,采用稀释涂布法分离并纯化获得21 株真菌菌株(表1),经筛选获得一株耐盐碱抗植物病原真菌的菌株并编号为SYAT-1。

表1 采集与分离的真菌菌株Table 1 Collected and isolated fungal strains
2.2 菌株SYAT-1的鉴定
2.2.1 菌株形态鉴定 筛选得到的菌株SYAT-1 在PDA 平板上28℃条件下培养6 d 后,形成白色略带土黄色绒毛状密集菌丝体,呈圆形或近圆形,边缘不整齐,中心稍隆起。分生孢子梗直柱状,顶端膨大呈球形顶囊,产孢结构双层,梗基平行密集着生于顶囊上半部,分生孢子为单胞,球形或近球形(图1)。

图1 菌株SYAT-1 形态特征Fig. 1 Morphological characteristics of strain SYAT-1
2.2.2 菌株分子生物学鉴定 对纯化的菌株提取DNA 进行PCR 扩增ITS-rDNA 片段,经序列测定分析表明,片段大小为541 bp,在NCBI 上用Blastn软件与GenBank 中己知的基因序列进行同源性比较,菌株SYAT-1 与其他23 株己报道的曲霉属菌株的同源性达70.2%-100%,与土曲霉(A. terreus)(KT899793.1, MH047280.1)菌株的同源性高达100%(图2)。构建的系统发育进化树显示,菌株SYAT-1 与A. terreus(KT899793.1, MH047280.1) 组成一进化簇。

图2 基于ITS-rDNA 核苷酸序列构建的系统进化树Fig. 2 Phylogenetic tree constructed based on ITS-rDNA nucleotide sequences
综合以上形态学和分子生物学鉴定结果,该菌株为土曲霉(A. terreus)。将该菌株保藏在中国微生物菌种保藏管理委员会普通微生物中心,保藏编号为CGMCC No. 21021。
2.3 菌株SYAT-1不同pH生长特性测定
在28℃不同pH 的培养基中菌株SYAT-1 开始生长的时间不同,培养1 d 后pH 7.0-10.0 都长出菌落,2 d后pH 11.0和pH 12.0长出菌落。在pH 7.0-12.0的PDA 培养基上均可以生长,表明菌株SYAT-1 可适应的pH 范围为pH 7.0-12.0。菌株SYAT-1 在不同pH 的PDA 培养基培养8 d 的生长曲线表明,其生长最适pH 范围为7.0-9.0(图3)。
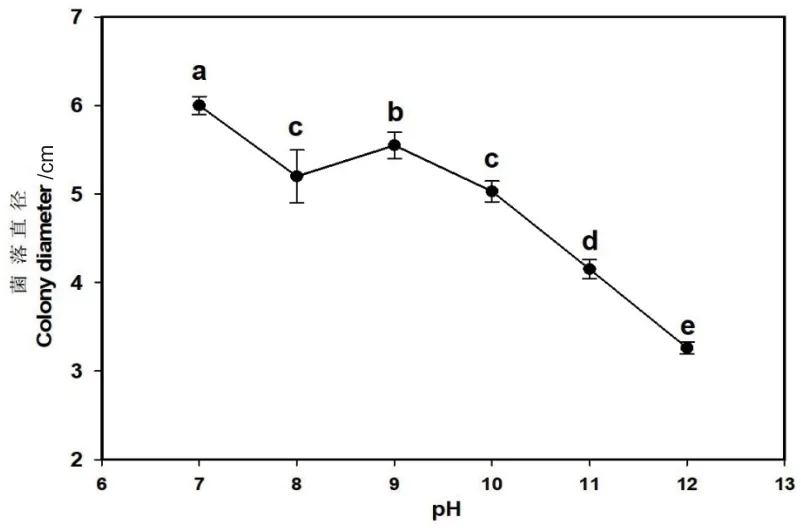
图3 菌株SYAT-1 在不同pH 下生长Fig. 3 Growth of strain SYAT-1 at different pH
2.4 菌株SYAT-1耐盐性测定
菌株SYAT-1 在梯度NaCl 含量的PDA 培养基上,在28℃,最适pH 值条件下培养24 d。结果发现,在28℃下菌株SYAT-1 在0-17.5 mg/mL NaCl PDA 培养基上均能生长,但在20 mg/mL NaCl PDA 培养基上不能生长。其中菌株在无NaCl PDA 培养基上生长最快,随着盐浓度增加菌落生长缓慢(图4)。

图4 菌株SYAT-1 28℃不同浓度NaCl 浓度生长情况Fig. 4 Growth of strain SYAT-1 at 28℃ with different concentrations of NaCl
在28 ℃最适pH 值条件下培养10 d,菌株SYAT-1 在2、4 mg/mL NaHCO3的PDA 培养基均能生长,其中菌株在不含NaHCO3的 PDA 培养基上生长最快,随着盐浓度增加菌落生长缓慢(图5)。综合菌株SYAT-1 在梯度NaCl 和NaHCO3含量的PDA培养基生长情况,该菌株属于耐高盐特性的真菌。

图5 菌株SYAT-1 28℃不同浓度NaHCO3 下生长情况Fig. 5 Growth of strain SYAT-1 at 28℃ with different concentrations of NaHCO3
2.5 菌株SYAT-1拮抗植物病原真菌分析
通过菌株SYAT-1 对6 种不同植物病原真菌菌株的离体抑菌率测定,结果表明,菌株SYAT-1 对供试植物病原真菌均有一定的抑制效果,抑菌率为21.57%-50.59%,具有广谱抑制作用,其中对玉米大斑病菌抑菌率最高,为50.59%,显著高于对其他病原真菌的抑菌率(P<0.05)(图6,表2)。
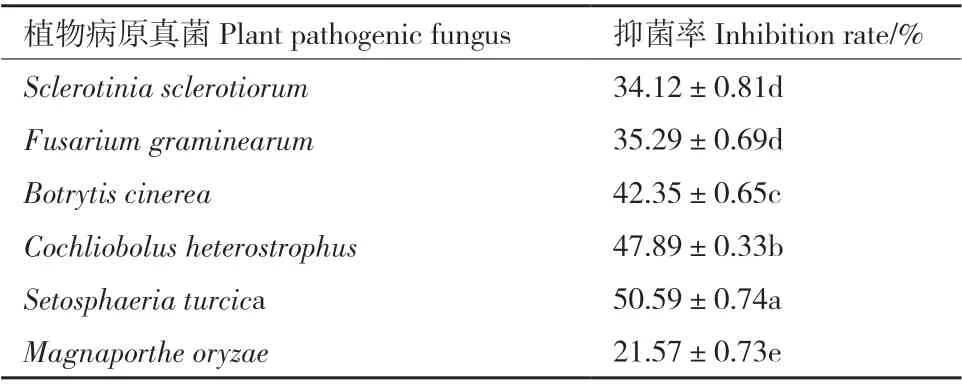
表2 菌株SYAT-1 对6 种植物病原真菌的抑菌率Table2 Inhibition rates of strain SYAT-1 against six plant pathogenic fungi

图6 菌株SYAT-1 对不同病原真菌的拮抗效果Fig. 6 Antagonistic effect of strain SYAT-1 against different pathogenic fungi
2.6 菌株SYAT-1潜在致病性测试
菌株SYAT-1 接种大豆、烟草、番茄和玉米叶片潜在致病性测试结果(图7)显示,菌株SYAT-1和核盘菌菌饼接种后,保湿培养24 h 再正常培养3 d 后,接种核盘菌的叶片出现不同程度坏死病斑,而菌株SYAT-1 均无明显病斑出现。菌株SYAT-1 和玉米大斑病原菌孢子悬浮液接种到玉米叶片上,保湿24 h 再正常培养 3 d 后,接种玉米大斑病菌部位产生枯死斑,而接种菌株SYAT-1 和20% Tween-20水的部位均无明显病斑。因此,可以明确菌株SYAT-1 对以上 4 种供试植物无潜在的致病性。
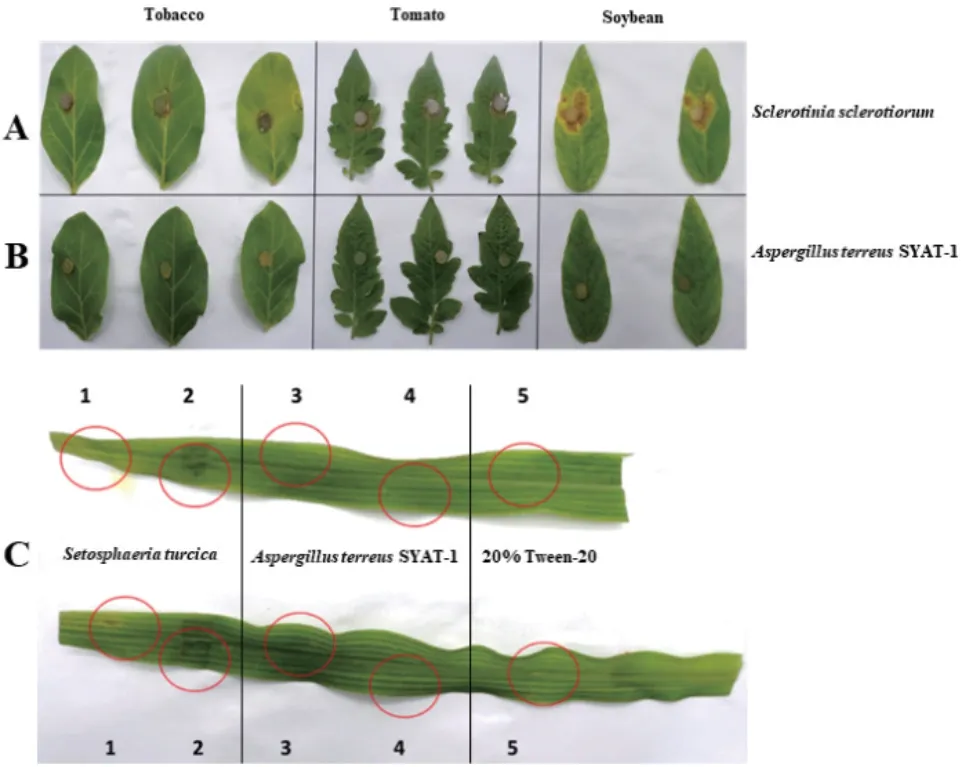
图7 菌株SYAT-1 潜在致病性测试Fig. 7 Potential pathogenicity test of the strain SYAT-1
3 讨论
近年来,随着耐(嗜)盐碱微生物资源的发掘和利用,通过微生物改良盐碱地的方法越来越多。盐碱环境中的微生物在长期进化过程中形成了独特适应性和生物学特性,因此成为微生物改良盐碱地的首选[5,15]。本研究从吉林省松原市典型苏打盐碱地土壤中分离到1 株耐盐碱真菌菌株SYAT-1,该菌株在pH 7.0-12.0、0-17.5 mg/mL NaCl 及0-4 mg/mL NaHCO3的PDA 培养基均能生长,显示出耐高盐碱特性,为利用微生物改良盐碱土提供菌株资源。大多数嗜盐真菌生活在海洋和高盐陆地土壤中,大量关于生物多样性和生理学的研究都集中在表征上。研究表明曲霉属(Aspergillus)及其有性态(Eurotium)真菌具有耐(嗜)盐碱特性[6],但目前报道的耐(嗜)盐碱曲霉属真菌相对较少。Kis-Papo 等[7]从死海及周边环境中分离得到的黑曲霉(A. niger)和杂色曲霉(A. versicolor)在纯死海海水中可分别存活3 周和8 周。刘晓丹等[16]从晒盐场盐池周边野生植被上分离得到的耐盐曲霉具有极强的耐盐性,在NaCl质量分数高达31%的极端环境中也能生长。郑晓梅等[17]从青岛海边盐土土样中筛选得到1 株黑曲霉(A. niger),能够分泌有机酸,具有较好耐盐能力,在盐碱地改良中具有较好的应用潜力。李学平等[18]从黄河三角洲盐碱化根际土壤中筛选到1 株解磷塔宾曲霉(A. tubingensis)。这些耐盐碱曲霉属真菌的研究为微生物改良和利用提供理论基础和宝贵资源。
在利用微生物改良盐碱土方面,只靠单一功能的微生物并不能解决问题,应挖掘和开发兼具多种功能的微生物。目前,土曲霉真菌的研究多数都是集中在医药领域,研究其次生代谢产物抗肿瘤、抗氧化、抗病毒等功能和利用[12],在抗植物病原物方面的研究还未见报道。本研究从盐碱土中分离的土曲霉真菌SYAT-1 对植物病原真菌有很好的抑制效果,为盐碱地作物真菌病害的生物防治奠定基础。植物病害生物防治具有绿色、安全、无污染等优势,可有效减少化学农药对生态环境的影响,是目前极具应用潜力的防治措施之一。目前关于曲霉属真菌防治植物病原物的报道多集中在海洋曲霉抗菌活性的研究,海洋曲霉属是海洋真菌中抑制植物病原真菌的优势属之一[9,19],已报道的具有抗植物病原真菌活性的海洋曲霉有短棒曲霉(A. clavatonanicus)MF-13[20]、杂色曲霉(A. versicolor)D5[19]、烟曲霉(A.fumigatus)D17[19]、曲 霉(Aspergillussp.)D20[19]、文氏曲霉(A. wentiiEN-48)[21]、阿拉巴马曲霉(A.alabamensis)[22]、聚多曲霉(A. sydowii)[22]和构巢曲霉(A. nidulans)[22]等。除了海洋曲霉外,李祝等[23]发现黑曲霉能拮抗植物病原菌,并创制了黑曲霉菌剂新产品。这些曲霉真菌为微生物天然产物农药的研发提供重要的先导化合物来源。
曲霉属真菌的部分种是人体、动物和植物重要的致病菌,如黄曲霉(A. flavus)侵染粮食作物、食品和饲料引起霉变,产生黄曲霉毒素[24];黑曲霉(A.niger)是枣果霉烂病的优势致病菌[25]。关于土曲霉(A. terreus)研究多集中于次生代谢用于临床重要药物研发方面[12],未见其对植物具有致病性的报道。本研究获得土曲霉真菌SYAT-1,对供试4 种作物无潜在致病性,综合其抗病原真菌特性,该菌株在盐碱地作物真菌病害生物防治中具有潜在应用价值。
4 结论
本研究从典型苏打盐碱地土壤中分离到1 株耐盐碱真菌菌株SYAT-1,鉴定为土曲霉(A. terreus)。该菌株在碱性(pH 7.0-12.0)、0-17.5 mg/mL NaCl及0-4 mg/mL NaHCO3的PDA 培养基均能生长。该菌株抑菌普广,对玉米大斑病菌、玉米小斑病菌和灰葡萄孢等植物病原真菌均有抑制作用,抑菌率21.57%-50.59%。该菌株对植物无潜在的致病性。

