叶绿体特异蛋白质表达谱对本氏烟不同气孔密度的响应
撒世娟 伍涵宇 温媛 陈雪娜 郑蕊 姚新灵
(1. 宁夏大学宁夏优势特色作物现代分子育种重点实验室,银川 750021;2. 宁夏大学西部特色生物资源保护及利用教育部重点实验室,银川 750021)
气孔是植物吸收CO2、释放H2O 的门户,大气CO2上升诱导气孔密度降低[1-3],并对光合作用产生影响。研究结果显示,CO2富集诱导气孔导度降低达22%。气孔导度降低可能是植物对高CO2浓度的主动适应过程[4],该适应过程与叶绿体如何联系尚属未知。
随着光合作用相关蛋白识别及功能注释的不断深入,气孔运动与叶绿体间的联系逐渐显现,其中包括共同影响叶绿体和气孔动态的环境因素如光照、高温,还有叶绿素a/b 结合蛋白LHCB(light-harvesting chlorophyll a/b binding proteins)和碳固定代谢参与蛋白等,这些线索为揭示气孔动态与叶绿体间的代谢联系提供了基本依据。
研究发现,高温导致气孔导度降低的同时,叶绿体荧光参数也随之降低,叶绿体和气孔哪个首先受到环境因素的影响有待确定[5]。早期研究发现,保卫细胞中表达叶绿素酶基因,使保卫细胞叶绿素缺乏,继而导致气孔形态瘦小[6],意味着叶绿体光系统参与了气孔的形态发生。
叶绿体光系统I(PSI)是光驱动的氧化还原复合体[7],其反应中心核心组成蛋白包括PSAN(photosystem I reaction center subunit PSI-N)、PSAD-2(photosystem I reaction center subunit II-2)、PSBC(photosystem I iron-sulfur center protein)、CB5-E(cytochrome b5) 和AVP1(Arabidopsisvacuolar proton-pumping pyrophosphatase 1)。PSI 组 装 蛋 白ycf4(cytochrome f4)等构成了调控PSI 积累的网络,质体 蓝 素 DRT112(DNA-damage-repair/toleration) 参与PSI 与细胞色素间电子传递。PSI 叶绿素a/b 结合蛋白2(light-harvesting chlorophyll a/b binding proteins 2, LHCA2)介导LHCII-PSII 磷酸化及其迁移,促进PSI-PSII-LHCII 和PSI-LHCII 超复合体形成[8-10]。
叶绿体PSII 反应中心蛋白质PSBA(PSII protein D1)、PSBB(PSII CP47 reaction center protein)、PSBC(PSII CP43 reaction center protein)和修复蛋白PSB27-H1(PSII repair protein PSB27-H1) 等 与叶绿素结合产生光诱导的光化学反应,PSBA 和PSB27-H1 等也参与PSII 损伤修复[10-12]。光系统II稳定/组装因子HCF136(photosystem II stability/assembly factor HCF136)、高叶绿素荧光表型HCF173(high chlorophyll fluorescence phenotype 173)和PSII亚 基PSBQ2(oxygen-evolving enhancer protein 3-2)参与PSII 组成亚基和细胞色素559 的组装[13-14],细胞 色 素b559 亚 基α(PSII cytochrome b559, PSBE)是PSII 反应中心电子传递链组分的核心组分[15],PETC(cytochrome b6-f complex iron-sulfur subunit)担负PSII 和PSI 间线性和环形电子传递[10,16-18],在光系统上游,原叶绿素酸酯还原酶B(protochlorophyllide reductase B, PORB)催化原叶绿素酸酯还原产生叶绿素酸酯[19],cis-八氢番茄红素去饱和酶PDS3(cis-phytoene desaturase)等代谢八氢番茄红素形成ζ-胡萝卜素[20],ATP 合成酶亚基δ(ATP synthase δ subunit, ATPD)等组成了光合磷酸化ATP 合成酶[21-22],单脱水抗坏血酸还原酶4(monodehydroascorbate reductase, MDAR4)参与H2O2解毒抗坏血酸合成[23-24]。
在碳固定下游,3-磷酸甘油醛脱氢酶GAPB(glyceraldehyde-3-phosphate dehydrogenase)、1- 磷酸葡萄糖腺苷转移酶APL3(glucose-1-phosphate adenylyltransferase large subunit 3)、二磷酸果糖醛缩酶FBA3(fructose-bisphosphate aldolase 3)、6- 磷 酸葡萄糖异构酶PGI1(glucose-6-phosphate isomerase 1)、苹果酸异丙酯脱氢酶IMD2(isopropylmalate dehydrogenase 2)、NADP 依赖的苹果酸酶4(NADPdependent malic enzyme 4, NADP-ME4)和磷酸丙酮酸激酶1(pyruvate phosphate dikinase 1, PPDK1)调控三羧酸(tricarboxylic acid, TCA)循环CO2固定[25]。谷氨酸合成酶GLU1(glutamate synthase 1)和谷胱甘肽转移酶GSTF8(glutathione S-transferase F8)代谢还原谷氨酸与疏水亲电配体的接合[26-28]。
表皮模式因子2(EPIDERMAL PATTERNING FACTOR2,EPF-2)和Stomagen分别正向和反向调控叶片气孔密度, 继而影响光合作用[29-32]。气孔形成后,叶肉细胞蔗糖和苹果酸积累、保卫细胞叶绿体储存淀粉降解均参与气孔运动[33-34]。尽管叶绿体如何介导气孔发育有待确定,但可以确定气孔发育和运动与叶绿体内相关代谢密切关联。
研究发现,叶绿素结合蛋白 CP24(chlorophyllbinding protein 24)正向响应光照,反向调控叶绿素积累[35],叶绿素a/b 结合蛋白LHCB 6(light-harvesting chlorophyll a/b-binding proteins 6)过量积累,则气孔对赤霉素(abscisic acid, ABA)更为敏感[36],叶绿素b 缺失突变体的气孔功能异常,而遮阴条件下LHCB 6 积累增加,气孔功能随即恢复[37],叶绿体LHCB 成员与气孔动态如何关联有待确定。
本研究通过体内调控本氏烟草表皮模式因子2(Nicotiana benthamiana EPIDERMAL PATTERNING FACTOR2,NtEPF2)基因表达,获得不同气孔密度转化株系,测定不同气孔密度叶片蛋白质组表达谱,揭示随气孔密度变化叶绿体组分特异表达蛋白质及其表达变化,明确叶绿体组分蛋白质对气孔动态的响应,结果对深入研究气孔动态具有重要作用,对高效碳固定分子育种具有重要意义。
1 材料与方法
1.1 材料
重组根癌农杆菌(Agrobacterium tumefaciens)菌株GV3101-epf2-和GV3101-epf2+由本实验室保存,其中分别含有35S 启动子驱动的正义和反义StEPF2(DMG400027541)cDNA 重组载体pC-epf2-和pCepf2+,StEPF2 为马铃薯(Solanum tuberosumL.)表皮模式因子编码基因StEPF2(DMG400027541)。
供试材料本氏烟草(Nicotiana benthamiana)室内培养采用旁氏培养基质,试管苗及基质培养苗培养条件为(24±2)℃,14 h 光照,10 h 黑暗,光照强度为100 μmol/(m2·s),相对湿度60%-80%,土壤含水量70%±5%。
1.2 方法
1.2.1StEPF2-体内转化及表达阳性株系筛选 采用撒世娟等[38]的方法,完成正义和反义StEPF2 在本氏烟草体内转化。转化株系培苗培养生长第30 天时,采集其顶端幼叶,分别提取gDNA 和总RNA,用于转化阳性株系选择。转化阳性株系PCR 选择用表1 所示的引物EP,按照上海酶联生物科技有限公司生产的GUS 试剂盒说明书,完成PCR 阳性株系GUS 染色筛选。
按照大连宝生物工程有限公司生产的SYBR®Premix Ex TaqTMII(Tli RNaseH Plus)试剂盒说明,分别用表1 所示的StEPF2 特异引物EP+和EP-完成StEPF2 mRNA 积累RT-PCR 半定量测定,用比较Ct 值法计算StEPF2 相对表达量。

表1 实验所用引物及序列Table 1 Primers and sequences used in the study
1.2.2 阳性株系表型测定 基质培养苗龄达到30 d时,选择并标记相同位置叶片及叶片相同位置,用15%的硝化纤维素丙酮液均匀涂抹标记位置叶片背面,静止15 min 后用镊子剥离涂抹位置叶片表皮,置于载玻片蒸馏水滴中,用镊子展平叶片表皮,用纸吸干多余水分,在展平叶片表皮加10%染色碘液,静止1 min 后加洗脱蒸馏水,用纸吸干多余水分和碘液,加盖玻片封闭,排除气泡和浮色晾干制片并标记,显微镜下观察并拍照,以每平方毫米(mm-2)叶片面积为单位计数气孔数,计数设置3 次,每次计数重复3 次。叶绿素相对含量和光合参数测定按照撒世娟等[38]的方法。
1.2.3 叶片样品iTRAQ 气孔密度增加、减少和对照株系叶片样品总蛋白提取、质检、定量、去盐,蛋白质酶水解、iTRAQ 标记均按照Spanos 等[39]的方法进行,水解产物标记后样品等量混合酸化后,用Thermo DINOEX Ultimate 3000 BioRS 色谱仪(Thermo Fisher,USA)分离肽段,用QSTAR XL 质谱仪(Applied Biosystems,USA)采集同位素标签丰度等数据,计算同一多肽不同同位素标签丰度比值,以此作为同一多肽的相对表达量。
1.2.4 数据及分析 参考Vaudel 等[40]的方法,完成原始数据处理和Uniprot 数据库检索,设定相对表达量t检验显著为阈值,选择上下调及检出DEPs,在STRING 平 台(https://www.string-db.org/) 选 择多序列检索工具,用所选择DEGs 的氨基酸序列,mapping 拟南芥基因组,设定mapping 一致性大于60%为阈值,选择气孔密度增加和减少DEPs。
在GO(GENE ONTOLOGY) 界 面(http://geneontology.org/),用mapping ID 在线完成GO 富集分析;在Panther 数据库(http://pantherdb.org/tools/)平台,分别选择和下载包含叶绿体的GO 归类ID 及其包含的全部DEPs ID 和功能注释,用于其后的叶绿体组分DEGs 比较。
2 结果
2.1 叶绿素积累模式响应气孔密度变化
筛选得到StEPF2 抑制和过量表达株系各2 株,叶片StEPF2 基因mRNA 相对表达量测定结果如图1-A 所示,StEPF2 过量和抑制表达株系叶片StEPF2基因mRNA 相对表达量,分别极显著高于和低于对照,表明研究实现了StEPF2 体内过量和抑制表达,获得了StEPF2 过量株系ntepf-p1 和ntepf-p2 及抑制株系ntepf-m1 和ntepf-m2。如图1-F-H 所示,叶片气孔密度区别明显。如图1-B-D 所示,ntepf-p1 和ntepf-p2 株系叶片气孔密度、气孔导度及净光合速率分别低于对照株系,ntepf-m1 和ntepf-m2 株系叶片气孔密度、气孔导度及净光合速率分别比对照提高了约40%、200%和67%,结果表明,StEPF2 过量和抑制分别降低和增加了气孔密度,气孔密度正向改变气孔导度和净光合速率。
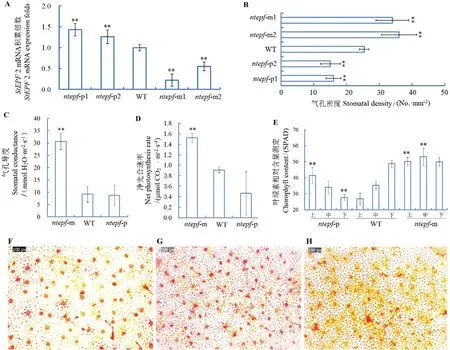
图1 株系 ntepf-m 和ntepf-p 气孔密度、叶绿素积累、光合测定和气孔观察结果Fig. 1 Assay on stomatal density, chlorophyll accumulation and photosynthesis as well as stomata observation for ntepf-m and ntepf-p lines
叶绿素含量测定结果如图1-E 所示,高气孔密度株系上、中、下叶片叶绿素含量均值高于对照均值43%,且保持了与对照下部叶片同样的高水平,对照株系叶片叶绿素含量自上而下呈现增加的常规模式。低气孔密度株系叶片叶绿素含量与对照株系的常规模式完全相反,即上、中、下叶片叶绿素含量呈现递减模式。
以上结果表明,气孔密度增加不仅加速了叶片叶绿素形成,而且保持了不同叶龄叶片叶绿素高水平积累。气孔密度降低加速了幼叶叶绿素积累,但随叶龄增加而逐渐减少,与对照株系叶绿素积累自上而下增加的模式比较,气孔密度降低株系上、中、下叶片叶绿素积累呈现倒置模式。
2.2 气孔密度增加产生的叶绿体响应
依据设定的DEPs 相对定量阈值,选择iTRAQ识别DEPs 的结果显示,响应气孔密度降低显著上下调的DEPs 为381 个,气孔密度增加显著改变了357 个DEPs 的积累量(P<0.05)。以DEPs 序列映射拟南芥基因组,选择序列相似性大于60%的DEPs进行GO 归类富集,结果如表2 所示,ntepf-m 中识别了更多分子功能GO ID,更多细胞组分的变化发生于ntepf-p 中。

表2 与拟南芥同源物相似性大于60% DEPs 的GO 富集结果Table 2 GO enrichment with DEPs sharing >60%similarity with orthologs in Arabidopsis
计算本研究识别的GO ID 所含DEPs 个数(upload)与拟南芥基因组注释记载中GO ID 所含DEPs 总数(REFLIST)间的比值(U/R, upload/REFLIST),用于比较随气孔密度变化的GO归类变化。从GO 富集中选择叶绿体、类囊体和光系统GO ID,比较获得气孔密度增加和降低共同GO ID(图2)。
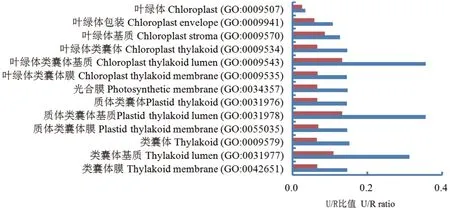
图2 气孔密度上、下调叶片DEPs GO 富集中共同出现的叶绿体GO IDsFig. 2 Chloroplast common GO IDs in GO enrichment of DEPs identified from the leaves of up- or downstomatal density
气孔密度增加和降低共同GO ID 共计13 个,U/R 比值比较发现,共同GO ID 中的ntepf-m 株系U/R比值均显著高于ntepf-p 株系,其中,ntepf-m 株系GO:0009543 和GO:0031978 两 个GO ID 的U/R 比 值均为0.36,即气孔密度增加调控了这两个GO ID 包含DEPs 的表达,调控DEPs 数量达到各自GO ID 包含全部DEPs 的36%,而气孔密度降低仅调控了全部DEPs 的13%。表明气孔密度增加牵动了更多的DEPs 表达变化,即气孔密度增加对叶绿体组分等产生更明显影响。
比较识别了如表3 所示的ntepf-m 株系特异GO ID,10 个GO ID 中的7 个分别来自光系统I 和光系统II,且U/R 比值平均数0.34,表明气孔密度增加特异调控了光系统近1/3 组分的表达。比较结果未见ntepf-p 株系特异GO ID,表明气孔密度降低并未诱导叶绿体特异DEPs 表达变化,相对而言,气孔密度增加诱导了更多叶绿体特异DEPs 表达变化,这与ntepf-m 和ntepf-p 株系两者共同GO ID 中DEPs表达变化趋势一致。

表3 气孔密度增加特异DEPs GO 富集Table 3 GO enrichment with stomatal density rising specific DEPs
2.3 气孔密度增加正向调控PSI电子传递
下载各GO ID 所含DEPs,删除重复项及未审核(unreviewed)DEPs 后,选择得到如图3 所示的22 个共表达DEPs,其中随气孔密度增加表达量降低的DEPs 有15 个(图3-A, B),表达量随之增加的DEPs 有7 个(图3-C)。
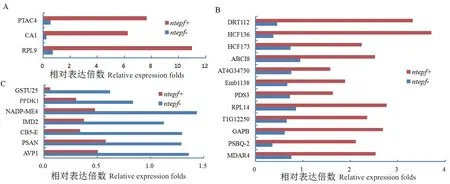
图3 气孔密度上、下调叶片共表达DEPs 积累变化Fig. 3 Accumulation variation of co-expreesion DEPs resulting from the leaves of up- or down-stomatal density
7 个DEPs 表达量随气孔密度正向变化,且其在高气孔密度下的积累量较低气孔密度高2.2-10.6倍,另外15 个DEPs 的积累量与气孔密度呈反向变化,即低气孔密度下的积累量较高气孔密度高2.0-24.6 倍。
高气孔密度下显著升高的7 个DEPs 中,IMD2、NADP-ME4 和PPDK1 参与CO2固定的三羧酸循环(TCA)。光系统I 反应中心蛋白N(PSAN)、细胞色素b5(CB5-E)、质子泵(AVP1)是光系统电子传递链的核心组分。这些蛋白质显著增加结果表明,气孔密度增加正向调控TCA 和PSI 电子传递。
气孔密度降低上调了15 个共表达DEPs,光系统II 稳定/组装因子HCF136、高叶绿素荧光表型HCF173 和光系统II 亚基Q-2(PSBQ2)参与PSII 组成亚基D1、D2 和细胞色素559 的组装,质体蓝素(DRT112)参与PSI P700 与细胞色素b6-f 间电子传递,3-磷酸甘油醛脱氢酶(GAPB)参与TCA 中1,3二磷酸甘油酸还原,八氢番茄红素去饱和酶3(PDS3)代谢八氢番茄红素形成ζ-胡萝卜素。
这些DEPs 积累随气孔密度降低上调表达的结果表明,气孔密度降低产生了PSII 组成亚基组装、PSI 电子传递和TCA 的改变,胡萝卜素合成增加预示着气孔密度降低增强了光保护反应。
2.4 气孔密度增加促进PSII-PSI复合体形成
气孔密度增加条件下,识别了如图4 所示的15个DEPs,其中如图4-A 所示的PSI 叶绿素a/b 结合蛋白2(LHCA2)和细胞色素b559 亚基α(PSBE)积累分别上调了(1.77±0.22)和(1.62±0.20)倍。LHCA2 介导LHCII-PSII 磷酸化及其迁移,促进PSIPSII-LHCII 和PSI-LHCII 超复合体形成,电子传递链组分PSBE 是PSII 反应中心的核心组分之一,两者积累上调的结果表明,气孔密度增加,加速了PSIIPSI 复合体形成和其电子传递。
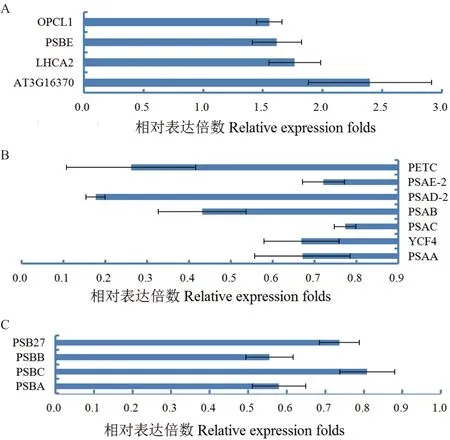
图4 气孔密度增加特异响应DEPs 积累变化Fig. 4 Accumulation variation of specific DEPs in response to rising stomatal density
气孔密度增加条件下,识别了如图4-B 所示的7 个DEPs 表达特异下调表达,其中PSI 反应中心亚基II-2(PSAD-2)减少了约18%,PSI 铁硫中心蛋白(PSBC)减少了约81%。PSI 是光驱动的电子传递氧化还原复合体,这些PSI 基本组分积累随气孔密度增加而降低的结果表明,气孔密度增加,改变PSII 和PSI 间电子传递模式。
气孔密度增加条件下,识别了如图4-C 所示的4 个特异下调表达PSII 组成蛋白质,PSII 反应中心组 成 蛋 白PSBA、PSBB(CP47) 和PSBC(CP43)积累分别减少了约58%、56%和81%,三者下调表达的结果表明,气孔密度增加,改变了PSII 组分及其与叶绿素结合模式。PSB27-H1 积累下调也意味着PSII 光系统损伤修复的改变。
结合图1-B、D 和E 结果表明,气孔密度增加,改变了PSII 反应中心蛋白质结合及光系统损伤修复模式,加速了PSII-PSI 复合体形成和其电子传递,保持了不同叶龄叶片叶绿素高水平积累,净光合速率随之增强。
气孔密度增加增强了PSII 和PSI 间的电子传递、光损伤修复水平降低的结论,与本文结果2.3 中气孔密度增加,增强了电子传递、降低光损伤修复的结论一致。
2.5 气孔密度降低倒置了叶绿素积累模式
气孔密度降低条件下,识别了如图5 所示的特异表达蛋白质。如图5-A 所示,PORB 和ATPD 分别是对照的(11.85±2.56)和(4.29±1.22)倍,PORB 催化原叶绿素酸酯还原产生叶绿素酸酯,ATPD 是光合磷酸化中F1F0 复合体组分,两者显著上调表达的结果表明,气孔密度降低增加了叶绿素积累和光合磷酸化ATP 合成。
气孔密度降低诱导了5 个蛋白质特异下调表达,其表达倍数如图5-B 所示,1-磷酸葡萄糖腺苷转移酶3(APL3)、二磷酸果糖醛缩酶3(FBA3)、6-磷酸葡萄糖异构酶1(PGI1)积累随气孔密度减少分别降低了约33%、53%和59%,即气孔密度降低,碳固定下游代谢酶的积累仅是对照的约一半。

图5 气孔密度降低特异响应DEPs 积累变化Fig. 5 Accumulation variation of specific DEPs in responses to lowering stomatal density
结合图1-B、D 和E 结果,考虑到用于iTRAQ的样品是顶端幼叶,以上结果表明,气孔密度降低,增加了幼叶叶绿素积累和光合磷酸化ATP 合成,但碳固定下游代谢活性显著降低,随叶龄增加叶绿素积累递增,株系上、中、下叶片叶绿素积累呈现倒置模式。
3 讨论
3.1 提高气孔密度可能是应对大气CO2升高的有效途径
CO2还原和H2O 光解发生在叶绿体内,气孔作为CO2和H2O 进出叶绿体的开关,响应环境变化调控CO2和H2O 的进出。长期进化形成了气孔相对固定的调控模式,维持CO2和H2O 的进出平衡,协调植物对环境的适应[41-42]。大气CO2上升及温室等人造环境的应用,要求植物重新建立气孔适应环境的平衡[42]。揭示光合作用响应气孔变化机制,不仅有助于更深入理解气孔的工作原理,而且可能开辟通过调控气孔增加作物产量的全新育种思路。
有研究已明确,气孔密度随大气CO2上升而降低[1-3],CO2富集诱导气孔导度降低达22%[4],表明以往大气CO2浓度是植物碳固定的饱和临界点。本研究发现低气孔密度导致CO2吸收不足,碳饥饿导致叶绿体早衰,碳固定仅为高气孔密度下的1/3;高气孔密度增强光合电子传递,维持高水平叶绿素积累和CO2固定;高低气孔密度导致的相反结果为应对大气CO2升高提供有益的启示。
3.2 LHCA2促进PSI-PSII-LHCII超复合体形成,参与了气孔响应
光捕获复合体PSI(LHCI)由高达70 个叶绿素a 和b 及15 个胡萝卜素和蛋白组成,其功能是吸收光能[10],LHCA2 介导LHCII-PSII 磷酸化,促进PSI-PSII-LHCII 和PSI-LHCII 超复合体形成[13-14]。本研究发现LHCA2 积累随气孔密度增加而上升,即气孔密度增加诱导LHCA2 积累增加,两者呈现正向变化;低气孔密度诱导LHCA2 积累减少,与PSIPSII-LHCII 和PSI-LHCII 超复合体结合的叶绿素应该减少;高温诱导气孔导度和叶绿体荧光参数降低、幼叶气孔形成和叶绿素合成基因呈现低水平表达的研究报道[5],证实了以上推测结论。
3.3 气孔密度、碳固定正向调控叶绿素积累
正常气孔密度下,幼叶气孔形成和叶绿素合成基因呈现低水平表达[5],低气孔密度下,幼叶PORB 和ATPD 高表达显著增加了叶绿素积累,但随着叶片发育,叶绿素积累迅速降低。该结果为气孔密度决定叶绿素积累提供了直接证据,结果也意味着大气CO2上升诱导的气孔密度降低可能减少光合产物的积累。
研究显示,保卫细胞中表达叶绿素酶基因导致叶绿素缺乏及气孔形态瘦小[6],叶肉细胞光合作用下游产物蔗糖和苹果酸积累参与气孔运动动态[11],即除了外界环境因素调控气孔动态外,叶绿体内代谢物也对气孔动态产生反馈调控。本研究发现气孔密度正向调控叶绿素积累,这些结果指向气孔密度与叶绿素积累存在相互作用,叶绿素B 缺失突变体的气孔功能异常也证实了这一点[15],互作途径解析则需本研究识别的响应气孔密度动态的DEPs。
3.4 气孔密度可能成为改变光系统损伤修复的途径
PSII 反应中心组成蛋白PSBB 和PSBC 可结合叶绿素启动光化学反应,又具有光系统损伤修复功能[22]。正常气孔密度下,遮阴可弥补叶绿素B 缺失,恢复气孔功能[37],遮阴意味着光保护色素胡萝卜素减少、光损伤修复水平下降,叶绿素积累增加吸收更多光子,以弥补遮阴的光照不足。本研究发现气孔密度增加,PSBB 和PSBC 积累随之减少,光系统损伤修复水平下降。遮阴和气孔密度增加均导致光损伤修复水平下降,遮阴减少光照,无需高水平光系统损伤修复,高气孔密度下的低水平光系统损伤修复意味着,高气孔密度诱导的光系统增强了对光照的耐受,即调控气孔密度增强植物对光照的适应性存在潜力。
4 结论
气孔密度增加,加速了PSII-PSI 复合体形成和其电子传递,降低了光损伤修复水平,保持了不同叶龄叶片叶绿素积累和净光合的高水平,碳固定随之增加。气孔密度降低,幼叶叶绿素和ATP合成增强,碳固定下游代谢酶积累减少,随叶龄增加,叶片叶绿素积累模式发生了倒置。

