异源三倍体普通烟草(SST)减数分裂期的分子细胞学研究
汪格格 邱诗蕊 张琳晗 杨国伟 徐小云 汪爱羚 曾淑华 刘雅洁
(1. 四川农业大学农学院,成都 610000;2. 四川中烟工业有限责任长城雪茄厂,德阳 618400)
烟草属(Nicotiana)有75 个种,包括11 个四倍体种、33 个二倍体种和31 个非整倍体种[1]。其中,普通烟草是种植最广泛、影响力最大的栽培烟草,利用远缘杂交将二倍体野生烟草中的优秀性状导入栽培烟草,将为栽培烟草品种改良创建资源材料。
目前,已报道的普通烟草种间杂种至少有400多种,有16 例利用烟草种间的基因转移和基因渗入进行烟草改良的成功实例[2],例如,利用种间杂交将抗烟草花叶病毒的N 基因从野生烟草Nicotiana glutinosa成功转移到栽培烟草中,育成的抗性栽培烟草品系是目前最重要的花叶病病毒病抗性资源。利用多种野生烟草细胞质和栽培烟草细胞核的胞质不育,创建了目前生产上广泛使用的雄性不育系类型,为杂交种的制备提供便利[3]。然而,远缘杂交种染色体配对异常和非同源染色体互作引起减数分裂紊乱和染色体失衡,产生非对称和非整倍体配子,极大降低了远缘杂种早期世代的育性[4],部分杂种可以通过大量的回交以恢复育性,但仍有超过60 个烟草种间无法产生子代。
异源种间杂种的减数分裂研究主要集中在减数分裂行为异常观察,包括减数分裂不同步、部分同源配对、不减数配子的产生、微核和多分孢子等。Risso-Pascotto 等[5]发现Brachiaria ruziziensis和Brachiaria brizantha种间三倍体杂种的减数分裂从中期I 到末期II 过程中发现了来自双亲基因组的不同步行为。Wang 等[6]在海甘蓝和甘蓝型油菜的属间体细胞杂种的花粉母细胞中,通过基因组原位杂交方法检测到了海甘蓝染色体和甘蓝型油菜染色体之间的部分同源配对。徐利远等[7]利用甘蓝型油菜品种奥罗和蓝花子杂交获得杂种F1,发现在杂种花粉母细胞减数分裂终变期,存在一种染色体不配对的减数分裂类型,这一类型能产生少量未减数配子。罗向东等[8]在野黄瓜与栽培黄瓜种间杂种雄配子减数分裂末期中发现,4 个染色体子群和早期落后的染色体周围逐渐形成细胞壁,产生不同类型的多分孢子体。Binsfeld 等[9]在向日葵的种间杂种的减数分裂中观察到一些落后的染色体浓缩,进而形成四分体中的微核,这些微核会形成小的不育花粉粒。
正常配子形成过程中,减数分裂只进行一次DNA 复制,进行2 次染色体分离[10]。目前许多减数分裂相关的基因已经被鉴定出。细胞周期蛋白CYCA1,2/TAM/SDS 调控减数分裂前期CO 结构的形成并且能抑制减数分裂I 的退出,其功能缺失导致减数分裂缺陷[11]。细胞周期蛋白激酶CDKA1控制减数分裂时染色体联会和二价体形成。此外,DNA 重组酶DMC1 在减数分裂I 后期的DNA 双链断裂(DSB)形成后,介导同源重组中的IH DNA 修复。外层动粒核心组份MIS12 影响着动粒复合体的装配及染色体与纺锤体微管的正确连接[12]。着丝粒组蛋白H3(CENH3,在人类中称为CENP-A)通过招募大量的动粒蛋白,介导减数分裂I 后期的同源染色体分离[13],其功能缺失导致减数分裂的着丝粒行为异常。这些减数分裂相关基因的动态平衡共同保证了减数分裂的有序进行,而种间杂种中这种平衡被打破,如油菜异源三倍体中负责同源重组配对的基因被下调表达[14]。
虽然关于减数分裂细胞学方面的研究较多,但种间杂种减数分裂相关的分子和细胞学调控机制仍有待研究。
本研究利用普通烟草栽培种K326(2n=48,SSTT)为母本,烟草野生种林烟草Q67(2n=24, SS)为父本进行远缘杂交获得异源三倍体SST,通过观察花粉母细胞减数分裂过程、染色体行为及其育性水平,找寻普通烟草-林烟草三倍体育性障碍的细胞学原因。并通过分析减数分裂相关基因表达水平变化,从分子遗传角度判断其减数分裂异常原因,为后续探寻异源种间杂种减数分裂异常的遗传学机制提供思路,为利用远缘杂交改良栽培烟草品质和抗性提供种质资源。
1 材料与方法
1.1 材料
试验所用材料为普通烟草栽培种K326(Nicotiana tabacumL.cv.K326,4n=48)和林烟草(Nicotiana sylvestriscv.Q67, 2n=24)。林烟草由四川省烟草科学研究所提供,普通烟草K326 由四川农业大学农学院提供。
1.2 方法
1.2.1 杂交种获得及体细胞染色体计数 以林烟草Q67 和普通烟草K326 为父母本杂交,得到杂种F1的种子。光照培养箱(25℃)中水培后取长度约0.5 cm 的根尖,用0.002 mol/L 的8-羟基喹啉处理24 h后转移至卡诺固定液(无水乙醇∶冰醋酸=3∶1)固定。用酸解法处理根尖,并用压片法制片后显微观察。
1.2.2 花粉育性调查 采用醋酸洋红染色法调查花粉育性。取花朵未散粉花药于37℃处理12-24 h,待花粉散出后制片观察。统计可育花粉粒以及不可育花粉粒的数目,计算百分比,并保证每个材料统计的花粉数目不低于600 个。
花粉育性(%)=可育花粉数/(可育花粉数+不可育花粉数)×100%
1.2.3 异源三倍体减数分裂行为观察 将花蕾置于卡诺固定液中处理24 h,再转入70%乙醇中4℃保存。花药处理同根尖,经卡宝品红染色,压片法制片后置于显微镜下观察减数分裂过程并拍照统计异常分裂相。
1.2.4 基因组原位杂交(GISH) 随机引物法标记探 针,使 用Invitrogen 公 司BioPrime®DNA Labeling System 试剂盒,以2.5 μg 林烟草Q67 基因组DNA 为模板,按照试剂说明制成探针;随后继续制备封阻DNA,将提取的普通烟草K326 DNA 置于沸水浴中处理30 min,于1%琼脂糖凝胶电泳检测片段长度,100-500 bp 长度内可作封阻DNA。
酶混合液中酶的成分和浓度为4%纤维素酶、2%果胶酶、1%蜗牛酶,酶解时间90-120 min。具体操作方法参照文献[15]。Olympus CX 31 荧光显微镜下观察拍照,Adobe Photoshop(2020)软件合成图像。
1.2.5 实时定量PCR 提取普通烟草K326、林烟草Q67 及两者种间异源三倍体杂种总RNA,提取材料为成熟期处于减数I 中期至减数II 末期的花蕾,重量大于0.1 g。所用耗材经DEPC 处理,利用反转录试剂盒(KR118, TIANGEN)按照试剂说明合成第一链cDNA,以ACTIN为内参基因,利用实时定量试剂盒(FP205, TIANGEN)进行RT-qPCR,反应程序为95℃ 15 min;94℃ 10 s,60℃ 20 s,40 个循环(表1)。

表1 RT-qPCR 所用引物Table 1 Primers used in RT-qPCR
2 结果
2.1 异源三倍体SST的细胞学鉴定
以普通烟草K326(SSTT, 4n=48)为母本,以林烟草(SS, 2n=24)为父本,杂交获得117 个单株,根尖染色体计数结果表明,染色体条数为36 条的种间杂种(SST)共计68 株(表2,图1),占比58.12%;根尖染色体条数27-34 条的单株34 个,占29.06%,包括部分多次统计染色体条数不一致的单株及未能成功统计染色体条数的单株;染色体条数为48 条的植株共计15 株,占12.82%,推测可能为杂交过程中花粉污染所致。选取染色体条数为36 的单株编号后盆栽,用于后续试验。

表2 杂交后代染色体条数统计Table 2 Chromosome number statistics of hybrid off spring
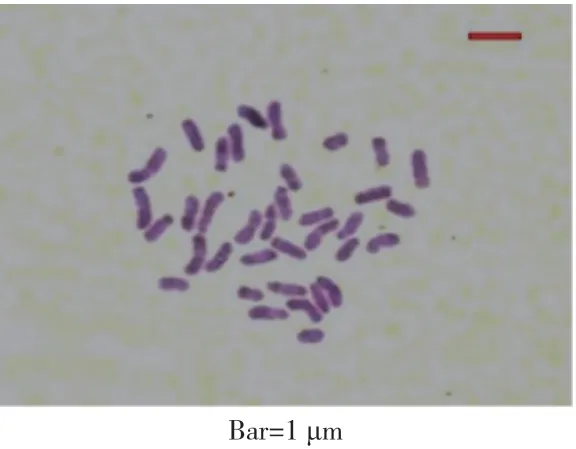
图1 种间杂种染色体计数Fig. 1 Chromosome number of the allotriploid hybrids
对染色体条数为36 条的种间杂种体细胞进行基因组原位杂交分析(图2),在种间杂种的36 条染色体中,有24 条染色体可被S 基因组探针标记,表明种间杂种的染色体组成为SST,进一步证实种间杂种为异源三倍体。
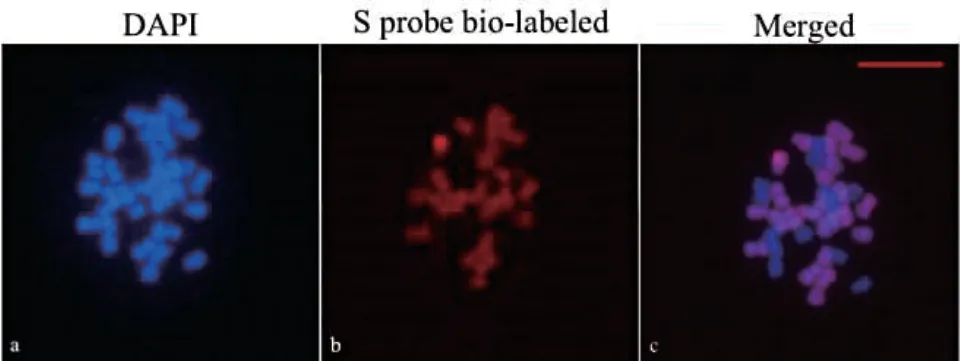
图2 种间杂种体细胞原位杂交Fig. 2 GISH analysis of allotriploid hybrids
表型统计结果(图3)表明,体染色体条数为36 的种间杂种的株高、叶片数、最大叶长叶宽、花冠长宽、花色均介于双亲之间,方差分析结果(表3)表明,种间杂种在苗期和成熟期的叶柄型态与母本K326 相似,叶色和叶型介于双亲之间,叶型呈长椭圆状与K326 类似,叶尖渐圆类似林烟草。花冠整体型态和颜色偏向K326,但是花冠长度介于双亲之间。全部种间杂种F1(2n=36)的型态表现几乎一致,均兼备双亲的多个典型表型特征,表型结果验证其为杂种。
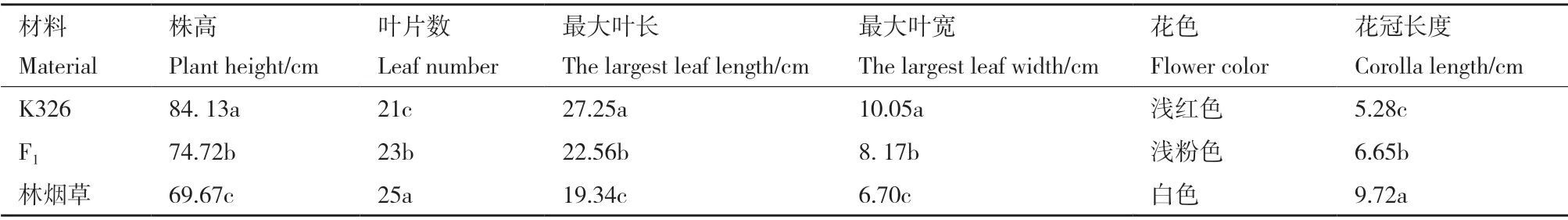
表3 种间杂种及其亲本植株形态特征比较Table 3 Morphological characteristics comparison between the allotriploid and parents

图3 种间杂种及其亲本形态学比较Fig. 3 Morphological characteristics of allotriploid hybrids and parents
2.2 异源三倍体SST的花粉育性鉴定
利用醋酸洋红染色统计体染色体条数为36 的种间杂种的花粉可染性,结果表明,种间杂种的花粉大多数着色浅、干瘪,花粉粒直径小于两亲本,正常染色的花粉数量少仅为11.05%,远低于双亲(表4 和图4),其中,包括1.28%的超大可染花粉粒(花粉直径为其余花粉粒直径的1.5 倍以上),推测其为未减数配子。由此推测种间杂种雄配子发育异常,但少量的可染花粉仍具备一定能力的育性。

表4 种间杂种及其亲本花粉育性统计Table 4 Pollen fertility of the allotriploid, BC1 and parents
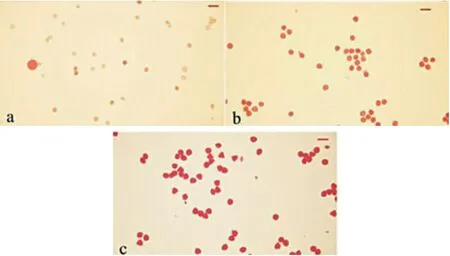
图4 种间杂种及其亲本花粉育性Fig. 4 Pollen fertility of the allotriploid and parents
2.3 异源三倍体SST减数分裂行为观察
利用涂片法观察花粉母细胞(PMCs)的减数分裂行为,体细胞染色体条数为36 的种间杂种减数分裂异常的细胞占统计总量的29.26%(图5-图6 和表5-表7)。观察到的减数分裂异常行为包括板外染色体(减数I 中期、减数II 中期)、染色体桥(减数II 前期和中期)、滞后染色体(减数I 后期、减数II 后期)、微核(减数II 末期)(图5),其中减数分裂I 和减数分裂II 中期的异常细胞频率最高,分别达到异常细胞总数中的29.52%和36.17%(表5)。此外,在减数第一次分裂前期,观察到种间杂种的部分PMCs 的同源染色体在偶线期并未完全联会(图5-a 和图5-b)。

表5 种间杂种SST 减数分裂进程的异常染色体行为Table 5 Abnormal chromosome behavior during the meiosis of the F1 SST
对减数分裂I 和减数分裂II 中期染色体落后的统计结果表明,T 染色体组的染色体在减数分裂中期更易出现板外分布。减数分裂I 和减数分裂II 中期落后染色体条数分布在1-3 条间,其中,落后2条染色体的异常细胞均最多,在2 个时期分别占比51.35%和59.56%(表6 和图6)。GISH 分析结果显示,种间杂种减数分裂I 和减数分裂II 中期的异常细胞中58.18%和52.94%的落后染色体来源于T 染色体组,23.64%和25.00%异常细胞的落后染色体来源于S 染色体组,14.55%和17.65%异常细胞的落后染色体来源于S 和T 染色体组(表7 和图6)。
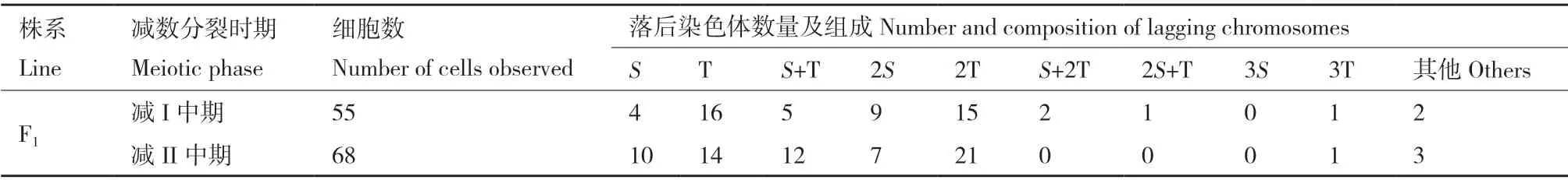
表7 落后染色体来源的 GISH 分析结果Table 7 GISH statistics of lagging chromosomes composition
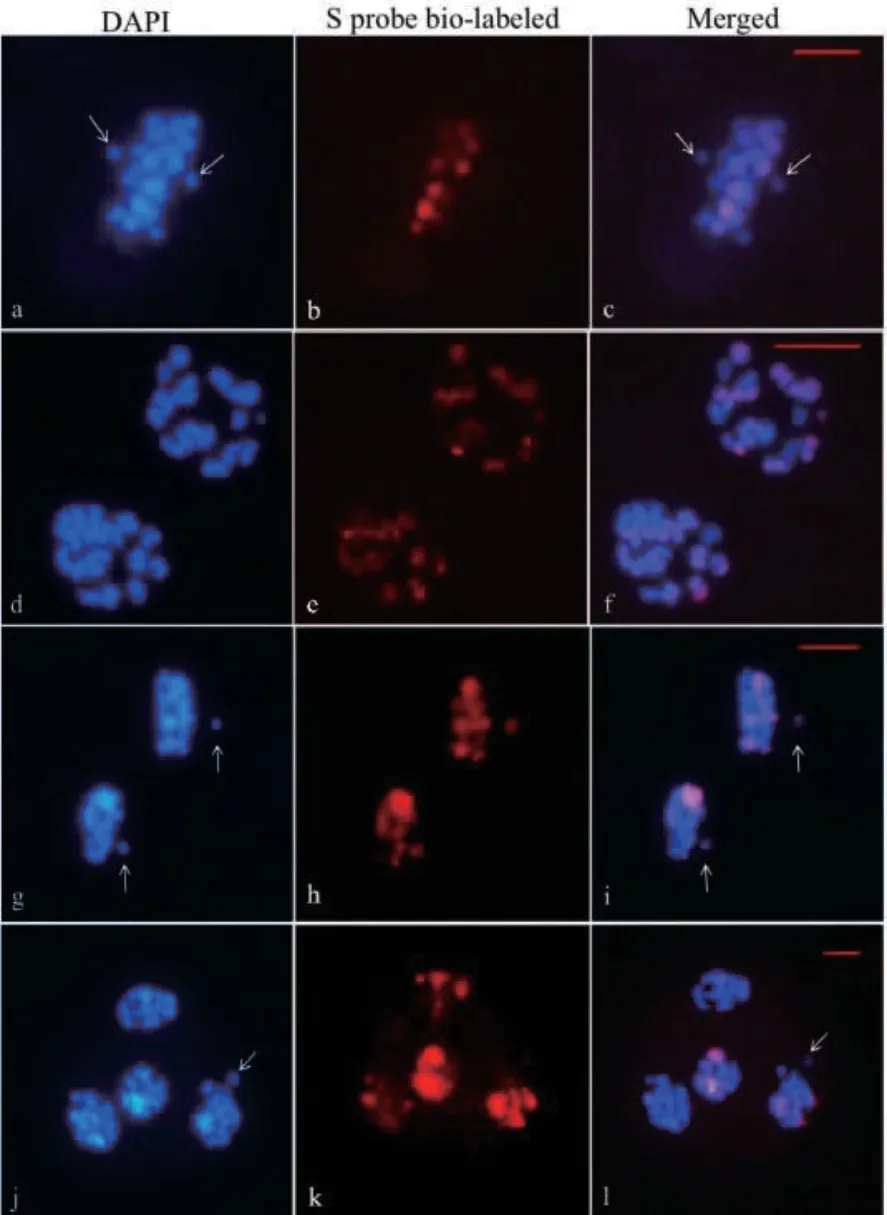
图6 种间杂种减数分裂原位杂交Fig. 6 GISH analysis of allotriploid hybrids
减数分裂I 后期和减数分裂II 后期及末期的统计结果表明,落后染色体和不均等分离同时出现,但分离后的染色体组成仍接近2∶1(S∶T)。减数分裂I 后期的主要异常为不均等分离,占到该时期异常细胞总数的77.42%,且落后一条分离比为17∶18 的类型最多,占该时期不均等分离细胞中的29.17%,不均等分离后的染色体组成大多呈现S∶T=2∶1 的比例,与体细胞SST 的染色体组成基本一致,统计到的分离比如(11S+7T):(13S+4T)(包含1 条落后染色体)、(13S+8T)∶(11S+4T)、(14S+7T)∶(10S+5T)等(表6)。减数分裂II 末期观察到占比较少的微核形成(图5-g),推测其为不均等分离或者落后染色体的导致。
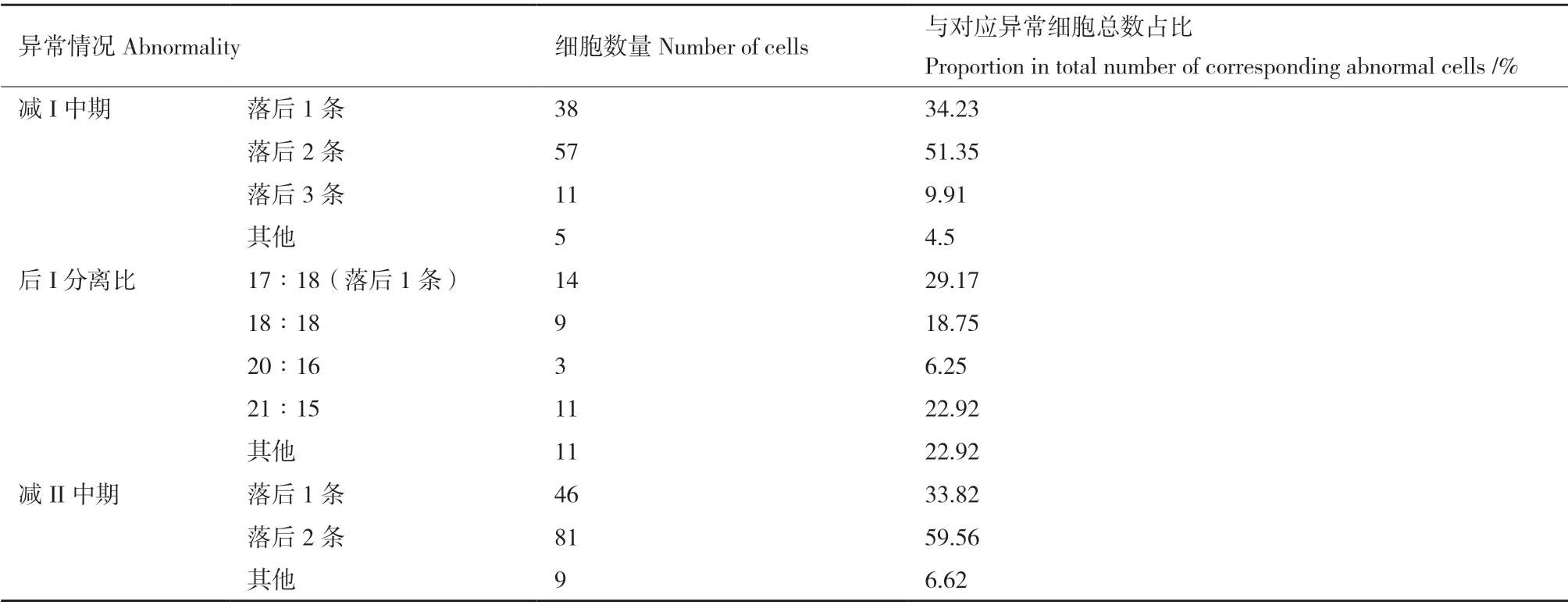
表6 种间杂种SST 减数分裂进程的染色体具体行为Table 6 Chromosome behavior of interspecific hybrids SST during meiosis
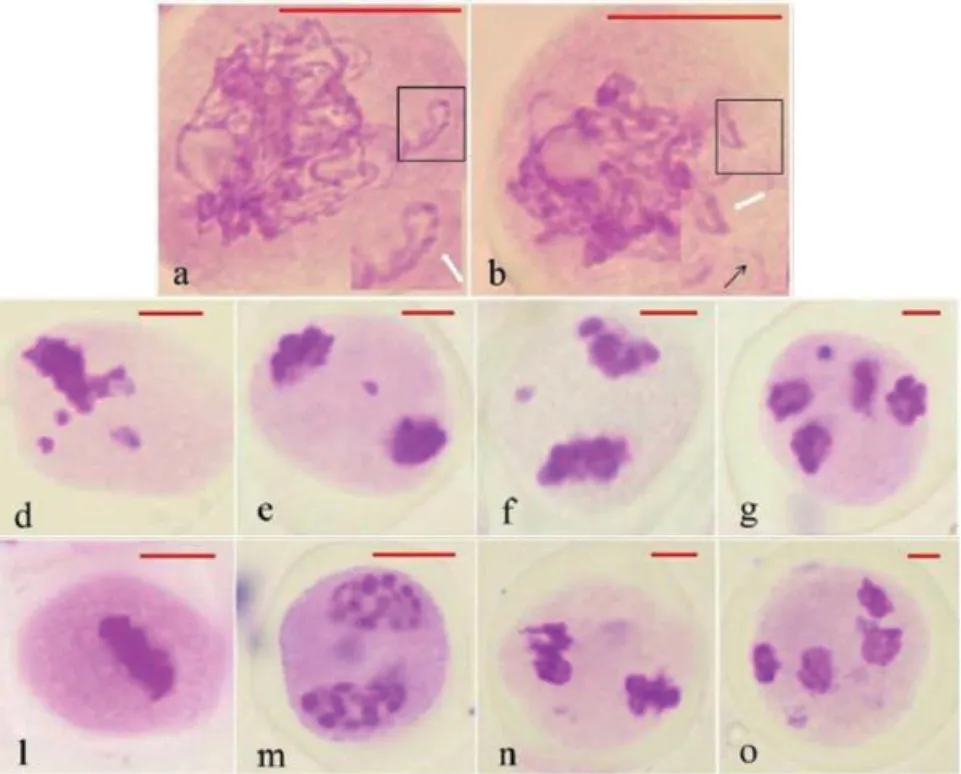
图5 种间杂种、K326 减数分裂Fig. 5 Meiosis of the allotriploids hybrid and K326
2.4 异源三倍体STO减数分裂相关基因的表达分析
按花蕾长度对减数分裂前期I 和减数分裂I 中期-减数分裂II 末期的花蕾进行分别取材,分析2 份花蕾中减数分裂相关基因(DMC1、CENH3、CDKA、CYCA和MIS12)表达水平变化,结果(图7-A)显示,种间杂种在减数分裂I 前期,除来源于S 染色体组的CDKA:5319表达显著上调和CYCA:6720表达极显著上调,其余基因均极显著下调表达,其中,包括中前期联会复合体组成相关基因DMC1,以及着丝粒相关基因MIS12和CENH3,其相对K326 极显著下调,与细胞学同源染色体联会异常的结果表现一致,缺乏MIS12表达产物致使纺锤体微管缺乏张力,导致错误的染色体行进方向。且MIS12 作为动粒外层蛋白复合物,需要与CENH3 协作以发挥其功能[12]。着丝粒相关基因的表达异常可能是导致不均等分离和落后染色体的原因。
种间杂种在减数分裂I 中期至减数分裂II 末期,相较于对照,除了MIS12和来自于T 染色体组的CDKA:0239无显著变化,其余基因(CENH3、CDKA:5319、CYCA:0111和CYCA:6720)均呈显著或极显著上调(图7-B)。其中,包括来源于S 基因组的CDKA:5319,这可能影响同源染色体重组频率,从而影响配子的形成;以及来源于S 和T 基因组的CYCA,表示三倍体减数分裂的周期转换可能出现异常,导致周期过程中精准有序的进程被打乱,造成大量的减数分裂异常表现。
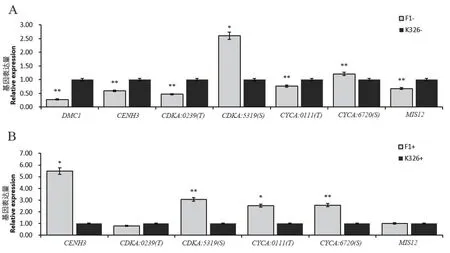
图7 减数分裂相关基因在异源三倍体及亲本K326 中的差异表达Fig. 7 Differential expressions of meiosis related genes in allotriploid and parent tobacco K326
3 讨论
异源多倍体植物,由于受到杂合性和多倍性因素的双重影响,其减数分裂过程往往具有非常复杂的染色体行为[16-19]。Li 等[20]在对种间杂种油茶的研究发现,种间杂种减数分裂过程明显异常,频繁出现染色体桥和落后染色体。王玉蛟等[21]研究表明,种间杂种芍药花粉母细胞存在单价体、三价体、不均等分离等异常,导致最终形成二分体或三分体。本研究发现种间杂种的PMCs 减数分裂进程中存在很多减数分裂异常现象,可以归为联会异常、落后染色体、染色体不均等分离、染色体桥和微核。落后染色体在种间杂种减数分裂异常情况中均占比最大,这些落后的染色体造成遗传物质增多或减少,随着分裂的进行或丢失,或在减数分裂末期形成微核,使孢子的育性降低。这些减数分裂异常的细胞都导致了不育配子的产生,但这些异常现象并不是孤立存在的,它们在不同的时期出现并且相互关联,导致了种间杂种的大部分孢子中遗传物质的不均衡,最终形成不育配子,从细胞学的角度解释了种间杂种高度不育的原因。此外,这些异常的出现伴随着染色体片段缺失、臂内倒位等变异,这些变异也造成了种间杂种植株的性状改变。种间杂种的GISH分析结果显示,在2 次减数分裂中出现最多携带落后染色体的情况,其落后的染色体都来自T 基因组。推测S 基因组染色体能够基因组内正常配对,而T基因组染色体极少形成基因组间和基因组内配对,导致T 基因组染色体落后。出现染色体桥即说明同源染色体和异源染色体发生配对,进而导致后代遗传物质交换和更激烈的遗传变化。
为进一步探索种间杂种育性下降以及植株高度不育的原因,本研究对异源三倍体SST 进行了减数分裂相关基因表达量的分析。对异源三倍体SST 中减数分裂相关基因的表达量进行分析发现,在减数第一次分裂前期,种间杂种的DMC1表达量低于同期K326 的表达量,从基因表达的层面解释了种间杂种和回交子代在偶线期联会异常。MIS12 作为动粒外层蛋白复合物,需要与CENH3 协作以发挥其功能[17],而种间杂种在减数分裂I 中期至减数第二次分裂末期,CENH3和MIS12的表达趋势均不同步,这可能导致着丝粒组蛋白和动粒蛋白不能同时发挥作用,最终造成着丝粒功能紊乱,落后染色体的出现即是着丝粒功能紊乱在减数分裂过程中的具体体现。在减数分裂I 中期至减数第二次分裂末期,相较于对照K326,种间杂种F1中来源于T 基因组的CDKA:0239表达被抑制,来源于S 基因组的CDKA:5319和CYCA:6720以及来源于T 基因组的CYCA:0111表达量均显著上调,由此从分子的角度推断种间杂种的细胞周期紊乱,细胞内出现染色体不均等分离的现象。尽管关于烟草异源三倍体的研究已经出现了很多,但是将杂交种的减数分裂行为细胞学研究与减数分裂相关基因的表达水平进行同时研究的报道还不是很多。而本研究通过K326 与林烟草进行远缘杂交,创建出新的异源三倍体种质材料,并对其生长发育情况、花药发育过程、减数分裂细胞学分析、基因表达分析进行了一系列的相关研究,讨论了杂交过程对其生殖细胞发育过程的影响,对研究种间杂交异源多倍体材料的遗传稳定性提供了一定的参考,后续可应用到包括烟草在内的多种作物的研究和遗传改良中。虽然种间杂种烟草目前在生产栽培上尚未体现出直接的应用价值,但种间杂种可以通过与其他倍性作物的杂交创建异附加系、异代换系等遗传材料,并能够以种间杂种为中间桥梁挖掘祖先种中优秀遗传资源培育新的材料。比如利用人工合成的种间杂种植物材料已经创建出了野油菜-芥蓝[22]、白菜型油菜-甘蓝头状花序[23]、甘蓝型油菜-菘蓝[24]以及抗白粉病小麦-黑麦6R[25]等单体异附加系和二体异附加系,进而研究基因组之间的亲缘关系和基因表达。
4 结论
以林烟草为父本、普通烟草为母本进行种间杂交获得68 株异源三倍体杂种,其体染色体为36 条,染色体组成为SST,种间杂种单株间表型相似,其株高、叶片数、最大叶宽叶长、花冠长度、花色兼具双亲特征,可育花粉仅有11.05%。种间杂种的花粉母细胞减数分裂期异常细胞占比为29.26%,主要异常行为为减数分裂I 和II 中期的T 染色体组来源的染色体滞后,落后染色体条数为1-3 条,其中,减数分裂I 中期和II 中期落后类型最多的分别为落后1 条T 染色体和落后2 条T 染色体的细胞;减数分裂I 后期和减数分裂II 后期及末期的异常类型主要为不均等分离、落后染色体和微核,其中减数分裂I 后期统计到多种异常分离比,但分离后染色体组成仍接近2∶1(S∶T)。减数分裂相关基因的调控功能紊乱和缺失均会导致减数分裂的异常最终影响植株的育性。