二斑叶螨抗性木薯木质素合成途径基因表达特性研究
姚晓文 梁晓 陈青 伍春玲 刘迎 刘小强税军 乔阳 毛奕茗 陈银华 张银东
(1. 海南大学热带作物学院,海口 571000;2. 中国热带农业科学院环境与植物保护研究所 农业农村部热带作物有害生物综合治理重点实验室 海南省热带作物病虫害生物防治工程技术研究中心,海口 571101;3. 中国热带农业科学院三亚研究院 海南省南繁生物安全与分子育种重点实验室,三亚 572000)
木薯(Manihot esculentaCrantz)是世界三大薯类作物之一,在世界粮食安全、生物质能源和食品加工等领域具有不可替代的地位和作用[1-3],木薯作为重要的能源和工业原料在我国热区广泛种植。二斑叶螨是世界危险性害螨[4],也是我国木薯产区的四大危险性有害生物之一, 严重制约了我国木薯产业的可持续发展[5]。目前对于二斑叶螨的防治主要依赖化学药剂,但化学防治过程中因施药技术落后和药剂难以靶标,导致农药有效利用率不足、农药的使用频率及使用剂量不断加大,造成农药残留(residue)、害虫抗药性(resistance)、害虫再猖獗(resurgence)等问题日趋严重[6]。因此,寻求安全有效绿色防控二斑叶螨的策略与方法,成为目前木薯产业发展中亟待解决的重要课题。
培育和利用抗虫品种是国内外公认的防治二斑叶螨最经济、有效、简便的带有方向性的防治途径。植物中具有抗虫功能的次生代谢物质的创新利用是培育抗虫品种的有效途径[7]。木质素是最重要的次级代谢物质之一,是细胞壁的主要成分。木质素是含量仅次于纤维素的生物高聚物[8],作为一种复杂的酚醛聚合物,不仅能起到增强细胞壁刚性的作用,还是二次增厚植物细胞壁的主要成分[9],因此,木质素是防止害虫和病原体的重要屏障。考虑到酚类物质在植物防御策略中的作用,木质素及其合成的中间体还能对害虫起到直接与间接作用,如阿魏酸在抗性棉花品种中含量更高,且对棉铃虫的生长与存活存在影响,使得幼虫体重增长迟缓、死亡率增高[10],木质素合成的中间体在作物抗虫中的重要作用,也在水稻对褐飞虱[11]、蓖麻对蓖麻夜蛾[12]、棉花对玉米螟蛉[13]的互作研究中有较多报道[14]。
木质素的生物合成是由两类基因参与调控的,一类是苯丙烷代谢途径基因,包括苯丙氨酸解氨酶(PAL)、反式肉桂酸4-单加氧酶(C4H)、4-香豆酸辅酶A 连接酶(4CL)基因;另外一类是木质素特异合成途径调控基因,由若干个调控基因组成[15]。木质素的生物合成是由木质素合成途径中的关键基因调控,研究表明,抑制4CL基因将导致转基因杨树中的木质素含量下降[16],在转基因烟草中下调了CCR基因,木质素含量同样显著下降[17]。
迄今为止,虽有研究表明木薯中的单木质素和木脂素能够对粉虱起到拒食效果[18],然而木质素及其合成途径基因在木薯抗螨性中的作用尚未见报道。鉴于此,本研究系统分析了二斑叶螨取食前后木质素合成基因表达变化情况及其与木薯抗螨性的相关性,阐明木质素及其合成途径在木薯抗螨性中的作用,为抗螨木薯新种质创制及鉴定评价提供理论依据。
1 材料与方法
1.1 材料
1.1.1 供试木薯 抗螨木薯品种C1115、缅甸(Myanmar)、SC9,感螨木薯品种SC205、面包(Bread)、BRA900[6]均由本单位木薯种质资源圃提供。
1.1.2 供试二斑叶螨饲养 二斑叶螨为本实验室以豇豆长期继代,室内饲养的试验种群。饲养温度27℃,相对湿度70%。
1.1.3 候选木质素合成途径基因 根据KEGG 网站(https://www.kegg.jp/kegg/)中已经发布的木质素合成通路,并结合前人的文献报道,选取在植物木质素合成调控研究中最为广泛的10 个基因作为候选基因,用于木薯木质素合成基因表达差异与木薯抗螨性的相关性分析,分别是PAL(苯丙氨酸解氨酶)、4CL(4-香豆酸辅酶A 连接酶)、C4H(反式肉桂酸4-单加氧酶)、HCT(莽草酸羟基肉桂酰转移酶)、CSE(咖啡酰莽草酸酯酶)、CCoAOMT(咖啡酰辅酶A-O-甲基转移酶)、COMT(咖啡酸-O-甲基转移酶)、F5H(阿魏酸-5-羟基化酶)、CCR(肉桂酰辅酶A还原酶)和CAD(肉桂醇脱氢酶)。
1.2 方法
1.2.1 二斑叶螨接种与取样 二斑叶螨接种和取样参照实验室前期建立的方法进行[19],每片叶均接种二斑叶螨50 头,并用羊毛脂均匀涂抹包裹住木薯叶柄基部防止二斑叶螨在叶片间迁移。分别于螨害后1 d、4 d 采集叶片用于RNA 提取及含量测定等实验,同时以同一时间采集的未接螨的相同品种木薯叶片为对照,每个螨害时间点设3 个重复。
1.2.2 实时荧光定量PCR 分析 根据KEGG 中已经发布的木薯木质素合成途径信息,并结合前人的文献报道,设计木薯木质素合成途径候选基因引物(表1)。提取不同螨害时间叶片的RNA,用1%琼脂糖凝胶电泳和超微量紫外分光光度计(Thermo)检测RNA 的完整性和纯度。取1.0 μg 经gDNA Eraser(TOLOBIO 公司)去除gDNA 后的RNA 样品用于cDNA 合成。以木薯Meactin为内参基因,RT-qPCR反应体系的配制参照2×Q3 SYBR qPCR Master Mix试剂盒(TOLOBIO,中国)。PCR 反应条件为95℃预温育1 min 后,以40 个循环完成如下程序:95℃变性 15 s,56℃退火30 s,72℃延伸20 s。以未经二斑叶螨为害的木薯叶片样品为对照,螨害后的木薯木质素合成途径基因表达量变化情况以为害前的相对倍数表示,根据Livak 等[20]的 2-ΔΔCt方法计算而得,每个处理均设置3 个重复。

表1 木薯木质素合成途径候选基因引物Table 1 Candidate gene primers in the synthesis pathways of cassava(Manihot esculenta Crantz)lignin
1.2.3 数据分析 采用Gradphad Prism 9 进行数据汇总整理,使用统计学软件DPS(V15.10)进行基因表达量差异分析,采用Duncan’s 新复极差法方法进行数据间的多重比较(显著性水平均为α = 0.05)。
2 结果
2.1 二斑叶螨取食前后抗、感木薯品种叶组织中的PAL基因表达差异分析
二斑叶螨为害后,PAL基因在感螨木薯品种SC205、面包(Bread)和BRA900 中的表达量变化不显著(BRA900 螨害4 d 除外)。而在抗螨木薯品种C1115、缅甸(Myanmar)、SC9 中的表达量均表现出随为害时间延长而逐渐升高的趋势,其中螨害4 d 后,PAL基因在C1115 中的表达量显著上升了2.84倍,在缅甸中显著上升了5.49 倍,在SC9 中显著上升了4.94 倍(图1-A)。相关性分析结果表明,木薯品种抗螨性与螨害后PAL基因表达量的升高呈正相关(R=0.662 4)。进一步比较相同螨害时间内抗、感螨木薯品种PAL基因的表达量变化发现,抗螨木薯品种C1115 的表达量在相同螨害时间内,均显著高于其他木薯品种(图1-B)。

图1 螨害前后不同时间各品种PAL 基因表达量变化Fig. 1 Changes of PAL gene expressions in different varieties at different times before and after mite infestation
2.2 二斑叶螨取食前后抗、感木薯品种叶组织中的4CL基因表达差异分析
二斑叶螨为害后,4CL基因在感螨木薯品种SC205、面包中的表达量显著上升,在BRA900 中显著降低。而在抗螨木薯品种C1115、缅甸、SC9 中的表达量均表现出随为害时间延长而逐渐升高的趋势,其中螨害4 d 后,4CL基因在C1115 中的表达量显著上升了7.65 倍,在缅甸中显著上升了1.49 倍,在SC9 中显著上升了0.79 倍(图2-A)。相关性分析结果表明,木薯品种抗螨性与螨害后4CL基因表达量的升高呈正相关(R=0.705 6)。进一步比较相同螨害时间内抗、感螨木薯品种4CL基因的表达量变化发现,抗螨木薯品种的表达量在螨害4 d 后显著高于感螨木薯品种(图2-B)。
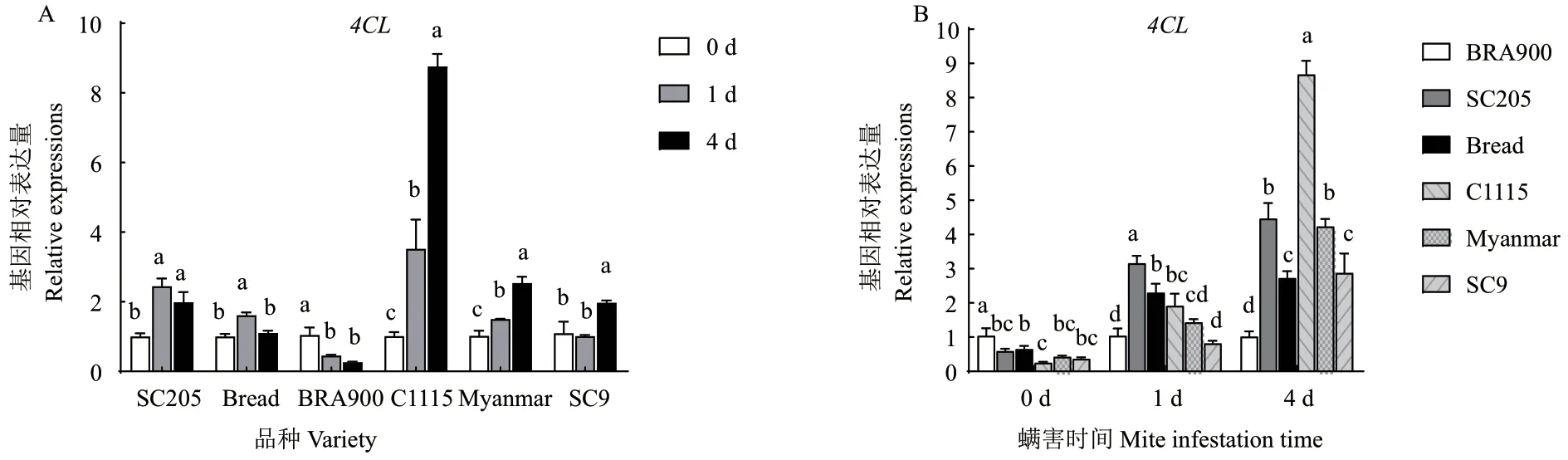
图2 螨害前后不同时间各品种4CL 基因表达量变化Fig. 2 Changes of 4 CL gene expressions in different varieties at different times before and after mite infestation
2.3 二斑叶螨取食前后抗、感木薯品种叶组织中的C4H基因表达差异分析
二斑叶螨为害后,不同感螨品种中C4H基因的表达量变化并无一致性(在SC205 中表达量提高,在面包中无显著变化,在BRA900 中显著减低)。而在3 个抗螨木薯品种中,C4H基因的表达量均随螨害时间的延长逐渐提高,其中螨害4 d 后,表达量分别较螨害前显著提高了1.96 倍(C1115)、3.75 倍(缅甸)和1.30 倍(SC9)(图3-A)。相关性分析结果表明,木薯品种抗螨性与螨害后C4H基因表达量的升高呈正相关(R=0.745 4)。进一步比较相同螨害时间内不同木薯品种C4H基因的表达量差异发现,抗螨木薯品种中C4H的表达量并不一定高于感螨木薯品种(图3-B)。
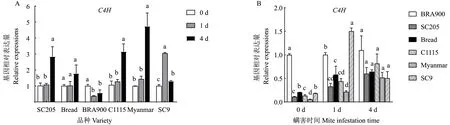
图3 螨害前后不同时间各品种C4H 基因表达量变化Fig. 3 Changes of C4H gene expressions in different varieties at different times before and after mite infestation
2.4 二斑叶螨取食前后抗、感木薯品种叶组织中的HCT基因表达差异分析
二斑叶螨为害后,HCT基因在感螨木薯品种面包和BRA900 中的表达量变化不显著,在SC205 中显著下降。而在抗螨木薯品种C1115、缅甸中的表达量先显著上升而后下降,SC9 中的表达量随螨害时间延长而逐渐升高(SC9 螨害1 d 除外),其中螨害4 d 后,HCT基因在C1115 中的表达量显著上升了1.82 倍,在缅甸中显著上升了1.96 倍,在SC9 中显著上升了4.72 倍(图4-A)。相关性分析结果表明,木薯品种抗螨性与螨害后HCT基因表达量的升高呈正相关(R=0.746 4)。进一步比较相同螨害时间内抗、感螨木薯品种HCT基因的表达量变化发现,抗螨木薯品种中HCT的表达量并不一定高于感螨木薯品种(图4-B)。
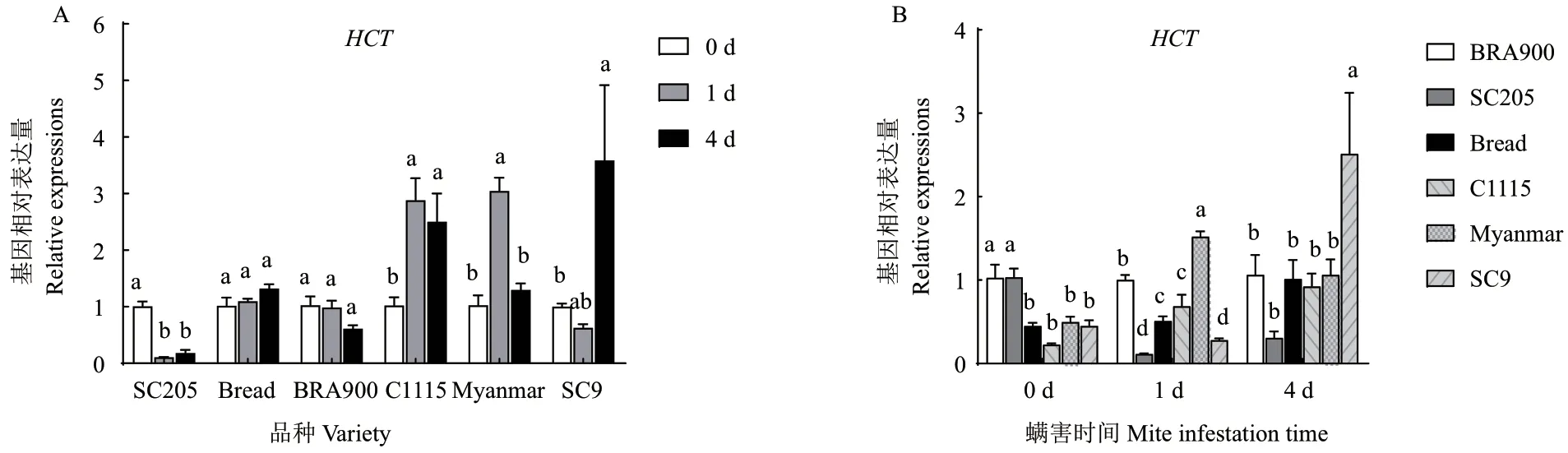
图4 螨害前后不同时间各品种HCT 基因表达量变化Fig. 4 Changes of HCT gene expressions in different varieties at different times before and after mite infestation
2.5 二斑叶螨取食前后抗、感木薯品种叶组织中的CSE基因表达差异分析
二斑叶螨为害后,CSE基因在感螨木薯品种SC205、面包和BRA900 中的表达量均表现出随为害时间延长而逐渐降低的趋势(面包螨害1 d 除外),分别下降了47.4%、81.8%和75.5%。而在抗螨木薯品种C1115、缅甸、SC9 中的表达量均表现出随为害时间延长而逐渐升高的趋势(缅甸螨害4 d 除外),螨害4 d 后,在C1115 中的表达量显著上升了1.82 倍,在SC9 中显著上升了4.72 倍(图5-A)。进一步比较相同螨害时间内不同木薯品种CSE基因的表达量差异发现,抗螨木薯品种中CSE的表达量并不一定高于感螨木薯品种(图5-B)。

图5 螨害前后不同时间各品种CSE 基因表达量变化Fig. 5 Changes of CSE gene expressions in different varieties at different times before and after mite infestation
2.6 二斑叶螨取食前后抗、感木薯品种叶组织中的COMT基因表达差异分析
二斑叶螨为害后,COMT基因在感螨木薯品种面包中表达量变化不显著,在SC205 和BAR900中表达量显著下降随后上升。而抗螨木薯品种C1115、SC9 中 的 表 达 量 显 著 下 降 了73.5% 和84.9%(螨害1 d),缅甸中的表达量变化不显著(图6-A)。进一步比较相同螨害时间内抗、感螨木薯品种COMT基因的表达量变化发现,抗螨木薯品种中COMT的表达量并不一定高于感螨木薯品种(图6-B)。
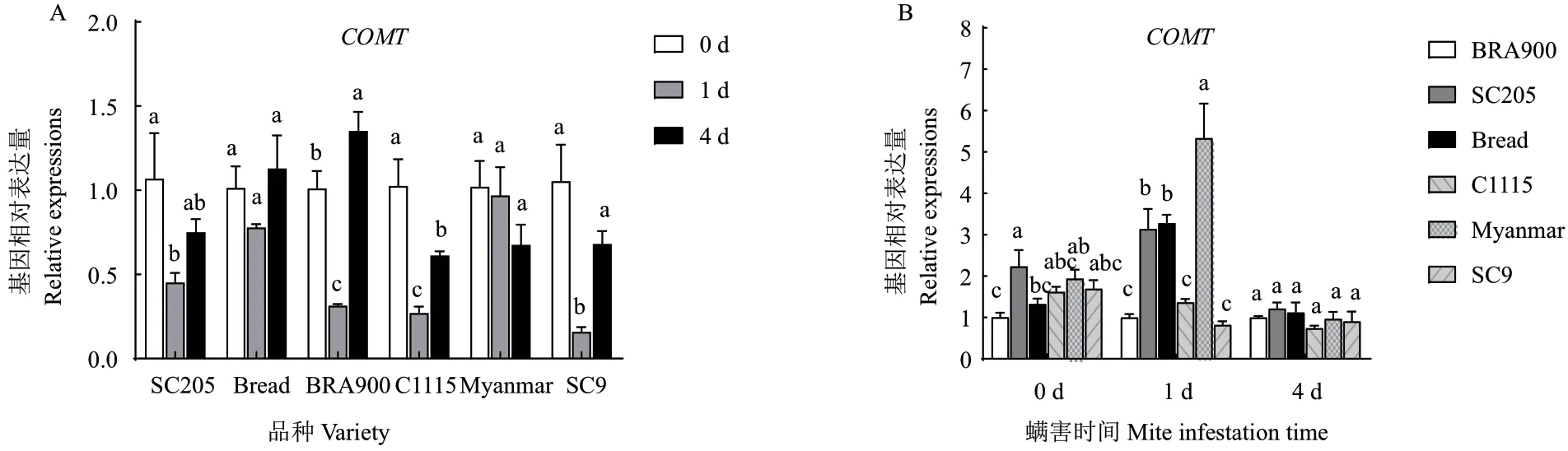
图6 螨害前后不同时间各品种COMT 基因表达量变化Fig. 6 Changes of COMT gene expressions in different varieties at different times before and after mite infestation
2.7 二斑叶螨取食前后抗、感木薯品种叶组织中的CCoAOMT基因表达差异分析
二斑叶螨为害后,CCoAOMT基因在感螨木薯品种SC205、面包中的表达量变化不显著,在BAR900中显著下降了43.8%。而在抗螨木薯品种C1115、缅甸、SC9 中的表达量均表现出随为害时间延长而逐渐升高的趋势,其中螨害4 d 后,CCoAOMT基因在C1115 中的表达量显著上升了1.29 倍,在缅甸中显著上升了1.38 倍,在SC9 中显著上升了4.96倍(图7-A)。相关性分析结果表明,木薯品种抗螨性与螨害后CCoAOMT基因表达量的升高呈正相关(R=0.636 5)。进一步比较相同螨害时间内抗、感螨木薯品种CCoAOMT基因的表达量变化发现,抗螨木薯品种的表达量在螨害4 d 后显著高于感螨木薯品种(图7-B)。
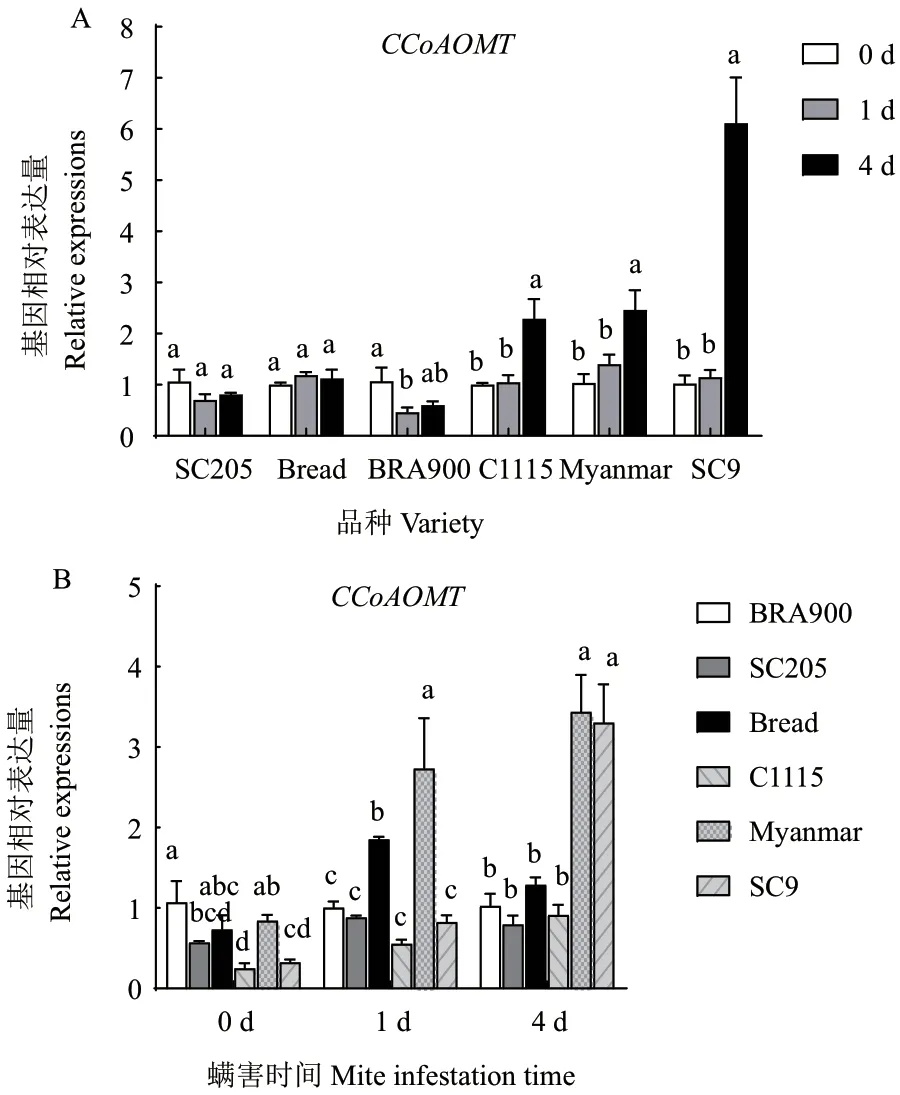
图7 螨害前后不同时间各品种CCoAOMT 基因表达量变化Fig. 7 Changes of CCoAOMT gene expressions in different varieties at different times before and after mite infestation
2.8 二斑叶螨取食前后抗、感木薯品种叶组织中的F5H基因表达差异分析
二斑叶螨为害后,F5H基因在感螨木薯品种SC205 中的表达量随螨害时间显著上升,在面包和BRA900 中的表达量变化不显著。而在抗螨木薯品种C1115、SC9 中的表达量均表现出随为害时间延长而逐渐升高的趋势,螨害4 d 后分别上升了3.61 倍和4.44 倍,在缅甸中的表达量变化不显著(图8-A)。进一步比较相同螨害时间内抗、感螨木薯品种F5H基因的表达量变化发现,F5H基因虽然在感螨品种SC205 中的表达量显著上升,但在螨害1 d 后显著低于抗螨品种,而抗螨木薯品种C115 和缅甸的表达量在螨害4 d 后均显著高于感螨木薯品种(图8-B)。
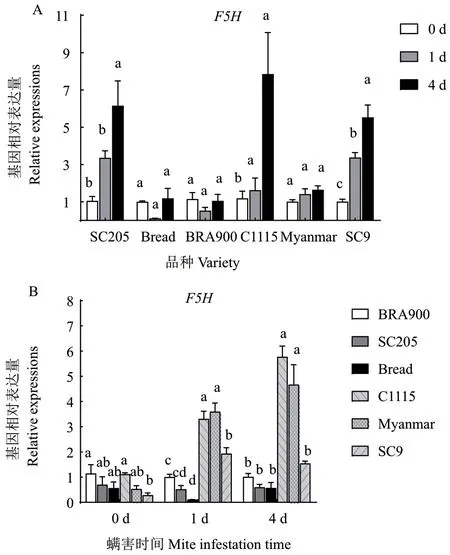
图8 螨害前后不同时间各品种F5H 基因表达量变化Fig. 8 Changes of F5H gene expressions in different varieties at different times before and after mite infestation
2.9 二斑叶螨取食前后抗、感木薯品种叶组织中的CCR基因表达差异分析
二斑叶螨为害后,CCR基因在不同感螨品种中的表达量变化并无一致性(在SC205 中表达量提高,在面包中显著减低,在BRA900 中无显著变化)。而在抗螨木薯品种C1115、缅甸、SC9 中的表达量均表现出随为害时间延长而逐渐升高趋势(SC9 螨害4 d 除外),其中螨害4 d 后,CCR基因在抗螨木薯品种C1115、缅甸、SC9 中的表达量显著上升了2.98 倍、1.1 倍和1.7 倍(图9-A)。相关性分析结果表明,木薯品种抗螨性与螨害后CCR基因表达量的升高呈正相关(R=0.769 8)。进一步比较相同螨害时间内抗、感螨木薯品种CCR基因的表达量变化发现,抗螨木薯品种的表达量在螨害4 d 后均显著高于感螨木薯品种(图9-B)。
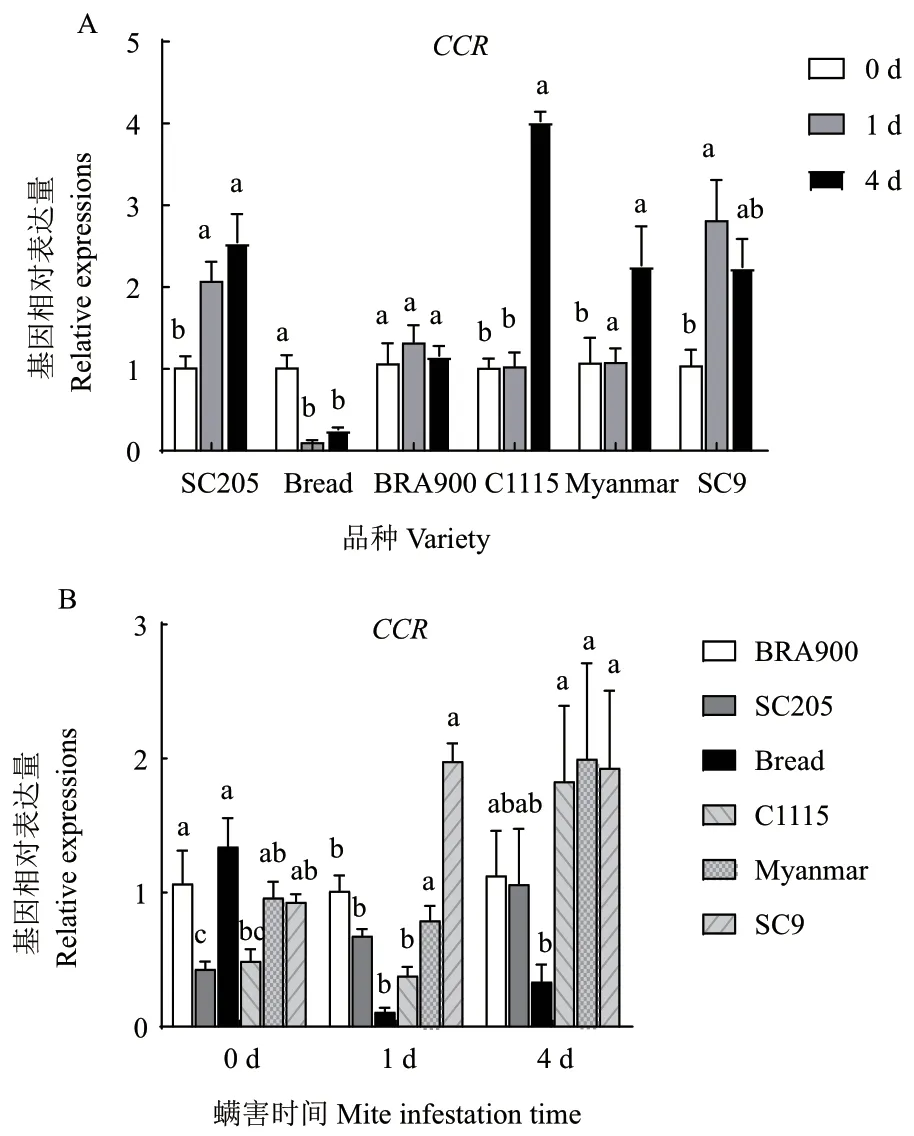
图9 螨害前后不同时间各品种CCR 基因表达量变化Fig. 9 Changes of CCR gene expressions in different varieties at different times before and after mite infestation
2.10 二斑叶螨取食前后抗、感木薯品种叶组织中的CAD基因表达差异分析
二斑叶螨为害后,CAD基因在感螨木薯品种SC205 中的表达量显著下降,在面包和BRA900 中表达量变化不显著。而在抗螨木薯品种C1115、缅甸、SC9 中的表达量均表现出随为害时间延长而逐渐升高的趋势,其中螨害4 d 后,CAD基因在C1115、缅甸和SC9 中的表达量显著上升了2.68 倍、1.11 倍和3.07 倍(图10-A)。相关性分析结果表明,木薯品种抗螨性与螨害后CAD基因表达量的升高呈正相关(R=0.813 7)。进一步比较相同螨害时间内抗、感螨木薯品种CAD基因的表达量变化发现,抗螨木薯品种中CAD的表达量并不一定高于感螨木薯品种(图10-B)。

图10 螨害前后不同时间各品种CAD 基因表达量变化Fig. 10 Changes of CAD gene expressions in different varieties at different times before and after mite infestation
3 讨论
3.1 作物次生代谢物含量及其调控基因与作物抗虫性密切相关
木质素作为植物细胞壁的主要成分,在作物抗虫中具有重要作用[21],研究发现,高粱中阿魏酸含量与其对高粱芒蝇因取食后死亡率呈正相关,而对香豆酸与之相反[22]。同样地,在玉米中也发现阿魏酸浓度与欧洲玉米螟幼虫生长速率显著负相关[23]。研究表明,木质素合成途径基因的表达水平高低,直接影响木质素含量积累。调控木质素合成途径基因的表达水平会影响木质素含量,如在转基因烟草中过表达PAL基因,木质素含量及PAL的活性均增加[24];降低转基因杨树[25]、玉米[26]中CCR的活性,植株中木质素含量将会降低甚至降到原来含量的一半;抑制甜荞[27]、桉树[28]中CCoAOMT基因的表达,能显著降低木质素含量。本研究发现,与二斑叶螨取食前相比,抗螨木薯品种中,木质素合成途径基因表达量不仅在螨害后呈显著上升的趋势,而且也高于相同螨害时间的表达水平。推测木薯的抗螨性可能与螨害后木质素合成途径基因的表达量显著提高有关,这与上述研究结果具有相似性。
3.2 木质素合成通路基因的诱导表达是植物防御害虫为害的有效途径
亚麻籽中的木脂素与新木脂素能够对桃蚜有直接的毒害作用[14],木质素含量高的植株通常具有较强的抗性[29-32]。而CCR基因在华中五味子中能够同时调控木质素与木脂素的含量[33]。同时发现作物遭受害虫为害后,其中抗性品种中的木质素合成基因的表达水平较高,响应速度较快,如多头切花菊接种桃蚜后,木质素合成基因PAL、F5H的表达量发生显著变化,并且相较于感蚜品种,抗蚜品种表达量变化响应更快,上升幅度更大,并导致木质素的迅速积累[34];抗虫水稻品种受褐飞虱取食后,PAL基因表达量迅速上升且显著高于感虫品种[35];蚜虫取食后,玉米中PAL、C4H基因的表达量在短时间内迅速提高[36]。
通过对木质素合成途径基因表达水平分析发现,木薯木质素合成途径中C4H、HCT、CSE、F5H、CAD这5 个基因在二斑叶螨为害后,抗、感螨木薯品种中的表达量总体上有所提高,而未保持较高的表达水平,且在相同螨害时间内,这5 个基因的表达量在抗、感木薯品种间整体上未表现出显著差异。与之相反,PAL、4CL、CCoAOMT、CCR基因的表达量在抗螨木薯品种中显著提高,在感螨木薯品种中显著降低或无显著差异,并且在相同的螨害时间内,抗螨木薯品种中这4 个基因的表达量普遍高于感螨木薯品种,尤其以螨害4 d 后表达量表现出显著差异。可以发现,抗螨木薯品种具有更强的调控木质素合成基因的能力以抵抗螨害,PAL、4CL、CCoAOMT、CCR这4 个基因受螨害4 d 后,在抗螨木薯品种中的表达量均显著高于感螨木薯品种,其表达量的升高均与木薯抗螨性呈显著正相关,推测木质素合成途径基因参与调控木薯抗螨机制。
3.3 下一步研究展望
本研究仅从木质素合成途径基因转录水平层面阐述了木薯对二斑叶螨的抗性机制,而二斑叶螨为害前后,木质素合成途径关键酶活性、木质素的含量差异变化尚未进行测定,其与基因表达和酶活水平是否具有一致性,及其与木薯品种对二斑叶螨抗性的相关性尚不明确。此外,本研究发现表达量显著变化的4 个基因PAL、4CL、CCoAOMT、CCR均位于木质素合成途径的前端部分,说明木质素合成中间体的特化同样可能参与木薯抗螨性的调控,上述疑问仍需后续试验进一步验证和解答。
4 结论
二斑叶螨为害后,抗螨木薯品种中木质素合成途径基因PAL、4CL、CCoAOMT、CCR的表达量显著高于螨害前水平及相同螨害时间的感螨木薯品种,表明上述4 个基因可能与木质素合成途径介导的木薯抗螨性有关。