小桐子XTH 基因家族和与之互作的miRNAs 的全基因组鉴定及其在低温适应中的作用
吕宇婧 吴丹丹 孔春艳,2 杨宇 龚明
(1.云南师范大学生命科学学院 生物能源持续开发利用教育部工程研究中心 云南省生物质能与环境生物技术重点实验室,昆明 650500;2.云南省农业科学院甘蔗研究所,红河 661699)
木葡聚糖是双子叶和非禾本科单子叶植物初生细胞壁中最丰富的半纤维素多糖[1-3]。其具有1,4-β-葡聚糖主链,主链上有1,6-α-木糖基残基[4]。木葡聚糖与纤维素通过非共价键连接,与果胶和其他多糖等物质作用形成一个三维网络,构成了植物初生细胞壁的主要承重结构[5]。木葡聚糖内转糖苷酶/水 解 酶(xyloglucan endotransglucosylase/hydrolases,XTH)属于糖苷水解酶16 家族(glycoside hydrolase 16, GH16),是细胞壁的修饰酶,参与植物细胞壁的扩张、重建和重构[6]。目前已知XTH 的最适底物是低聚葡聚糖和木葡聚糖。该酶可以切断木葡聚糖并将新产生的还原端连接到另一个木葡聚糖的非还原端(葡萄糖转移)或水解,故而具有两种活性,即催化木葡聚糖分子1,4-β-糖苷键断裂的木葡聚糖内转糖苷酶活性(XET)和催化木葡聚糖水解的水解酶活性(XEH)[7-8]。
XTH 家族由多基因编码,研究表明XTH基因家族在拟南芥[9]、水稻[10]、烟草[11]、大豆[12]和大麦[13]中分别有33、29、56、61 和24 个成员。XTH家族成员具有一个高度保守的催化位点ExDxE;还存在两个保守结构域,分别命名为Glyco_hyho_16和XET_C。XET_C 结构域是XTH 蛋白区别于GH16超家族其他蛋白的主要原因。根据XTH 蛋白的结构特点,可将该家族成员分为Group I/II、Group III和祖先组。Group I/II 表现出显著的木葡聚糖转移酶(XET)活性,Group III 成员被证明可以催化木葡聚糖水解(木葡聚糖内水解酶活性,XEH)[14-15]。XTH 通过调控细胞壁扩张性、从而对调节植物细胞生长发育起重要作用,如花的发生、根的形成和维管组织发育。在康乃馨中,DcXTH2和DcXTH3转录本在花瓣中显著积累,并在花期表现出高XET 活性[16]。拟南芥AtXTH21可通过改变纤维素的沉积和细胞壁的伸展来调节初生根的生长[17]。鹰嘴豆CaXTH1参与调节上胚轴薄壁细胞的伸长和维管组织的发育[18]。另一方面,多种非生物胁迫会对细胞壁代谢产生影响;植物响应胁迫时,XTH的表达水平及酶活性会发生变化,通过调节细胞壁的可塑性、进而调节植物细胞对逆境胁迫的响应与适应[19]。过表达辣椒CaXTH3基因可增强拟南芥植株的抗旱和抗盐性[20]。过表达AtHAP5A的拟南芥植株对冰冻胁迫表达出更强的耐受性[21]。AtXTH31通过调节细胞壁木葡聚糖含量和铝结合能力来影响拟南芥对铝胁迫的敏感性[15]。过表达胡杨PeXTH可增强木葡聚糖的降解,从而降低转基因烟草对Cd2+的吸收和积累,使Cd2+的毒性得到缓解[22];并通过改善烟草在盐胁迫下根系的生长和叶片的肉质化,进而提高其耐盐性[23]。上述研究表明XTH参与调节植物细胞的生长发育及其对多种逆境胁迫的抗性。
小桐子(Jatropha curcasL.)又称麻疯树、膏桐等,由于其种子的高含油量、茎叶中某些生物活性物质的医学用途及耐干旱瘠薄土壤环境的特性,是一种极具开发潜力的多用途能源植物[24-25]。由于其原产地为中美洲和南美洲的热带和亚热带地区[26],也是一种对零上低温敏感的冷敏植物(chilling-sensitive plant),当遭受零上低温胁迫时,细胞会发生一系列变化,如膜损伤、活性氧产生、渗透胁迫以及丙二醛积累等[27]。本团队前期研究表明,12℃低温锻炼48 h 可显著缓解小桐子幼苗在1℃强低温胁迫下的氧化胁迫和渗透胁迫,提高其存活率和抗冷性[28-29]。
miRNAs(microRNAs)是一种长度为21-24 nt的内源性小RNA,可通过转录本剪接、翻译抑制等参与对靶基因表达的负调控,进而参与植物细胞生长发育的调控及对逆境胁迫的响应[30-31]。前期研究表明,12℃低温锻炼会引发小桐子细胞内数百个miRNAs 的响应,进而调控抗冷性相关基因的表达[32]。但是否有miRNAs 参与调控植物XTH基因目前尚未见报道。
基于本实验室早期研究[33]和近期完成的小桐子低温锻炼的转录组及降解组测序结果的数据分析[34-35],发现小桐子中有数个XTH基因对12℃低温锻炼表现出强烈响应,且有多个miRNAs 靶向作用于小桐子XTHs,但目前小桐子XTH基因家族及其与之互作的miRNAs 尚未见报道。本研究对小桐子XTH基因家族以及对该基因家族成员具有靶向调控作用的miRNAs 进行了全基因组鉴定,分析了该家族各成员的理化性质、染色体定位、系统发育关系、蛋白特征、基因结构及在小桐子植株不同器官及低温锻炼、干旱及盐胁迫下的表达情况,构建了JcXTH基因家族成员与相应miRNAs 的互作网络图,以试图从一个侧面阐明JcXTH基因家族及与之互作的miRNAs 在小桐子对低温响应与适应中的作用。
1 材料与方法
1.1 材料
实验所用小桐子种子来自云南元谋县。种子用1.5%硫酸铜消毒后进行暗萌发,待其生根后,种入基质中并在植物培养箱培养,温度条件为26℃/20℃,光周期为16 h/8 h。待幼苗的第3 片真叶展开后,于12℃进行低温锻炼,分别在0、6、12、24 和48 h 取样,液氮速冻后置于-80℃下保存备用[34-36]。
1.2 方法
1.2.1 转录组、miRNA 组和降解组测序 小桐子幼苗在12℃低温锻炼过程中的转录组、miRNA 组和降解组测序见前文[34-35]。转录组数据登录号为PRJNA661688,miRNA 组登录号为PRJNA660857,降解组登录号为PRJNA661178。
1.2.2 小桐子XTH 家族成员的鉴定与理化性质预测 将拟南芥[9]、水稻[10]和大麦[13]的XTH蛋白序列作为种子序列,在小桐子基因组数据库JCDB[37](http://jcdb.liu-lab.com/) 中 进 行blastp比对,以及通过HMM 的Glyco_hydro_16 结构域(PF00722)和XET_C 结构域(PF06955)对小桐子蛋白库进行搜索,得到候选蛋白序列。进一步使用CDD(https://www.ncbi.nlm.nih.gov/cdd)和MEME v5.3.3(https://meme-suite.org/meme/tools/meme)对XTH蛋白保守结构域、特征性motif 进行验证[38-39]。去除冗余序列,将鉴定到的蛋白命名为JcXTH(1-29)。将小桐子XTH 蛋白序列提交至ExPASy 中的ProParam 工具(https://web.expasy.org/protparam/),计算氨基酸残基数量、分子量(Mw)、理论等电点(pI)和总亲水性平均值(GRAVY)。蛋白质亚细胞定位的预测通过Plant-mPLoc(http://www.csbio.sjtu.edu.cn/bioinf/plant-multi/#))进行。
1.2.3 小桐子XTH基因家族染色体定位与系统发育分析 根据Wu 等[40]发表的基因连锁图谱获取JcXTHs的位置信息,鉴定家族蛋白中存在的重复事件,计算Ka/Ks 值。Ka/Ks 值是每个非同义位点的非同义替换次数(Ka)与每个同义位点的同义替换次数(Ks)之比,该值大于1、等于1 及小于1 分别表示正向选择、中性选择和纯化选择,可以用来衡量重复基因对之间的作用。使用MEGA 10.0.5 对拟南芥和小桐子XTH 蛋白进行多序列比对,以邻接法(Neighbour-Joining method, NJ)、Bootstrap method 1 000 次重复构建进化树。
1.2.4 小桐子XTH 家族的基因结构、保守结构域以及保守蛋白基序分析 使用Gene Structure Display Server 2.0(http://gsds.gao-lab.org/)分析JcXTH家族的基因结构组成。利用TBtools 的Smart 工具分析家族蛋白的保守结构域。使用MEME v5.3.3(https://meme-suite.org/meme/tools/meme)分析家族的保守蛋白基序。
1.2.5JcXTH家族基因的表达谱分析和相应miRNAs作用网络图构建 基于本实验室的小桐子低温锻炼转录组(PRJNA661688)及miRNA 组(PRJNA660857)数据,对JcXTH家族成员及相应的miRNAs 进行表达谱分析。从小桐子数据库JCDB 下载RNAseq 数据[37],分析小桐子植株不同器官及盐和干旱胁迫下该家族成员的表达情况。从miRNA 组(PRJNA660857)和降解组(PRJNA661178)中获得靶向于JcXTHs基因的miRNAs,并在Cytoscape 软件中将靶向关系进行可视化展示,miRNAs 与JcXTHs基因用不同颜色进行区分。
1.2.6 小桐子XTH基因家族在低温锻炼下的RTqPCR 分析 为研究在低温锻炼的过程中小桐子XTH基因家族的响应,基于转录组数据分析,将6 个显著变化的JcXTHs进行RT-qPCR 验证。使用TRIzol试剂依说明书从叶片中提取总RNA,根据反转录试剂盒PrimeScript RT reagent Kit with gDNA Eraser(TaKaRa, 大连)说明将RNA 反转录为cDNA,存于-80℃。根据基因序列设计RT-qPCR 引物,以GAPDH作为内参基因[41](表1)。利用LightCycler®96 System(Roche,Switzerland)进行RT-qPCR 反应。配置10 μL 终反应体系,TB Green Premix Ex Taq II 5 μL、正反向引物各0.4 μL(10 μmol/L)、cDNA 模板1 μL 和ddH2O 3.2 μL。程序设置为95℃预变性30 s;95℃变性5 s,60℃退火5 s,2 步扩增45 个周期;最后一步进行60-97℃熔解曲线分析。采用2-ΔΔCT方法对基因的相对表达量进行分析[41]。用SPSS(v26.0)进行显著性分析,以不同的英文字母表示显著性差异(P<0.05)。

表1 RT-qPCR 分析相关引物Table 1 Related primers for RT-qPCR analysis
2 结果
2.1 小桐子XTH家族成员鉴定及理化性质分析
将拟南芥、水稻和大麦已鉴定的XTH 蛋白序列对小桐子蛋白库通过blastp 以及HMM 方法得到小桐子XTH基因家族的候选序列后,将蛋白序列提交至CDD 以及MEME 验证其结构域,鉴定到小桐子中XTH 家族成员共有29 个,将其命名为JcXTH1-29。对家族成员的理化性质预测分析结果表明(表2),该家族成员蛋白序列长度在269-341 个氨基酸,平均长度为291 个氨基酸,分子量在30.87-39.64 kD,理论等电点在4.88-9.05,GRAVY 均小于0,为亲水性蛋白。对蛋白的亚细胞定位显示,所有XTHs 均定位于细胞壁,其中15 个也同时定位于细胞质中。

表2 已鉴定的小桐子XTH 蛋白的理化性质和亚细胞定位Table 2 Physicochemical properties and subcellular location of identified XTH proteins in J. curcas
2.2 小桐子XTH家族系统发育分析
将拟南芥(AtXTH)[9]和小桐子(JcXTH)的62 个XTH 全长蛋白序列进行比对,使用MEGA 10.0.5 构建系统发育树。结果表明,XTHs 可被分为3 个主要类群,拟南芥和小桐子在各类群中的蛋白数量分布相似(图1)。分析结果表明,Group I 和Group II 之间无明显差别,成为XTH 家族最大的分支;22 个JcXTHs 和22 个AtXTHs 聚类于Group I/II中,5 个JcXTHs 在Group III 中。Group III 可 被 进一步分为A 和B 两个组,分别有2 个和3 个蛋白;Ancestral Group 则聚类到了AtXTH1、2、3 和11 及JcXTH21 和22。Group I/II 通常表现出显著的木葡聚糖转移酶(XET)活性,而聚类在Group III 中的5个蛋白JcXTH(12-16)可能具有XEH 活性。

图1 小桐子和拟南芥XTH 家族系统发育分析Fig. 1 Phylogenetic analysis of XTH family from J. curcas and Arabidopsis
2.3 小桐子JcXTH基因家族成员染色体定位和重复事件分析
基于已报道的连锁图谱[40],小桐子共有11 条染色体。将JcXTHs进行染色体定位,结果显示,29 个JcXTHs基因分布于其中9 条染色体上,且呈现不均匀分布(图2)。其中JcXTH22、JcXTH27、JcXTH25分别定位在chr01、chr08、chr10 上,在chr06 和chr09 上分布了2 个JcXTHs,chr02、chr03和chr07上各有4个JcXTHs,chr11 上分布的XTH基因最多,仅一条染色体上就有10 个JcXTHs成员(图2)。
一般认为位于100 kb 的距离范围内,5 个或更少的基因座所分隔的基因被认为是串联复制的。在chr11 和chr02 上100 kb的范围内检测到6对基因(JcXTH3/JcXTH4、JcXTH3/JcXTH5、JcXTH4/JcXTH20、JcXTH5/JcXTH6、JcXTH6/JcXTH7、JcXTH8/JcXTH10)为串联复制。串联复制基因对蛋白序列相似性较高,除JcXTH4/JcXTH20的相似性为73.8%以外,其他5 对均超过90%。此外,复制的基因距离较远,甚至位于不同的染色体上被认为是片段复制,故推测JcXTH21/JcXTH22和JcXTH23/JcXTH25两个基因对可能来自于片段复制或全基因组复制。为了确定基因的选择行为,对所有复制基因进行Ka/Ks 检验,Ka/Ks 比值均小于1(图2),说明小桐子XTH的重复基因对可能是从纯化选择进化而来。
2.4 小桐子XTH家族的特征性motif和多序列比对
XTH 家族成员具有一个高度保守的催化位点:ExDxE,对29 个小桐子XTH 家族成员进行motif 分析,表明该位点高度保守(图3-A);通过DNAMAN对其家族各成员进行多序列比对表明(图3-B),第一个谷氨酸残基(E)作为催化亲核试剂启动酶促反应,第二个E 残基是激活底物的关键[42]。图3-B 中以星号(*)标出了N-糖基化位点(NxT/S/Y),此位点可以与多聚糖结合,与蛋白质的稳定性有关。在Group I/II 中,N-糖基化位点所在位置与催化结构域相邻;Group IIIA/B 的JcXTH(12-16)蛋白,N-糖基化位点从催化结构域向C 端位移了12 个氨基酸,已报道的其他物种中也表现出相似的特征。JcXTH21 和JcXTH22 蛋白则没有这个N-糖基化位点(图2)。
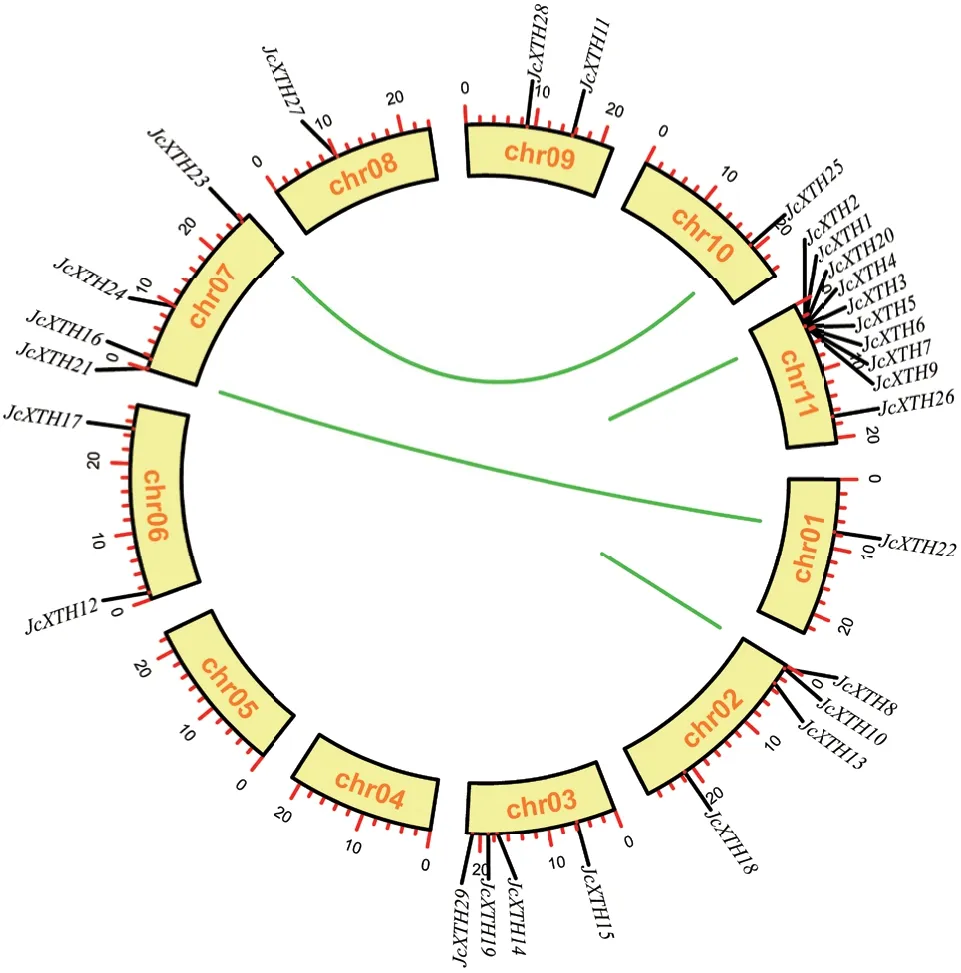
图2 小桐子JcXTH 基因家族成员染色体定位及重复事件分析Fig. 2 Chromosome location and repeat event analysis of JcXTH gene family members of J. curcas

图3 小桐子XTH 家族的特征性motif(A)和多序列比对结果(B)Fig. 3 Characteristic motif(A)and multiple sequence alignment results(B)of XTH family in J. curcas
为揭示小桐子JcXTH家族成员对12℃低温锻炼的响应,根据本实验室的测序数据[34-35],将其进行表达谱的绘制及分析。如图6 所示,在12℃低温锻炼48 h 期间,小桐子JcXTH家族各成员呈现出不同的表达模式。其中JcXTH15、JcXTH8和JcXTH2在整个低温锻炼期间均上调表达,且在48 h 时表达倍数最高;JcXTH1在48 h 内均上调表达并在24 h 时表达较显著;JcXTH19、JcXTH3、用TBtools 的Smart 工具及MEME v5.3.3 对小桐子XTH 家族蛋白进行保守结构域和蛋白基序分析(图4)。结果表明,XTH 家族蛋白中含有一个Glyco_hydro_16 结构域和一个XET_C 结构域,motif 6-3-4-1-7-2 覆盖了Glyco_hydro_16 结构域。在其中一些蛋白中,也有缺少motif 6、motif 7 的情况,对其进行结构域检测,Glyco_hydro_16 完整存在。motif 5-8 主要存在于XET_C 结构域中,在JcXTH2、JcXTH20 蛋白中,motif 10 取代了motif 5。XTH 家族的特征性motif 为motif 4。

图4 小桐子XTH 家族蛋白的保守结构域和motif 分析Fig. 4 Conserved domain and motif analysis of proteins in the XTH family of J. curcas
为进一步了解小桐子JcXTH基因在进化中的结构多样性,根据进化分组关系,使用GSDS 2.0 对其外显子/内含子结构进行了分析,获得了每个XTH蛋白的基因编码序列的结构。在29 个小桐子JcXTH基因家族成员中,15 个JcXTHs含有3 个外显子,14 个JcXTHs含有4 个外显子。Group III 和Ancestral Group 的基因均有4 个外显子,Group I/II 中7 个成员具4 个外显子,15 个含3 个外显子(图5)。

图5 小桐子JcXTH 家族基因结构分析Fig. 5 Analysis of gene structure of JcXTH family of J. curcas
2.5 小桐子XTH家族的保守结构域和蛋白基序分析以及基因结构分析
2.6 小桐子JcXTH基因家族成员在低温锻炼期间的表达谱分析
JcXTH27、JcXTH28、JcXTH16和JcXTH18则呈现出下调表达的趋势;JcXTH24、JcXTH23和JcXTH11为先下调后上调,在24 h 时明显下调;而JcXTH20和JcXTH21在冷锻炼期间没有检测到表达。值得注意的是,该基因家族的大多数成员在冷锻炼下的本底表达量均较低,JcXTH2、JcXTH18、JcXTH23和JcXTH24则显示出较高的表达丰度(图6)。

图6 小桐子JcXTH 基因家族成员在12℃低温锻炼期间的表达谱分析Fig. 6 Expression profile analysis of members of JcXTH gene family of J. curcas during chill-hardening at 12℃
2.7 小桐子JcXTH基因家族成员在不同器官中及在盐和干旱胁迫下的表达谱分析
通过对已公开的RNA-seq 数据进行分析发现,小桐子JcXTH基因家族各成员在不同器官中及在干旱和盐胁迫条件下均有明显的差异化表达现象。如图7-A 所示,在小桐子植株的不同器官中,JcXTH家族各基因在不同器官内广泛表达且表达量呈现出极大的差异。JcXTH29、JcXTH10和JcXTH13在种子和根中的表达相较于其他器官更高,在叶中的表 达 最 低;JcXTH6、JcXTH14、JcXTH1、JcXTH27和JcXTH21在各个器官中均显示高表达且表达量相差不大,表明这些基因在不同器官中均可优势表达;相较于其他基因,JcXTH18在茎中显著高表达,JcXTH3和JcXTH6在花蕾中高表达,暗示着这些基因在茎和花蕾形成中起重要作用。结果表明JcXTH基因家族的不同成员在不同的器官表现出特异性的表达模式,这可能与不同器官中特定JcXTH基因的独特功能有关。
在盐和干旱胁迫下,JcXTHs基因总体呈现明显的上调,且JcXTHs对干旱比盐胁迫响应更强烈,但不同的JcXTHs基因对盐和干旱胁迫响应有差异化的时空表达模式,在叶片中JcXTHs基因的总体上调表达趋势较根系更为明显。其中在盐胁迫下7 d 后,叶片中JcXTH28、JcXTH12、JcXTH27和JcXTH29有显著上调;在干旱胁迫下7 d 后,叶片中JcXTH28、JcXTH29、JcXTH13、JcXTH12、JcXTH14、JcXTH21等均有显著上调;另一方面,JcXTH8和JcXTH10在叶片中的表达量较低或不表达(图7-B)。
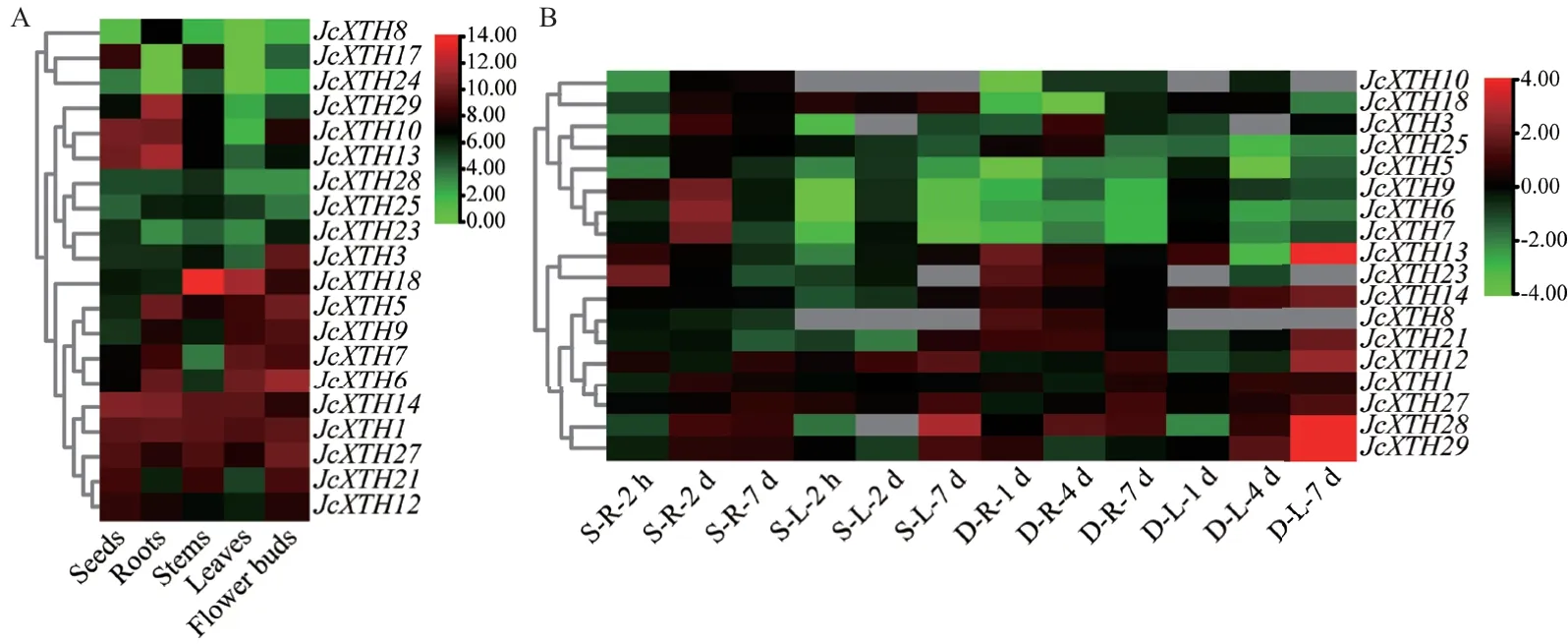
图7 JcXTH 基因在小桐子不同器官中(A)以及在盐和干旱胁迫下(B)的表达谱Fig. 7 Expression profiles of JcXTH genes in different organs(A)and under salt and drought stress(B)
2.8 小桐子JcXTH家族中低温响应基因的实时定量分析
表达谱分析结果表明,在12℃低温锻炼48 h期间,小桐子JcXTH家族29 个成员呈现出不同的表达模式(图6)。为进一步验证小桐子JcXTHs基因对低温锻炼的响应,挑选出6 个在冷锻炼下高响应的JcXTHs基因,进行RT-qPCR 分析。如图8 所示,在这6 个基因中,JcXTH2有其独特的表达模式,从0 h 到24 h 不断攀升,最高点的相对表达量是0 h 的90.75 倍,48 h 则下降,与6 h 时几乎持平,相对表达量为0 h 的8 倍左右;JcXTH3和JcXTH18的表达在冷锻炼期间呈下降趋势;而JcXTH23和JcXTH27在48 h 冷锻炼期间呈现出先下降后上升的趋势,JcXTH19则表现出先上升后下降的趋势。将RT-qPCR 结果(图8)与表达谱结果(图6)进行相关性分析表明,其中5 个基因(JcXTH3、JcXTH18、JcXTH19、JcXTH23和JcXTH27)的相关系数依次为0.97、0.93、0.98、0.92 和0.83,相关性较高;而JcXTH2的表达谱数据在48 h 时达到最大值,RTqPCR 检测在48 h 时的相对表达值较低,故相关系数较低,为0.41。

图8 小桐子JcXTH 基因家族中响应冷锻炼基因在12℃冷锻炼期间的RT-qPCR 分析Fig. 8 RT-qPCR analysis of the genes responding to chill-hardening in JcXTH gene family of J. curcas during chill-hardening at 12℃
2.9 靶向JcXTHs基因的miRNAs的鉴定与互作网络分析
基于本实验室的小桐子转录组和降解组数据,对靶向于JcXTHs的miRNAs 进行筛选鉴定,共发现68 个miRNAs 靶向调控JcXTH基因家族中的26 个成员。图9 表明,miRNAs 与JcXTHs基因的靶向互作普遍存在着一对多和多对一的关系。其中JcXTH14受到了9 个miRNAs 调控,JcXTH23与JcXTH28、JcXTH12与JcXTH16分 别 受 到 了6 个和5 个miRNAs 的调控;从miRNA 的角度来看,miR10412-y 靶向调控7 个JcXTHs成员,miR2948-x、miR5293-x、miR529-x 和miR5641-y 分别靶向调控3个JcXTHs成员(图9)。
2.10 低温锻炼期间靶向于JcXTHs基因的部分miRNAs的表达谱分析
从靶向于JcXTHs基因的68 个miRNAs 中,选取低温锻炼期间表达变化差异显著的7 个miRNAs进行表达谱分析(图10),结果显示,miR3631-y、miR7747-x 和miR7731-y 总体呈现出上调表达的趋势;miR5293 表现出先下调后上调的趋势,在12 h的下调表达倍数最高,miR11117-y 表达则与之相反;miR5373-y 和novel-m0125-5p 在6 h 时负调,12-48 h 时为正调。根据miRNAs 与JcXTHs的靶向关系(图9),对它们的表达谱(图6 和图10)进行相关性分析,miR5373 和miR7747-x 靶向于JcXTH16,相关系数为-0.74 和-0.76;miR3631-y 靶向作用于JcXTH26,其相关系数为-0.81,表明这些miRNAs 与靶向的JcXTHs基因总体呈负调控趋势。

图9 miRNAs 靶向调控JcXTHs 的网络图Fig. 9 Network diagram of targeted regulated JcXTHs by miRNAs

图10 靶向于JcXTHs 基因的部分miRNAs 在12℃低温锻炼期间的表达谱Fig. 10 Expression profile of some miRNAs targeting JcXTHs genes during chill-hardening at 12℃
3 讨论
木葡聚糖内转糖苷酶/水解酶(XTH)作为一种细胞壁修饰酶,可通过内转糖苷酶/水解酶活性对细胞壁进行松弛和重建,进而调控细胞的生长发育和对逆境胁迫的响应与适应[6,43]。XTH基因家族的鉴定在拟南芥、水稻、烟草、大豆和大麦等植物中已有研究[9-13],但在小桐子中尚未见报道。本研究表明,小桐子JcXTH基因家族共有29 个成员,可分为3 个组别,分别为具木葡聚糖转移酶(XET)活性的Group I/II、具木葡聚糖水解酶(XEH)活性的Group III 以及Ancestral Group。这29 个成员不均匀地分布于9 条染色体上;其中存在着6 对串联复制事件,均为Group I/II 的成员,以及2 对片段复制或全基因组复制事件。基因结构分析结果显示,小桐子JcXTH基因家族29 成员均含3-4 个外显子,编码269-341 个氨基酸,其蛋白主要定位于细胞壁,结构均具有Glyco_16 结构域和XET_C 结构域,并且具有负责催化活性的保守催化位点ExDxE 以及可以与多聚糖结合的N-糖基化位点。在不同的物种中,ExDxE 序列高度保守[9-13],并且是所有XTH 蛋白的结构特征,这种保守性意味着这些蛋白质的功能保守。
已有一些研究表明XTHs基因参与植物对多种逆境胁迫的响应与适应。过表达柿子DkXTH1增强了转基因拟南芥植株对盐、ABA 和干旱胁迫的耐受性[44]。在低温胁迫下,水稻OsXET9在叶片和穗部的各发育阶段均能被显著诱导上调表达[45]。拟南芥中,5 个XTH基 因(XTH-9、-15、-16、-17和-19)在近红外线到远红外线的条件下呈正向调控;敲除XTH15和XTH17基因的突变体对光信号的避光反应丧失,这些结果表明XTH介导的细胞壁松弛是植物避阴反应的关键因素[46]。玉米ZmXTH可以通过减少Al 在植物根和细胞壁的积累来提高转基因拟南芥植株对Al 的耐受性[47]。拟南芥XTH19和XTH23通过油菜素内酯信号通路转录因子BES1 依赖的途径,参与侧根的发育并帮助侧根适应盐胁迫[48]。本实验室前期研究表明,在12℃下低温锻炼2 d 可显著提高植株的耐冷性。对低温锻炼期间转录组测序数据及RT-qPCR 分析表明,小桐子JcXTH家族各成员呈现出不同的表达模式,其中JcXTH2呈现极显著上调,在冷锻炼24 h 可比对照高出90.8 倍,暗示着JcXTH2可能在小桐子低温适应中起重要作用,可作为后续小桐子分子育种的候选基因。此外,对小桐子植株不同器官的JcXTHs表达谱分析发现,大部分JcXTH家族基因具有组织特异性的表达模式,而JcXTH家族的不同成员基因对盐和干旱胁迫也呈现出不同的响应模式。这些研究结果有助于解析JcXTH基因家族不同成员的特定功能,更好探索JcXTHs基因在小桐子生长发育及逆境胁迫适应中的作用。
已知众多miRNAs 参与数以万计基因的调控、进而调节植物的生长发育及其对逆境胁迫的响应与适应[49],但目前尚未见到植物XTH基因被miRNAs调控的报道。本研究基于降解组测序数据分析结果发现,68 个miRNAs 靶向调控JcXTH基因家族中的26 个成员,并普遍呈现着一对多和多对一的关系;对低温锻炼高响应的miRNAs 与其靶向的JcXTHs的基因表达谱进行的相关分析表明二者之间呈现总体的负相关,表明miRNAs 的确参与了低温锻炼下JcXTHs基因的表达调控。这也表明植物XTHs基因的表达除受转录因子调控外,还受到许多miRNAs的调控。后续深入研究miRNAs 如何调控XTHs基因表达对更好理解植物XTH基因家族功能及其调控有重要的科学意义,而进一步阐明低温锻炼期间小桐子JcXTHs基因与相应的miRNAs 如何互作来参与小桐子对低温胁迫的适应,有助于从一个侧面揭示小桐子抗冷性形成的分子机制。
4 结论
从小桐子中鉴定到JcXTH基因家族成员29 个,可分为3 个组别,定位于9 条染色体上。29 个家族成员在小桐子不同器官、低温锻炼过程及干旱和盐胁迫下各成员存在显著的差异化表达模式,表明该基因家族不同成员的作用不尽相同。鉴定到68 个miRNAs 靶向调控JcXTH基因家族中的26 个成员,miRNAs 与其靶向的JcXTHs的基因表达呈总体负相关,表明miRNAs 参与了低温锻炼下JcXTHs基因的表达调控。

