预酶解对玛咖蛋白胃肠消化及免疫调节活性的影响
潘蕾蔓,张祎,贺萍,张艺哲,林政立,杨锦熹,张丽娜,吴晖,张猛猛
(华南理工大学食品科学与工程学院,广东广州 510640)
玛咖(Lepidium meyeniiWalp.)是一种十字花科独行菜属的一年生草本植物,原产于秘鲁安第斯高原,亦被称为“秘鲁人参”[1]。上世纪末,玛咖受到联合国粮农组织的推荐种植[2]。玛咖于2000年首次被引入国内;玛咖粉在2011年获批为新资源食品[3,4]。研究表明玛咖具有多种生物活性,如提高生育力与性欲、抗疲劳、提高免疫力、抗氧化、提高记忆力、抗肿瘤以及降血糖等功能[5-7]。目前的研究认为玛咖的这些活性主要与其中的多糖、玛咖烯和玛咖酰胺等物质有关。事实上,玛咖还含有丰富的蛋白质(9.56%~21.90%),而蛋白质经胃肠消化后可产生各种活性肽,因此蛋白质可能在玛咖的功能活性中也发挥了一定作用。然而,据报道,玛咖蛋白经模拟胃肠消化的水解度[8]明显低于一些常见的植物蛋白,如大豆蛋白、玉米蛋白等,这意味着玛咖蛋白较难被胃肠道消化,直接食用的利用率不高。目前有很多研究利用外源蛋白酶,如碱性蛋白酶、复合蛋白酶等,通过预酶解的方法处理各种难消化蛋白的酶解物,以达到充分利用蛋白质的目的,但尚未有研究探究这种方法对玛咖蛋白可消化性的影响。此外,实验室前期研究表明玛咖蛋白经胃肠消化后产生的肽具有良好的免疫调节活性[8],而预酶解的加工处理方式对玛咖蛋白胃肠消化产物的免疫调节活性的影响尚不明确。
本研究采用单酶酶解与模拟胃肠道消化相结合的方式,研究经不同蛋白酶预酶解后的玛咖蛋白可消化性的变化,并以小鼠巨噬细胞RAW 264.7为模型探究预酶解对玛咖蛋白胃肠消化后的免疫调节活性的影响,解析活性最强的消化产物中肽的序列,然后对其中免疫活性较强的肽进行活性验证和构效分析。本研究在为玛咖蛋白的深加工利用方式提供技术支撑的同时,也将深化人们对玛咖蛋白免疫调节活性的认识。
1 材料与方法
1.1 材料与试剂
玛咖根茎粉末(黄玛咖),购于云南种植基地;中性蛋白酶(100 U/mg)、碱性蛋白酶(100 U/mg)、木瓜蛋白酶(800 U/mg)、菠萝蛋白酶(300 U/mg)、复合蛋白酶(120 U/mg),上海源叶生物科技有限公司;胃蛋白酶(≥250 units/mg)、胰酶(8×USP),美国Sigma公司;5% TNBS水溶液,美国Sigma公司;福林酚,北京索莱宝科技有限公司;小鼠TNF-αELISA试剂盒,欣博盛生物科技有限公司;细胞增殖及毒性检测试剂盒(CCK-8),大连美仑生物科技有限公司;胎牛血清,上海吉泰依科赛生物科技有限公司;其它试剂均为市售分析纯;小鼠巨噬细胞RAW 264.7,实验室保存。
1.2 主要仪器与设备
集热式恒温加热磁力搅拌器,巩义市予华仪器有限责任公司;低速离心机,安徽嘉文仪器装备有限公司;冷冻干燥机,上海继谱电子科技有限公司;旋转蒸发器,上海亚荣生化仪器厂;紫外可见光分光光度计,上海棱光技术有限公司;多微孔板检测仪,新加坡PerkinElmer公司;Q Exactive质谱仪,美国Thermo Fisher科技有限公司;Dionex Ultimate 3000 RSLCnano液相色谱,美国Thermo Fisher科技有限公司;全自动氨基酸分析仪,日本HITACHI公司。
1.3 实验方法
1.3.1 玛咖蛋白的制备
在Wu等[9]的方法基础上改进,具体为:取玛咖根茎粉末为原料,以Tris-HCl溶液(0.05 mol/L,pH值9.0)为提取液,料液比1:30(g/mL),超声(60 ℃,250 W,20 min),提取时间30 min,提取温度60 ℃。离心(4 000 r/min,5 min)、过滤(500目滤布)取上清液,加入1 mol/L HCl溶液至上清液pH值达到3.75,静置30 min后再次离心(4 000 r/min,10 min),用 0.6 mol/L NaOH溶液复溶沉淀,透析脱盐(5 000 u),冻干得玛咖蛋白,蛋白含量为87.02%±1.58%。
1.3.2 玛咖蛋白消化产物的制备
1.3.2.1 玛咖蛋白消化产物制备流程图
玛咖蛋白经模拟胃肠消化、单酶预酶解与模拟胃肠消化结合制备消化产物的工艺如图1所示。
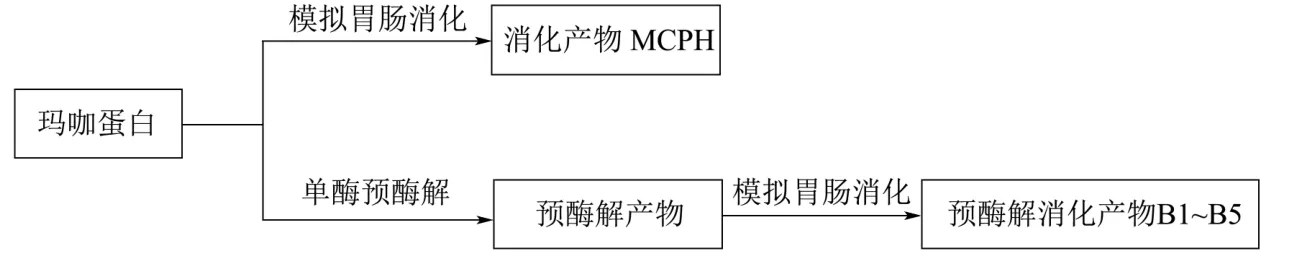
图1 玛咖蛋白消化产物制备流程Fig.1 Flow chart of preparation of maca protein digestion products
1.3.2.2 单酶预酶解
取0.5 g玛咖蛋白配成1%(m/V)的蛋白溶液,加酶至总酶活为2.0×104U,酶解3 h。沸水浴加热10 min,使玛咖蛋白中蛋白酶抑制剂失活。将温度和pH值调至表1各值,预热10 min。在酶解过程中,前30 min,每5 min调节一次pH值,随后每20 min调节一次pH值,使其保持恒定。反应结束后,将酶解液置于沸水浴中10 min以终止反应。
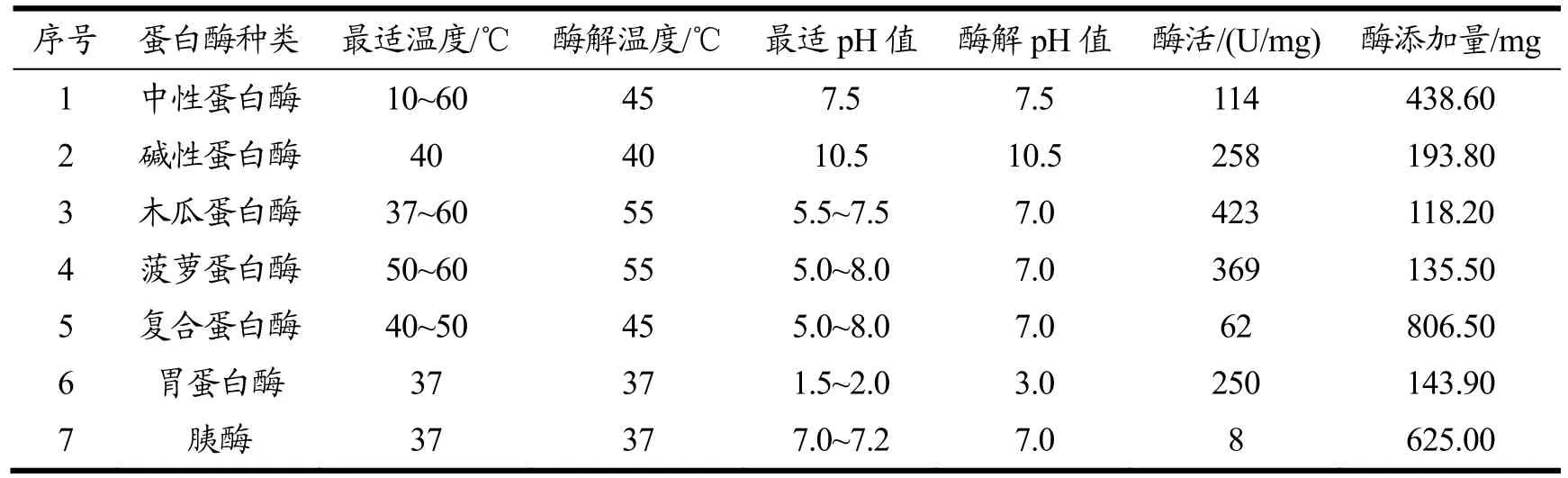
表1 七种酶的最适酶解条件Table 1 Optimal hydrolysis conditions of the seven enzymes
各酶的活力测定方法为:中性蛋白酶及碱性蛋白酶酶活的测定方法参照GB/T 23527-2009[10]紫外分光光度法;木瓜、菠萝及复合蛋白酶酶活的测定方法参照T/CCCMHPIE 1.18-2016[11];胃蛋白酶及胰酶酶活的测定方法参照《中华人民共和国药典》[12]。
1.3.2.3 体外模拟胃肠消化
参照Brodkorb等[13]的方法:①模拟胃消化阶段:滴加1 mol/L的HCl溶液使pH值达到3.0,在温度达到37 ℃后加入胃蛋白酶,磁力搅拌反应2 h;②模拟肠消化阶段:滴加1 mol/L的NaOH溶液使pH值达到7.0终止模拟胃消化,加入胰酶,37 ℃磁力搅拌反应2 h。随后将溶液pH值调至7.0,煮沸10 min使反应完全结束,冷却后离心(4 000 r/min,20 min),取上清液透析(截留量100 u),再冷冻干燥得体外模拟胃肠消化产物,并将所得各组消化产物按表1次序命名为B1、B2、B3、B4及B5。
1.3.3 消化产物得率的测定
体外模拟消化产物及预酶解后体外模拟消化产物的得率计算如下:
式中:
D——模拟胃肠消化产物得率,%;
m1——模拟胃肠消化产物干粉质量,g;
m0——所用玛咖蛋白质量,g。
式中:
D1——预酶解后模拟胃肠消化产物得率,%;
m2——预酶解后模拟胃肠消化产物干粉质量,g;
m——所用玛咖蛋白质量,g。
1.3.4 水解度(DH)的测定
1.3.4.1 玛咖蛋白的酸水解
参照Bandyopadhyay等[14]的方法,取10 mg玛咖蛋白,加入4.00 mL的HCl溶液(6 mol/L),混匀后密封于安瓿瓶中,在110 ℃下水解24 h,得玛咖蛋白完全水解液。
1.3.4.2 水解度(DH)的测定
采用J.Adler-Nissen[15]的方法(TNBS法)测定水解度,即取含有0.25×10-3~2.5×10-3amino equiv/L的酶解液(用1% SDS溶液稀释),加入2.00 mL磷酸缓冲液(pH值8.2),加入2.00 mL的0.1% TNBS溶液,振荡摇匀,水浴60 min(50±1 ℃),铝箔避光;最后加入4.00 mL的0.10 mol/L的HCl溶液终止反应,并于室温下静置30 min后在波长340 nm下完成吸光值的测定。
水解度的计算公式[16]如下:
式中:
DH——水解度,%;
hs——玛咖蛋白的氨基酸含量,mmol/L;
h0——消化产物的氨基酸含量,mmol/L;
ht——玛咖蛋白经过酸水解后的氨基酸含量,mmol/L,为1.55 mmol/L。
以L-亮氨酸为标准品,用1% SDS溶液配制浓度为0~2.0 mmol/L[17]的标准品溶液,按上述方法测定,并以在波长340 nm下测定的吸光值为纵坐标,以L-亮氨酸浓度为横坐标,绘制标准曲线。
1.3.5 可溶性肽得率(YSP)的测定
采用福林酚法测定可溶性肽含量,按照说明书方法进行测定:
称取2.0 mg预酶解消化产物配制浓度为 200 μg/mL的样品溶液,加入5.0 mL试剂甲,混匀后静置10 min,再加入0.5 mL试剂乙,立即摇匀,保温30 min,最后于波长500 nm比色。整个反应过程温度应控制在20~25 ℃。
可溶性肽得率的计算公式为:
式中:
YSP——可溶性肽得率,%;
Ts——可溶性肽含量,μg/mL;
Tp——底物中的蛋白含量,为153.55 μg/mL。
以牛血清白蛋白为标准品,配制1.0 mL浓度为0~250 μg/mL的标准液,按上述方法测定,并以波长500 nm下吸光值为纵坐标,以牛血清白蛋白浓度为横坐标,绘制标准曲线。
1.3.6 游离氨基酸含量的测定
测定方法参照GB/T 30987-2020[18]全自动氨基酸分析仪法。色谱条件:色谱柱为磺酸型阳离子交换柱;按标准配制流动相B1~B6,分离流动相流量为 0.35 mL/min,检测流动相流量为0.30 mL/min;进样量为20 μL;检测波长为570 nm和440 nm。分别吸取不同浓度的系列混合氨基酸标准工作溶液得到21种氨基酸的峰面积,建立标准工作曲线,并通过保留时间识别各氨基酸出峰顺序。将样品中各氨基酸色谱峰面积代入标准工作曲线计算含量,以水为空白样品,得各样品中氨基酸净含量。
1.3.7 分子量分布测定
测定方法参照GB/T 22729-2008[19]:采用Waters 1525高效液相色谱系统测定各玛咖蛋白消化产物的分子量。称取100 mg样品于10 mL容量瓶中,用流动相稀释至刻度,经0.22 μm微孔过滤膜过滤后进样。色谱柱:TSKgel 2000 SWXL(300 mm×7.8 mm);柱温:30 ℃;流动相:乙腈/水/三氟乙酸(45/55/0.1,V/V/V);检测波长:UV 220 nm;流速:0.5 mL/min。
称取细胞色素C(Mw 12 400 u)、杆菌酶(Mw 1 450 u)、乙氨酸-乙氨酸-酪氨酸-精氨酸(Mw 451 u)和乙氨酸-乙氨酸-乙氨酸(Mw 189 u)标准品用流动相溶解配制成0.2 mg/mL左右的标准分子量溶液。以标准品的logMw及洗脱时间绘制标准曲线:
1.3.8 免疫调节活性的评价
1.3.8.1 消化产物及肽对RAW 264.7细胞的毒性
取对数生长期的小鼠巨噬细胞RAW 264.7,以每孔1.0×105个的数量接种于96孔板,用DMEM培养液(含1%双抗,10%胎牛血清,V/V)在5% CO2、37 ℃环境中培养24 h后弃去上清液,加入100 μL含不同浓度样品的新鲜培养液(玛咖蛋白消化产物所用浓度为500 μg/mL,玛咖肽所用浓度为250 μg/mL),以正常培养液为阴性对照,培养24 h。弃去上清液,加入100 μL含10% CCK-8试剂的培养液,培养1 h后于波长450 nm处测定吸光值。
细胞存活率的计算公式为:
式中:
X——细胞存活率,%;
As——样品吸光值;
Ac——阴性对照组吸光值。
1.3.8.2 细胞因子TNF-α的测定
取对数生长期的小鼠巨噬细胞RAW 264.7,以每孔1.0×105个的数量接种于96孔板,用DMEM培养液(含1%双抗,10%胎牛血清,V/V)在5% CO2、37 ℃环境中培养24 h后弃去上清液,加入100 μL含不同浓度样品的新鲜培养液,以正常培养液为阴性对照,培养24 h。收集上清液,用小鼠TNF-αELISA试剂盒测定细胞因子TNF-α的表达量,具体操作按说明书进行。
1.3.9 消化产物中肽序列的测定
1.3.9.1 消化产物的超滤分组
称取25 mg免疫调节活性最高的玛咖消化产物,配制浓度为0.25 mg/mL的溶液,并超滤(5 000 r/min离心,60 min)取分子量小于3 ku的部分。为尽量避免截留量为3 ku的超滤膜被堵塞,在进行3 ku超滤分组前先将样品溶液经过截留量为10 ku(5 000 r/min离心,30 min)的超滤管分组。最后经蒸发浓缩、冷冻干燥得分子量小于3 ku部分消化产物。
1.3.9.2 消化产物中肽序列的测定
用样品溶解液(含φ=0.1%甲酸、φ=2%乙腈)溶解1.3.9.1所得消化产物,离心(4 ℃,13 200 r/min,20 min),取上清,进入液相色谱分离,分离后的肽段直接进入质谱仪进行在线检测。质谱原始文件经过MM File Conversion软件处理转换,得到MGF格式文件,然后用MASCOT检索UniProt数据库(Mascot:http://www.matrixscience.com/)。
1.3.10 免疫调节肽的筛选
1.3.10.1 预筛选
根据免疫调节活性肽具有肽链短、一般由2~10个氨基酸组成的特点[20,21],对1.3.9.2所得肽段进行筛选。
1.3.10.2 生物活性评估
将1.3.10.1筛选所得肽段导入Bioware网站的PeptideRanker程 序[22]( http://distilldeep.ucd.ie/ PeptideRanker/)预测肽段具有生物活性的可能性,并选择可能性评分大于0.5的肽段。
1.3.11 HPEPDOCK分子对接筛选
将1.3.10.2筛选得到的肽段导入HPEPDOCK网站[23],与模式识别受体TLR2(PDB ID:1FYW)及TLR4(PDB ID:5IJD)进行分子对接,筛选分子对接亲和力最强的10个肽段进行合成。
1.3.12 肽段合成
采用Fmoc固相合成法合成1.3.10.2筛选得到的10个肽段,该步骤委托吉尔生化(上海)有限公司完成。
1.3.13 AutoDock分子对接分析
利用软件 ChemBio3D Ultra 14.0及AutoDockTools-1.5.6对1.3.11筛选所得肽段经进行设计及处理。根据受体蛋白的ID从PDB数据库下载蛋白结构,利用PyMOL 2.3.0 AutoDockTools-1.5.6处理受体蛋白。最后,利用PyMOL 2.3.0和LIGPLOT V 2.2.4分析对接结果的相互作用模式。
1.3.14 HOMO分析
使用GaussView 5.0以及Gaussian 09进行密度泛函数理论计算;使用Gaussian 09以B3LYP/6-31制图并分析活性位点。
1.3.15 数据处理
使用SPSS 26.0软件进行显著性差异分析,将P<0.05视为差异显著;使用Origin 2021进行制图。
2 结果与讨论
2.1 预酶解对玛咖蛋白可消化性的影响
以L-亮氨酸为标准品测定的水解度标准曲线为y=0.286 1x-0.000 3(R2=0.999 6);根据牛血清蛋白测定的可溶性肽得率标准曲线为y=0.000 6x+0.000 9(R2=0.999 7)。
以仅经过体外模拟胃肠消化所得的消化产物MCPH为阴性对照,消化产物B1~B5的得率、水解度(DH)及可溶性肽得率(YSP)如表2。
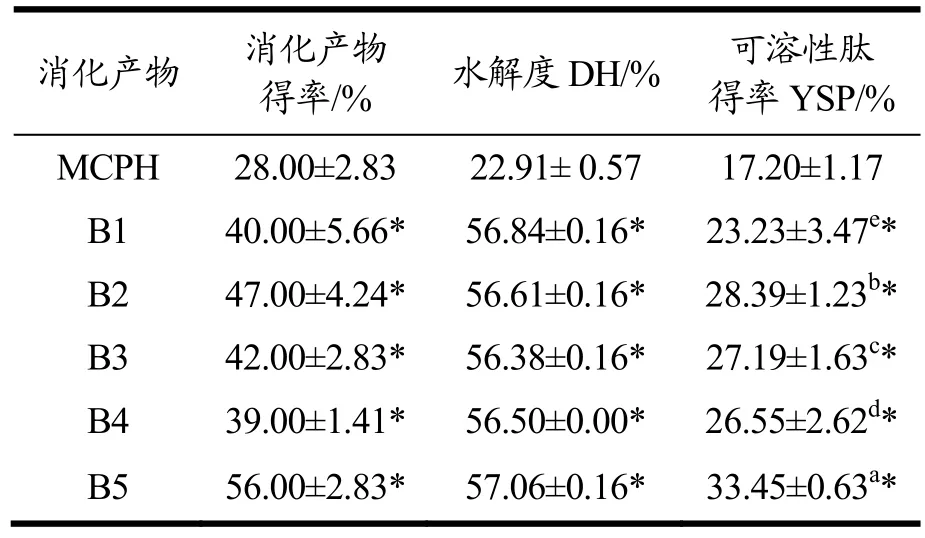
表2 六组消化产物的得率、水解度及可溶性肽得率Table 2 Yields, DHs, YSPs of the six digestion products
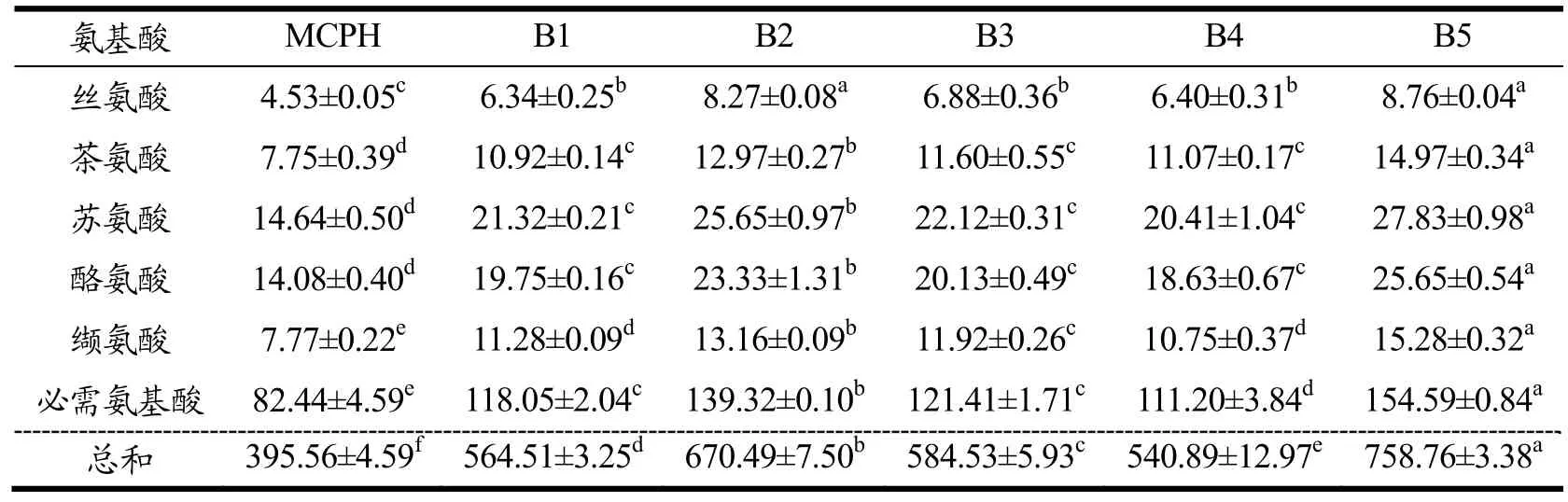
水解度是用于监控及描述蛋白水解程度的重要指标。玛咖蛋白经模拟胃肠消化后所得MCPH的水解度为22.91%,低于一些常见食物蛋白质消化产物的水解度,如小麦胚芽蛋白的为40.25%[24],豌豆蛋白的为53.62%[25],非洲核桃蛋白的为73.47%[26]。其原因可能是玛咖蛋白为碱溶蛋白,水溶性较差,在肠液中的分散性较低,难以与蛋白酶发生相互作用[27]。与MCPH相比,B1~B5的消化产物得率及水解度得到了显著的提高(P<0.05),其中消化产物得率的提高幅度为10%~ 30%,水解度提高约35%。蛋白质经酶解后会产生分子量不同的肽以及游离氨基酸;酶解程度越高,产生的可溶性肽和游离氨基酸的含量也越高。因此,可溶性肽和游离氨基酸的得率也可用于评价蛋白质的可消化性。MCPH的可溶性肽得率为17.20%,低于常见食物蛋白的数值,如小麦胚芽蛋白的为40.25%[24],大豆蛋白的为88%[28]以及卵清蛋白的为99%[29],而B1~B5的可溶性肽得率皆明显高于MCPH,增长幅度为5%~16%。由此可见,预酶解能显著提高玛咖蛋白经胃肠消化后产生的可溶性肽的含量。从表3可知,五组经预酶解处理所得产物的游离氨基酸总量皆明显高于MCPH的,增长幅度为37%~92%;其中B5的增长幅度最大,游离氨基酸总量的增长率约为92%,说明预酶解处理能提高玛咖蛋白胃肠消化产生的游离氨基酸含量。
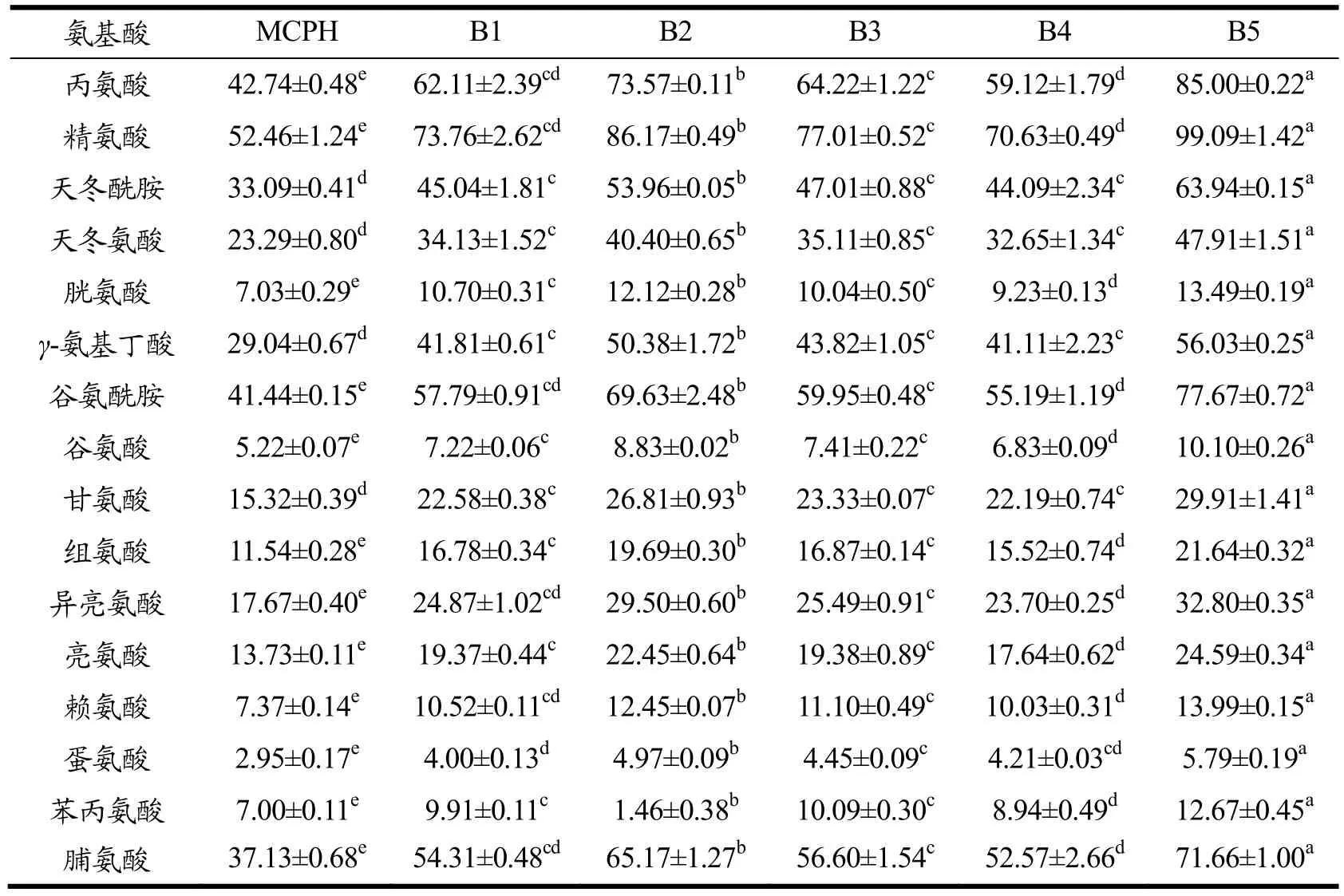
表3 六组消化产物的游离氨基酸含量(mg/100 g玛咖蛋白)Table 3 Free amino contents of the six digestion products (mg/100 g maca proteins)
续表3
综上,经过预酶解处理后,玛咖蛋白胃肠消化产物的水解度、可溶性肽得率及游离氨基酸含量皆得到了显著的提高(P<0.05),意味着预酶解处理能使玛咖蛋白具有更高的消化率和生物可及性[30],更易被人体所吸收利用。
2.2 各组消化产物的免疫调节活性
巨噬细胞是先天性免疫的重要组成部分,其发挥免疫功能的途径包括吞噬病原体、分泌细胞毒性分子(如NO)以及分泌细胞因子(如TNF-α、IL-6等)[21]。小鼠巨噬细胞RAW 264.7是评价天然产物免疫调节活性最常用的细胞模型,故本研究采用该模型探究MCPH及B1~B5各组消化产物的免疫调节活性,具体为各组消化产物对小鼠巨噬细胞RAW 264.7的存活率和TNF-α分泌情况的影响。由图2可见,500 μg/mL的各组消化产物对小鼠巨噬细胞RAW 264.7无明显毒性作用。在该浓度下,六组消化产物皆能提高TNF-α的分泌量。相比于MCPH,经相同质量浓度的B1~B5刺激的RAW 264.7细胞的TNF-α表达水平没有明显变化或略有降低,但由于B1~B5各组的消化产物得率比MCPH高10%~30%,即经预酶解后,玛咖蛋白通过胃肠消化所产生的具有免疫活性的消化产物更多。因此,预酶解实际上增强了玛咖蛋白的免疫活性,这与Cian等[31]的发现相同。
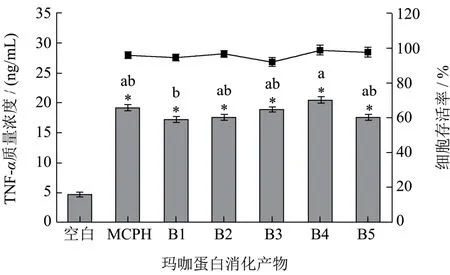
图2 玛咖蛋白消化产物对RAW 264.7细胞的存活率及TNF-α分泌量的影响Fig.2 Effects of maca digestion products on the viability and secretion of TNF-αof cell line RAW 264.7
蛋白质消化产物中的主要活性物质为小分子肽。一般认为,生物活性肽多为含2~10个氨基酸残基的短肽。在对食源免疫调节肽的研究中,Ahn等[32]发现鲑鱼副产物中的免疫调节肽分子量集中在1 000~ 2 000 u,Ndiaye等[33]发现黄豌豆种子免疫调节肽为小分子肽(1 000 u),而Wu等[34]从小麦胚芽蛋白中获得的免疫调节肽的分子量范围为300~1 450 u。由表4可知,经过预酶解处理后,玛咖蛋白模拟胃肠消化产物中分子量为500~2 000 u的小分子肽含量略有提高,其中B4中分子量处于500~2 000 u范围的小分子肽占比最大,这可能是B4活性更高的原因。
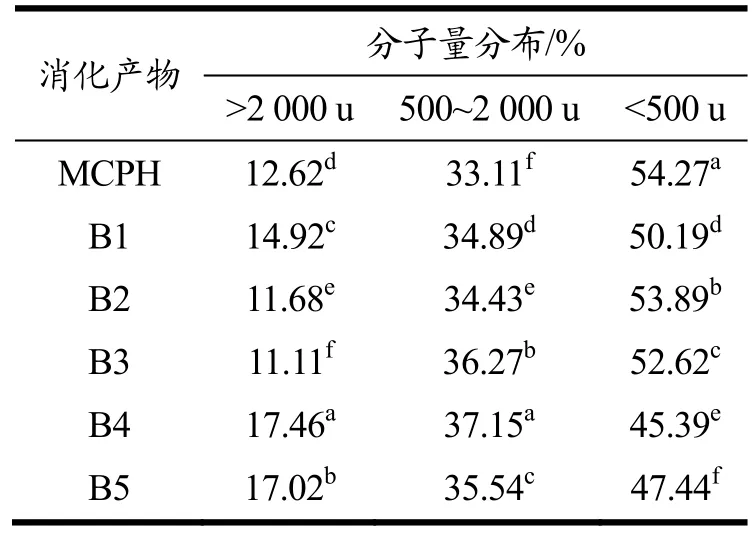
表4 六组消化产物的分子量分布Table 4 Molecular weight distributions of the six digestion products
2.3 预酶解消化产物B4中肽段的序列及免疫调节活性
由于B4展现出的免疫调节活性最高,因此后续选择预酶解消化产物B4进行肽段序列测定及免疫调节活性肽的筛选。多项研究表明,免疫调节肽为分子量在3 000 u以下的小分子肽[35],故本实验选择超滤后分子量小于3 000 u的组分进行肽段的测序,而该超滤组分冻干物的得率为65.10%。经鉴定,B4中分子量小于3 000 u的组分中共含有15 154个肽,其中符合免疫活性肽组成氨基酸数量一般规律(2~10个)[20,21]的有2 546个肽段。将符合条件的肽段导入Peptide Ranker程序评分,其中分数>0.5(具有生物活性的可能性>50%,一般可被认为具有生物活性)的肽段数量为437,占比为17.17%。另外,实验室前期从MCPH中经超滤小于3 000 u活性组分经测定含有3 345条肽,数量较B4的少。有研究指出,免疫活性肽激活巨噬细胞的机制包括了激活其细胞膜表面的toll-like受体(TLRs)[31],其中TLR2和TLR4是免疫活性肽最为常见的受体。HPEPDOCK能预测蛋白质-肽段的相互作用力,并给出结合模型的评分,分数的负值越大,表明该肽段与蛋白质受体的亲和力越强[23]。因此,肽段最后被导入HPEPDOCK网站分别与模式识别受体TLR2、TLR4进行分子对接,而评分在前10名的肽段如表5所示。免疫调节肽往往是富含疏水性氨基酸、芳香族氨基酸及带电荷[20]的小分子肽。由表5可知,10个最终筛选得到的肽段分子量集中在900~1 300 u,皆带有电荷,并都富含疏水性氨基酸及芳香族氨基酸,其中,疏水性的芳香族氨基酸(苯丙氨酸及色氨酸)占各肽段氨基酸个数的12.50%~33.33%,这可能暗示着10个肽段具有较强免疫调节活性。
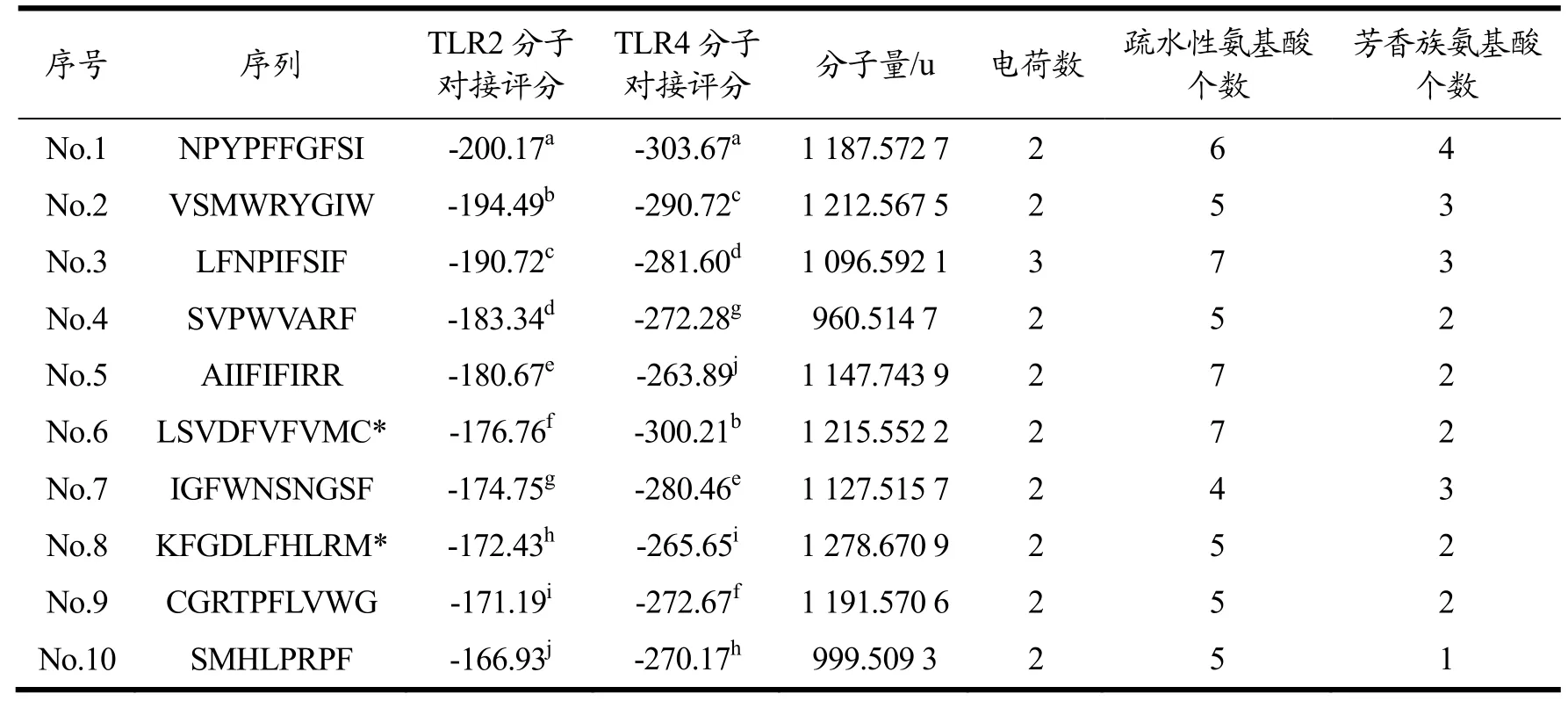
表5 十个筛选肽段的基本信息Table 5 Basic informations of the ten selected peptides
为进一步验证这10个肽段的免疫活性,本研究随后对其进行了合成,并利用RAW 264.7细胞探究了其免疫调节活性。由图3结果可知,在250 μg/mL的浓度下,10条肽段皆对小鼠巨噬细胞RAW 264.7无毒性,且皆能不同程度地促进RAW 264.7细胞分泌TNF-α。其中No.1肽NPYPFFGFSI展现出的免疫调节活性最强,这与分子对接评分的结果一致,但其他肽段活性的高低与分子对接的结果之间存在一定的差异;很多其他研究[36,37]也发现分子对接的结果与活性肽实际验证的结果并不完全一致。事实上,分子对接是利用计算机进行的一种理想化实验,化合物的活性在实际环境中还会受溶解度、溶液中离子强度和pH值等多种因素的影响,因此会与实际结果有一定的出入。
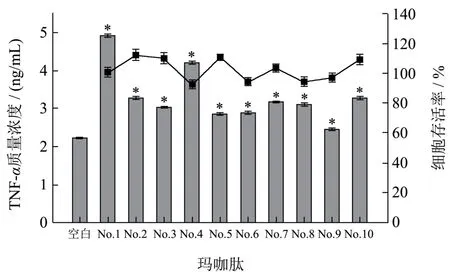
图3 玛咖肽对RAW 264.7细胞的存活率及TNF-α分泌量的影响Fig.3 Effects of maca peptides on the viability and secretion of TNF-α of cell line RAW 264.7
2.4 玛咖免疫调节肽的构效关系
2.4.1 玛咖免疫调节肽与受体的相互作用模式
在分子相互作用的研究中,如AutoDock的分子模拟软件常备用于模拟、分析配体-蛋白的结合情况。由于筛选打分结果仅反映肽段与受体结合程度的相对排名情况,并未体现活性肽与受体的相互作用模式,故通过AutoDock探究No.1肽NPYPFFGFSI与TLR2和TLR4的相互作用模式。由表6可知,No.1肽NPYPFFGFS与TLR2、TLR4的结合亲和力皆小于 -5.0 kcal/mol,说明其能与两个受体发生相互作用[8];本实验室前期发现玛咖胃肠消化产物中活性最强的肽段为RNPFLP,而No.1肽与TLR2的亲和结合力强于RNPFLP的-6.9 kcal/mol,与TLR4的亲和结合力则不及RNPFLP的-10.7 kcal/mol[8]。由图4可知,No.1肽与TLR2、TLR4之间的作用力主要为氢键及疏水作用力:与TLR2之间共存在3个氢键和22个疏水位点,与TLR4之间共存在8个氢键与12个疏水位点。另外,No.1肽与TLR2的结合亲和力更高,则其倾向于通过激活TLR2来刺激RAW 264.7细胞分泌更多的TNF-α。

表6 No.1肽与TLR2、TLR4的结合亲和力Table 6 Binding affinities between peptide No.1 and TLR2, TLR4
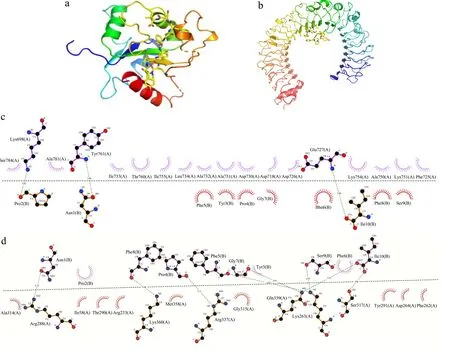
图4 No.1肽与TLR2(a,c)、TLR4(b,d)的相互作用模式Fig.4 Interaction patterns between peptide No.1 and TLR2 (a, c)/TLR4 (b, d)
2.4.2 玛咖免疫调节肽的活性位点判断
根据前线轨道理论,分子的反应活性随HOMO(最高占据分子轨道)能量的升高而增强,即位于HOMO的基团更有可能发生亲核反应,活性更高[38]。No.1肽NPYPFFGFSI中对HOMO贡献最大的原子是C28(表7),贡献比例为19.314%,则No.1肽的活性位点最有可能位于C28,HOMO主要分布在酪氨酸上(图5),酪氨酸与TLR2之间存在疏水作用,与TLR4之间形成了氢键(图4);另外,酪氨酸也被认为与肽的抗氧化[39]、抗癌[20]活性有关。No.1肽的HOMO都主要分布在芳香族氨基酸上,与免疫调节肽一般都含有芳香族氨基酸的规律[20,21]相符。另外,No.1肽的可能活性位点还包括O22-H105、C25、C24-H107和C26-H108。

表7 No.1肽中各原子对HOMO的贡献比例Table 7 Contribution rates of atoms of peptide No.1
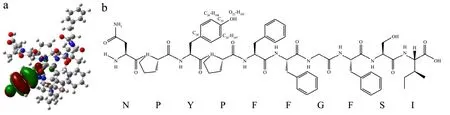
图5 No.1肽的HOMO轨道分布图(a)及分子结构式(b)Fig.5 HOMO distribution (a) and molecular formula (b) of peptide No.1
3 结论
本研究发现预酶解的加工处理方式能有效增强玛咖蛋白的可消化性,以及提高玛咖蛋白经胃肠消化后产生的活性肽和游离氨基酸的含量。其中,经菠萝蛋白酶预酶解处理得到的消化产物的免疫调节活性最强;该消化产物中活性最强的肽段为NPYPFFGFSI,而该肽段的免疫调节活性与所含的酪氨酸密切相关。本研究的结果表明预酶解的处理方式能够改善玛咖蛋白的可食用性,提高其营养学价值。

