猴头菇益生菌发酵对小鼠酒精性胃溃疡的保护作用
薛红洋,张智*,包瑞敏,蒋士龙,解庆刚,巩燕妮
(1.东北林业大学林学院,黑龙江哈尔滨 150038)(2.石家庄君乐宝乳业有限公司,河北石家庄 050221) (3.黑龙江飞鹤乳业有限公司,黑龙江哈尔滨 150100) (4.北大荒完达山乳业股份有限公司,黑龙江哈尔滨 150001)
猴头菇(Hericium erinaceus)是一种药食两用菌类[1],又名猴头菌、狮鬃菇、刺猬菌等,是一种低脂高蛋白且营养物质丰富的资源[2]。含有萜类[3]、黄酮类、多酚类[4]、糖类[5]、蛋白质、多肽等生物活性物质[6],具有保护胃黏膜、抗氧化、抗炎防溃疡、降血糖、提高身体免疫力[7,8]、抗肿瘤[9]等作用。基于很多科研工作者对猴头菇生物活性的研究,发现通过促进胃黏膜组织中有益生长因子的分泌和表达的通路已成为当下有效降低胃溃疡发病率的一种重要方式。
益生菌是一种能够促进肠道微生物菌群保持平衡,对食用者有利的菌种[10],在摄食保持足量时会对食用者产生有益影响[11]。益生菌具有免疫调节功能,可以产生抗菌化合物和有机酸,并与宿主微生物群相互作用,改善酶的形成和肠道屏障的完整性[12]。近年来果蔬加工技术不断发展,益生菌发酵果蔬技术的研究也日渐丰富[13]。在西欧等国家,果蔬发酵受到人们的普遍欢迎和深入研究[14]。果蔬发酵过程中产生的糖被乳酸菌转化成乳酸,用乳酸菌来发酵果蔬不仅可以改善味道延长保存期,还可以提高营养价值增加保健效果[15]。
胃溃疡是一种良性病变,有多种病因,是最常见的消化系统疾病之一。胃黏膜自我防御因子与引起黏膜损伤的攻击因子之间的平衡被打破,导致了胃黏膜的病变,是胃溃疡发病的主要机制[16]。当攻击因子的破坏程度超过防御因子的保护、修复程度,会造成胃黏膜的病变。临床上胃溃疡的常见病因有过度饮酒、幽门螺杆菌感染、过度使用非甾体类抗炎药、饮食习惯不规律、应激和精神心理因素等。随着人们生活方式的改变和压力的增加,对酒精的需求日渐显著[17],饮酒是引发胃溃疡疾病的重要因素,长期、大量饮酒可直接引起急慢性胃炎、胃溃疡甚至胃癌[18]。
现有的对乙醇刺激引起的胃溃疡具有保护作用的药物大多是通过抗氧化作用[19]、抗炎作用[20]加强胃粘膜的保护屏障来实现的,并且大多数药物都具有副作用[21]。猴头菇经发酵后黄酮[22]、多酚含量大大提高其抗氧化[23]抗炎[24]能力增强。本研究以保加利亚乳杆菌、嗜热链球菌、醋酸菌为发酵菌种,选取菌种复配比、发酵温度、发酵时间及接种量四个因素,以发酵液DPPH自由基清除率为响应值,进行响应面分析,对猴头菇的发酵工艺进行优化,旨在确定益生菌发酵猴头菇的最佳工艺条件并探究其对胃溃疡的保护作用。
1 材料与方法
1.1 原料与试剂
干猴头,哈尔滨比优特超市购买;保加利亚乳杆菌(Lactobacillus bulgaricus)、嗜热链球菌(Streptococcus thermophilus)、醋酸菌(Acetobacter),东北林业大学林学院食品微生物实验室提供。
蛋白胨、琼脂粉、葡萄糖、牛肉膏、磷酸氢二钾、酵母浸粉、丙三醇、吐温-80、乙酸钠、抗坏血酸、硫酸锰、柠檬酸氢二铵、硫酸镁等,上海源叶生物科技有限公司;均为国产分析纯;超氧化物歧化酶试剂盒、过氧化氢酶试剂盒、丙二醛试剂盒、肿瘤坏死因子-α试剂盒、白介素-6试剂盒、白介素-10试剂盒,南京建成生物工程研究所。
1.2 仪器与设备
FB2009分析天平,上海迈仪仪器有限公司;722s型紫外分光光度计,上海第三分析仪器厂;RT-6000型酶标仪,深圳雷杜生命科学有限公司;SJ-3F型pH计,上海圣科仪器设备有限公司;XY-500粉碎机,鹤壁市鑫运仪器设备有限公司;TGL-16G台式离心机,上海安亭科学仪器厂;SW-CJ-IFD超净工作台,北京思博晟达科技有限公司;DGS-280C手提式压力蒸气灭菌器,绍兴杰明仪器制造厂;303-2B型电热恒温培养箱,浙江尚城科技有限公司。
1.3 试验方法
1.3.1 猴头菇发酵液的制备
原料处理:挑选无发霉变质的猴头菇,烘干至恒重,粉碎过100目筛。将猴头菇粉与水按1:15(m/V)的比例进行混匀。121 ℃灭菌20 min后保存备用。
活化:在-20 ℃保存的保加利亚乳杆菌和嗜热链球菌斜面平板上挑取单菌落分别接种至已灭菌的MRS和M17培养基中,40 ℃条件下培养20~22 h,传代2次得到活化菌种备用[25,26]。在-20 ℃保存的醋酸菌斜面平板上挑取单菌落接种于已灭菌的醋酸菌培养基中,33 ℃条件下培养16~18 h,传代2次得到活化菌种备用[27]。
菌悬液的制备:将上述菌种的液体培养基摇匀,取4 mL于无菌离心管中,以6 000 r/min离心5 min,弃去上清液,用0.85%的无菌生理盐水进行清洗,再次离心后,用无菌生理盐水调节各菌悬液浓度[28],使保加利亚乳杆菌、嗜热链球菌和醋酸菌菌悬液浓度为1×105CFU/mL,即得到本次试验的发酵菌株。
1.3.2 猴头菇发酵液单因素及响应面优化试验
1.3.2.1 菌种复配比对发酵液DPPH自由基清除率和菌落数的影响
将灭菌备用的猴头菇样品调节pH值至6.5,按照总体积的6%接种保加利亚乳杆菌、嗜热链球菌和醋酸菌混合发酵剂(体积比分别为(3:3:1、2:2:1、3:3:2、1:1:1、2:2:3、1:1:2),接种后在37 ℃培养箱中静态放置24 h,得到猴头菇发酵液。
1.3.2.2 接种量对发酵液DPPH自由基清除率和菌落数的影响
将灭菌备用的猴头菇样品调节pH值至6.5,按照总体积的2%、4%、6%、8%、10%接种保加利亚乳杆菌、嗜热链球菌和醋酸菌混合发酵剂(体积比1:1:1),接种后在37 ℃培养箱中静态放置24 h,得到猴头菇发酵液。
1.3.2.3 发酵温度对发酵液DPPH自由基清除率和菌落数的影响
将灭菌备用的猴头菇样品调节pH值至6.5,按照总体积的8%接种保加利亚乳杆菌、嗜热链球菌和醋酸菌混合发酵剂(体积比1:1:1),接种后在31、34、37、40、43 ℃培养箱中静态放置24 h,得到猴头菇发酵液。
1.3.2.4 发酵时间对发酵液DPPH自由基清除率和菌落数的影响
将灭菌备用的猴头菇样品调节pH值至6.5,按照总体积的8%接种保加利亚乳杆菌、嗜热链球菌和醋酸菌混合发酵剂(体积比1:1:1),接种后在37 ℃培养箱中静态放置12、18、24、30、36 h,得到猴头菇发酵液。
1.3.2.5 起始pH值对发酵液DPPH自由基清除率和菌落数的影响
将灭菌备用的猴头菇样品调节pH值至3.5、4.5、5.5、6.5、7.5,按照总体积的8%接种保加利亚乳杆菌、嗜热链球菌和醋酸菌混合发酵剂(体积比1:1:1),接种后在37 ℃培养箱中静态放置24 h,得到猴头菇发酵液。
1.3.2.6 猴头菇发酵响应面优化试验
在单因素试验结果的基础上,选取菌种复配比(A)、接种量(B)、发酵温度(C)、发酵时间(D)四个因素,以发酵液DPPH自由基清除率(Y)为指标。采用Box-Behnken进行四因素三水平试验对猴头菇发酵工艺进行优化。
1.3.3 猴头菇发酵液对小鼠胃溃疡的影响
1.3.3.1 猴头菇发酵液的制备
将猴头菇粉与水按1:15(m/V)的比例混匀,调节pH值至6.5。灭菌后,冷却至室温,按照菌种复配比(保加利亚乳杆菌:嗜热链球菌:醋酸菌)1:1:1接入8.8%的菌种,在37.5 ℃的恒温培养箱中培养27 h后,得到猴头菇益生菌发酵液。将发酵液无菌过滤后,得到试验所需的猴头菇益生菌发酵液。
1.3.3.2 动物分组与给药及胃溃疡模型的建立
SPF级小鼠50只,适应性喂养一周后,随机分为正常组、模型组、奥美拉唑组、高剂量组、低剂量组,每组10只,分笼饲养。除高剂量组和低剂量组灌胃猴头菇发酵液外,其余组正常喂饲料。根据表1给药方案每天灌胃1次,连续一个月。

表1 动物分组及给药方案Table 1 Grouping of animals and administration plan
造模前24 h,小鼠禁食不禁水,最后一次给药1 h后,除正常组小鼠外,其余小鼠均给予无水乙醇灌胃(10 mL/kg),1 h后取眼球血脱颈椎处死,用手术剪将小鼠腹腔小心剪开并取出胃。用注射器向胃内注入1%甲醛溶液1 mL,并将整个胃放置于装有1%甲醛溶液的烧杯中固定20 min,取出后用手术刀剪沿胃大弯一侧剪开,使用0.85%生理盐水反复冲洗内容物至干净,然后用滤纸吸干表面的水分,一部分展平,用于观察溃疡,另一部分置于-80 ℃条件下保存备用[29]。
1.3.3.3 溃疡指数与溃疡抑制率
观察胃溃疡情况,溃疡的最大长度及宽度用游标卡尺进行测量,取最大的长宽径为损伤指标评分(长度和宽度均以最大径计;出血点每个1分)。溃疡评分标准见表2。
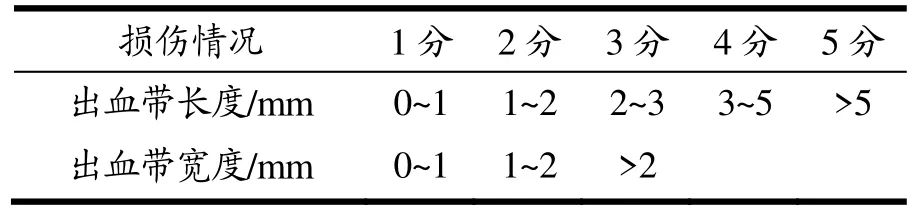
表2 溃疡指数评分标准Table 2 Ulcer index scoring criteria
式中:
A——溃疡抑制率,%;
B——模型组溃疡指数;
C——给药组溃疡指数。
1.3.3.4 ELISA法检测胃组织中MDA、SOD、CTA水平
取胃组织1.5 g,按胃组织质量:生理盐水=1:9制备组织匀浆,在3 500 r/min条件下离心15 min,取上清液;按试剂盒说明书上的方法进行操作并计算各含量。 1.3.3.5 ELISA法检测血清中IL-6、IL-10、TNF-α相关因子含量
眼球取血后,将血液静置1 h后3 000 r/min离心20 min,分离血清;按试剂盒说明书上的方法进行操作并计算各含量。
1.3.4 数据分析
每个实验重复3次,取平均值。采用SPSS 17.0进行单因素方差分析与显著性差异分析,运用Origin 9.0软件进行作图,Design-Expert 8.0.6进行Box- Behnken试验设计。
2 结果与讨论
2.1 发酵单因素试验
2.1.1 各因素对发酵液DPPH自由基清除率和菌落数的影响
由图1a可知,随着醋酸菌所占比例的增大,DPPH·清除率呈现先升后降的趋势,当醋酸菌所占比例为1/3时,DPPH·清除率达到最大值为75.73%,菌落数也达到最大值8.03×109CFU/mL。分析产生这种显著性变化的原因为醋酸菌前期菌体繁殖速度快,一段时间后当所占比例过大时,会影响其他乳酸菌的繁殖,乳酸菌在所占比例低时,水解出的多酚、黄酮等抗氧化物质较少,抗氧化活性较低[29]。所以,选取最佳的菌种复配比为保加利亚乳杆菌:嗜热链球菌:醋酸菌=1:1:1。
由图1b可知,接种量的多少会影响乳酸菌发酵初期的繁殖速度,当接种量小于8%时,接种量过低,乳酸菌生长的延滞期变长;当接种量等于8%时,DPPH·清除率达到最大值为75.19%,菌落数也达到最大值8.25×109CFU/mL。当接种量大于8%时接种量过高时,乳酸菌延滞期缩短并很快到达对数生长期,多酚、黄酮等活性物质在此阶段也会被利用,不利于后期发酵的持续性进行,也使抗氧化能力减小[30]。所以,选取最佳的接种量为8%。
由图1c可知,当发酵温度为37 ℃时,发酵液的DPPH·清除率达到最大值为77.89%,菌落数也达到最大值8.13×109CFU/mL。因此,确定37 ℃为发酵猴头菇的最佳温度。
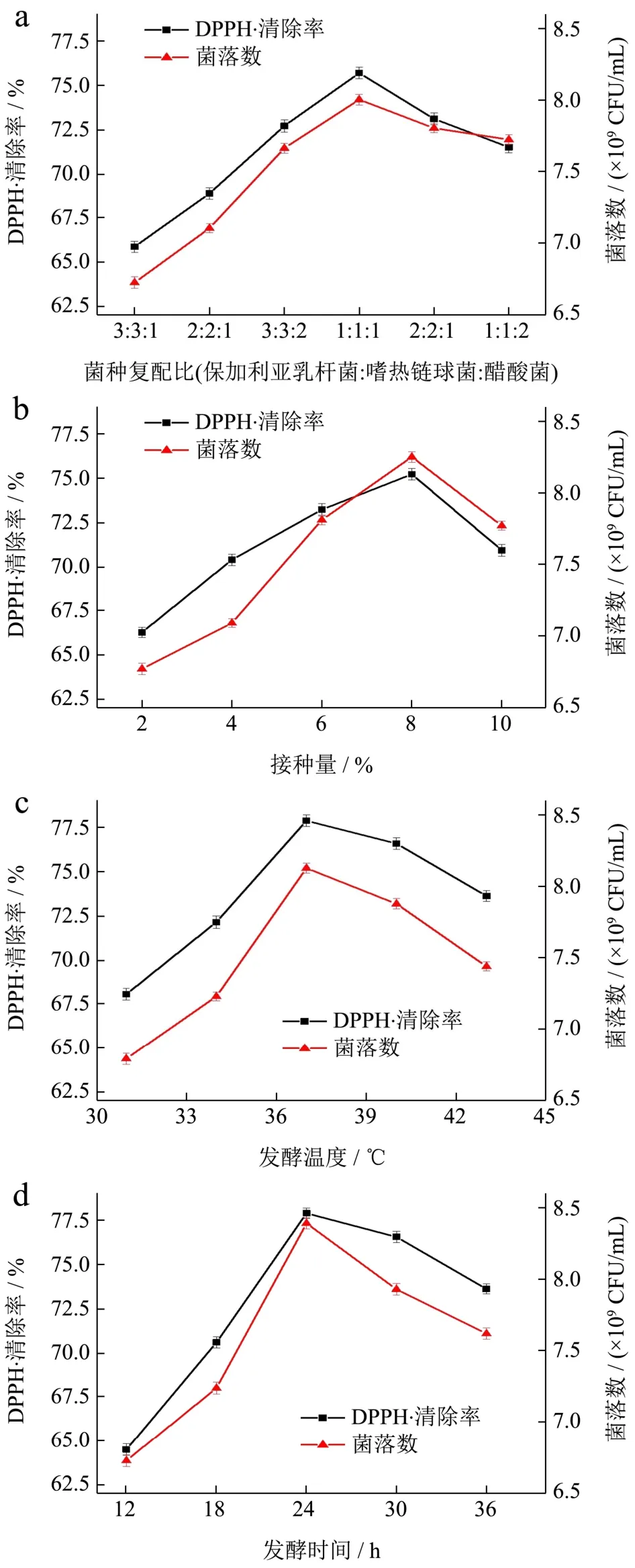
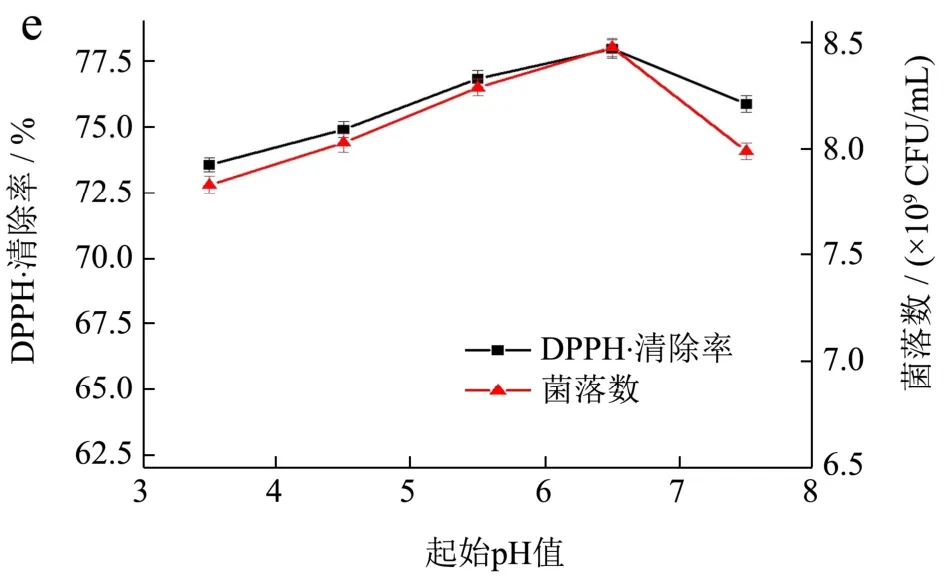
图1 不同因素对DPPH·清除率和菌落数的影响Fig.1 Effects of different factors on DPPH· clearance rate and colony count
由图1d可知,发酵时间的延长,发酵液的DPPH·清除率呈现先升后降的趋势。这可能是由于发酵过程中的大分子酚类物质被逐渐转化为小分子游离酚类物质,DPPH·能够与小分子酚类物质给出的H+生成稳定产物[31,32]。第24 h时,发酵液DPPH·清除率达到最大值为77.87%,菌落数也达到最大值 8.39×109CFU/mL。第24 h之后发酵液的DPPH·清除率开始下降,其原因可能是发酵液中的小分子游离酚类等抗氧化物质被乳酸菌进一步分解,使发酵液的抗氧化活性下降[33]。因此,适宜的发酵时间为24 h。
由图1e可知,起始pH值对DPPH·清除率的影响不大,可能是因为醋酸菌生长pH值为3.5~6.5、保加利亚乳杆菌生长pH值为4.5~7.0、嗜热链球菌生长pH值为4~6.8,三个菌种在偏酸环境下都可以生长,所以发酵液中菌落总数变化不明显,营养物质含量差异不大,对DPPH·清除率影响不是特别显著。在pH值为6.5时发酵液DPPH·清除率达到最大值为77.97%,菌落数也达到最大值8.48×109CFU/mL。所以,选择最佳的起始pH值为6.5。
2.1.2 响应面优化试验结果与分析
2.1.2.1 响应面试验方案及优化结果
以单因素试验结果为依据,确定菌种复合比(A)、接种量(B)、发酵温度(C)、发酵时间(D)为响应面的因素,以发酵液DPPH·清除率(Y)为响应值,采用Box-Behnken中心组合设计对猴头菇发酵工艺进行优化。响应面因素与水平见表3,结果见表4。
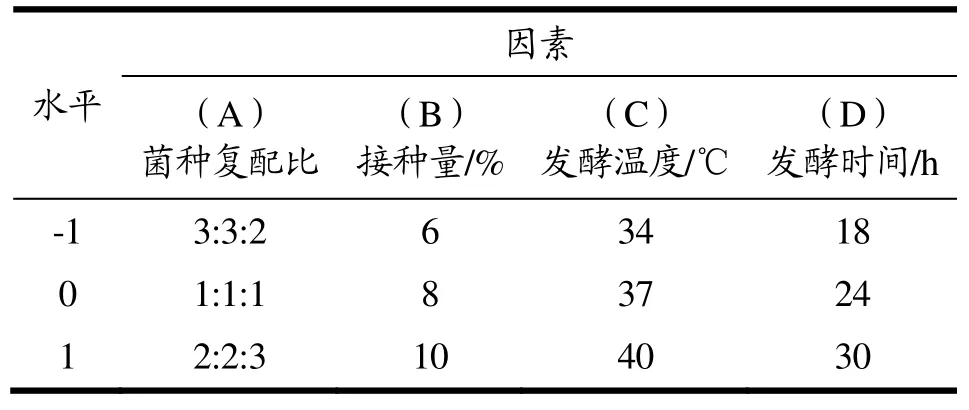
表3 响应面分析因素与水平Table 3 Variables and levels of response surface analysi
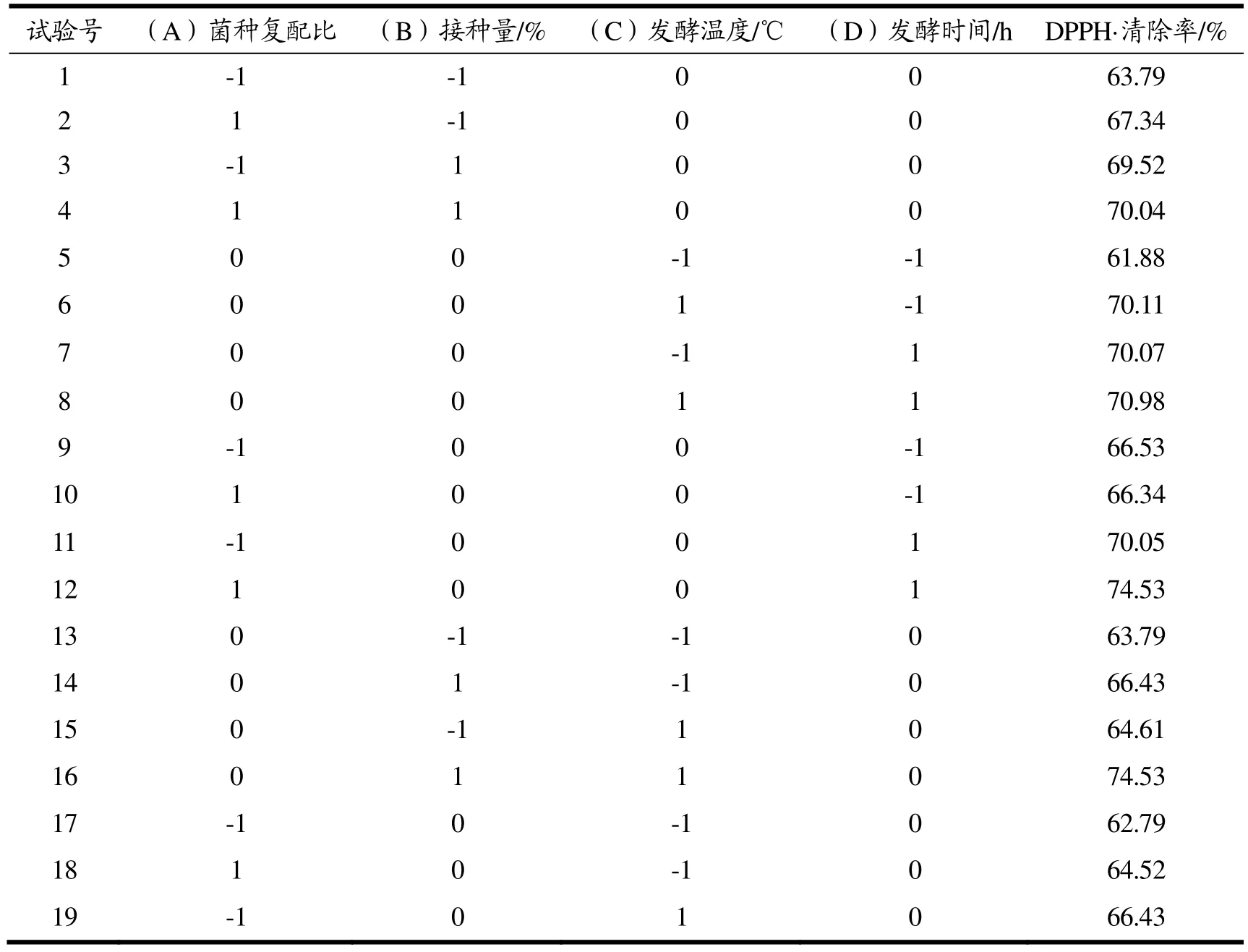
表4 响应面分析试验结果Table 4 Response surface analysis test results
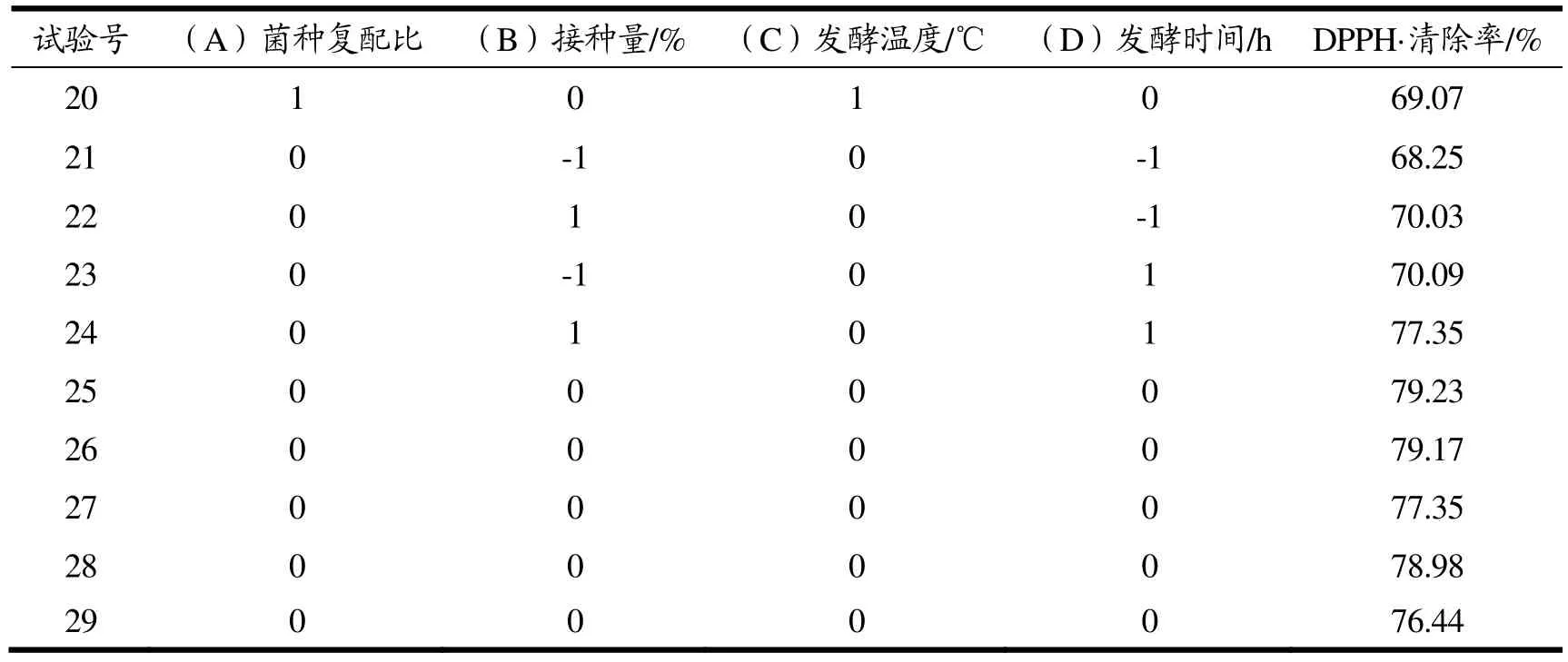
续表4
2.1.2.2 模拟方程的建立及显著性分析
运用Desing-Expect 8.0.6软件对表3中的结果进行多元回归拟合得到DPPH·清除率和四个因素之间的关系为:
对回归方程进行方差分析,结果如表5所示。
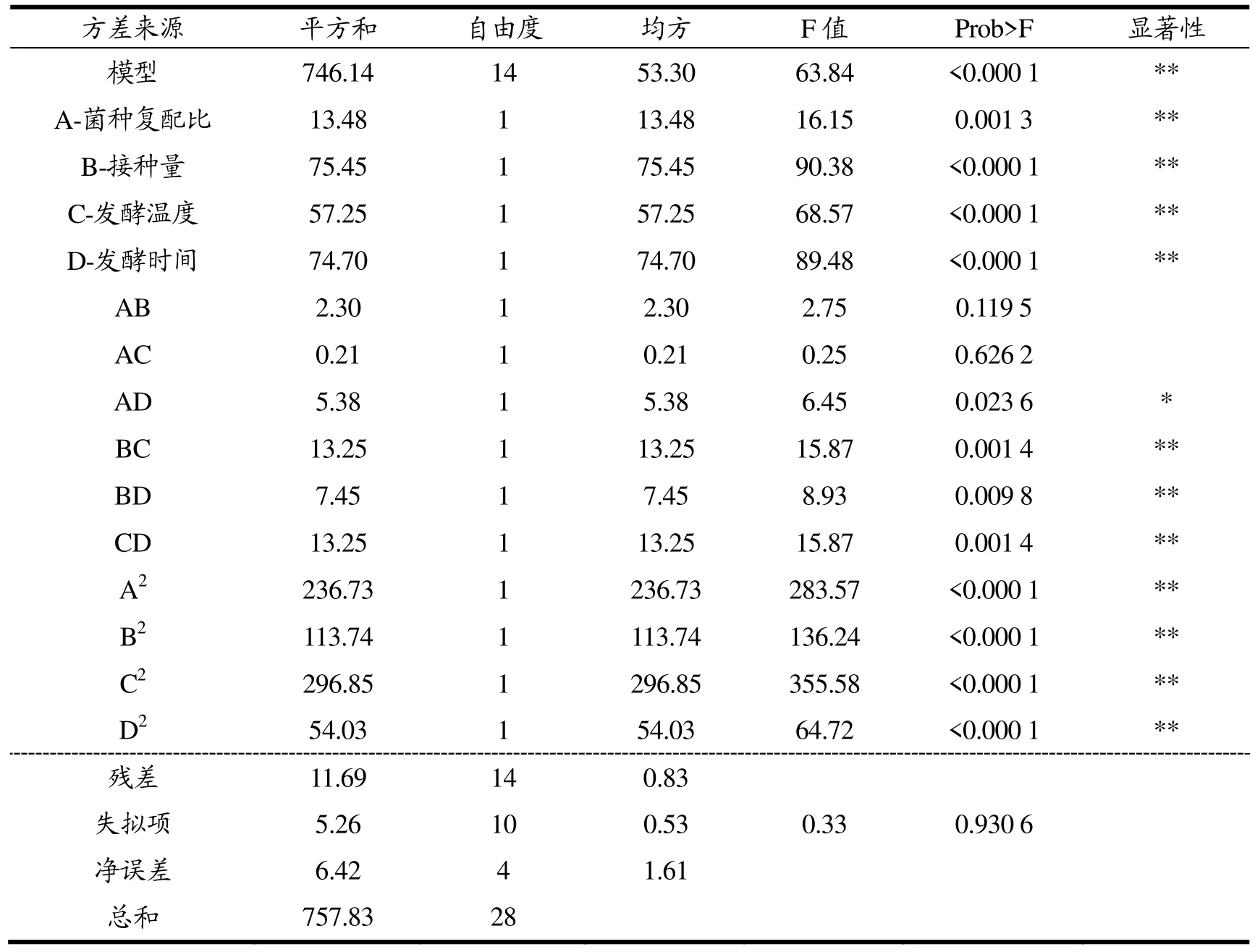
表5 响应面试验方差分析Table 5 The variance analysis of response surface test
表5为模型方程回归方程方差分析结果,该回归模型的回归效果极显著(P<0.05),线性关系较好(R2=0.984 6)。失拟项P=0.930 6>0.05不显著,说明未知因素对试验结果的干扰较小,该试验模型充分拟合试验数据,可以用于确定益生菌发酵猴头菇的最佳工艺。由F值可判断各因素对响应值得影响,结果显示:四个因素对响应值的影响大小顺序为B>D>C>A,即接种量>发酵时间>发酵温度>菌种复配比。A、B、C、D、AD、BC、BD、CD、A2、B2、C2、D2、的P值均<0.05,其中AD对发酵液中DPPH清除率影响显著(P<0.05),A、B、C、D、BC、BD、CD、A2、B2、C2、D2对发酵液中DPPH·清除率影响极显著(P<0.05)。由表5还可以看出Pac>Pab>Pad>Pbd>Pbc=Pcd,比较P值可知菌种复配比与发酵温度的交互作用对发酵液DPPH·清除率干扰最小,而接种量与发酵温度和发酵时间与发酵温度的交互作用对发酵液DPPH·清除率干扰最大。
2.1.3 最佳发酵工艺的验证
利用Desing-Expect 8.0.6软件进行分析,得到猴头菇发酵最佳工艺条件为:菌种复配比1:1:1.07、发酵温度37.45 ℃、发酵时间27.01 h、接种量8.81%,在此条件下DPPH·清除率的预测值为79.59%。考虑到试验的实际情况,对各参数作出调整,即起始pH值6.5、发酵时间27 h、发酵温度37.5 ℃、菌种复配比1:1:1、接种量8.8%。为了验证响应面实验的准确性,按上述最佳工艺条件进行3次重复试验。结果显示,3次重复试验的平均值为79.48%,与预测值相近,说明该模型具有可靠性。
2.2 发酵液对胃溃疡小鼠的影响
2.2.1 小鼠试验期的状态
正常组小鼠整个实验过程中精神状态良好,活泼好动,喜欢攀爬;给予酒精灌胃的各组小鼠状态不佳,相继出现了行动缓慢、精神不振、蜷缩不动、嗜睡等症状。与模型组小鼠相比,高、低剂量组及药物组灌胃的小鼠上述症状较轻,高、低剂量组的小鼠精神状态无明显差异。
2.2.2 小鼠胃组织溃疡图
如图2所示,正常组的小鼠胃黏膜呈淡粉色,有光泽,表面滑嫩,粘膜皱壁完整。模型组的大鼠胃黏膜呈红色充血状态,黏膜表面大面积损伤出血,高中低剂量组以及药物组的小鼠胃黏膜损伤情况较模型组均有大程度的减轻,其中高剂量组的胃黏膜成淡红色,仅有少量点状出血,优于及其他剂量组,药物组小鼠胃粘膜呈淡粉色,有少量条状出血。
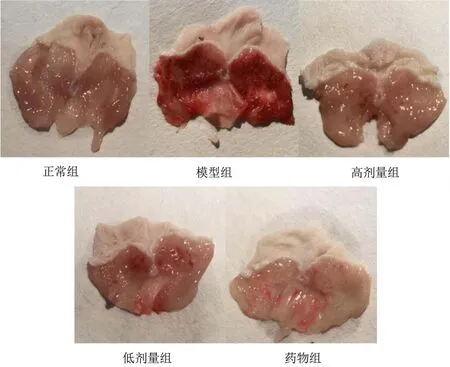
图2 小鼠胃组织溃疡图Fig.2 Gastric tissue ulcer in mice
2.2.3 溃疡指数与溃疡抑制率
由图3可以看出,与正常组相比,胃溃疡模型组出血情况严重,溃疡指数显著增加,模型建立成功。经益生菌猴头菇发酵液低、高剂量和药物干预后,均显著减少了小鼠的溃疡指数,经计算胃溃疡抑制率分别为50.90%、68.1%和71.37%。
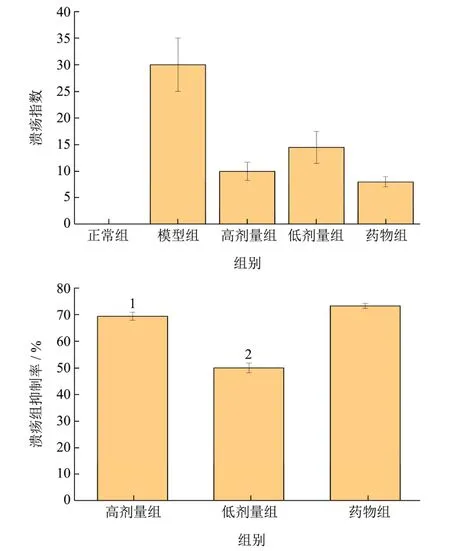
图3 溃疡指数与溃疡抑制率Fig.3 Ulcer index and ulcer inhibition rate
2.2.4 小鼠胃溃疡的胃组织匀浆中MDA、SOD、CTA的含量
由图4可以看出,与正常对照组比较,模型组胃组织中抗氧化因子CAT水平降低了68.61%(P<0.05);与模型组比较,药物组、高剂量组、低剂量组CAT水平分别升高了79.96%、99.89%、47.94%,有显著意义(P<0.05);与奥美拉唑组比较,高、低剂量组差异有显著意义(P<0.05)。与正常对照组比较,模型组胃组织中MDA水平显著升高了419.61%(P<0.05);与模型组比较,药物组、高剂量组、低剂量组MDA水平分别降低了51.39%、47.45%、12.19%,有显著意义(P<0.05);与奥美拉唑组比较,低剂量组差异有显著意义(P<0.05),高剂量组有统计学意义 (P<0.05)。与正常对照组比较,模型组胃组织中SOD水平降低了19.08%(P<0.05);与模型组比较,药物组、高剂量组、低剂量组SOD水平分别升高了78.62%、71.38%、57.79%,有显著意义(P<0.05);与奥美拉唑组比较,低剂量组有统计学意义(P<0.05),高剂量组无统计学意义(P<0.05)。
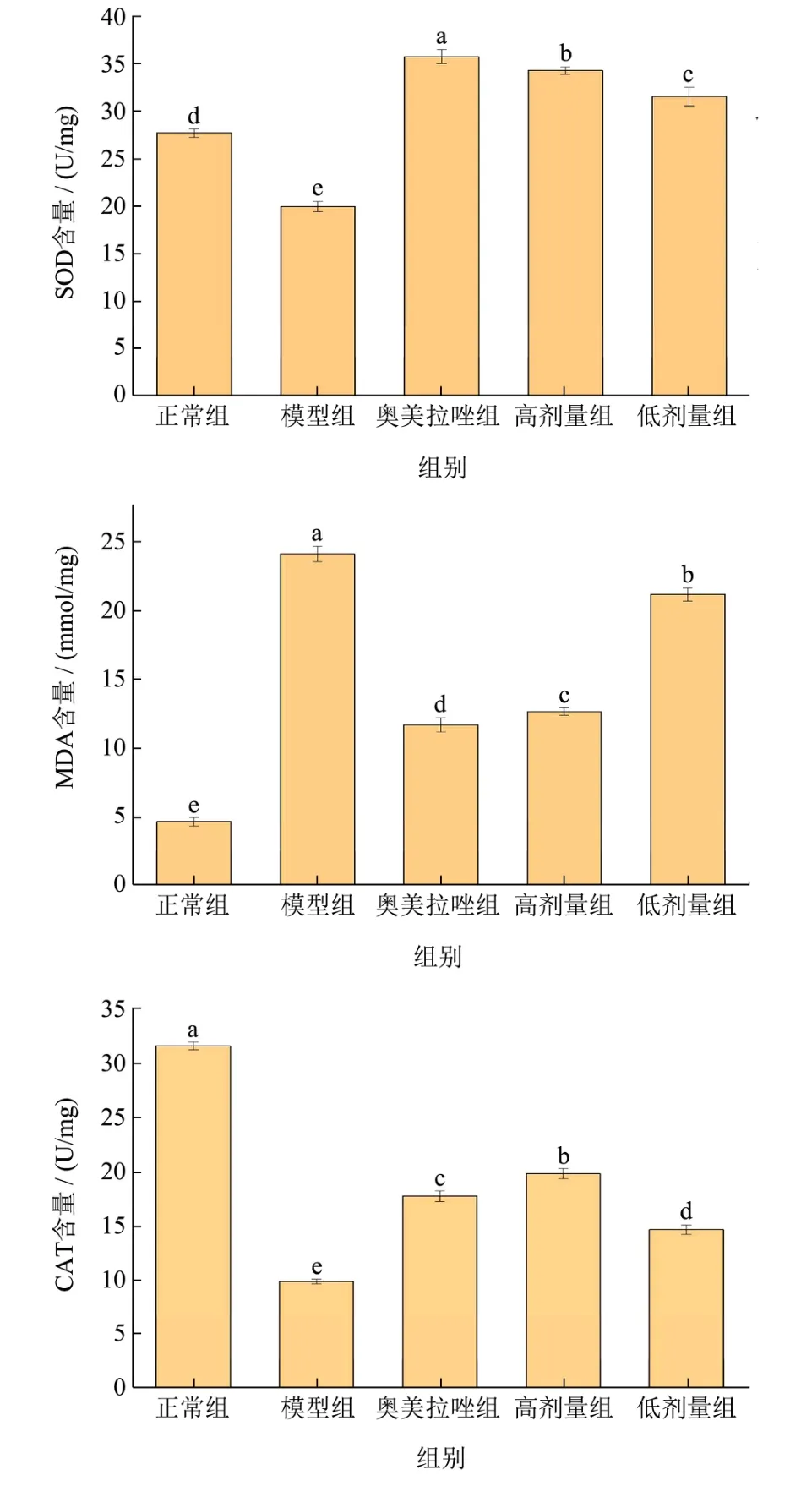
图4 猴头菇益生菌发酵液对胃溃疡小鼠胃组织中SOD、MDA、CAT水平的影响Fig.4 Effects of Probiotic fermentation broth of Hericiumhericium on SOD, MDA and CAT levels in gastric tissue of mice with gastric ulcer
结果表明,益生菌猴头菇发酵液灌胃后提高了CAT和SOD水平,增强了机体清除自由基的能力,使脂质过氧化的程度降低,减少胃黏膜攻击因子MDA的生成,与周臻[34]等研究结果一致。
2.2.5 小鼠血清中IL-6、IL-10、TNF-α含量的影响
结果如图5所示,与正常对照组比较,模型组血清中IL-6含量升高了148.58%(P<0.05);与模型组比较,药物组、高剂量组、低剂量组IL-6含量分别降低了23.68%、34.95%、15.19%,有显著意义(P<0.05);与奥美拉组比较,高剂量组差异有显著意义(P<0.05),低剂量组有统计学意义(P<0.05)。与正常对照组比较,模型组血清中TNF-α含量升高了77.42%(P<0.05);与模型组比较,药物组、高剂量组、低剂量组TNF-α含量分别降低了28.54%、32.66%、17.50%,有显著意义(P<0.05);与奥美拉组比较,高剂量组差异有显著意义(P<0.05),低剂量组有统计学意义(P<0.05)。与正常对照组比较,模型组血清中IL-10含量降低了41.51%(P<0.05);与模型组比较,药物组、高剂量组、低剂量组IL-6含量分别升高了89.76%、100.46%、75.92%,有显著意义(P<0.05);与奥美拉唑组比较,高剂量组有统计学意义(P<0.05),低剂量组无统计学意义(P<0.05)。
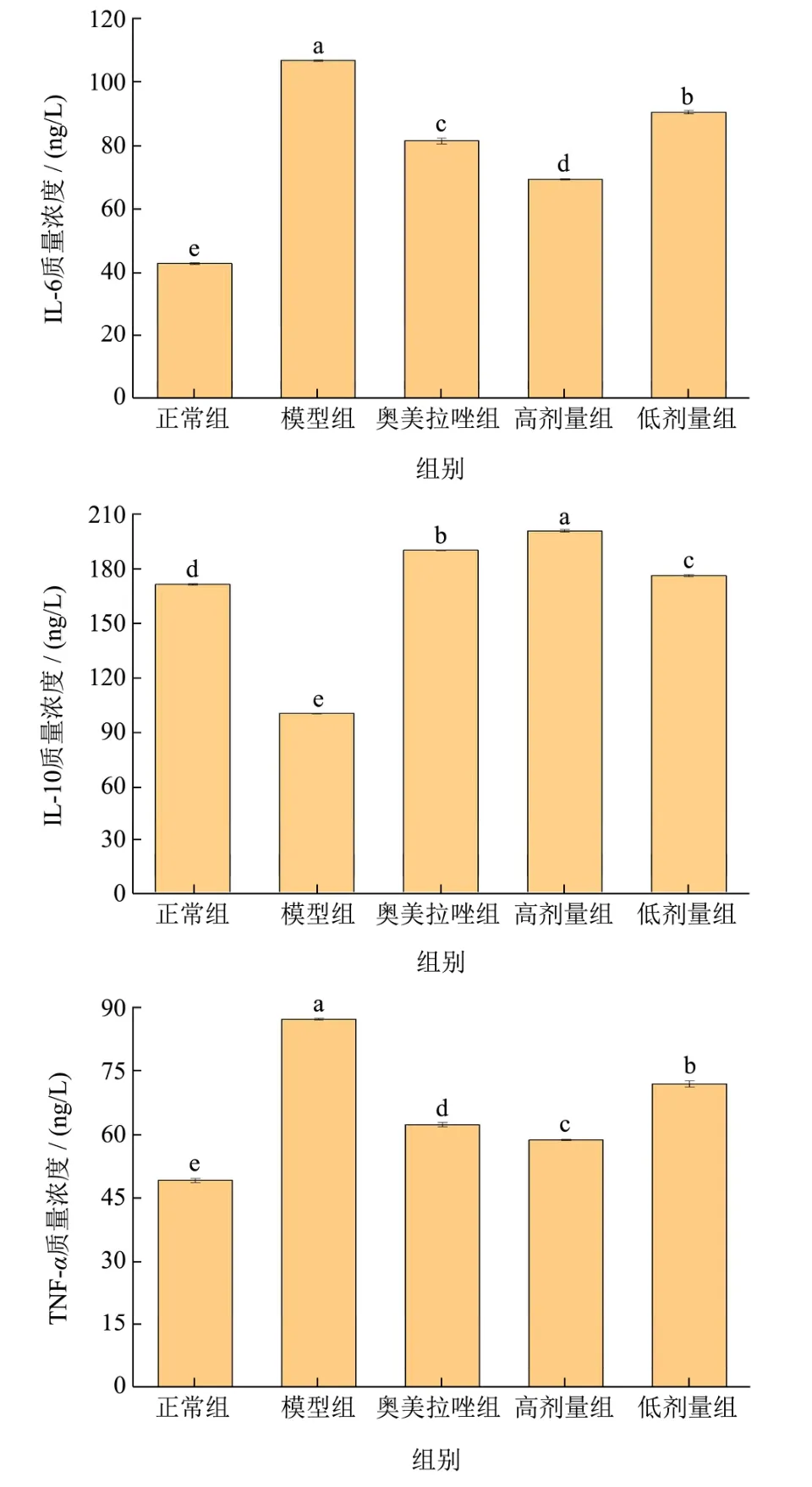
图5 猴头菇益生菌发酵液对胃溃疡小鼠血清中IL-6、IL-10、TNF-α含量的影响Fig.5 Effects of Probiotic fermentation broth of Hericiumhericium on serum LEVELS of IL-6, IL-10 and TNF-α in mice with gastric ulcer
结果表明,益生菌猴头菇发酵液灌胃后通过提高血清中IL-10含量从而降低TNF-α、IL-6等炎性因子的表达来产生抗炎作用,与李有连等[35]研究结果一致。
3 结论
本研究以猴头菇为原料,通过单因素及响应面优化试验,确定了猴头菇发酵的最优工艺条件:起始pH值6.5、菌种复配比(保加利亚乳杆菌:嗜热链球菌:醋酸菌)为1:1:1,发酵温度37.5 ℃,发酵时间27 h,接种量为8.8%。最终获得菌落数为8.72×109CFU/mL;猴头菇发酵液DPPH自由基清除率可达到79.59%。并采用乙醇建立酒精性胃溃疡模型来评价猴头菇益生菌发酵液对急性酒精性胃溃疡病症的影响,发现猴头菇益生菌发酵液可有效减轻小鼠乙醇所致胃溃疡症状,能显著提高胃溃疡小鼠胃组织中SOD、CAT水平,降低血清中MDA及炎症因子IL-6、TNF-α水平,抑制炎性因子IL-6、TNF-α的释放;对急性酒精性胃溃疡起到保护作用。有研究者证明猴头菇多糖对小鼠胃溃疡模型有显著的保护和修复作用、益生菌可以使酒精性胃溃疡小鼠血清抗氧化能力增强。因此,猴头菇益生菌发酵液中多糖、益生菌和发酵液的抗炎抗氧化性谁的作用大,三者有无协同作用,还需进一步研究。本研究为发酵猴头菇提供了菌种复配的理论依据,提高了猴头菇产品的利用价值,为发挥猴头菇的商业价值助力。

