枸杞多糖的分离纯化及其体外抗增殖和抗炎活性分析
乔西凤,马丛伟,张颖,林展乐,黄菁霞,林丽,张勇民,杨宜婷*,杜志云*
(1.广东工业大学生物医药学院,广东广州 510006)(2.无限极(中国)有限公司,广东广州 510623) (3.佛山市康伲爱伦生物技术有限公司,广东佛山 523281)(4.索邦大学分子化学研究所,法国巴黎 75005) (5.内蒙古大学化学化工学院,内蒙古呼和浩特 010021)
乳腺增生是一种以乳腺组织导管和小叶出现结构退行性改变,以周期性乳房疼痛为主要特征的非炎症、非肿瘤的慢性乳腺疾病[1]。因竞争压力增加及生活习惯改变,本病以中年女性发病率较高,尤以肝郁气滞型最常见,严重时可发展成乳腺癌[2-4],西医治疗主要以激素类,如黄体酮、三苯氧胺及维生素类等为主,但这类药物存在很大的副作用。中医药有着悠久且丰富的临床治疗经验,并以其经济、安全、副作用小,在治疗乳腺增生中取得较好效果,已被广大患者接受。中医认为乳腺增生属于“乳癖”范畴,明代龚居中在《外科活人定本》[5]中载:“乳癖,此症生于正乳之上,乃厥阴,阳明之经所属也……何谓之癖,若硬而不痛,如顽核之类”,介绍了乳癖与肝、脾间的关系。随着多数医学者对乳癖的逐渐认识,发现其病因主要为情志、饮食和劳倦内伤等,进而导致肝气郁结、冲任不和、寒凝气滞、瘀血阻络,寻找具有相关功效的中草药,对缓解乳腺增生疾病具有重要的价值。
枸杞为传统的中药材及药食同源产品,近年来,作为一种具有高度优势的营养、预防和治疗功能的超级功能性食品而备受瞩目[6]。在中国药典中,枸杞是一种有助于视力和长寿,以及平衡体内阴阳协调来治疗糖尿病的药物[7,8]。同时,在抗肿瘤[9]、免疫调节[10,11]、血糖稳态、脂质代谢、促进男性生育等方面具有调控作用[12]。多糖、类胡萝卜素和酚类物质是枸杞中三种主要的活性物质。枸杞多糖作为最重要的成分,是由6种单糖组成(葡萄糖,半乳糖,阿拉伯糖,鼠李糖,甘露糖和木糖)[13]。研究发现,枸杞多糖可调节雌激素代谢,抑制MCF-7细胞增殖作用[14],还可通过激活ERK1/2通路抑制MCF-7细胞的细胞周期S期停滞、诱导细胞凋亡抑制细胞增殖作用[15]。枸杞多糖还可抑制乳腺炎小鼠组织中TNF-α表达水平[16]。研究发现,机体的免疫调节活性与生理功能息息相关,例如,炎症、肿瘤及癌症等的发生,均是机体免疫系统紊乱的结果。在植物多糖研究中,小鼠RAW264.7巨噬细胞常作为体外免疫调节研究的模型[17,18],其能够产生促炎细胞因子,如肿瘤坏死因子α(TNF-α)、白细胞介素-1β和分泌NO等炎症介质,来调节免疫反应[19]。
研究发现,体外培养的原代正常人的乳腺上皮细胞仍具有体内细胞的遗传特性,且在体外联合应用E2和P可促进增殖[20]。因此,为拟构建体内乳腺组织良性增生模型,本研究通过体外E2+P联合诱导小鼠乳腺上皮细胞增殖模型,MTT法检测枸杞多糖对HC11细胞增殖作用,流式细胞术分析枸杞多糖对HC11细胞凋亡和细胞周期分布影响,ELISA检测ERα表达水平,同时,通过LPS诱导RAW264.7巨噬细胞的炎症模型,检测炎症介质NO的产生,揭示枸杞多糖组分对E2+P联合诱导HC11细胞增殖的抑制作用。本论文以枸杞多糖为研究对象,探索其分离纯化、体外抗增殖及抗炎活性,为枸杞多糖的深度开发提供重要的理论基础。
1 材料与方法
1.1 样品试剂
枸杞,购自中国青海;小鼠乳腺上皮细胞(HC11细胞)、小鼠单核巨噬细胞(RAW264.7细胞),中国科学院上海生命科学研究院细胞资源中心;细胞培养皿,美国Corning公司;MTT,美国Sigma公司;DEAE-52纤维素、大孔树脂、G-50葡聚糖凝胶、G-25葡聚糖凝胶,北京瑞达恒辉科技发展有限公司;乳癖消片(RPXP),辽宁恒仁药业有限公司;黄体酮(P),浙江仙琚制药股份有限公司苏州分公司;苯甲酸雌二醇注射液(E2),宁波通用药业股份有限公司;脂多糖(LPS,纯度>99%),美国Sigma公司;DMEM高糖培养基、青霉素链霉素溶液、PBS缓冲液、0.25%胰蛋白酶、胎牛血清,美国Gibco公司;Annexin V-FITC细胞凋亡试剂盒、BCA蛋白浓度检测试剂盒、雌激素受体(ERα)ELISA检测试剂盒、一氧化氮(NO)检测试剂盒,碧云天生物技术有限公司。
1.2 仪器
玻璃层析柱(内径12 mm×高度800 mm),伟业玻璃制品有限公司;N-1300V-W旋转蒸发仪,东京理化;Infinite M200 Pro酶标仪,美国Bio-Tek基因有限公司;TGL-16GA二氧化碳培养箱,美国Thermo公司;AUW120D电子分析天平,日本岛津公司;VD-650超净台,江苏通净净化设备公司;LC-2030C高效液相色谱仪,日本岛津公司;ShedexOHpak HQSB 804色谱柱(8.0 mm×300 mm)与HQSB 802.5色谱柱 (8.0 mm×300 mm),日本岛津公司;FACSCalibur流式细胞仪,美国Becton Dickinson公司。
1.3 枸杞多糖组分的提取与分离
称取枸杞100 g,提取两次,第一次加10倍量超纯水,煮沸提取2 h;第二次加8倍量超纯水,煮沸提取1 h[21,22]。80目筛网过滤,温度65~80 ℃,真空度-0.04~0.07 MPa,浓缩至固形物含量为35%±5%,降温出料。检测固形物含量,先加浓缩液再边搅拌边缓慢加入乙醇,调至乙醇浓度为75%,静置过夜(12 h以上)。抽取上清液,取出沉淀物。提取物在70~100 ℃烘箱烘干,获得枸杞多糖。利用大孔树脂,解吸已吸附的色素,洗涤大孔树脂,使大孔树脂再生。脱色2遍后,将多糖溶液在65 ℃的水浴中旋转蒸发,浓缩后再脱色一次。采用Sevage法去除蛋白,向枸杞多糖溶液中加入氯仿:正丁醇混合溶剂(4:1,V/V),充分混匀60 min后离心取上清液。重复脱蛋白操作步骤共3次,对上清液进行浓缩,冻干后得枸杞粗多糖[23]。
依次用0.1 mol/L盐酸、超纯水、0.1 mol/L氢氧化钠溶液,先对DEAE-52纤维素柱进行预处理;配制50 mg/mL的枸杞多糖水溶液,缓慢上样5 mL,依次用超纯水、2 mol/L氯化钠溶液洗涤,分别收集样品洗脱液,重复步骤多次。用超纯水溶解配制50 mg/mL的枸杞多糖溶液,上样5 mL,采用Sephadex G-50与Sephadex G-25葡聚糖凝胶柱分离纯化,用超纯水洗脱,按次序收集洗脱液。采用苯酚硫酸比色法检测,以洗脱管数为横坐标,紫外分光光度法测的吸光度为纵坐标,绘制曲线。根据洗脱曲线,对同一洗脱峰的样品进行合并,对洗脱液进行浓缩,干燥,收集单一枸杞多糖组分。
1.4 枸杞多糖组分平均相对分子量测定
取样品2 mg,溶于0.4 mL 0.1 mol/L Na2SO4溶液中溶解(5 mg/mL),配制成 5 mg/mL的溶液,HQSB 804色谱柱与HQSB 802.5色谱柱串联,流动相为 0.1 mol/L Na2SO4溶液,流速为0.6 mL/min,柱温为35 ℃,进样量为100 μL[24]。标准品为已知分子量的葡聚糖标准品,并将其将其配制成1.0 mg/mL的溶液,按上述条件测定标准品和枸杞多糖的保留时间,以葡聚糖标准品平均分子质量的对数值lgMw为因变量,保留时间t为自变量,进行相关回归分析,得到一元线性回归方程,根据回归方程,计算枸杞多糖样品的平均分子量。
1.5 枸杞多糖组分对HC11细胞增殖作用
选择对数生长期的HC11细胞传代后,将密度调整为每毫升6×104个,取6×103个HC11细胞(100 μL)接种于96孔板中,培养24 h后,每孔替换加入含各浓度(0、5、25、125、250、500、1 000 μg/mL)枸杞多糖组分(GQ-01至GQ-07)的培养基100 μL,继续培养24 h。去除旧培养基,用PBS清洗一遍并吸除。避光,每孔加入100 μL MTT(0.5 mg/mL)溶液,继续孵育4 h。去除MTT溶液,加入200 μL DMSO,震荡10 min,酶标仪中570 nm检测细胞存活率。
1.6 枸杞多糖组分对HC11细胞凋亡的作用
细胞铺板至96孔板24 h后,替换加入2 mL E2(25 μg/mL)+P(250 μg/mL)诱导HC11细胞,及250 μg/mL枸杞粗多糖(GQ)与250 μg/mL枸杞多糖(GQ-01和GQ-06)及阳性对照乳癖消片(PRXP)浓度为500 μg/mL。组别设置为空白组,E2+P造模组,(E2+P)造模组+阳性对照组,(E2+P)造模+枸杞多糖组分组(GQ-01及GQ-06),每组设3个复孔,各多糖组分处理24 h后,收集细胞,PBS清洗一次,加入0.25%胰酶消化细胞,并加入细胞培养液轻吹打细胞,转移至离心管中,1 700 r/min离心5 min,弃上清,收集细胞,用PBS重悬细胞并计数。各组样品取5~10万重悬的细胞,1 000 r/min离心5 min,弃上清,加入195 μL Annexin V-FITC结合液轻重悬细胞,加5 μL Annexin V-FITC,轻混匀,再加10 μL PI染色液,室温避光孵育10~20 min,立即用上流式细胞仪检测。
1.7 枸杞多糖组分对HC11细胞的细胞周期作用
细胞铺板及实验分组同实验步骤1.6,收集细胞后,加入预冷φ=70%乙醇4 ℃固定30 min,重悬于0.5 mL碘化丙啶(PI)溶液中,37 ℃避光温浴30 min。利用流式细胞仪分析细胞周期分布。
1.8 枸杞多糖组分对HC11细胞的雌激素受体(ERα)表达水平的影响
细胞铺板及实验分组同实验步骤1.6,24 h后取培养上清,1 200 r/min离心5 min,取上清液备用,利用BCA法测定蛋白浓度,再使用ERα试剂盒检测其蛋白表达水平。
1.9 枸杞多糖组分对RAW264.7细胞毒性作用及NO水平检测
根据实验步骤1.5,检测不同浓度枸杞多糖对RAW264.7细胞的细胞毒性作用;筛选合适的浓度后,进行NO检测实验。将RAW264.7细胞铺板至96孔板24 h,加入各枸杞多糖组分及LPS,组别分别设为不加药物单加细胞组为空白组、1 μg/mL LPS组为阳性对照组、250 μg/mL枸杞多糖组分+LPS组为实验组(GQ-01-GQ-07)。处理24 h后,检测NO水平。
1.10 数据处理
数据分析使用GraphPad Prism 5软件进行统计学分析,试验结果用平均值±标准差表示,*代表P<0.05表示数据有显著差异,**代表P<0.01表示数据有极显著差异。
2 结果与讨论
2.1 枸杞多糖组分分离纯化及平均相对分子质量
目前在植物多糖分离纯化中,通常采用离子交换色谱柱和凝胶色谱柱这两种色谱柱对粗多糖组分进行分离,离子交换色谱柱主要通过不同多糖组分与离子交换剂间的作用力强弱不同进行分离,而凝胶色谱柱主要根据分子量大小进行分离[25]。研究发现采用DEAE纤维素柱和Sephadex G-150柱结合对枸杞多糖进行分离纯化,最后获得5个高纯度组分[26]。
本研究采用DEAE-52离子色谱柱与Sephadex G-50、Sephadex G-25凝胶树脂柱结合,通过对枸杞多糖的分离纯化共获得7种枸杞多糖组分,如表1所示,对DEAE纤维素柱已用超纯水洗脱的枸杞多糖,通过G-50葡聚糖凝胶柱共分离纯化出2种枸杞多糖组分(GQ-01、GQ-02)(表1);对DEAE纤维素柱已用氯化钠洗脱的枸杞多糖溶液,利用G-50葡聚糖凝胶与G-25葡聚糖凝胶柱共分离纯化出5种枸杞多糖组分(GQ-03、GQ-04、GQ-05、GQ-06、GQ-07)(表1)。通过使用高效液相色谱分析其平均相对分子量,根据葡聚糖标准品的lgMw为纵坐标(y),保留时间t为横坐标(x),得线性回归方程为y=11.17-0.234 1x(R2=0.994 3),计算枸杞多糖各组分的平均相对分子量(Mw),结果如表1所示,发现GQ-01相对分子质量为113 ku,占比96.7%;GQ-02相对分子质量为小于1 ku,占比为64.0%;GQ-03相对分子质量分别为367 ku,占比62.08%;GQ-04相对分子质量为613 ku,占比为70.3%;GQ-05相对分子质量为81 ku的多糖,占比为71.2%;GQ-06相对分子质量为110 ku的多糖,占比为52.7%;GQ-07相对分子质量为小于1 ku的多糖,占比为53.9%。根据以上结果表明,共分离出2种分子量较大枸杞多糖组分GQ-03(367 ku)和GQ-04(613 ku);3种中等分子量枸杞多糖组分GQ-01(113 ku)、GQ-05(81 ku)和GQ-06(110 ku);2种小分子量的枸杞多糖组分GQ-02、GQ-07均小于1 ku。
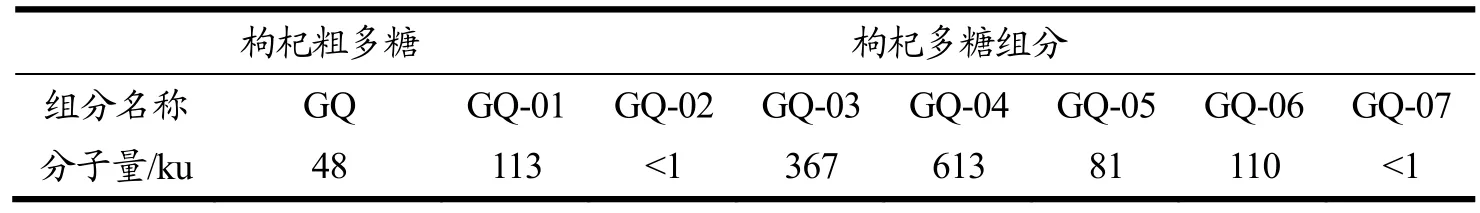
表1 枸杞多糖组分平均相对分子质量Table 1 Average relative molecular weights of Lyciumbarbarum polysaccharides components
2.2 枸杞多糖组分对HC11细胞增殖的影响
乳腺疾病的发生是一个渐进过程,从起初发病至严重癌变是乳腺上皮细胞增殖过度及细胞凋亡减弱的结果。为研究各枸杞多糖组分是否影响乳腺上皮细胞的增殖活性,利用MTT实验检测枸杞多糖组分对HC11细胞活力的作用。结果如图1所示,当用不同浓度(5、25、125、250、500、1 000 μg/mL)的枸杞多糖组分及阳性对照处理HC11细胞时,发现250 μg/mL(RPXP、GQ-01及GQ-06)即可极显著抑制HC11细胞增殖(P<0.01),HC11细胞活性分别降低了40.65%、36.74%、30.73%,且呈剂量依赖效应。结果表明,当用不同浓度枸杞多糖组分直接刺激HC11细胞,发现其对HC11细胞具有低浓度促进细胞增殖,高浓度抑制细胞增殖的作用。但枸杞多糖组分抑制HC11细胞增殖的浓度有所差异,仅有GQ-01及GQ-06随着浓度的升高,会呈现更显著抑制HC11细胞的过度增殖的作用。
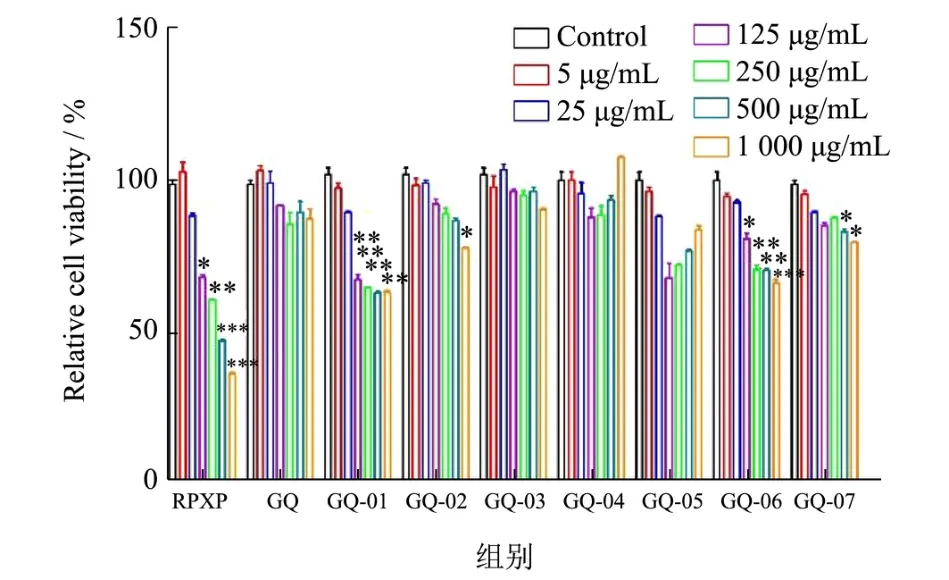
图1 枸杞多糖组分对HC11细胞增殖的影响Fig.1 Effects of Lyciumbarbarum polysaccharides components on the proliferation of HC11 cells
2.3 利用不同激素水平处理检测枸杞多糖组分对HC11细胞增殖的影响
本研究利用E2与P联合刺激HC11细胞,构建HC11细胞增殖模型,结果如图3所示,单独用不同浓度(5~1 000 μg/mL)P处理HC11细胞,发现 250 μg/mL P会显著促进HC11细胞增殖(P<0.05),HC11细胞活性增加了11.70%(图2a);单独用不同浓度(0.01~25 μg/mL)E2处理HC11细胞时,研究发现25 μg/mL E2可显著促进HC11细胞增殖(P<0.01)HC11细胞活性增加了20%(图2b);最后选择不同浓度E2(0.01~25 μg/mL)与浓度为250 μg/mL P联合处理HC11细胞,发现当25 μg/mL E2与250 μg/mL P联合(浓度比为1:10)处理时,可极显著促进HC11细胞增殖(P<0.001),HC11细胞活性增加了36.25% (图2c),结果表明,当单独使用P浓度为250 μg/mL或E2浓度为25 μg/mL时,均可显著促进乳腺上皮细胞增殖。然而,当25 μg/mL E2与250 μg/mL P联合使用时,也可极显著促进乳腺上皮细胞增殖,提示E2与P联合使用比单独使用E2或P,具有较好地促进乳腺上皮细胞增殖的作用。表明E2+P联合诱导可在体外成功构建小鼠乳腺上皮细胞增殖模型。
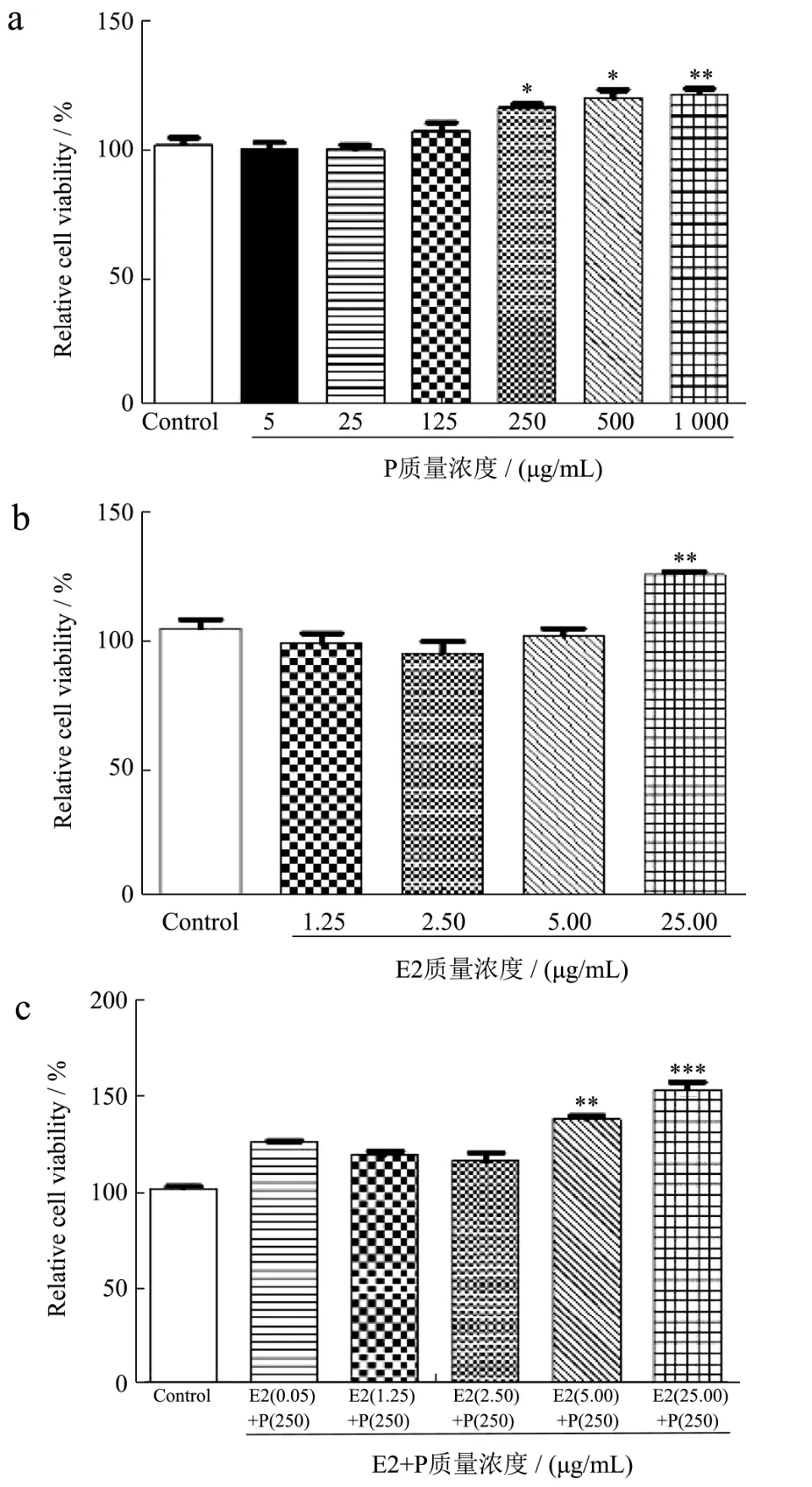
图2 E2+P联合诱导HC11细胞增殖Fig.2 E2+P joint induced HC11 cell proliferation
2.4 枸杞多糖组分对激素造模后的HC11细胞增殖的影响
为检测枸杞多糖组分是否对E2+P联合造模HC11细胞增殖的影响,利用MTT实验检测枸杞多糖组分处理造模后HC11细胞增殖活性。结果如图3所示,与对照组比较,E2+P联合处理HC11细胞模型组,可显著促进HC11细胞增殖(P<0.01);与模型组比较,250 μg/mL(GQ-01,GQ-03,GQ-04,GQ-06)可显著抑制E2+P联合诱导的HC11细胞增殖作用(P<0.01),HC11细胞活性分别降低了28.13%、22.15%、26.74%、30.83%,其中随着浓度增加,GQ-01、GQ-04及GQ-06对HC11细胞的抑制作用增强,存在统计学意义,并具有剂量依赖效应,尤其,GQ-01与GQ-06对HC11细胞的抑制率更高,表明250 μg/mL枸杞多糖组分(GQ-01及GQ-06)可显著抑制HC11细胞增殖作用。
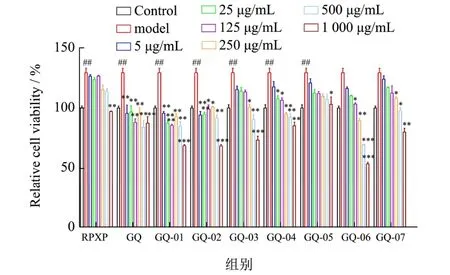
图3 枸杞多糖组分抑制E2+P联合诱导HC11细胞增殖Fig.3 Lyciumbarbarum polysaccharides components inhibited (E2+P)-induced the proliferation of HC11 cells
2.5 枸杞多糖组分对HC11细胞凋亡的影响
乳腺增生的发病主要由雌、孕激素比例失调,雌激素水平较高,导致Bcl-2蛋白(抗凋亡因子)的大量表达,抑制线粒体细胞色素C的释放,无法激活含半胱氨酸的天冬氨酸蛋白水解酶(Caspase),抑制细胞凋亡,进而造成乳腺上皮细胞的过度增殖,使乳腺组织过度增生和复旧不全[27,28]。组织细胞凋亡也叫程序性死亡,是一种由遗传控制的有序的死亡形式[29]。本研究利用流式细胞仪检测枸杞多糖组分对HC11细胞凋亡作用。结合2.2及2.4实验结果,选择GQ-01及GQ-06用于流式细胞术检测细胞凋亡作用。结果如图5所示,与正常组(图4a)相比,E2+P诱导模型组中凋亡细胞未见明显增多(图4b);与模型组比较,GQ-01及GQ-06处理后,未见明显的细胞凋亡现象 (图4e、4f)。结果表明,在体外,枸杞多糖可能不是通过影响细胞凋亡来抑制HC11细胞增殖作用,具体机制还需进一步探究。
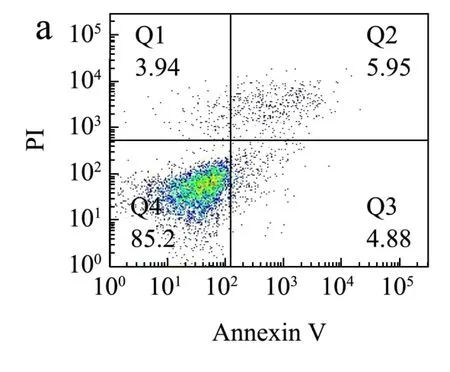
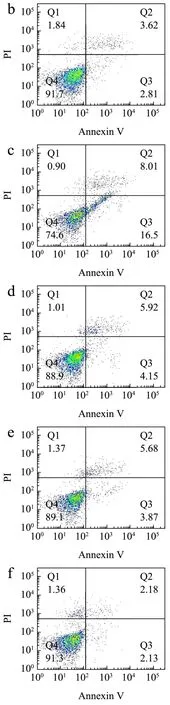
图4 枸杞多糖对E2+P联合诱导HC11细胞凋亡的影响Fig.4 Effect of Lyciumbarbarum polysaccharides components on (E2+P)-induced apoptosis in HC11 cells
2.6 枸杞多糖组分对HC11细胞周期的影响
细胞周期是由G0/G1期向S期过渡,使细胞由静止的G0/G1期向DNA合成器(S期)即S转化,并为细胞由S期向活跃的有丝分裂期G2/M期转化提供有利条件,而增强细胞增殖[30]。本研究通过流式细胞术检测枸杞多糖组分对细胞周期分布的影响,结果如图5所示,与对照组比较,模型组(E2+P)可降低G0/G1的比例,G2/M期的HC11细胞比例增加;与模型组比较,GQ、GQ-01、GQ-06组的G2/M期的细胞比例降低,G0/G1期比例逐渐增加。此结果表明枸杞多糖组分在体外可能通过调节G0/G1、G2/M期的转变,影响细胞周期分布及进程,进而抑制乳腺上皮细胞的过度增殖,但具体的作用机制还需进一步研究。
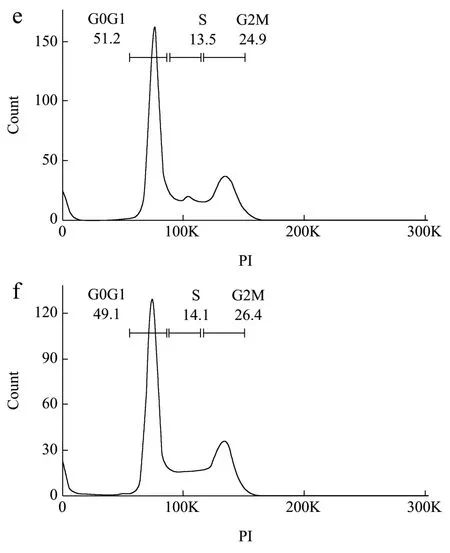
图5 枸杞多糖组分对E2+P诱导HC11细胞的细胞周期分布的 影响Fig.5 Effect of Lyciumbarbarum polysaccharides components on (E2+P)-induced cell cycle distribution in HC11 cells
2.7 枸杞多糖组分对HC11细胞中雌激素受体(ERα)水平的影响
在前期研究中发现,枸杞粗多糖可显著抑制乳腺增生小鼠中ERα的表达水平[22]。本研究通过ELISA实验检测乳腺增生小鼠中ERα的表达水平。结果如 图6所示,与空白组比较,枸杞多糖组分极显著抑制E2+P诱导的ERα的水平(P<0.01);与模型组比较,GQ-01显著抑制E2+P诱导的ERα的水平,ERα水平降低了4.90%(P<0.05),而RPXP与GQ-06极显著抑制E2+P诱导的ERα的水平,ERα水平分别降低了6.36%、5.54%(P<0.01)。研究发现E2升高或P缺乏会引起E2/P比例失调而引起乳腺上皮细胞的过度增殖。增殖细胞又会通过激素受体系统促进ER和孕激素受体(PR)的合成,形成病理性的增殖循环。ER和PR可结合E2和P。ER含有ERα和ERβ两个亚基,可与E2结合形成激素受体复合物[31]。E2可促进乳腺上皮细胞中ER和PR的表达,增加乳腺组织对激素的敏感性而诱导乳腺增生的产生[32]。因此,结果表明GQ-06能通过抑制ERα的水平,抑制乳腺上皮细胞的表达,缓解乳腺增生的症状。
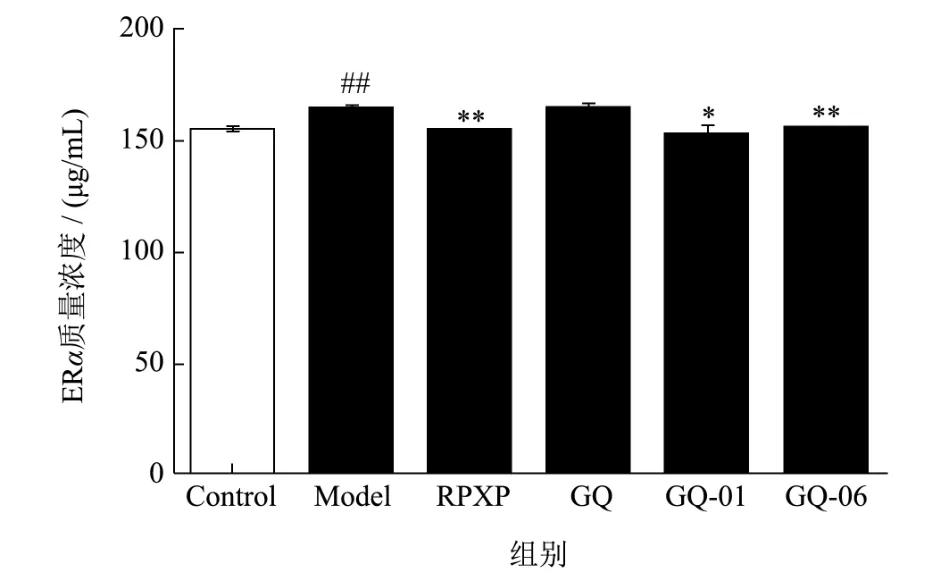
图6 枸杞多糖组分抑制E2+P诱导的HC11细胞的ERα的产生Fig.6 Lyciumbarbarum polysaccharides components inhibited (E2+P)-induced the production of ERα in HC11 cells
2.8 枸杞多糖组分对RAW264.7细胞的NO水平的影响
RAW264.7细胞为小鼠体内的单核巨噬细胞,能对外界刺激产生促炎因子,如IL-6、TNF-α及分泌NO等炎症介质,间接杀死病原体[19]。NO是由iNOS合成,是许多器官引起炎症的炎症调节子,可调节许多生理与病理条件,包括神经转导与炎症反应。尽管NO在抗肿瘤,抗病毒复制及其他疾病中发挥重要作用,但过量NO的产生会危害宿主的健康[33]。因此,抑制过量的NO,可抑制炎症作用。巨噬细胞可通过LPS诱导活化,产生大量NO等炎症介质,适量的炎症介质可提高机体免疫反应及修复机体损伤,而过量或持续产生NO等炎症介质则会引起细胞的炎症反应,导致细胞损伤和凋亡[34]。因此,本文检测了枸杞多糖组分对RAW264.7巨噬细胞中NO水平的调节,结果如图7所示,随着枸杞多糖浓度升高,细胞增殖率越高,表明细胞毒性越小(图7a),因此,选择250 μg/mL的枸杞多糖进行后续实验。利用NO检测试剂盒发现,与空白组比较,LPS可诱导RAW264.7巨噬细胞的NO水平的产生(P<0.001);与LPS组比较,RPXP、GQ、GQ-04及GQ-06可显著抑制LPS诱导RAW264.7巨噬细胞中NO水平的产生、其巨噬细胞中NO水平分别降低了12.82%、29.46%、13.43%、12.65%(P<0.05)(图7b)。王莹等[25]发现两种枸杞多糖组分可促进巨噬细胞的增殖与吞噬能力。杨青等[35]发现枸杞多糖可显著促进巨噬细胞由M2向M1的极化状态转变,有助于促进巨噬细胞来抵抗小鼠胰腺癌细胞的毒性作用,从而达到抗炎及抗肿瘤的作用。因此,本结果表明GQ-04及GQ-06可抑制LPS诱导巨噬细胞的炎症反应,调节机体的免疫反应。
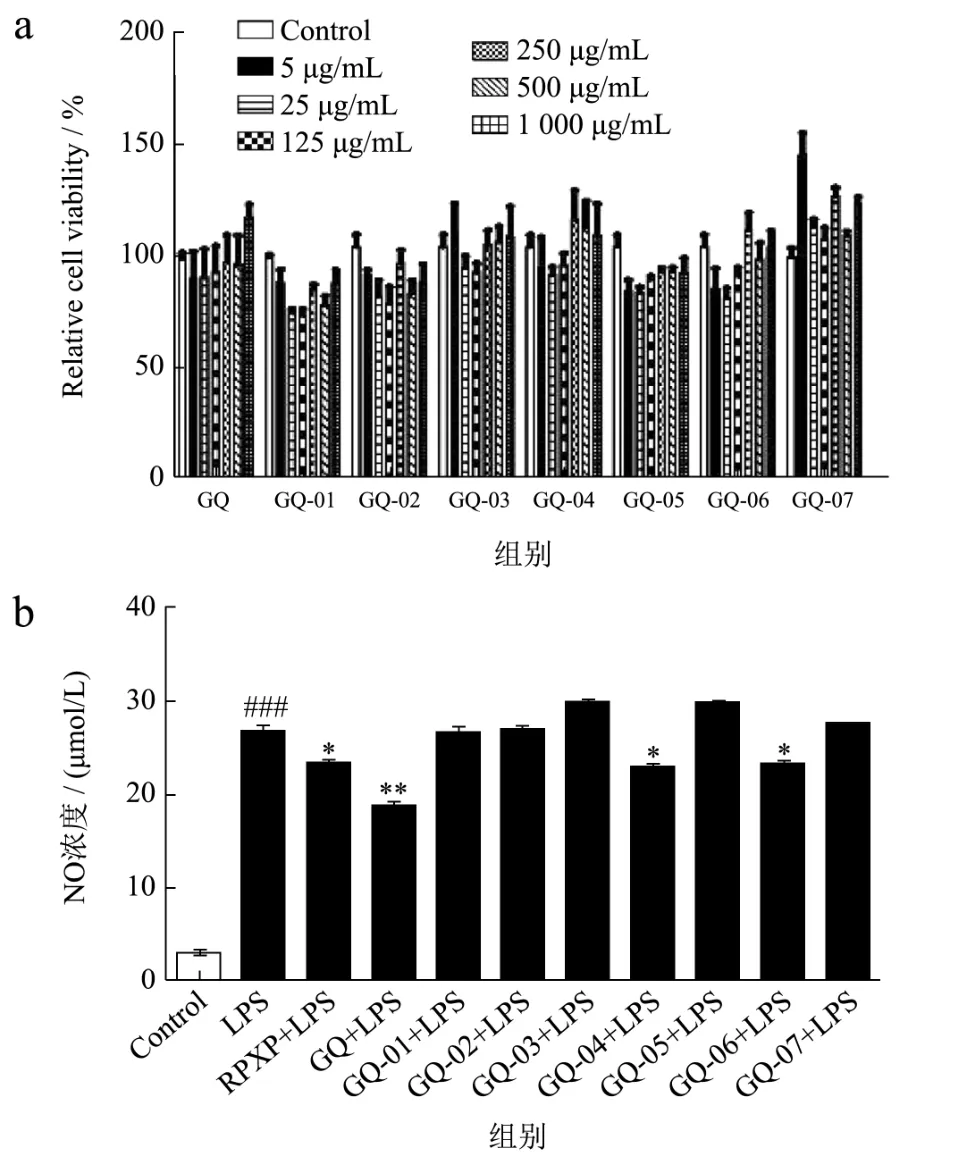
图7 枸杞多糖组分调节RAW264.7巨噬细胞中NO水平的产生Fig.7 Lyciumbarbarum polysaccharide components regulates the production of NO in RAW264.7 macrophages
3 结论
本研究共分离纯化7种不同分子量的枸杞多糖组分,2种为枸杞中性多糖,5种为枸杞酸性多糖。在体外实验中,通过E2+P联合诱导HC11细胞增殖模型发现GQ-01,GQ-03,GQ-06对E2+P诱导的HC11细胞增殖具有明显抑制作用,GQ-01及GQ-06可通过调节细胞周期分布影响HC11细胞增殖,但其对细胞凋亡作用无影响;GQ-06可显著抑制E2+P联合诱导的HC11细胞产生ERα的水平;同时,发现GQ-04和GQ-06可显著抑制LPS诱导的RAW264.7细胞的NO水平的产生。综上,发现GQ-06(Mw=110 ku)可能主要通过抑制乳腺上皮细胞的过度增殖,及抑制巨噬细胞的炎症作用,而发挥抗乳腺细胞增殖及抗炎症活性。随着多糖研究的不断深入,枸杞多糖作为一种天然产物,也将为功能性食品的开发与应用提供重要的理论依据。

