生物炭对四环素污染土壤微生物群落结构的影响及环境因子关联的剂量效应分析
李慧君,卫婷,黄枫城,陈艺杰,李高洋,张伟健,吴伟健,蔺中,甄珍*
(1.广东海洋大学滨海农业学院,广东 湛江 524088;2.广东海洋大学化学与环境学院,广东 湛江 524088)
四环素类抗生素是一类具有并四苯结构的广谱性抗生素,常用种类包括四环素(Tetracycline,TC)、金霉素(Chlortetracycline,CTC)和土霉素(Oxytetracycline,OTC),在防治细菌感染、促进动物生长和防止病虫害等方面有巨大贡献[1]。四环素因价格低廉、抑菌效果好[2]而被广泛应用于养殖业和农业生产(年均用量10 002.73 t)中[3]。据统计,30%~90%的四环素可随尿粪排出体外,并伴随粪肥农用在我国农田土壤中累积[4]。我国农业用地(菜田、大棚)四环素检测范围介于0~2 450 μg·kg-1之间[5],部分地区抗生素浓度远超欧盟标准的生态安全风险值(100 μg·kg-1)[6]。进入农田土壤的四环素严重破坏土壤微生物种群结构,诱导土壤中耐药基因的产生,干扰土壤生态系统的物质循环和流动。更为关键的是,土壤中的四环素还会被蔬菜等作物吸收,并通过食物链传播给人类[7]。土壤四环素污染已严重威胁我国农业产地环境和农产品质量安全,进而影响到人体健康。因此,寻求一种高效经济的措施促进四环素去除,保障生态安全成为当前研究的热点。
农田土壤四环素修复技术主要包括物理、化学和生物修复[8-9]。物理(如吸附)或化学(如氧化)修复技术,由于成本高昂、可持续性差、易造成二次污染等问题而难以大范围推广。与之相比,生物修复技术是一种更有效和环保的方法。目前,土壤四环素的生物修复多集中于接种驯化的降解菌。然而,实际应用中面临的环境适应力差、与土著微生物相互竞争、受污染物种类和浓度限制等诸多限制因素,致使田间修复效果欠佳。大量研究证实,土壤中的Trichosporon mycotoxinivorans、Stenotrophomonas maltophilia和Sphingobacterium等微生物能够代谢四环素[10-12]。在自然环境中,降解微生物生长缓慢、丰度低、分解代谢活性差,致使其降解四环素能力较低。近年来,国内外学者致力于激发土著微生物降解效率的驱动因素研究,从而尝试解决上述限制因素。例如改善微生物生存环境条件、添加营养物刺激微生物的代谢活性等[13-15]。
生物炭是由作物秸秆、污泥等生物质材料在限氧条件下,经过高温热解炭化形成的多孔富碳材料[16],其理化性质稳定,比表面积大,孔隙结构丰富,富含C、N、P等元素。一方面,生物炭不仅可以提高土壤的透气性,改善土壤环境[17],为微生物提供良好的栖息环境。另一方面,生物炭可作为土壤微生物代谢碳源,为微生物生长和繁殖提供必需的营养元素[18]。此外,生物炭含有羟基、羧基、羰基等官能团,可有效吸附土壤中的四环素,减少四环素在环境中的迁移[19]。因此,生物炭作为一种新型改良剂,在四环素的去除中发挥着重要作用。不同剂量生物炭对土壤中四环素去除的影响效果和机制差异很大。低剂量生物炭的施入可能导致土著微生物活性激发不完全,效果不佳[15]。高剂量生物炭易产生较强的吸附固定效果,反而延缓土壤中四环素的生物降解,且造成资源浪费[20]。适宜的剂量是决定生物炭修复农田土壤中四环素效果的关键因素,明确合适的生物炭剂量对于修复农田土壤四环素污染具有重要的现实意义。
据此,本研究以南方农业生产中常见的废弃物甘蔗渣为原材料制备生物炭,选取3 种剂量(1%,2%,3%)生物炭对农田土壤中四环素的去除性能进行探究。运用高通量测序测定不同剂量生物炭对农田土壤微生物群落结构的影响,寻找潜在的降解微生物类群。通过测定土壤酶活性反映生物炭施入后对土壤健康质量状况的改善情况。进一步运用冗余分析(Redundancy analysis,RDA)对土壤理化性质、四环素去除效率以及细菌群落结构进行相关性研究,以期明确生物炭通过改变何种环境因子,促进污染土壤四环素的去除。研究结果为开发一种高效环保的农田四环素污染修复技术提供理论和技术支持。
1 材料与方法
1.1 供试材料
本试验土壤采集自广东省湛江市麻章区郊区农田(21°04′1.85″N,110°19′27.86″E),用土壤取样器取表层0~20 cm 的土壤,土样采集后风干研磨过0.25 mm 筛备用。土壤中未检测出四环素。供试土壤理化性质:pH 为5.35,有机质含量为31.66 g·kg-1,腐殖质含量为11.92 g·kg-1。
生物炭原材料为甘蔗渣,收集于广东湛江市遂溪制糖厂,生物炭具体制备步骤:原材料经自然风干、粉碎、研磨后过2 mm 筛。将研磨的甘蔗渣置于陶瓷坩埚中,压实盖上盖,于马弗炉中按目标温度热解炭化。马弗炉升温速率为10 ℃·min-1,升至550 ℃并保持2 h。待炉内温度自然冷却后取出生物炭,置于广口瓶中,干燥保存待用。生物炭理化性质:pH 为9.03,有机质含量为548.69 g·kg-1。
盐酸四环素(纯度>98%)购于美国Sigma-Aldrich公司。乙腈、甲醇和乙酸乙酯购于美国Sigma-Aldrich 公司,为高效液相色谱(HPLC)级。其他化学品均购于中国科城生物技术有限公司,均为分析纯。
1.2 试验设计
试验共设置4 个处理:土壤+四环素(CK)、土壤+四环素+1%生物炭(BC-1)、土壤+四环素+2%生物炭(BC-2)、土壤+四环素+3%生物炭(BC-3),每个处理设置3 个重复。依据文献报道的农田土壤中四环素污染现状[21](检测范围介于0.01~300.00 mg·kg-1),本研究以四环素含量为5.00 mg·kg-1(以干土质量计)代表四环素在土壤中污染的情况。供试土壤初始含水率为10%,将60.00 mg 盐酸四环素溶解于水中,并与1.00 kg 供试土壤充分混合30 min。将人工污染土壤与11.00 kg 供试土壤混合,制备成最终均匀土壤样品。将土壤平均分成12份,放入宽10 cm、高30 cm的圆柱形培养瓶内。按试验设计分别添加1%、2%和3%的生物炭。随后,将土壤的含水率调节到田间持水量的60%。所有处理均在25 ℃的恒温和黑暗密封条件下培养。于第0、10、20、30、40 天,5 个时间段分别采集样品,并置于-20 ℃冷冻保存,测定四环素残留量、土壤理化性质和酶活性指标。试验结束时(第40天)高通量测序土壤样品的细菌群落结构。
1.3 四环素残留量的测定
将冷冻干燥后的土壤样品过0.15 mm 筛,随后称取土壤样品1.00 g。将土样置于50 mL带盖塑料离心管中。先向离心管中加入20 mL McIlvaine -Na2EDTA-甲醇提取液用于提取四环素,在漩涡振荡器上室温(约25 ℃)提取1 min,使土壤与提取液混合均匀,然后将离心管置于超声波清洗仪下10 min,最大程度破碎土壤颗粒,在机械振荡提取仪中室温(约25 ℃)提取20 min,充分提取四环素,于15 ℃下置于4 000 r·min-1的离心机上,离心10 min 后取上清液至另一离心管中。向残渣中依次加入20、10 mL Mc-Ilvaine-Na2EDTA-甲醇提取液,重复提取两次,合并上清液并用提取液定容至50 mL。取5 mL 上清液置于氮气吹干仪上,室温下避光吹至原体积的一半左右,加适量水稀释至5 mL,然后以1.00 mL·min-1的速度通过已活化处理的固相萃取柱。依次用5 mL 水、5 mL 甲醇-水淋洗固相萃取柱,将以上过程的流出液全部弃去,减压抽干5 min,再用5 mL 色谱纯甲醇洗脱目标物。将洗脱出的样品再次置于氮气吹干仪上吹至近干,最后用1 mL 的甲醇溶解残渣,过0.22 μm有机相滤膜,样品待测。色谱柱为安捷伦的规格为4.66 mm×260.00 mm 的烷基C18 反相柱;流动相为三元流动相,甲醇∶草酸∶乙腈=10∶80∶10;流速1 mL·min-1;柱温为左右端均25 ℃;进样量为10 μL;紫外灯检测波长为355 nm。每个试验样品进行3 次重复测定,回收率在95.80%~102.50%之间。
1.4 土壤理化性质测定
土壤理化性质测定依据《土壤农业化学分析方法》[22],具体为:
土壤pH 的测定:土壤pH 采用电位法(水土比为2.5∶1)测定。称取过2 mm筛的风干土样10.00 g,将其置于50 mL 烧杯中,加入25 mL 无CO2的水,搅动1 min,使土样充分分散。静置30 min 后将校准过的雷磁pH 计(型号为PHSJ-3F,上海仪电科学仪器股份有限公司)插入上部澄清液中,待读数稳定后读取pH值。
有机质的测定:在外加热的条件下(油浴温度为180 ℃,沸腾5 min),用一定浓度的重铬酸钾-硫酸溶液氧化土壤有机碳,剩余的重铬酸钾用硫酸亚铁滴定,通过所消耗的重铬酸钾量按校正系数计算出有机碳含量。
腐殖质的测定:用含有焦磷酸钠和氢氧化钠的浸提剂提取腐殖质,将土壤中难溶和易溶的结合态腐殖质一次结合成易溶的腐殖酸钠盐,从而将腐殖质浸出,然后用重铬酸钾氧化外加热法进行测定。
1.5 土壤酶活性测定
蔗糖酶活性的测定:蔗糖酶活性采用3,5-二硝基水杨酸比色法测定[23]。采用还原糖共热法将3,5-二硝基水杨酸还原为3-氨基-5-硝基水杨酸,利用分光光度计在508 nm 波长下进行比色测定,其活性以每日每克土生成葡萄糖的量表示,单位为mg·g-1·d-1。
脲酶活性的测定:脲酶活性测定采用靛酚蓝比色法测定[24]。酶促产物氨在碱性基质中与苯酚及次氯酸钠作用产生靛酚蓝,靛酚蓝的生成量与氨浓度呈正比,利用分光光度计在578 nm 处进行比色分析,其活性以每日每克土壤生成铵态氮的量表示,单位为mg·g-1·d-1。
过氧化氢酶活性的测定:过氧化氢酶活性采用高锰酸钾滴定法测定[25]。用高锰酸钾滴定量之差计算分解量,以1.00 g 干土每1 h 内消耗0.10 mol·L-1KMnO4的体积数(以mL计)表示,单位为mL·g-1·h-1。
脱氢酶活性的测定:脱氢酶活性采用TTC还原法测定[26]。采用氯化三苯基四氮唑还原法,用三苯基四唑氯化物作为氢的受体生成红色三苯基甲䐶(TPF),TPF 的量与红色深浅有关。利用分光光度计在485 nm 处进行比色测定,脱氢酶活性以每日每克土生成的TPF的量表示,单位为μg·g-1·d-1。
1.6 土壤微生物群落结构测定
利用Bio Fast 土壤DNA 提取试剂盒(BIOEER,杭州)提取土壤样品DNA,利用NanoDrop 200 检测DNA浓度和纯度。用338F(5′-ACTCCTACGGGAGGCAGCA-3′)和806R(5′-GGACTACHVGGGTWTCTAAT-3′)通用引物进行PCR 扩增,扩增区域为16S rRNA V3+V4高变区。PCR反应体系由KOD FX Neo缓冲液5 μL(2 mmol·L-1)、dNTP 2 μL(各2 mmol·L-1)、KOD FX Neo 0.2 μL、引物0.3 μL、模板DNA 50 ng、去离子水(加至终体积10 μL)组成。PCR 扩增条件:95 ℃预变性5 min,95 ℃变性30 s,50 ℃退火30 s,72 ℃延伸60 s,共30个循环,最后于72 ℃延伸5 min。将扩增后的产物用2%琼脂糖凝胶进行检测并回收,并委托上海美吉生物医药科技有限公司进行纯化和测序。
1.7 数据分析
在Illumina MiSeq 高通量测序平台进行双末端测序后,使用Usearch 11.0 对序列在97%的相似度水平下进行聚类获得操作分类单元(Operational taxonomic units,OTUs)。使用Silva 数据库(https://www.arbsilva.de/)对所有OTUs进行分类学注释。为了评估细菌微生物群落的丰富度和复杂性,使用QIIME 1.8.0获得属水平上的物种组成图和聚类热图[27]。土壤理化性质、酶活性均采用SPSS 25.0 进行正态性分布和方差齐性检验后对数据进行单因素方差分析(Oneway ANOVA),采用邓肯(Duncan′s)法进行多重比较(P<0.05),来检验不同处理间的显著差异性。利用Origin 2022 绘制柱形图,利用Canoco 5.0 中的线性模型RDA 分析降解率与微生物群落结构及环境因子的相关关系。
2 结果与分析
2.1 不同剂量生物炭对土壤四环素去除的影响
如图1 所示,生物炭处理下的土壤中四环素含量均显著低于CK(P<0.05),说明添加生物炭可以显著加速四环素的降解效率。经过40 d的培养后,BC-2处理下四环素的去除效率(79.50%)显著高于BC-3(62.50%)和BC-1(50.30%)处理(P<0.05),表明不同剂量的生物炭对四环素的去除效果有一定差异,其中BC-2处理效果最优。
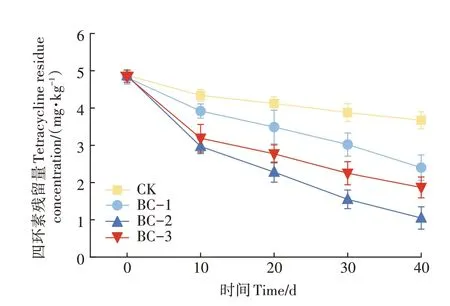
图1 不同处理下的四环素残留量Figure 1 Residual concentrations of tetracycline under different treatments
2.2 不同剂量生物炭对四环素污染土壤理化性质的影响
不同剂量生物炭对土壤理化性质有显著影响(表1)。与CK相比,添加生物炭提高了土壤pH值和有机质、腐殖质含量。培养40 d 后,生物炭处理(BC-1、BC-2 和BC-3)的pH 值分别比CK 提高了0.46、0.54个和0.80 个单位。不同剂量生物炭对土壤有机质的含量也有较大影响。施入生物炭后(0 d 时),BC-1、BC-2和BC-3处理土壤有机质含量较CK显著增加了5.37%、8.85%和19.23%(P<0.05)。在整个培养期间,各生物炭处理组有机质含量呈逐渐下降趋势,但均高于CK 处理。40 d 后,BC-1、BC-2 和BC-3 处理土壤的腐殖质含量均显著大于CK,与CK 处理相比,BC-1、BC-2 和BC-3 处理增幅分别为37.06%、54.18%和43.09%(P<0.05),且生物炭处理组腐殖质含量始终呈逐渐上升的趋势。
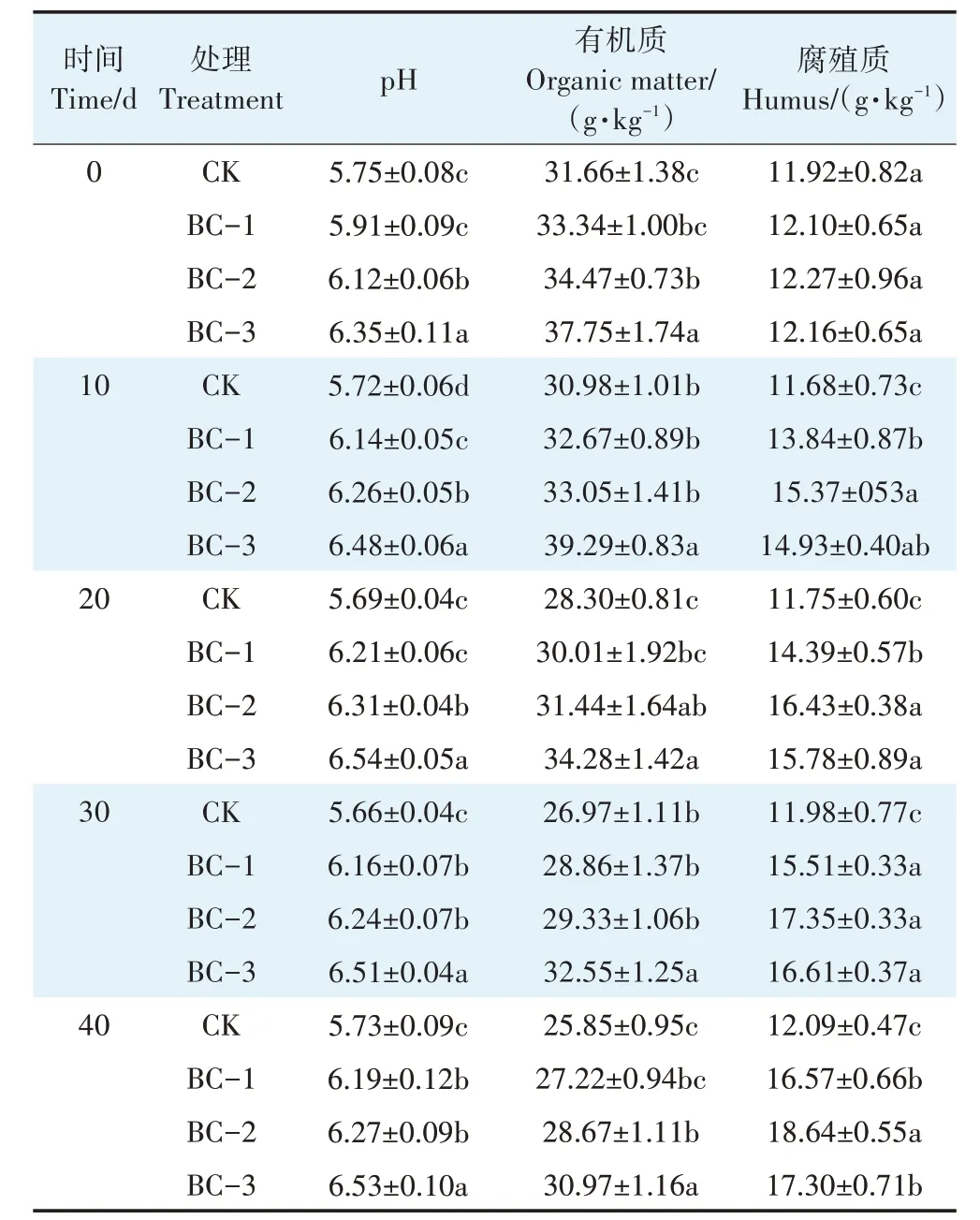
表1 不同处理下土壤理化性质的变化Table 1 Changes of soil physical and chemical properties under different treatments
2.3 不同剂量生物炭对四环素污染土壤微生物群落结构的影响
试验结束时,在所有土壤中共获得386 984 条有效序列,每个样品的有效序列范围为80 254~80 796条,其中共鉴定出3 055 个OTUs,相似度为97%。在属水平上,将相对丰度前20 的细菌属选为优势细菌属,剩余的归为其他(Others)。图2a 为不同处理下属水平细菌群落结构的变化,CK 中Achromobacter(无色杆菌属)、Sphingomonas(鞘脂单胞菌属)、Stenotrophomonas(寡养单胞菌属)、Trichosporon(毛孢子菌属)、Shewanella(希瓦氏菌属)、Pseudomonas(假单胞菌属)等为主要优势菌。不同剂量生物炭添加后,Achromobacter(无色杆菌属)、Sphingomonas(鞘脂单胞菌属)、Stenotrophomonas(寡养单胞菌属)、Trichosporon(毛孢子菌属)、Shewanella(希瓦氏菌属)、Pseudomonas(假单胞菌属)、Ralstonia(雷尔氏菌属)和Klebsiella(克雷伯菌属)的丰度发生了显著的变化。添加不同剂量的生物炭显著提升了土壤中优势微生物的丰度。和CK相比,BC-1、BC-2和BC-3处理中Achromobacter(无色杆菌属)的相对丰度分别提升103.02%、224.22%和145.41%,Sphingomonas(鞘脂单胞菌属)的相对丰度分别提升138.12%、209.53% 和5.22%,Trichosporon(毛孢子菌属)的相对丰度分别提升8.31%、150.42%和25.01%,Pseudomonas(假单胞菌属)的相对丰度分别提升150.00%、283.31%和16.34%,Ralstonia(雷尔氏菌属)的相对丰度分别提升175.21%、300.43%和500.20%,Klebsiella(克雷伯菌属)的相对丰度分别提升12.13%、240.31%和17.64%,其中除Ralstonia(雷尔氏菌属)外的其他菌属的相对丰度均为BC-2 处理提升的幅度最大。Stenotrophomonas(寡养单胞菌属)仅在BC-2 处理中增长了20.61%,在BC-1 和BC-3 处理中分别下降了13.82%和10.44%。Shewanella(希瓦氏菌属)也仅在BC-2 处理中增长了17.60%,在BC-1 和BC-3 处理中分别下降了58.90%和35.30%。Bacillus(芽孢杆菌属)仅在BC-1 处理中增长了68.70%,在BC-2 和BC-3 处理中分别下降了28.50%和28.70%。与CK 相比,BC-1、BC-2、BC-3处理中Comamonas(丛毛单胞菌属)的相对丰度分别下降了17.20%、14.30%和7.60%。图2b 为不同处理下属水平微生物群落结构聚类热图,根据细菌属的层次聚类热图,将样品分为三大类。BC-1、BC-2 与CK 和BC-3 组合分离,表明添加生物炭对细菌群落结构有显著影响。与CK处理相比,BC-2处理的细菌群落结构变化最大。
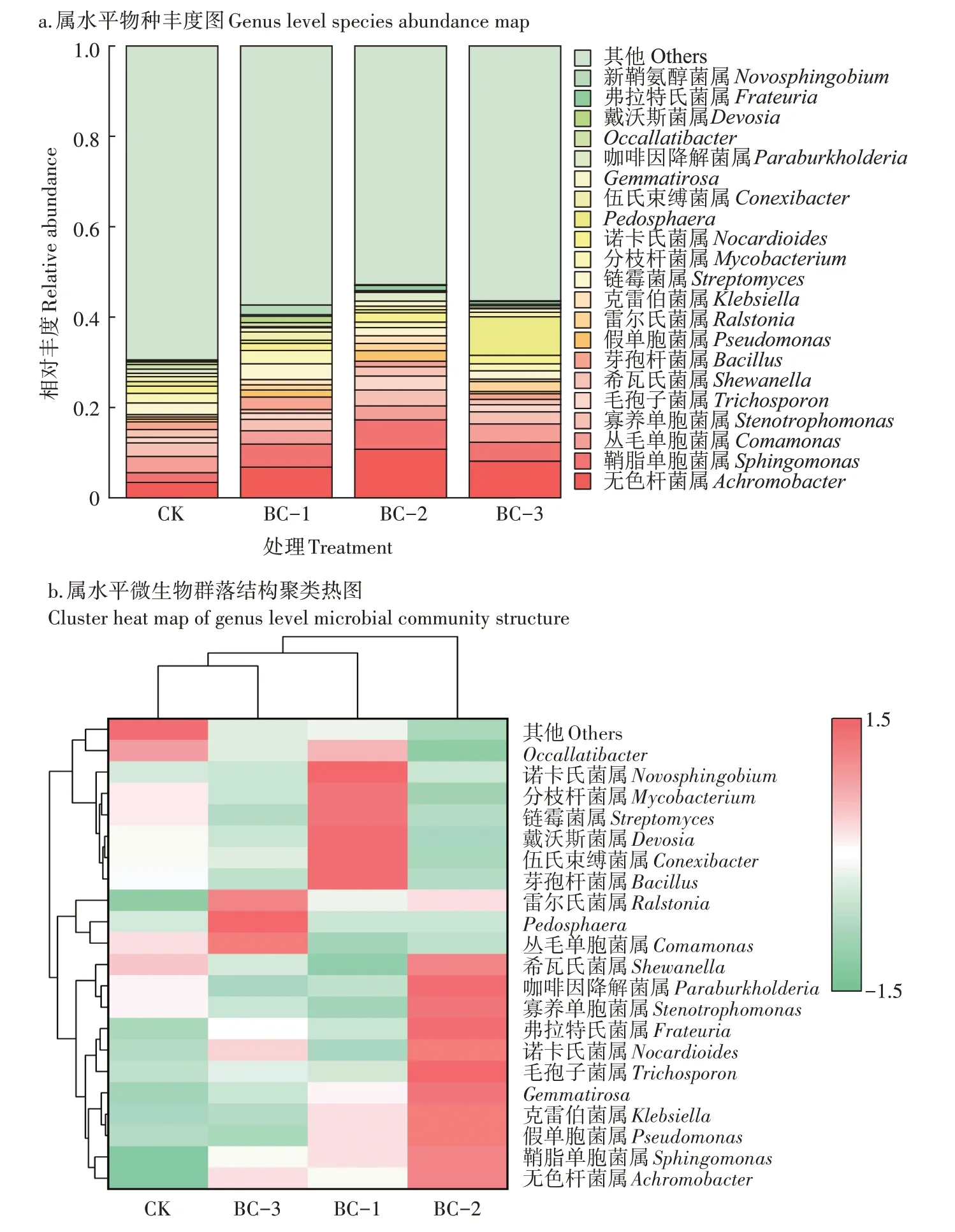
图2 不同处理下微生物群落结构的变化Figure 2 Changes of microbial community structure under different treatments
2.4 不同剂量生物炭对四环素污染土壤酶活性的影响
添加不同剂量生物炭均可以提升土壤脲酶、蔗糖酶、过氧化氢酶和脱氢酶的活性。图3a 显示,添加不同剂量生物炭处理中土壤脲酶活性在20 d 时达到峰值,试验结束时,BC-1、BC-2 和BC-3 的脲酶活性分别为4.27、5.16、4.47 mg·g-1·d-1,显著高于CK(3.61 mg·kg-1·d-1),其中BC-2 对脲酶活性的促进作用最显著。添加不同剂量生物炭处理中土壤蔗糖酶活性在30 d 时达到峰值,随后降低(图3b),40 d 后BC-1、BC-2、BC-3 的土壤蔗糖酶活性分别较CK 增加了164.10%、183.30%、128.50%。生物炭处理中,过氧化氢酶活性在20 d 时达到峰值,但脱氢酶活性在整个培养过程中持续升高。试验结束时,BC-1、BC-2和BC-3 处理的过氧化氢酶活性分别为6.86、7.39 mL·g-1·h-1和6.97 mL·g-1·h-1,均显著高于CK(4.47 mL·g-1·h-1),脱氢酶活性分别为0.89、1.39 μg·g-1·d-1和1.14 μg·g-1·d-1,也均显著高于CK(0.54 μg·g-1·d-1)。综上所述,生物炭的施入大幅度提升了土壤的酶活性,其中以BC-2 处理提升效果最好。
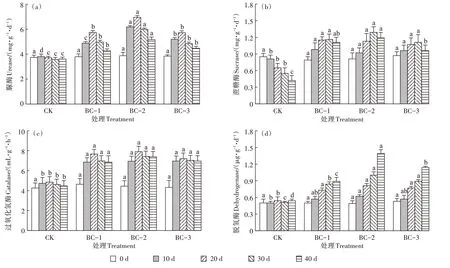
图3 不同处理下土壤酶活性的变化Figure 3 Changes of soil enzyme activities under different treatments
2.5 环境因子、土壤微生物及四环素降解效率的关联分析
土壤微生物群落、环境因子和四环素降解效率之间的相关性如图4所示。RDA 结果表明,第一轴解释关联性信息的57.70%,第二轴解释25.10%,累计解释信息量为82.80%。由此得出,土壤微生物群落结构、环境因子与四环素降解效率的相关性主要是由第一轴来解释。第一轴主要与Achromobacter(无色杆菌属)、Sphingomonas(鞘脂单胞菌属)、Stenotrophomonas(寡养单胞菌属)、Trichosporon(毛孢子菌属)、Shewanella(希瓦氏菌属)、Pseudomonas(假单胞菌属)、Ralstonia(雷尔氏菌属)、Klebsiella(克雷伯菌属)等细菌属有关。第二轴主要与土壤理化性质(pH、有机质和腐殖质含量)有关。添加不同剂量生物炭对土壤四环素降解效率的影响主要源于其对土壤蕴含的微生物种群结构和丰度的影响,土壤理化性质的改变贡献率次之。第一轴微生物群落中,Achromobacter(无色杆菌属)、Sphingomonas(鞘脂单胞菌属)、Stenotrophomonas(寡养单胞菌属)、Trichosporon(毛孢子菌属)、Shewanella(希瓦氏菌属)、Pseudomonas(假单胞菌属)、Ralstonia(雷尔氏菌属)、Klebsiella(克雷伯菌属)和Nocardioides(诺卡氏菌属)与四环素降解效率呈正相关,Mycobacterium(分枝杆菌属)、Streptomyces(链霉菌属)、Bacillus(芽孢杆菌属)和Comamonas(丛毛单胞菌属)与四环素去除效率呈负相关。第二轴土壤理化性质中,四环素去除效率主要与pH 和腐殖质含量呈正相关。
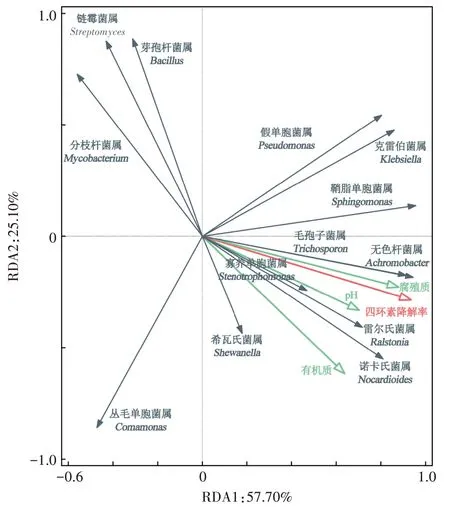
图4 环境因子、土壤微生物与四环素去除效率的冗余分析Figure 4 Redundancy analysis of environmental factors,soil microorganisms and tetracycline removal efficiency
3 讨论
本研究探讨生物炭的不同剂量对土壤中四环素去除效率的影响。培养40 d后,生物炭处理的四环素残留量显著低于CK,说明生物炭处理显著加快了土壤中四环素的去除,且BC-2 处理的四环素去除效率(79.50%)显著高于BC-3(62.50%)和BC-1(50.30%)处理。同时发现土壤原生微生物在四环素污染土壤的解毒净化中发挥着重要作用。不同剂量的生物炭在不同程度上提高了土壤降解微生物的丰度。结果表明,生物炭能改善土壤理化性质和土壤微生物群落结构,提升具有四环素降解功能的微生物的丰度,进而加速四环素在土壤中的降解。本研究发现四环素降解在土壤中既有生物因素也有非生物因素,其中生物因素占主导作用。
生物炭在土壤中的应用被认为是一种环保且具有成本效益的方法,它可以加速污染物降解并减少污染物带来的风险[28]。本研究表明,添加生物炭后土壤中某些细菌群落的丰度发生了变化,这些细菌群落可能可以作为评价四环素对土壤环境污染程度的生物指标。施入生物炭后,Achromobacter(无色杆菌属)、Sphingomonas(鞘脂单胞菌属)、Stenotrophomonas(寡养单胞菌属)、Trichosporon(毛孢子菌属)、Shewanella(希瓦氏菌属)、Pseudomonas(假单胞菌属)、Ralstonia(雷尔氏菌属)、Klebsiella(克雷伯菌属)、Bacillus(芽孢杆菌属)和Comamonas(丛毛单胞菌属)的细菌丰度相比于CK 显著提高。RDA 冗余分析表明,Achromobacter(无色杆菌属)、Sphingomonas(鞘脂单胞菌属)、Stenotrophomonas(寡养单胞菌属)、Trichosporon(毛孢子菌属)、Shewanella(希瓦氏菌属)、Pseudomonas(假单胞菌属)、Ralstonia(雷尔氏菌属)和Klebsiella(克雷伯菌属)与四环素降解效率呈正相关,说明他们显著影响着四环素在土壤中的降解。Achromobacter(无色杆菌属)、Sphingomonas(鞘脂单胞菌属)、Stenotrophomonas(寡养单胞菌属)、Trichosporon(毛孢子菌属)、Shewanella(希瓦氏菌属)、Pseudomonas(假单胞菌属)和Klebsiella(克雷伯菌属)被发现为潜在的降解菌。其中,Achromobacter(无色杆菌属)被发现是四环素潜在降解菌,可以促进四环素的高效降解,Wang 等[29]研究发现在四环素的污染环境下,Achromobacter(无色杆菌属)在降解四环素过程中起主导作用。Shao等[30]发现Klebsiella(克雷伯菌属)可以在8 d 内降解超过89.66%的四环素。Sphingomonas(鞘脂单胞菌属)含有编码NADP 依赖的单加氧酶的tetX基因,可针对性地对土壤中的四环素进行降解[11]。Stenotrophomonas(寡养单胞菌属)可以将四环素或其代谢物作为碳源,在四环素降解过程中保持较高的活性[31]。Pseudomonas(假单胞菌属)可以矿化多种药物,包括四环素、磺胺甲恶唑和环丙沙星[32]。在生物炭处理中,这些细菌在BC-2 处理中的丰度提升幅度最大,说明适宜浓度的生物炭可以促进土壤中四环素降解菌群丰度的提高,进一步加速微生物对四环素的生物降解。
土壤酶作为土壤组分之一,是一种具有加速土壤生化反应速率功能的蛋白质,其参与土壤生物化学过程中许多有关物质循环和能量流动的反应[10]。土壤酶活性的高低能够表征土壤中微生物活性的高低,同时反映出土壤养分转化及其运移能力的强弱,是土壤综合肥力特征的有效反映[33]。土壤脲酶是唯一能对尿素起转化作用的酶,能够破坏C--N键,催化尿素分解生成氨、二氧化碳和水,为植物提供氮素营养[34]。土壤蔗糖酶是一种能将蔗糖水解为葡萄糖和果糖,增加土壤中易溶性营养物质,为微生物提供能源的水解酶[33]。土壤脱氢酶和过氧化氢酶是直接参与异生物解毒的主要微生物催化剂,已得到广泛的研究[33,35]。本研究表明,四环素污染降低了土壤的酶活性,这与Chessa 等[36]关于外源添加四环素会对土壤微生物活性产生不利影响的研究结果一致,也与李研等[37]研究抗生素菌渣作为有机肥施入土壤中对土壤酶活性产生影响的结果一致。造成抑制作用的原因是四环素进入土壤后与土壤内的酶分子形成了稳定的络合物,从而使酶活性降低,表现出抑制性。施入生物炭之后,土壤酶活性得到了提升,其中BC-2处理提升能力最强。由于生物炭自身含碳丰富,施入土壤直接增加了碳源,为微生物提供了温床,使优势微生物得到生长,间接提高了土壤中的微生物数量和酶活性[38]。同时,生物炭可以为微生物提供生活所需的能量,生物炭蕴含的有效养分和可溶性碳可促进土壤微生物的生存与繁殖,使之生命活动旺盛,从而间接增强土壤酶活性[39]。生物炭由于自身的吸附能力,减缓了四环素对酶活性的抑制作用。生物炭吸附在土壤酶基上,促进酶促反应位点,提高土壤酶活性[40],并间接增强土壤自身的解毒能力,本研究与Briceno 等[41]研究一致。生物炭的施入极大促进了土壤中四环素污染物降解菌群丰度的提高,加速了微生物对四环素的消耗,从而降低了土壤中四环素对微生物的毒害,使得土壤过氧化氢酶、脲酶、脱氢酶和蔗糖酶的活性提高。
土壤是一个复杂的多相体系。土壤的理化性质(pH 和有机质、腐殖质含量)会影响四环素的降解[42]。RDA 结果表明,四环素的降解效率与土壤pH 和有机质、腐殖质含量呈正相关关系(图4)。土壤pH 是影响四环素降解的重要因素,施入生物炭显著提高了土壤pH。大量研究表明,与酸性土壤相比,四环素在中性或碱性土壤中更容易被降解[43-44]。在碱性环境中,四环素苯环C6位置的羟基在氢氧根离子的作用下容易形成氧负离子,向C11发生分子内亲核进攻,破坏C环,从而生成非活性的内酯异构体,加速四环素的去除[45]。此外,pH 可以影响有机质对四环素的吸附和固定作用,从而改变四环素的生物利用度,加速其在土壤中的去除[21]。四环素在土壤中的吸附率随土壤pH 的增加而降低。腐殖质结构以芳香核为主体,附以大量羰基、酚羟基等基团。当腐殖质增多时,羧基和酚羟基与四环素的--N(CH3)2基团结合发生反应,从而促进四环素的氧化降解[46]。因此,生物炭可以通过提高土壤pH 和有机质、腐殖质含量加速四环素的去除。同时,土壤中的电子传递作用会影响四环素的降解,促使四环素结构中双键的电子转移到配位键上,强化的亲核性质,削弱双键的稳定性,使得更容易破坏四环素的结构,使得四环素的毒性显著降低[47]。
4 结论
(1)1%(BC-1)、2%(BC-2)、3%(BC-3)3 种不同剂量的生物炭均可加速四环素在土壤中的去除,表现为BC-2(79.50%)>BC-3(62.50%)>BC-1(50.30%)。
(2)3 种不同剂量的生物炭提升土壤原生四环素潜在降解微生物Achromobacter(无色杆菌属)、Sphingomonas(鞘脂单胞菌属)、Stenotrophomonas(寡养单胞菌属)、Trichosporon(毛孢子菌属)、Shewanella(希瓦氏菌属)、Pseudomonas(假单胞菌属)、Klebsiella(克雷伯菌属)的丰度,进而显著加速土壤四环素的去除,其中BC-2处理对土壤原生潜在降解微生物丰度的提升最强。3 种不同剂量的生物炭均可提升土壤的理化性质(pH、有机质、腐殖质),其中BC-3 处理对pH 和有机质的提升效果最好,BC-2 处理对腐殖质的提升效果最好。
(3)3 种不同剂量生物炭的施入均可以显著提高四环素污染土壤中脲酶、过氧化氢酶、蔗糖酶和脱氢酶的活性,提高土壤健康质量状况,其中BC-2处理对酶活性的提升效果最优。

