面向3D打印多孔陶瓷材料外科植入物宏微观结构特征的分析评价方法
张晨,董双鹏,张述,马会,董恩纯,康建峰,李涤尘,王玲
1.国家食品药品监督管理局天津医疗器械质量监督检验中心,天津 300384;2.无源植入器械质量评价重点实验室,天津300384;3.西安交通大学机械制造系统工程国家重点实验室,陕西 西安 710049;4.国家药品监督管理局医用增材制造器械研究与评价重点实验室,陕西 西安 710054
引言
3D打印技术又称增材制造技术,是一种通过简单的二维逐层累加材料的方式直接成型三维复杂结构的数字制造技术[1],其可实现内部复杂结构、外部几何形状的自由制造,因此广泛应用于医疗领域[2-4]。3D打印陶瓷技术主要包括光固化成形、三维印刷、选择性激光烧结、分层实体制造和挤出成形等打印工艺[5-6]。可供打印的医用生物陶瓷材料,根据生理环境中所发生的生物化学反应可分为生物惰性陶瓷(如氧化铝、氧化锆、氧化钛、氧化硅等,特点为耐腐蚀、耐磨损、不降解,适用于制备义齿、人工关节等,图1a)[7]、生物活性陶瓷(如羟基磷灰石陶瓷,对骨细胞生长有一定的引导诱发作用,能促进缺损骨组织的修复,图1b)[8]、生物降解陶瓷(如β-磷酸三钙,在体内溶解度较大,溶解产物进入体液,随血液循环参与机体的新陈代谢,在种植体部位重新产生新的组织,可用于骨填充块或人工关节涂层,图1c)[9]。

图1 3D打印陶瓷材料外科植入物[7-9]
3D打印用的陶瓷粉末是陶瓷粉末和某一种粘结剂粉末所组成的混合物[10]。由于粘结剂粉末的熔点较低,激光烧结时只是将粘结剂粉末熔化而使陶瓷粉末粘结在一起。在激光烧结之后,需要将陶瓷制品放入到温控炉中,在较高的温度下进行后处理,其制备的样品特征为既呈现孔径>10 μm的宏孔如图2a中黄色大圈所示,内连接如图2a中红色小圈所示,又存在孔径≤10 μm的微孔如图2b中红圈内所示。这与3D打印金属材料的多孔特征均为宏孔存在显著不同(图3)[11],因此,针对多孔生物陶瓷支架需从宏观和微观2个方面进行特征分析。

图2 3D打印多孔陶瓷的宏孔、内连接(a)和微孔(b)

图3 3D打印金属多孔样件与CT扫描图像[11]
在3D打印陶瓷材料的外科植入物中,以羟基磷灰石和β-磷酸三钙陶瓷材料的使用最广泛[12],该材料的骨替代物是目前公认的自体骨和同种异体骨移植替代品[13-15],其主要优点如下:① β-磷酸三钙为合成材料,可以避免传染性疾病感染患者;② 该材料在骨植入部位显示出骨传导作用,可促使材料表面愈合,且生物相容性较好[16];③ β-磷酸三钙骨替代物的愈合过程与其多孔结构相关,足够大的孔和内部连接可以使新骨长入整个植入物,且孔隙率也会影响陶瓷的吸收水平,微孔量越多,溶解率越高[17-18]。有研究表明,多孔结构对于骨替代物的有效性有重要影响[18],当孔径在300~600 μm时,利于细胞长入和血供,并最终形成矿化骨[19]。陶瓷的微结构还会对力学性能产生影响:当内连接径不变、孔径增大时,孔隙率下降,力学性能增强;孔径不变时、内连接径增大,孔隙率变大,力学性能下降。因此,针对多孔3D打印陶瓷件的孔隙结构特征进行分析是器械临床前性能评价的必要步骤。
根据食品药品监管总局发布的《钙磷/硅类骨填充材料等3项注册技术审查指导原则》[20]中对3D打印多孔陶瓷的多孔特征进行分析的要求为:对于多孔结构的产品或者固化后为多孔结构的产品,描述产品内部多孔结构几何特征,包括总孔隙率、开孔孔隙率和/或孔连通率、平均孔径、孔径分布等。但指导原则中未提及相应的测试方法。在2018年1月1日实施的YY/T 1558.3-2017《外科植入物 磷酸钙 第3部分:羟基磷灰石和β-磷酸三钙骨替代物》[21]标准中明确了多孔结构形貌技术指标为总孔隙率、微孔、宏孔和内连接径。基于此,本文旨在针对多孔结构的宏微观技术指标提出相应的测定方法、检测难点及最终解决方案。
1 材料与方法
1.1 测试样品
3D打印β-磷酸三钙陶瓷材料骨替代物样品如图4所示,规格为直径10 mm×高度5 mm。

图4 3D打印β-磷酸三钙陶瓷材料骨替代物样品注:a.样品放大细节图;b.微孔测试用包埋试样。
1.2 测试设备
使用微米X射线CT(Micro-CT,Y.Cheetah,德国)对多孔样件进行扫描,扫描时使用锥形束螺旋式扫描方式,扫描电压为90 kV,扫描层厚为0.011 mm。完成扫描后输出Dicom数据以开展相关数据分析。样件微孔孔径检测设备为场发射扫描电子显微镜(SU-8010,日本)。
CT扫描参考GB/T 36984-2018《外科植入物用多孔金属材料X射线CT检测方法》[22],但该标准仅界定了相关结构特征参数的含义,具体实施方法尚不明确。为此,还需基于多孔样件扫描图像数据,结合统计学方法基本原理,建立测试参数及相关数据处理方法。
1.3 测试方法
通过对YY/T 1558.3-2017[21]中总孔隙率、宏孔、微孔和内连接径的测试方法进行分析后,本文将各种方法的检测难点和解决方案进行归纳和总结(表1)[23-24],通过表1对比发现,使用Micro-CT可以对样件直接进行无损检测,并且可以观察样件三维特征,对扫描数据处理可以同时得到孔隙率、宏孔孔径与内连接参数,因此对以上参数特征选取该方法进行检测。而对于微孔孔径特征,选择使用扫描电镜进行观测。
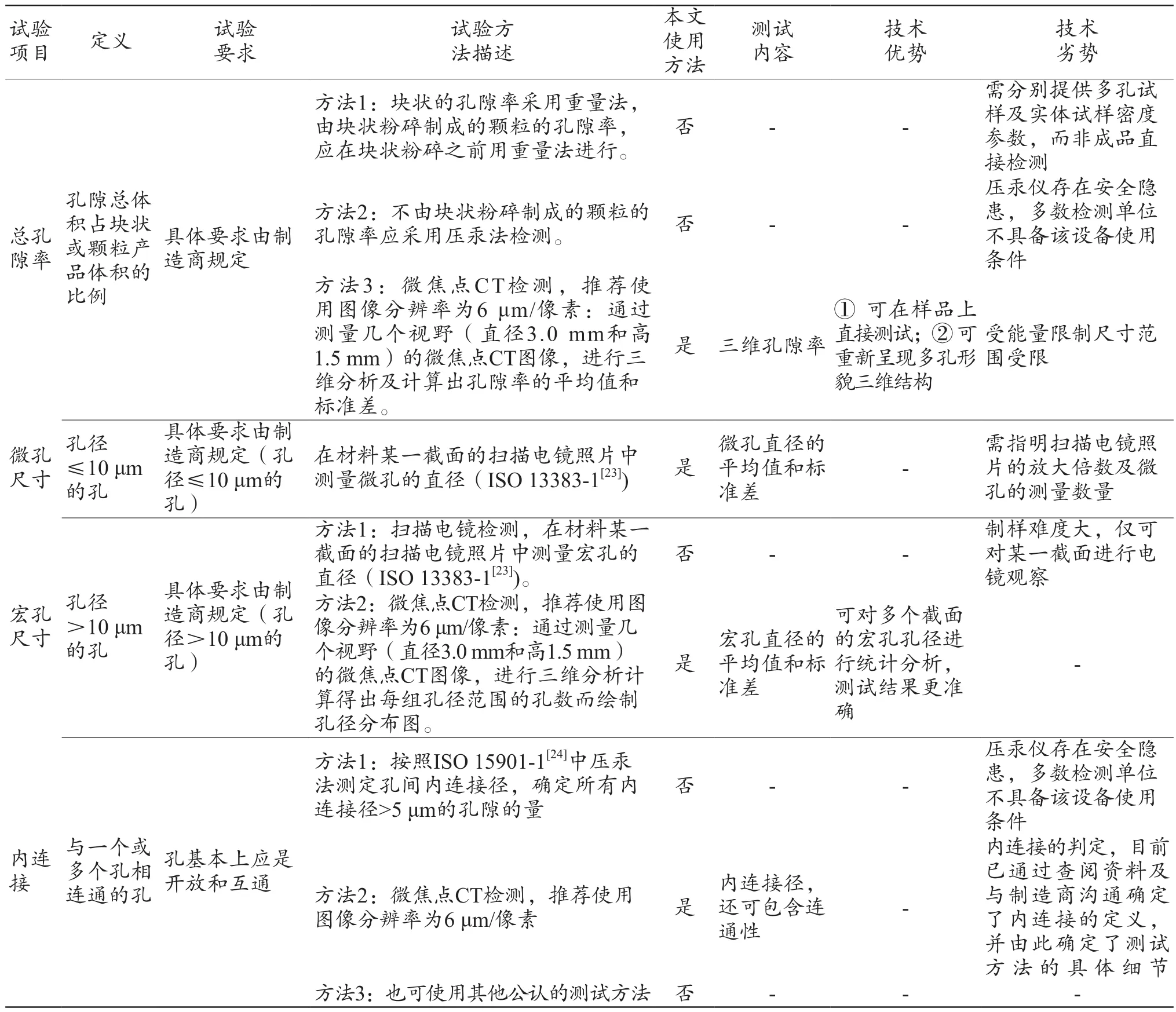
表1 依据YY/T 1558.3-2017的陶瓷多孔结构的测试方法[23-24]
2 测试步骤
为消除样件摆放位置和边缘阴影对分析结果的影响,将扫描后的多孔样件在中间截取直径8 mm×高度3 mm的圆柱体。基于扫描数据对多孔结构特征进行检测,测试数据如下。
2.1 总孔隙率
包括单张图像孔隙率,所有图像的平均孔隙率、三维孔隙率。在软件Mimics 16.0中设定材料的灰度阈值提取实体材料,并输出沿圆柱轴向所有图像的实体面积,计算出每张图像的孔隙率。在软件VG Studio MAX 3.0中设定材料的灰度阈值提取实体材料,使用杂物分析功能计算样件的三维孔隙率。
2.2 微孔孔径
使用扫描电子显微镜对样件微孔孔径进行测量,测量时随机选取一个视场,调整合适放大倍数,测量其中孔径小于10 μm的5个孔的横向和纵向数值,获得微孔孔径的测量值。
2.3 宏孔孔径
采用内切圆方法进行宏孔孔径分析,在垂直于圆柱轴线方向等距选择5个截面,然后在每个截面内选择四周和中心5个样本点进行取样,取样时避免选取周边位置,减少样件摆放位置与边缘阴影影响(图5)。
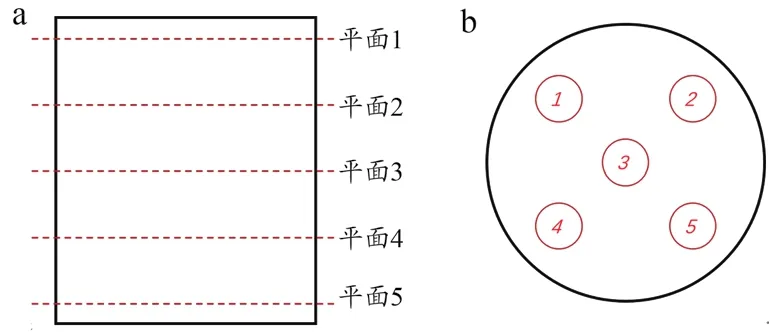
图5 多孔样件宏孔孔径采样点位置分布
2.4 内连接
2.4.1 内连接径
内连接径为相邻多孔结构连接部位的尺寸,反映了多孔结构之间的相互连通情况。按照上述宏孔孔径的采样方式分别对多孔样件孔内连接径进行测量,测量示意图如图6所示。
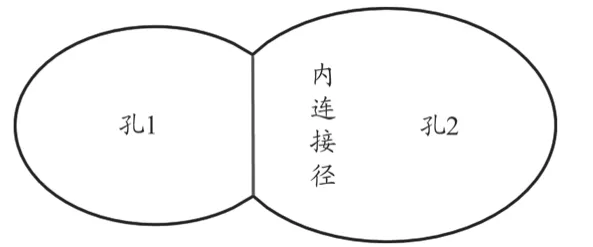
图6 孔内连接径测量示意图
2.4.2 连通性
使用Mimics 16.0软件中孔分析功能,对多孔样件的连通性进行分析。
2.5 开/闭孔率
开/闭孔率在YY/T 1558.3-2017[21]中未涉及,使用VG Studio MAX 3.0软件中杂物分析功能对样件的开/闭孔体积进行分析,样件开孔率计算方式如公式(1)所示,样件闭孔计算率如公式(2)所示。
式中,P开为开孔率,V开为开孔区域体积,V总为样本总体积。
式中,P闭为闭孔率,V闭为闭孔区域体积,V总为样本总体积。
3 结果
3.1 孔隙率
3.1.1 单张图像的孔隙率
单张图像的孔隙率及孔隙率频数统计如图7所示,样件轴向方向孔隙率变化范围为0.564~0.612。
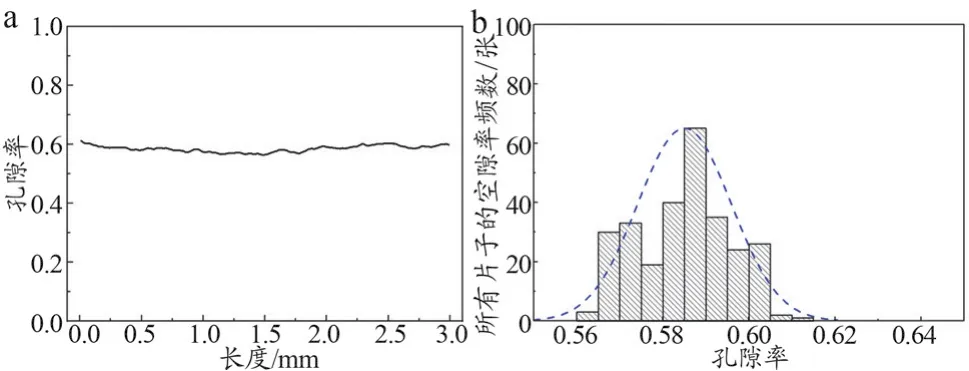
图7 轴向方向所有片子孔隙率的分布(a)和频数(b)
3.1.2 所有扫描图像平均孔隙率及孔隙分布均匀性
对样件轴向方向图像孔隙率进行统计分析,共计279张片子的孔隙率为58.5%±1.9%。
3.1.3 三维孔隙率
在软件VG Studio MAX 3.0中通过阈值划分,区分图像中的空气与实体部分的边界,对该区域进行三维重建,重建效果如图8所示,灰色区域为多孔实体部分,其余为空隙。通过软件中的空隙/杂物分析功能计算得到多孔样件的三维孔隙率为64.55%(图9)。

图8 多孔样件三维重建示意图

图9 多孔样件孔隙率计算结果
为验证该方法,通过对称重数据处理所得的孔隙率实测值为64.90%。2种方法计算结果的相对误差为0.35%。
3.2 微孔孔径
多孔样件微孔观测图像如图10所示,取样位置为左图样品上红框处,右图为放大4000倍下的扫描电镜图,红圈处为随机选取的5个微孔1#~5#,微孔孔径的采集数据结果如表2所示,经计算,微孔孔径均值为(1.827±0.969)μm。
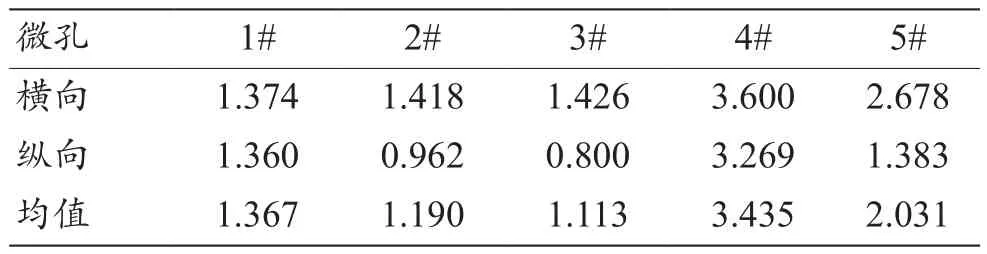
表2 多孔样件微孔孔径测量结果(μm)

图10 微孔观测图像
3.3 宏孔孔径
按照图5选择宏孔孔径的测量位置,测量数据共计25个,内切圆宏孔孔径的采集数据结果如表3所示,经计算,内切圆宏孔孔径均值为(0.358±0.172)mm。宏孔孔径分布如图11所示,统计图中统计了25个数据的分布情况,其中,孔径尺寸主要集中在0.1~0.5 mm之间。

图11 宏孔孔径分布示意图
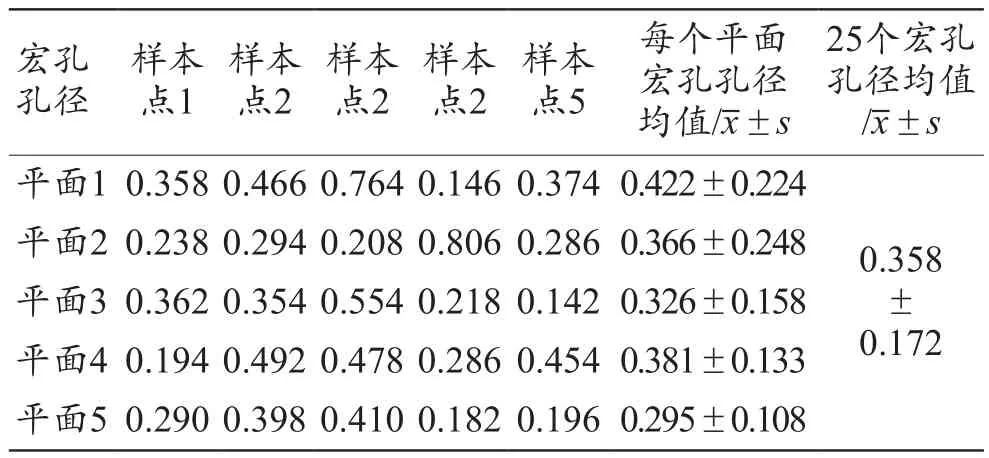
表3 多孔样件各平面的内切圆宏孔孔径测量结果(mm)
3.4 内连接
3.4.1 内连接径
按照图5选择内连接径的测量位置,测量数据共计25个,不同平面孔内连接径的采集数据结果如表4所示,经计算,孔内连接径均值为(0.137±0.090)mm。孔内连接径分布如图12所示,统计图中统计了25个数据的分布情况,其中,内连接径尺寸主要集中在0.05~0.20 mm 之间。

图12 内连接径分布示意图
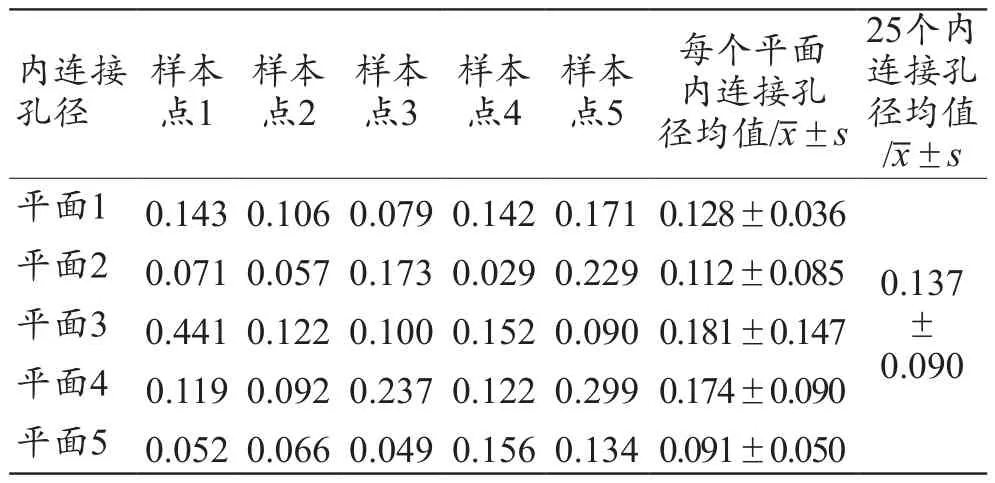
表4 多孔样件各平面孔内连接径测量结果(mm)
3.4.2 连通性
采用Mimics 16.0软件中孔分析功能计算多孔样件连通率为99.38%。
3.5 开/闭孔率
采用VG Studio MAX 3.0软件中杂物分析功能得到样件闭孔分布如图13所示。计算多孔样件开孔率为64.40%,闭孔率为0.15%。

图13 样件开/闭孔分布
4 讨论
3D打印外科植入物多孔结构几何特征参数对其在体内的服役性能的影响至关重要,在充分调研国际及国内相关测试方法后,发现相关标准虽然提到了测试方法,但仅说明了可能采用的相关测试设备,并无明确的测试步骤,同时对每种测试设备的测试难点及是否可行没有明确的结论,且目前国内鲜见具体测试方法的研究。基于此,本文开展了多孔结构的孔隙率、微孔孔径、宏孔孔径、连通性测试方法的研究,测试方法参考了YY/T 1558.3-2017[21]和GB/T 36984-2018[22]。通过对测试方法中检测难点的剖析,形成了一套多孔结构形貌的具体量化测试方法,且该方法具有科学性和可操作性,可适用于大部分多孔结构样件。
在孔隙率的测试方法上,本文还对Micro-CT扫描数据分析得到的三维孔隙率和称重法实测测量值进行比较,结果显示,三维孔隙率和称重法所得孔隙率分别为64.55%和64.90%,2种方法计算结果的相对误差为0.35%,表明通过三维分析能有效反映多孔结构孔隙率。相比以上2种测试方法,Micro-CT扫描数据分析法无需分别提供实体和多孔样块,且无需考虑样品干燥程度、空气湿度等因素的影响,更为便捷有效。
同时对YY/T 1558.3-2017[21]中未涉及的开/闭孔率进行了测试方法研究。开/闭孔率作为多孔结构的重要评价指标之一,食品药品监管总局发布的《总局关于发布钙磷/硅类骨填充材料等3项注册技术审查指导原则》[20]中也提及了该内容,因闭孔对于骨长入是无效的,则该项目可作为多孔结构性能评价的研究内容之一,利于帮助制造商更好地提高制造水平。
3D打印陶瓷样件在高温脱脂烧结过程,表面会形成微米级的多孔结构,Micro-CT目前可以最小分辨亚微米级的结构,但受分辨率限制,需要严格限制送检样件的宏观尺寸以达到良好的观测效果,如期望最小观察1 μm左右的微孔结构,需要将样件尺寸限制在1 mm以下,即样件最大宏观尺寸不宜超过最小微观特征的1000倍,这给样件制备带来较大困难[25]。而使用扫描电镜观察微孔结构时,受设备限制,观测样件以薄片效果最佳,并且仅可观察样件表面形貌,无法观察样件内部微结构形态。因此目前对于3D打印陶瓷样件内部微孔的检测,仍存在诸多困难,具体检测方法的选择应根据样件具体性能及特征尺度观测需求进行合理选择。
5 结论
本研究主要面向3D打印多孔结构陶瓷材料外科植入物,通过对不同测试方法的理论对比和可行性分析,提出了基于Micro-CT和扫描电镜扫描成像方法进行3D打印多孔结构陶瓷样件的孔隙结构的宏微观特征表征和分析的统计方法,形成了一套3D打印多孔结构陶瓷材料外科植入物形貌宏微结构尺寸特征的有效的测量和评价方法。本文提出的方法,有利于实现多孔结构宏微观特征的相关测试内容和试验过程的规范统一,确保测试过程方法有据可依,结果评价准确有效,有利于提升产品的加工精度,便于不同企业同种工艺制造的多孔结构特征参数之间等同比较,并可为医疗器械行业多孔结构宏微观特征的数据积累奠定基础,有利于提高与人体生命安全息息相关的外科植入物产品的研发和制造水平。

