含NO供体的水杨酸卟啉酯类化合物的合成、体外活性及作用机制
瑜文美,杨玲艳,刘振华,李 辉,田泽杰,李嘉欣,易小婵,何 军,刘运美*
(南华大学 a.药学院,b.化学化工学院,中国 衡阳 421001)
水杨酸是一种单羟基苯甲酸,是从柳树中提取出来具有抗炎活性的天然产物[1]。近年来,研究发现炎症与癌症之间有着复杂多样的联系[2-5]。Kutlu等人[6]通过实验验证了水杨酸对A549细胞具有抗增殖活性。研究表明,阿司匹林(对乙酰水杨酸)会影响多种癌细胞的生长[7-9],NO-阿司匹林衍生物通过GSH和蛋白硫醇反应诱导肿瘤细胞凋亡[10,11]。一氧化氮(NO)是一种多功能自由基,在体内由一氧化氮合酶(NOS)调节其水平[12]。NO作为信号分子,可调控多种生理过程,近些年研究发现,NO与肿瘤的发生和增殖相关[13-15],且呈现出浓度依赖性的特点[16]。NO等气体疗法作为一种新型的肿瘤治疗方法也成为研究的热点。
卟啉是一类杂环有机化合物,在植物和哺乳动物的生命活动中发挥着重要作用。在20世纪初,研究者们发现血卟啉能选择性地聚集在肿瘤组织中并发生光敏化[17]。卟啉作为光敏剂应用于光动力疗法(PDT)被广泛研究。PDT利用可见光与光敏剂的肿瘤定位作用治疗恶性肿瘤,使其在不损伤正常组织或器官的情况下选择性靶向,产生对癌细胞具有杀伤性的ROS,最终破坏肿瘤细胞[18-21]。相对于传统的肿瘤治疗方法,PDT具有简单有效、毒副作用小及无创等多方面的特点[22-25],这对于传统治疗方法不耐受的患者尤为适用。
虽然光动力疗法因其毒副作用小及无创等特点而被广泛关注,但是单一的PDT无法达到完全治疗的目的。联合治疗是目前癌症治疗的新趋势和新方向之一。为了增强卟啉化合物的抗肿瘤活性,大量研究表明,将卟啉与多种天然抗癌药结合能够得到疗效更好、毒性更低的抗肿瘤药物。为此,本文设计并合成含NO供体的卟啉-水杨酸衍生物,并采用MTT法对其抗肿瘤活性进行研究,期望得到活性更好、毒副作用小的抗肿瘤药物。同时,对其进行分子模拟研究,将目标化合物与CDK和PI3K靶蛋白进行分子模拟对接,推测目标化合物的体内抗肿瘤作用机制。
1 仪器与试剂
Bruker AVANCE-500兆核磁共振波谱仪(瑞典,德国),APCI-MS光谱仪(美国加州),二氧化碳培养箱(赛默飞科技有限公司),酶标仪(BIO-TEK 公司)。薄层硅胶G板和0.075—0.154 mm孔径硅胶粉(安徽良臣硅源材料有限公司)。水杨酸、5-氯水杨酸、吡咯、2-溴乙醇、3-溴丙醇、4-溴-1-丁醇、5-溴-1-戊醇、6-溴-1-己醇、4-羟基苯甲醛及苯甲醛等从阿拉丁试剂有限公司购入,均为分析纯,无须进一步纯化。MTT(噻唑蓝)试剂(上海麦克林生化科技有限公司)。DEAM Basic (1X),Fetal Bovine Serum (FBS),Trypsin-EDTA(胰蛋白酶)及PBS磷酸盐缓冲剂等均从Gibco Company购入。
2 方法
2.1 合成路线
设计合成20个含NO供体的卟啉-水杨酸化合物。首先将溴代醇(2-溴乙醇,3-溴-1-丙醇,4-溴-1-丁醇,5-溴-1-戊醇,6-溴-1-己醇)分别与浓硝酸进行硝化反应合成溴代硝酸酯(2a-2e),2a-2e再分别与水杨酸或5-氯水杨酸发生取代反应生成化合物3a-3e和4a-4e,进一步酰氯化后与卟啉化合物进行反应合成了目标化合物(7a-10e)。化合物的合成路线如图1所示。
2.2 实验步骤
2.2.1 溴代硝酸酯(2a-2e)的合成 量取1.1 mL浓硝酸和2.4 mL浓硫酸加入到圆底烧瓶,在冰浴条件下搅拌10 min,缓慢加10 mmol 2-溴乙醇到反应瓶中,继续反应1 h。将反应液倒入冰水中,用CH2Cl2进行萃取,萃取得到的有机相用无水Na2SO4干燥,减压浓缩,放于真空干燥箱中干燥,得到黄色油状液体2a。分别以3-溴-1-丙醇,4-溴-1-丁醇,5-溴-1-戊醇,6-溴-1-己醇替代2-溴乙醇,以同样的方法得到黄色油状液体2b-2e,收率为89%~98%。
2.2.2 水杨酸衍生物(3a-4e)的合成 精确称取0.9 mmol水杨酸、4.5 mmol无水K2CO3加入到圆底烧瓶,DMF作溶剂,在氮气保护的条件下于室温下搅拌10 min,加0.9 mmol上一步合成的溴代硝酸酯到反应瓶中,继续反应1 h。反应液倒入分液漏斗,用CH2Cl2萃取,并水洗4~5次除去DMF,将有机相用无水Na2SO4干燥,减压浓缩,放于真空干燥箱中干燥,得淡黄色油状粗产物。用二氯甲烷和正己烷作为洗脱剂过硅胶柱纯化,干燥后得化合物3a-3e,收率为47%~55%。以5-氯水杨酸替代水杨酸,用相同的合成方法得到化合物4a-4e,收率为47%~53%。
2.2.3 卟啉化合物(5和6)的合成 精确称取10.2 g苯甲醛、5.3 g对羟基苯甲醛加入到500 mL三颈烧瓶中,以丙酸作溶剂,于135 ℃油浴锅加热至反应液回流,用恒压滴液漏斗缓慢滴4.8 mL新蒸吡咯和丙酸的混合液到反应瓶中,继续搅拌2 h。反应液于室温下放置冷却,向其中加入等量的无水乙醇,在4 ℃下冷藏24 h。抽滤,得蓝紫色粗产物,过硅胶柱纯化(洗脱剂V(二氯甲烷)∶V(正己烷)=3∶1),收集第二条色带,得到蓝紫色的晶体5,收率为8%。以对氯苯甲醛代替苯甲醛,用相同的合成方法得到蓝紫色的晶体6,收率为9%。
2.2.4 卟啉-水杨酸衍生物(7a-10e)的合成 取0.2 mmol3a,0.2 mmol SOCl2和0.2 mmol DMF加入到50 mL圆底烧瓶,用CH2Cl2溶解,于室温反应,TLC点板监测至反应完全,减压旋去溶剂,加入CH2Cl2放置备用。精确称取0.1 mmol晶体5,0.5 mmol无水K2CO3加入到100 mL 圆底烧瓶,以DMF作溶剂,在60 ℃下反应30 min,将上述所得的酰氯化合物滴加到反应液中,TLC点板监测至反应完全。用CH2Cl2萃取,水洗4~5次除去DMF,将有机相用无水Na2SO4干燥,减压浓缩,放于真空干燥箱中干燥,得粗产物。用二氯甲烷和正己烷作为洗脱剂过硅胶柱分离纯化,收集第一条色带,再用正己烷和乙醇重结晶,得到紫色的目标化合物7a。分别以3b,3c,3d,3e,4a,4b,4c,4d,4e代替3a,卟啉化合物6代替卟啉化合物5,用相同的合成方法得到目标化合物7b-10e。
2.2.5 抗增殖活性测试 以5-FU为阳性对照组,卟啉化合物母体5和6以及水杨酸化合物为原型药对照组,采用MTT法研究合成的目标化合物7a-10e对HCT-116和A549的体外抗增殖活性。将细胞(对数生长期)消化至略微脱落,加入培养基吹打形成细胞悬浮液,以每孔的细胞数目大约为5×103接种至96孔板,于细胞培养箱培养24 h。按浓度梯度以成倍稀释的关系(128,64,…,2,1 μmol·L-1)加入待测药物的含药培养基,各浓度重复6个孔,各孔150 μL,同时设置A板光照组和B板黑暗组并做相同处置。4 h后,A板弃去原有溶液,各孔加入150 μL PBS,使用12 W紫外灯照射10 min,弃去PBS,往96孔板中重新加入新的培养基,各孔150 μL。培养48 h后,各孔加20 μL配置的MTT溶液,温育4 h,舍弃所有溶液,各孔加入150 μL DMSO溶液摇床摇晃10 min,酶标仪检测570 nm处的OD值,最终计算得出药物的抑制率(IC50值)。
2.2.6 分子对接 PI3K和CDK是目前研究较为广泛的靶标蛋白。在快速增殖的肿瘤组织中PI3K的活性增强,PI3K在调节细胞的生理过程中发挥重要作用,CDK对细胞增殖起关键作用,CDK失活能够导致有丝分裂的停止。从蛋白质数据库(http://www.ncbi.nlm.nih.gov/protein/)下载CDK蛋白(PDB: 4y72)和PI3K蛋白(PDB: 1e7u),分别与筛选出的具有较好肿瘤细胞抑制活性的9b和9c用SYBYL-X 2.0软件进行分子对接实验研究。
3 结果与讨论
3.1 目标化合物的合成
3.1.1 产率及结构表征数据 化合物7a:收率为40%,1H NMR (500 MHz, Chloroform-d) δ 8.86 (d,J=7.3 Hz, 8H, pyrrole-β-H), 8.22~8.29(m, 7H, meso-Ph-H), 8.17~8.20(m, 2H, meso-Ph-H),7.73 (q,J=7.5, 6.3 Hz, 10H, meso-Ph-H), 7.16~7.29(m, 4H, Ph-H), 4.61 (t,J=6.3 Hz, 2H, —CH2—), 3.83 (t,J=6.1 Hz, 2H, —CH2—), -2.75 (s, 2H, pyrrole-NH). MS (MALDI-TOF):m/z 理论值(C53H37N5O6+840.898 6[M+H]+), 实测值 840.856 3.
化合物7b:收率为41%,1H NMR (500 MHz, Chloroform-d) δ 8.84~8.88(m, 8H, pyrrole-β-H), 8.23 (dt,J=7.4, 1.2 Hz, 7H, meso-Ph-H), 8.11~8.14(m, 2H, meso-Ph-H), 7.77 (dqd,J=8.7, 7.2, 1.9 Hz, 10H, meso-Ph-H), 7.24 (s, 4H, Ph-H), 4.84 (t,J=6.3 Hz, 2H, —CH2—), 4.33 (t,J=5.8 Hz, 2H, —CH2—), 2.39 (p,J=6.1 Hz, 2H, —CH2—), -2.75 (s, 2H, pyrrole-NH). MS (MALDI-TOF):m/z理论值(C54H39N5O6+854.925 2[M+H]+), 实测值 854.904 7.
化合物7c:收率为38%,1H NMR (500 MHz, Chloroform-d) δ 8.88 (d,J=10.7 Hz, 8H, pyrrole-β-H), 8.16~8.32(m, 7H, meso-Ph-H), 8.10~8.15(m, 2H, meso-Ph-H), 7.77 (qd,J=6.6, 3.4 Hz, 10H, meso-Ph-H), 7.22~7.27(m, 4H, Ph-H), 4.66 (td,J=6.1, 2.4 Hz, 2H, —CH2—), 4.24 (q,J=5.9, 5.2 Hz, 2H, —CH2—), 2.10 (dtt,J=13.8, 7.2, 3.5 Hz, 4H, —CH2—), -2.73 (s, 2H, pyrrole-NH). MS (MALDI-TOF):m/z理论值(C55H41N5O6+868.951 7[M+H]+), 实测值 868.892 4.
化合物7d:收率为37%,1H NMR (500 MHz, Chloroform-d) δ 8.84~8.91(m, 8H, pyrrole-β-H), 8.23 (dt,J=7.7, 1.3 Hz, 7H, meso-Ph-H), 8.11~8.14(m, 2H, meso-Ph-H), 7.73~7.82(m, 10H, meso-Ph-H), 7.22~7.30(m, 4H, Ph-H), 4.58 (t,J=6.6 Hz, 2H, —CH2—), 4.24 (t,J=6.1 Hz, 2H, —CH2—), 2.01 (dt,J=15.3, 6.4 Hz, 2H, —CH2—), 1.93 (dq,J=8.5, 6.7 Hz, 2H, —CH2—), 1.75~1.81(m, 2H, —CH2—), -2.75 (s, 2H, pyrrole-NH). MS (MALDI-TOF):m/z理论值(C56H43N5O6+882.978 3[M+H]+), 实测值 882.917 5.
化合物7e:收率为39%,1H NMR (500 MHz, Chloroform-d) δ 8.84~8.91(m, 8H, pyrrole-β-H), 8.23 (dt,J=7.6, 1.3 Hz, 7H, meso-Ph-H), 8.10~8.14(m, 2H, meso-Ph-H), 7.76 (qd,J=6.6, 5.0 Hz, 10H, meso-Ph-H), 7.24~7.30(m, 4H, Ph-H), 4.25 (t,J=6.3 Hz, 2H, —CH2—), 3.64 (t,J=6.7 Hz, 2H, —CH2—), 1.98~2.02(m, 2H, —CH2—), 1.91 (q,J= 6.9 Hz, 2H, —CH2—), 1.63~1.70(m, 4H, —CH2—), -2.75 (s, 2H, pyrrole-NH). MS (MALDI-TOF):m/z理论值(C57H45N5O6+897.004 9[M+H]+), 实测值 897.923 8.
化合物8a:收率为48%,1H NMR (500 MHz, Chloroform-d) δ 8.78 (d,J=7.3 Hz, 8H, pyrrole-β-H), 8.24~8.31 (m, 7H, meso-Ph-H), 8.19~8.23(m, 2H, meso-Ph-H),7.71 (q,J=7.7, 6.5 Hz, 10H, meso-Ph-H), 7.25 (s, 3H, Ph-H), 4.62 (t,J=6.3 Hz, 2H, —CH2—), 4.59 (t,J=6.2 Hz, 2H, —CH2—), -2.76 (s, 2H, pyrrole-NH). MS (MALDI-TOF):m/z理论值(C53H36ClN5O6+875.343 6[M+H]+), 实测值 875.302 1.
化合物8b:收率为45%,1H NMR (500 MHz, Chloroform-d) δ 8.86 (d,J=8.3 Hz, 8H, pyrrole-β-H), 8.18~8.28(m, 7H, meso-Ph-H), 8.13 (d,J=8.3 Hz, 2H, meso-Ph-H), 7.77 (qd,J=6.6, 3.6 Hz, 10H, meso-Ph-H), 7.26 (s, 3H, Ph-H), 4.84 (td,J=6.3, 2.3 Hz, 2H, —CH2—), 4.31~4.35(m, 2H, —CH2—), 2.39 (ddt,J=9.3, 6.2, 3.2 Hz, 2H, —CH2—), -2.75 (s, 2H, pyrrole-NH). MS (MALDI-TOF):m/z理论值(C54H38ClN5O6+889.370 2[M+H]+), 实测值 889.319 3.
化合物8c:收率为46%,1H NMR (500 MHz, Chloroform-d) δ 8.78 (d,J=7.3 Hz, 8H, pyrrole-β-H), 8.11~8.25(m, 7H, meso-Ph-H), 7.95~8.09(m, 2H, meso-Ph-H), 7.72 (t,J=7.5 Hz, 10H, meso- Ph-H), 7.18~7.21(m, 3H, Ph-H), 4.57 (t,J=6.4 Hz, 2H, —CH2—), 4.39 (t,J=6.3 Hz, 2H, —CH2—), 1.83~1.88(m, 4H, —CH2—), -2.75 (s, 2H, pyrrole-NH). MS (MALDI-TOF):m/z理论值(C55H40ClN5O6+903.396 8[M+H]+), 实测值 903.337 4.
化合物8d:收率为43%,1H NMR (500 MHz, Chloroform-d) δ 8.87 (d,J= 16.7 Hz, 8H, pyrrole-β-H), 8.18~8.29(m, 7H, meso-Ph-H), 8.12 (d,J=8.3 Hz, 2H, meso-Ph-H), 7.72~7.82(m, 10H, meso-Ph-H), 7.26 (d,J=8.5 Hz, 3H, Ph-H), 4.58 (t,J=6.6 Hz, 2H, —CH2—), 4.25 (t, J=6.1 Hz, 2H, —CH2—), 2.03 (q,J=7.5, 7.0 Hz, 2H, —CH2—), 1.94 (q,J=7.2 Hz, 2H, —CH2—), 1.78 (q,J= 8.5 Hz, 2H, —CH2—), -2.76 (s, 2H, pyrrole-NH). MS (MALDI-TOF):m/z理论值(C56H42ClN5O6+917.423 4[M+H]+), 实测值 917.386 2.
化合物8e:收率为40%,1H NMR (500 MHz, Chloroform-d) δ 8.84~8.89(m, 8H, pyrrole-β-H), 8.21~8.26(m, 7H, meso-Ph-H), 8.13~8.16(m, 2H, meso-Ph-H), 7.74~7.81(m, 10H, meso-Ph-H), 7.32~7.36(m, 3H, Ph-H), 4.30 (t,J=6.3 Hz, 2H, —CH2—), 3.67 (t,J=6.6 Hz, 2H, —CH2—), 2.01~2.07(m, 2H, —CH2—), 1.91~1.98(m, 2H, —CH2—), 1.63~1.76(m, 4H, —CH2—), -2.76 (s, 2H, pyrrole-NH). MS (MALDI-TOF):m/z理论值(C57H44ClN5O6+931.45[M+H]+), 实测值 931.408 3.
化合物9a:收率为49%,1H NMR (500 MHz, Chloroform-d) δ8.83~8.89(m, 8H, pyrrole-β-H), 8.17~8.37(m, 9H, meso-Ph-H), 7.77 (d,J=8.1 Hz, 7H, meso-Ph-H), 7.32 (d,J=8.7 Hz, 4H, Ph-H), 4.65 (t,J=6.2 Hz, 2H, —CH2—), 4.57 (t,J=5.9 Hz, 2H, —CH2—), -2.78 (s, 2H, pyrrole-NH). MS (MALDI-TOF):m/z理论值(C53H34Cl3N5O6+944.233 8[M+H]+), 实测值 944.203 7.
化合物9b:收率为50%,1H NMR (500 MHz, Chloroform-d) δ 8.81~8.92(m, 8H, pyrrole-β-H), 8.08~8.16(m, 9H, meso-Ph-H), 7.69~7.78(m, 7H, meso-Ph-H), 7.28 (d,J=8.2 Hz, 4H, Ph-H), 4.40 (t,J=5.8 Hz, 2H, —CH2—), 3.93 (t,J=6.3 Hz, 2H, —CH2—), 2.44 (p,J=6.0 Hz, 2H, —CH2—), -2.81 (s, 2H, pyrrole-NH). MS (MALDI-TOF):m/z理论值(C54H36Cl3N5O6+958.260 3[M+H]+), 实测值 958.219 5.
化合物9c:收率为46%,1H NMR (500 MHz, Chloroform-d) δ 8.88~8.91(m, 8H, pyrrole-β-H), 8.16~8.21(m, 9H, meso-Ph-H), 7.95 (dd,J=8.1, 5.7 Hz, 7H, meso-Ph-H), 7.71 (dd,J=8.3, 2.9 Hz, 4H, Ph-H), 4.46 (t,J=5.8 Hz, 2H, —CH2—), 4.15 (t,J=6.2 Hz, 2H, —CH2—), 1.89~1.98(m, 4H, —CH2—), -2.78 (s, 2H, pyrrole-NH). MS (MALDI-TOF):m/z理论值(C55H38Cl3N5O6+972.286 9[M+H]+), 实测值 972.225 6.
化合物9d:收率为47%,1H NMR (500 MHz, Chloroform-d) δ 8.84~8.95(m, 8H, pyrrole-β-H), 8.12~8.18(m, 9H, meso-Ph-H), 7.77 (d,J=8.2 Hz, 7H, meso-Ph-H), 7.30 (d,J=8.8 Hz, 4H, Ph-H), 4.62 (t,J=6.5 Hz, 2H, —CH2—), 4.29 (t,J= 6.1 Hz, 2H, —CH2—), 2.03~2.10(m, 2H, —CH2—), 1.95~2.01(m, 2H, —CH2—), 1.81 (t,J= 7.9 Hz, 2H, —CH2—), -2.78 (s, 2H, pyrrole-NH). MS (MALDI-TOF):m/z理论值(C56H40Cl3N5O6+986.313 5[M+H]+), 实测值 986.258 1.
化合物9e:收率为45%,1H NMR (500 MHz, Chloroform-d) δ 8.89 (d,J=4.7 Hz, 2H, pyrrole-β-H), 8.83 (d,J=4.0 Hz, 6H, pyrrole-β-H), 8.06~8.17(m, 9H, meso-Ph-H), 7.71~7.79(m, 7H, meso- Ph-H), 7.28 (d,J=8.5 Hz, 4H, Ph-H), 4.26 (t,J=6.3 Hz, 2H, —CH2—), 3.64 (t,J=6.6 Hz, 2H, —CH2—), 2.01 (p,J=6.6 Hz, 2H, —CH2—), 1.93 (p,J=6.8 Hz, 2H, —CH2—), 1.65~1.74(m, 4H, —CH2—), -2.81 (s, 2H, pyrrole-NH). MS (MALDI-TOF):m/z理论值(C57H42Cl3N5O6+1 000.340 0[M+H]+), 实测值 1 000.289 3.
化合物10a:收率为53%,1H NMR (500 MHz, Chloroform-d) δ 8.74~8.83(m, 8H, pyrrole-β-H), 8.17~8.37(m, 9H, meso-Ph-H), 7.75 (d,J=8.3 Hz, 7H, meso-Ph-H), 7.31 (d,J=8.6 Hz, 3H, Ph-H), 4.63 (t,J=6.3 Hz, 2H, —CH2—), 4.59 (t,J=6.1 Hz, 2H, —CH2—), -2.81 (s, 2H, pyrrole-NH). MS (MALDI-TOF):m/z理论值(C53H33Cl4N5O6+978.678 8[M+H]+), 实测值 978.619 7.
化合物10b:收率为54%,1H NMR (500 MHz, Chloroform-d) δ 8.92 (d,J=4.8 Hz, 2H, pyrrole-β-H), 8.83 (d,J=2.5 Hz, 6H, pyrrole-β-H), 8.07~8.16(m, 9H, meso-Ph-H), 7.71~7.76(m, 7H, meso- Ph-H), 7.24~7.32(m, 3H, Ph-H), 4.40 (t,J=5.8 Hz, 2H, —CH2—), 3.93 (t,J=6.3 Hz, 2H, —CH2—), 2.44 (p,J=6.1 Hz, 2H, —CH2—), -2.82 (s, 2H, pyrrole-NH). MS (MALDI-TOF):m/z理论值(C54H35Cl4N5O6+992.705 4[M+H]+), 实测值 992.663 1.
化合物10c:收率为48%,1H NMR (500 MHz, Chloroform-d) δ 8.85 (d,J=2.4 Hz, 8H, pyrrole-β-H), 8.21~8.25(m, 9H, meso-Ph-H), 7.89~7.92(m, 7H, meso-Ph-H), 7.56~7.61(m, 3H, Ph-H), 4.57 (t,J=6.4 Hz, 2H, —CH2—), 4.43 (t,J=6.3 Hz, 2H, —CH2—), 1.87~1.96(m, 4H, —CH2—), -2.81 (s, 2H, pyrrole-NH). MS (MALDI-TOF):m/z理论值(C55H37Cl4N5O6+1 006.732[M+H]+), 实测值 1 006.702 8.
化合物10d:收率为46%,1H NMR (500 MHz, Chloroform-d) δ 8.83~8.95(m, 8H, pyrrole-β-H), 8.16 (t,J=7.4 Hz, 9H, meso-Ph-H), 7.77 (d,J= 8.1 Hz, 7H, meso-Ph-H), 7.30 (d,J=8.5 Hz, 3H, Ph-H), 4.59 (t,J=6.4 Hz, 2H, —CH2—), 4.31 (t,J=6.5 Hz, 2H, —CH2—), 1.95~2.02(m, 2H, —CH2—), 1.95~2.01(m, 2H, —CH2—), 1.75~1.82(m, 2H, —CH2—), -2.79 (s, 2H, pyrrole-NH). MS (MALDI-TOF):m/z理论值(C56H39Cl4N5O6+1 020.759[M+H]+), 实测值 1 020.714 9.
化合物10e:收率为45%,1H NMR (500 MHz, Chloroform-d) δ 8.90~8.94(m, 8H, pyrrole-β-H), 8.23 (t,J=7.4 Hz, 9H, meso-Ph-H), 7.71 (dd,J=8.2, 1.7 Hz, 7H, meso-Ph-H), 7.28~7.36(m, 3H, Ph-H), 4.32 (t,J=6.3 Hz, 2H, —CH2—), 3.77 (t,J=6.6 Hz, 2H, —CH2—), 2.01~2.06(m, 2H, —CH2—), 1.92~1.97(m, 2H, —CH2—), 1.66~1.74(m, 4H, —CH2—), -2.82 (s, 2H, pyrrole-NH). MS (MALDI-TOF):m/z理论值(C57H41Cl4N5O6+1 034.785[M+H]+), 实测值 1 034.706 9.
3.1.2 合成过程的影响因素 (1)在溴代醇的硝化反应中,碳链长的溴代醇反应收率略高于碳链短的溴代醇反应收率,由于溴是吸电子基团,因此它会减慢硝化反应的反应速率,随着碳链长度的延长,溴原子对反应的影响程度越来越小。(2)在水杨酸或5-氯水杨酸与溴代硝酸酯的取代反应中,水杨酸与溴代硝酸酯的反应收率略高于5-氯水杨酸与溴代硝酸酯的反应收率,这可能是因为氯原子的吸电子诱导效应大于给电子共轭效应,总的来说会降低苯环上的电子云密度,不利于进行亲核反应。(3)反应最后一步合成目标化合物,硝酸酯部分碳链短的水杨酸衍生物与卟啉反应的产物收率比硝酸酯部分碳链长的水杨酸衍生物与卟啉反应的产物收率高一点,原因可能是碳链长的位阻大,不利于反应的进行。
3.2 抗增殖活性特征
采用MTT法对所有最终产物进行抗HCT-116细胞和A549细胞增殖活性的检测。经典抗肿瘤药5-FU作为参比化合物。所有目标化合物(7a-10e)、卟啉化合物(5和6)及水杨酸单体的抗增殖效果如表1所示。在光照条件下,大部分目标化合物对HCT-116细胞和A549细胞的抑制作用强于卟啉母体化合物5和6及水杨酸单体化合物。在黑暗条件下,目标化合物对受试细胞株的毒性相对较小。与5-氟尿嘧啶(IC50=60.05 μmol·L-1)相比,化合物9c对HCT-116细胞的抑制作用最强,IC50值为37.65 μmol·L-1。相比于5-氟尿嘧啶(IC50=78.24 μmol·L-1),化合物9b和9c对A549细胞均有较好的抑制活性,IC50值分别为66.89 和58.36 μmol·L-1。
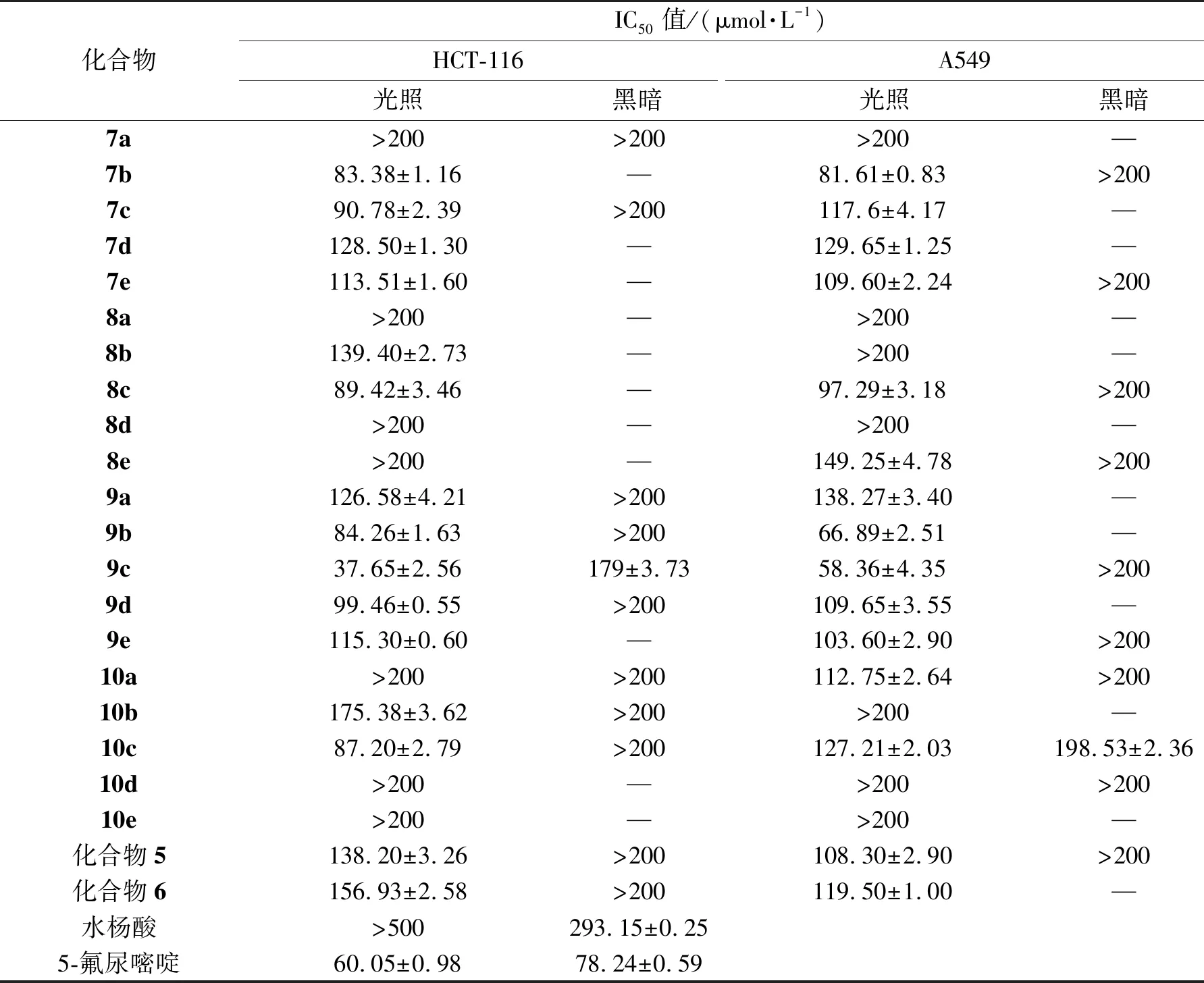
表1 卟啉-水杨酸化合物的抗肿瘤抑制作用
3.3 分子对接效应
化合物9b和9c的对接结果如图2所示。从图2(a)和(b)可以看出化合物9b和9c通过多个位点分别与PI3K靶蛋白进行结合。化合物9b主要通过卟啉母核吡咯环上的氮氢与氨基酸残基 LYS-807 形成1个氢键,水杨酸化合物中的NO供体部分与残基TYR-867及LYS833形成2个氢键。而在化合物9c中主要通过水杨酸化合物中的含NO供体部分与氨基酸残基 HIS-288及ARG-257形成2个氢键,卟啉母核与水杨酸结合处的酯基与残基LYS-195形成1个氢键。从图2(c)和(d)化合物9b和9c与CDK对接活性图中可以看出,化合物9b和9c主要通过水杨酸化合物中的含NO供体片段与氨基酸残基PHE147和ASP146形成2个氢键。由此可以看出化合物9b和9c与CDK及PI3K蛋白均具有较好的结合作用,这可能与其体内抗肿瘤作用存在一定相关性。
4 结论
通过化学合成手段成功制备了20个未见文献报道的含NO供体的卟啉-水杨酸化合物,其结构用氢谱及质谱进行了确证。其中化合物9b和9c对HCT-116细胞和A549细胞均显示出良好的体外抗增殖效果。分子对接结果显示化合物9b及9c能很好地与CDK及PI3K靶蛋白结合,9b及9c在体内可能通过与CDK及PI3K结合,阻断PI3K-AKT-mTOR通路,抑制肿瘤细胞的增殖,从而实现抗癌的功效。

