内质网应激在吸烟COPD模型小鼠膈肌细胞凋亡中的作用及机制研究①
任慧敏 韩树池 薛乾隆 王 慧 王 佳 (河北北方学院附属第一医院急诊科,张家口 075000)
慢性阻塞性肺疾病(chronic obstructive pulmo-nary disease,COPD)是以进行性发展的气流受限为特征的慢性呼吸系统疾病。膈肌是与呼吸功能直接相关的呼吸肌,长期存在的气流受限会增加膈肌负荷,引起膈肌功能障碍[1-2]。有研究报道,膈肌细胞凋亡是引起COPD患者膈肌功能障碍的重要因素之一,但目前COPD发病过程中膈肌细胞凋亡的调控机制尚不十分清楚[3]。
内质网应激(endoplasmic reticulum stress,ERS)是调控细胞凋亡的机制之一,具体是指病理刺激下未折叠或错误折叠蛋白在内质网聚集中引发的未折叠蛋白反应,进而通过下游蛋白激酶R样内质网激酶(protein kinase R-like ER kinase,PERK)、肌醇酶1α(inositol-requiringenzyme 1α,IRE1α)、活化转录因子6(activating transcription factor,ATF6)三种跨膜蛋白进行信号转导,最终介导细胞适应性存活或凋亡。有研究报道,COPD患者膈肌组织中ERS过度激活,多种ERS标志基因表达增加,但ERS在膈肌细胞凋亡中的作用尚不明确[4]。本研究拟通过动物实验探讨ERS在吸烟COPD模型小鼠膈肌细胞凋亡中的作用及机制,旨在为阐明COPD发病过程中膈肌细胞凋亡的分子机制提供依据。
1 材料与方法
1.1 材料
1.1.1 实验动物 野生型SPF级雄性C57BL/6小鼠由上海西普尔-必凯实验动物公司提供,生产许可:SCXK(沪)2018-0006;Perk基因敲除(Perk-/-)小鼠(C57BL/6背景)购自北京唯德生物科技有限公司。
1.1.2 主要试剂及仪器 芙蓉牌香烟(湖南中烟工业有限责任公司,每支含尼古丁1.0 mg、焦油12 mg);ERS拮抗剂4-苯基丁酸(4-PBA)、ERS激动剂毒胡萝卜素(MCE公司);IL-1β、IL-6 ELISA试剂盒(上海西唐生物公司);HE染色试剂盒(武汉博士德公司);TUNEL细胞凋亡检测试剂盒(上海碧云天公司);PERK、IRE1α、ATF6、PERK、CHOP、Caspase-12一抗(Abcam公司);eIF2α及p-eIF2α一抗(CST公司)。小动物肺功能仪(北京新行兴业科贸公司);正置显微镜(Nikon公司);凝胶电泳系统及成像系统(上海天能公司)。
1.2 方法
1.2.1 动物造模及给药 野生型雄性C57BL/6小鼠随机分为对照组、模型组、激动剂组、拮抗剂组,每组8只。Perk-/-雄性小鼠随机分为PERK-KO组、PERK-KO+模型组,每组8只。采用被动吸烟法制备COPD模型,方法如下:每日将小鼠置于自制薰烟箱内、暴露于10支香烟中2次,起始时燃烧4支香烟,然后每次燃烧2支香烟,每只香烟燃烧约12 min,换烟间隔3 min,2次被动吸烟间隔>4 h,持续12周。激动剂组每日2次被动吸烟之间给予300 ng/kg毒胡萝卜素腹腔注射,剂量选择参照HUANG等[5]的研究;抑制剂组每日2次被动吸烟之间给予0.35 g/kg 4-PBA灌胃,剂量选择参照任路平等[6]的研究。
1.2.2 肺功能检测 腹腔注射1%戊巴比妥钠,剂量40 mg/kg,麻醉后进行气管插管,与小动物肺功能仪连接,测定0.3 s用力呼气容积(forced expiratory volume in 0.3 second,FEV0.3)占用力肺活量(forced vital capacity,FVC)的比值(FEV0.3/FVC)和呼气峰流速(peak expiratory flow,PEF)。
1.2.3 血清及支气管肺泡灌流液(BALF)中炎症细胞因子的检测 完成肺功能测定后经眼球取血, 1 500 r/min离心分离血清;处死小鼠,做颈部切口暴露气管,插入灌流针并用预冷的磷酸盐缓冲液1 ml灌洗肺泡3次,吸出BALF并于1 500 r/min 离心 10 min,分离上清。采用ELISA试剂盒检测IL-1β、IL-6含量。
1.2.4 肺组织病理改变的HE染色 完成血清及BALF取材后,解剖得到适量肺组织,4%多聚甲醛固定后制作4 μm厚的病理切片,采用HE染色试剂盒染色,按照试剂盒说明书操作,显微镜下观察 肺组织病理改变,测量肺泡平均截距(mean linear intercept,MLI)。
1.2.5 膈肌组织细胞凋亡率的TUNEL检测 解剖膈肌组织适量,4%多聚甲醛固定后制作4 μm厚的病理切片,采用TUNEL试剂盒染色,按照试剂盒说明书操作,显微镜下观察TUNEL阳性染色和DAPI阳性染色的细胞并计数,按照TUNEL阳性细胞数/DAPI阳性细胞数计算细胞凋亡率。
1.2.6 Western blot检测膈肌组织中蛋白表达 另取适量膈肌组织,加入RIPA裂解液匀浆,提取得到蛋白后采用BCA法测定蛋白浓度,根据蛋白浓度取30 μg蛋白进行SDS-PAGE,电泳后电转移至PVDF膜,孵育1∶1 000稀释的PERK、IRE1α、ATF6、PERK、eIF2α、p-eIF2α、CHOP、Caspase-12一抗或1∶3 000稀释的β-actin一抗过夜,孵育1∶2 000稀释的二抗1 h,在凝胶成像系统中显影并计算蛋白条带吸光度,以β-actin为内参,对PERK、IRE1α、ATF6、PERK、eIF2α、CHOP、Caspase-12的表达水平进行半定量 分析。
1.3 统计学方法 采用SPSS20.0软件进行统计学处理,实验数据均为计量资料,经正态性检验符合正态分布,多组间比较采用方差分析,进一步两两比较采用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 吸烟COPD模型小鼠肺功能及肺组织病理改变 对照组小鼠肺泡结构清晰、肺泡壁完整。被动吸烟法制作COPD模型后,模型组出现肺泡结构紊乱、肺泡壁破裂、肺泡腔扩大等病理改变。测量MLI并比较可知:与对照组相比,模型组小鼠MLI明显增加。见图1。
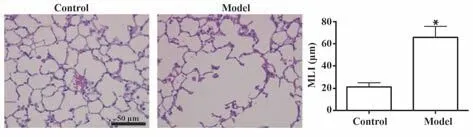
图1 对照组与模型组小鼠肺组织病理改变(HE染色)Fig.1 Pathological changes in lung tissue of mice in control group and model group (HE staining)
小动物肺功能仪检测对照组和模型组小鼠的肺功能指标FEV0.3/FVC、PEF,与对照组相比,模型组小鼠FEV0.3/FVC、PEF明显降低(P<0.05)。见表1。
表1 对照组与模型组小鼠肺功能的比较(±s)Tab.1 Comparison of lung function of mice between control group and model group (±s)

表1 对照组与模型组小鼠肺功能的比较(±s)Tab.1 Comparison of lung function of mice between control group and model group (±s)
Note:Compared with control group,1)P<0.05.
ELISA法检测血清及BALF中IL-1β、IL-6含量以进一步确认COPD造模成功,与对照组相比,模型组小鼠血清及BALF中IL-1β、IL-6含量明显增多(P<0.05)。见表2。
表2 对照组与模型组小鼠血清及BALF中IL-1β、IL-6含量的比较(±s,n=8)Tab.2 Comparison of IL-1β and IL-6 contents in serum and BALF of mice between control group and model group (±s,n=8)

表2 对照组与模型组小鼠血清及BALF中IL-1β、IL-6含量的比较(±s,n=8)Tab.2 Comparison of IL-1β and IL-6 contents in serum and BALF of mice between control group and model group (±s,n=8)
Note:Compared with control group,1)P<0.05.
2.2 吸烟COPD模型小鼠膈肌组织中ERS通路的变化及ERS激动剂、拮抗剂的干预效果 PERK、IRE1α、ATF6是ERS下游三种信号分子,Western blot结果表明:与对照组相比,模型组小鼠膈肌中PERK表达水平明显升高(P<0.05),IRE1α、ATF6表达水平无明显变化(P>0.05);与模型组相比,激动剂组小鼠膈肌中PERK、IRE1α、ATF6表达水平明显升 高(P<0.05),拮 抗 剂 组 小 鼠 膈 肌 中PERK、IRE1α、ATF6表达水平明显降低(P<0.05)。见图2。
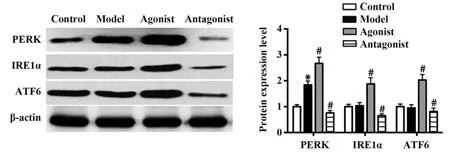
图2 4组小鼠膈肌组织中PERK、IRE1α、ATF6表达水平比较Fig.2 Comparison of expression levels of PERK, IRE1α and ATF6 in diaphragm tissues of mice among four groups
2.3 吸烟COPD模型小鼠膈肌组织中细胞凋亡率的变化及ERS激动剂、拮抗剂的干预效果 ERS的PERK通路具有促细胞凋亡作用,在证实模型组小鼠膈肌中PERK表达增加后,TUNEL检测结果表明:与对照组相比,模型组小鼠膈肌中细胞凋亡率明显升高(P<0.05);与模型组相比,激动剂组小鼠膈肌中细胞凋亡率明显升高,拮抗剂组小鼠膈肌中细胞凋亡率明显降低(P<0.05)。见图3。

图3 4组小鼠膈肌组织中细胞凋亡率比较Fig.3 Comparison of apoptosis rates in diaphragm tissue of mice among four groups
2.4 吸烟COPD模型小鼠膈肌组织中PERK下游基因表达的变化及ERS激动剂、拮抗剂的干预效果 PERK通路对细胞凋亡的促进作用依赖于下游eIF2α的磷酸化及ATF4、CHOP、Caspase-12表达的增加,Western blot结果表明:与对照组相比,模型组小鼠膈肌中p-eIF2α、ATF4、CHOP、Caspase-12表达水平明显升高(P<0.05);与模型组相比,激动剂组小鼠膈肌中p-eIF2α、ATF4、CHOP、Caspase-12表达水平明显升高,拮抗剂组小鼠膈肌中p-eIF2α、ATF4、CHOP、Caspase-12表达水平明显降低(P<0.05)。见图4。
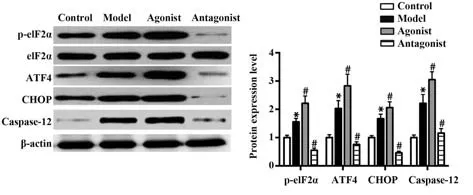
图4 4组小鼠膈肌组织中p-eIF2α、ATF4、CHOP、Caspase-12表达水平比较Fig.4 Comparison of expression levels of p-eIF2α, ATF4, CHOP and Caspase-12 in diaphragm tissues of mice among four groups
2.6Perk基因敲除对吸烟COPD模型小鼠膈肌组织中PERK及下游基因表达的影响 敲除Perk后,Western blot结果表明:PERK-KO组和PERK-KO+模型组膈肌组织中均不表达PERK,见图5;与对照组相比,PERK-KO组小鼠膈肌组织中p-eIF2α、ATF4、CHOP、Caspase-12表达水平明显降低(P<0.05);与模型组相比,PERK-KO+模型组小鼠膈肌组织中peIF2α、ATF4、CHOP、Caspase-12表达水平明显降低(P<0.05),见图6。
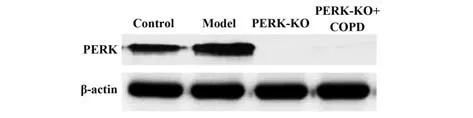
图5 4组小鼠膈肌组织中PERK表达水平比较Fig.5 Comparison of PERK expression levels in diaphragm tissues of mice among four groups
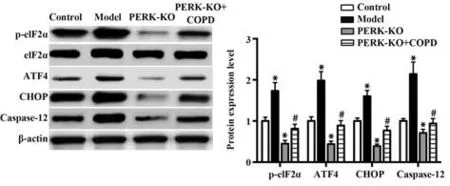
图6 Perk敲除后4组小鼠膈肌组织中p-eIF2α、ATF4、CHOP、Caspase-12表达水平比较Fig.6 Comparison of expression levels of p-eIF2α, ATF4, CHOP and Caspase-12 in the diaphragm tissues of mice among four groups after Perk knockout
2.7Perk基因敲除对吸烟COPD模型小鼠膈肌组织中细胞凋亡率的影响 TUENL检测结果表明:敲除Perk后,与对照组相比,PERK-KO组小鼠膈肌组织中细胞凋亡率无明显变化(P>0.05);Perk敲除小鼠采用被动吸烟法制作COPD模型,与野生型小鼠制作COPD模型的模型组相比,PERK-KO+模型组小鼠膈肌组织中细胞凋亡率明显降低(P<0.05),见图7。
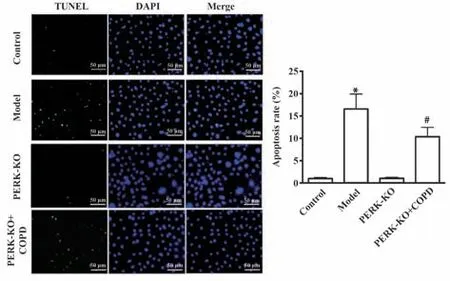
图7 Perk敲除后4组小鼠膈肌组织中细胞凋亡率的比较Fig.7 Comparison of apoptosis rates in diaphragm tissue of mice among four groups after Perk knockout
3 讨论
COPD患者长期处于气流受限、膈肌负荷加重状态,会造成膈肌做功增加,加以缺氧、营养不良等因素影响,会导致膈肌功能障碍。多项COPD相关临床研究表明,COPD患者存在膈肌移动度及收缩速度降低等膈肌功能障碍表现,且膈肌功能障碍程度与肺功能减退、病情急性加重有关[7-8]。因此,阐明COPD膈肌功能障碍的发病机制具有积极的临床意义。
膈肌细胞凋亡是近些年发现的与COPD发病过程中膈肌功能障碍密切相关的生物学环节,多项动物实验证实吸烟COPD模型大鼠及小鼠膈肌组织中的细胞凋亡率均明显增加[9-10]。本研究采用香烟烟雾吸入方式进行COPD造模,造模后模型组小鼠肺组织出现典型的COPD病理改变且肺功能明显减弱,表明COPD造模成功;而后通过TUNEL染色检测膈肌组织细胞凋亡,结果显示模型组小鼠膈肌组织细胞凋亡率明显升高,与既往文献中COPD模型大鼠及小鼠膈肌组织中细胞凋亡率增加的报道吻合,表明膈肌组织细胞凋亡与COPD的发病密切相关[9-10]。在此基础上,本研究深入探究了COPD发病过程中膈肌细胞凋亡的相关分子机制。
内质网是负责蛋白质合成、加工、转运的细胞器,在吸烟、感染、缺氧等病理因素刺激下会发生ERS,表现为内质网中未折叠及错误折叠蛋白聚集,进而通过下游PERK、IRE1α、ATF6三种膜蛋白进行信号转导引起未折叠蛋白反应、促进细胞凋亡[11-13]。有研究报道,在吸烟COPD模型大鼠肺组织中,ERS的PERK通路过度激活且与肺泡上皮细胞过度凋亡有关[14];另有COPD相关的临床研究证实,COPD患者膈肌组织中ERS相关的PERK、IRE1α、ATF6均表达增加,但差异无统计学意义[4]。本研究在COPD模型小鼠膈肌组织中检测到PERK表达明显增加,IRE1α、ATF6表达无明显变化,提示COPD小鼠膈肌组织中ERS的PERK通路过度激活,这可能是造成膈肌组织中细胞过度凋亡的分子机制。
在介导细胞凋亡的过程中,PERK通过引起下游eIF2α磷酸化途径增加ATF4表达,ATF4进一步诱导CHOP表达并使Caspase-12发生活化,最终Caspase-12引起Caspase的级联激活反应并导致细胞凋亡[15-17]。本研究在发现COPD小鼠膈肌组织中细胞凋亡率及PERK表达增加后,进一步对PERK下游凋亡相关基因的表达水平进行检测,结果显示COPD模型小鼠膈肌组织中p-eIF2α、CHOP、Caspase-12表达水平均明显增加,与细胞凋亡率及PERK表达增加的结果吻合,表明吸烟COPD模型小鼠膈肌组织中ERS的PERK通路过度激活可能是造成膈肌细胞凋亡的分子机制。
为进一步验证ERS在COPD小鼠膈肌细胞凋亡中的作用,本研究继续设计了ERS激动剂及拮抗剂实验、Perk基因敲除实验。在COPD造模过程中加用ERS激动剂后,膈肌组织中细胞凋亡率及p-eIF2α、CHOP、Caspase-12表达水平均进一步增加;而加用ERS拮抗剂后,膈肌组织中细胞凋亡率及p-eIF2α、CHOP、Caspase-12表达水平均明显降低。以上结果证实ERS激活与COPD小鼠膈肌细胞凋亡有关。ERS拮抗剂和激动剂同时针对ERS的三条通路发挥作用,加用拮抗剂和激动剂后PERK、IRE1α、ATF6的表达均发生了相应变化,仅通过拮抗剂和激动剂的实验无法直接证实PERK通路在膈肌细胞凋亡中的作用,因此本研究还设计了Perk基因敲除实验,在敲除Perk后进行COPD造模,结果显示:与野生型小鼠相比,Perk敲除小鼠进行COPD造模后膈肌组织中细胞凋亡率及p-eIF2α、CHOP、Caspase-12表达水平均降低,由此证实PERK通路直接参与COPD小鼠膈肌细胞凋亡的调控。
综上所述,吸烟COPD模型小鼠膈肌组织中细胞凋亡及ERS的PERK通路均过度激活,PERK通路激活通过下游p-eIF2α/CHOP/Caspase-12通路介导细胞凋亡。本研究的特殊和创新之处在于首次通过基因敲除小鼠阐明膈肌中ERS介导细胞凋亡在COPD发病中的作用,为今后阐明ERS在COPD膈肌细胞凋亡中的作用提供了实验依据,也为今后深入探究COPD发病过程中膈肌细胞凋亡的调控机制提供了新思路。

