金雀花对高血脂小鼠降脂作用
高庆鹏,侯亚婷,毕晓艳,刘福冲,刘平果,袁芝琼
大理大学公共卫生学院(大理 671000)
线叶金雀花(AspaLathus linears)的可食部分,为南非豆科植物[Aspalathus linearis(Brum.f.)R.Dahlgren]的叶子和细茎[1]。现代药理学研究证明,线叶金雀花含有丰富的茶多酚及类黄酮成分,植物衍生的多酚类物质可阻止肥胖和相关脂质代谢性疾病的发病,具有降低血脂的功能[2]。
高血脂症(hyperLipemia,HLP),是一种脂质代谢紊乱疾病[3],易引发动脉粥样硬化、糖尿病等疾病。由于金雀花的抗氧化功能好、安全性好及适用于多种慢性疾病的预防和调节而被广泛关注,但对于金雀花降低血脂的研究还存在较大空白。随着对高血脂症的深入研究,生理生化指标的异常成为医学上高血脂症的判断标准[4]。试验研究3种不同浓度梯度的金雀花对高脂血症模型小鼠TC、TG、LDL-C、HDL-C等指标的影响,旨在揭示金雀花对高血脂症小鼠及不同浓度梯度的暴露途径对血脂的调节作用,并为深入研究金雀花的降血脂功能提供药理基础资料。
1 材料与方法
1.1 试验动物
选用SPF等级的KM雄性小鼠:许可证号SYXK(滇)K2011-0004,湖南斯莱克景达实验动物有限公司,体重22~26 g。试验动物的饲养环境20±3 ℃,湿度35%~70%,空气流通,自然光照。在饲养过程中每天给予5 g/10 g小鼠普通饲料,每天更换饮水,每隔1 d更换垫料,定期消毒。
1.2 试验材料
新鲜金雀花(产地云南大理);食用猪油(产地浙江温州)。
1.3 试剂与仪器
99%胆固醇、亚硝酸钠(上海麦克林生化科技有限公司);3号胆盐、98%丙基硫氧嘧啶、丙二醇、无水乙醇、95%芦丁、没食子酸分析标准品、生理盐水(上海源叶生物科技有限公司);吐温-80(上海百舜生物科技有限公司);75%乙醇(云南昆明天亘消毒制品有限公司);无水碳酸钠、硝酸铝九水合物(上海罗恩化学技术有限公司);氢氧化钠(天津市大茂化学试剂厂);福林标准液(海标科技有限公司)。
0.22 μm无菌滤头(Biosharp);洪达医用注射器(广州平民药业连锁有限公司);RE-3000旋蒸蒸发仪(上海亚荣生化仪器厂);0412-1离心机[上海医疗器械(集团)有限公司];723N可见分光光度计(悦丰仪器仪表有限公司);JY5002电子天秤(上海衡平仪器仪表厂);SK8210HP超声波清洗器(上海科导超声仪器有限公司);SHZ-DⅢ循环水式真空泵(巩义市予华仪有限责任公司);MJ-54A高压蒸汽灭菌锅[旋都凯仪器设备(上海)有限公司];DZG-303A普力菲尔超纯水仪(上海富诗特仪器设备有限公司)。
1.4 试验方法
1.4.1 多酚标准曲线的绘制
根据文献[5],在760 nm吸收波长处,以试剂空白为参比测定吸光度,吸光度为y轴,没食子酸质量浓度(μg/mL)为x坐标,绘制标准曲线。回归方程式为y=45.893x-0.037 6,R2=0.980 3,线性关系良好。
配制多酚标准曲线测试溶液:准确称取0.005 g没食子酸标准样品,用蒸馏水溶解,定容至50 mL,得到0.1 mg/mL没食子酸标准溶液。取0.2,0.4,0.6,0.8,1.0和1.2 mL标准溶液,加入0.5 mL福林试剂,充分摇匀,等待1 min,加入1.5 mL 20% Na2CO3溶液,在75 ℃下反应10 min。
1.4.2 总黄酮标准曲线的绘制
根据文献[6],在510 nm吸收波长处,以试剂空白为参比测吸光度,以吸光度为y轴,芦丁质量浓度(mg/mL)为x坐标,绘制标准曲线。回归方程式为y=13.043x-0.014 6,R2=0.993 5,线性关系良好。
配制总黄酮标准曲线测试溶液:准确称取0.01 g芦丁,75%乙醇溶解,并定容至50 mL→0.2 mg/mL芦丁标准溶液→取标准溶液0.5,1.0,1.5,2.0,2.5,3.0,3.5和4.0 mL→加入0.5 mL 5%亚硝酸钠溶液,摇匀,放置5 min→加入0.5 mL 10%硝酸铝溶液,摇匀,放置5 min→加入5 mL 4%氢氧化钠溶液,用75%乙醇定容至10 mL,摇匀,放置10 min。
1.4.3 样品的测定
称取80 g金雀花,按照一定的比例分别用乙醇溶液和水溶液浸泡1 h,使用真空抽滤装置过滤,去渣,取300 mL上层清液,使用旋转蒸发仪提取,提取完成后,取出2 mL提取液,分别量取1 mL使用分光光度计按照标准曲线绘制方法进行测定,代入标准曲线方程(y=45.893x-0.037 6和y=13.043x-0.014 6)依次得出样液中多酚和总黄酮的浓度。试验结果均以多酚提取率和总黄酮提取率为考察指标[7],按式(1)计算。
1.4.4 正交设计方案
1.4.4.1 乙醇溶液的正交试验
在乙醇溶液提取过程中,因存在多种单因素影响提取结果,参考单因素对结果影响,列出影响较大的单因素:乙醇体积分数(A)、提取时间(B)、料液比(C)等,分别对各因素进行考察,得出最佳的提取水平,选择合适的单因素水平进行正交试验,获得提取所需成分最佳的工艺。
根据对乙醇溶液提取法的单因素试验,得出影响提取结果的单个因素水平见表1。
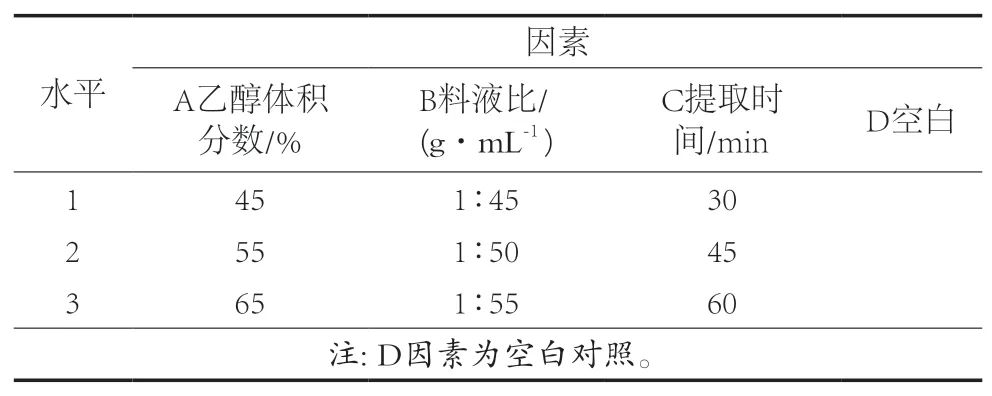
表1 正交设计试验单因素水平表
1.4.4.2 水溶液正交试验
在水溶液提取过程中,同样参考单因素对结果影响,列出影响较大的单因素:金雀花用量(A)、料液比(B)及提取时间(C),分别对各因素进行考察,得出最佳提取水平,选择合适的单因素水平进行正交试验,获得提取所需成分最佳的工艺。
根据对水溶液提取法的单因素试验,得出影响提取结果的单个因素水平见表2。

表2 正交设计试验单因素水平表
1.4.5 高血脂症模型的建立及分组
根据文献[8],高脂乳剂制作方法:25 g食品级猪油加入100 mL锥形瓶加热融化,加入15 g胆固醇,搅拌直至溶解,再次加入2 g 3号胆盐、1 g丙基硫氧嘧啶、20 mL吐温、20 mL丙二醇。搅拌至充分融合,加入蒸馏水至刻度线,待温度下降凝固,密封并在4 ℃环境中保存。每隔2 d制作1次,灌胃前水浴加温再对小鼠进行灌胃。
第一轮造模,将小鼠随机分为空白组和高血脂症组,空白组14只,高血脂症组62只。空白对照组给予一定质量的饲料,自由饮水。高脂血症组均以0.2 mL/10 g剂量进行灌胃,结束后给予相应质量的饲料,自由饮水。高脂乳剂灌胃每日1次,每隔1 d记录体重,连续灌胃5周。
造模结束后,禁食不禁水12 h,选取空白组小鼠6只,高血脂症组小鼠4只,进行生理指标的数据测定,测定其TC、TG、LDL-C、HDL-C、GLU含量,对其数据进行SPSS的单因素分析,高血脂症组所有指标高于空白组,即P<0.05时,造模成功。
试验阶段,金雀花溶液的最佳提取方法为水溶液提取,每只小鼠的安全灌胃剂量为5 mg/kg。将高血脂症组小鼠随机分为5个组:高血脂组、阳性对照组、金雀花提取物(1.165 g/mL)高浓度组、金雀花提取物(0.583 g/mL)中剂量组、金雀花提取物(0.291 g/mL)低剂量组。使用不同浓度梯度的金雀花提取液进行灌胃,每隔1 d记录体重,连续灌胃3周。

表3 试验分组
1.4.6 统计方法
数据收集采用Excel 2016软件,金雀花提取结果采用正交试验结果表进行表示,小鼠各组指标均以±s表示。分别使用SPSS 25.0软件进行正交试验设计、单因素方差分析、单因素检验,检验水平α=0.05。
2 结果与分析
2.1 正交试验提取结果
根据乙醇溶液提取正交设计方案,结果见表4和表5。
分析表4可得,可影响金雀花中总黄酮的提取率的因素主次顺序为乙醇体积分数(A)>料液比(B)>提取时间(C),金雀花中总黄酮旋转蒸发仪提取最佳工艺条件为A3B1C3,即乙醇体积分数65%、料液比1∶45(g/mL)、提取时间60 min,在此条件下提取金雀花中的总黄酮提取率最高,为1.48%。
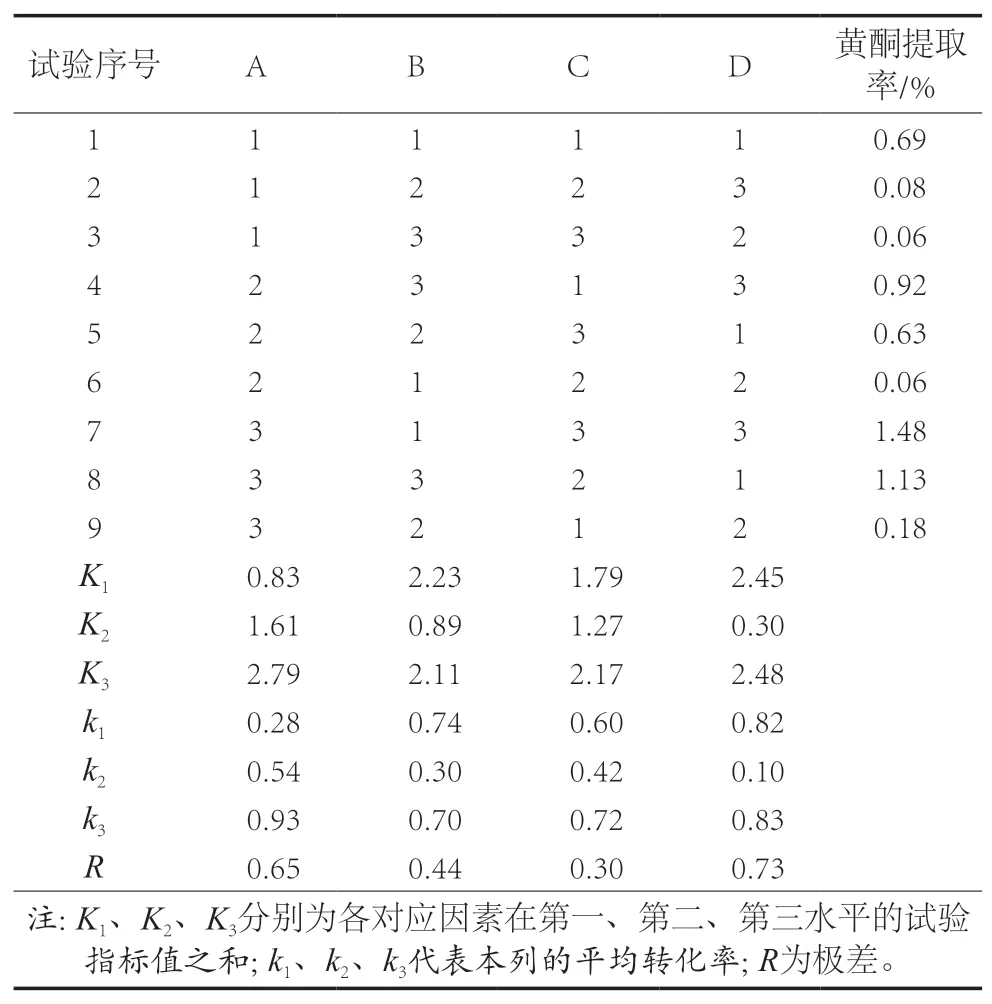
表4 正交试验乙醇溶液黄酮提取结果
分析表5可得,影响金雀花中多酚的提取率的因素主次顺序为乙醇体积分数(A)>提取时间(C)=料液比(B),金雀花中旋转蒸发仪提取多酚的最佳工艺条件为A3B3C3,即乙醇体积分数65%、料液比1∶55(g/mL)、提取时间60 min,在此条件下提取金雀花中的多酚提取率最高,为0.20%。

表5 正交试验多酚提取结果
根据水溶液提取结果可得,金雀花提取液中多酚和总黄酮的提取率与金雀花用量、提取时间呈正比,与料液比呈反比。由此,金雀花中旋转蒸发仪提取最佳工艺条件为金雀花用量100 g、料液比1∶10(g/mL)、提取时间60 min,在此条件下金雀花中的多酚提取率为1.221%,总黄酮提取率为6.996%。
2.2 一般情况
高血脂症模型建模5周后,选取部分小鼠进行生理指标检测,对检测的数据进行单因素方差分析,分析后,高血脂症造模小鼠的血清总胆固醇F=7.239,甘油三酯F=4.425,高密度脂蛋白F=1.524,低密度脂蛋白F=8.289。空白组与之相比差异均具有统计学意义(P<0.05),即高血脂症模型建造成功(见表6),小鼠体重变化结果见表7。
表6 部分小鼠的TC、TG、LDL-C水平(±s)单位:mmol/L
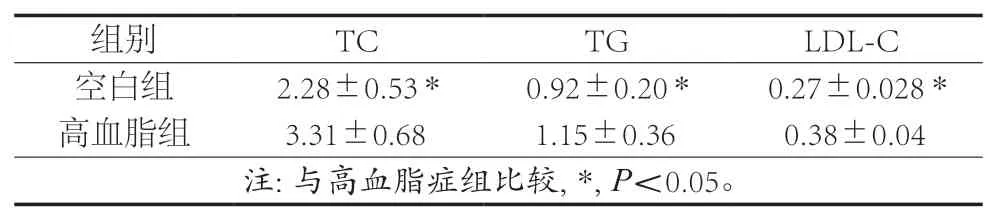
表6 部分小鼠的TC、TG、LDL-C水平(±s)单位:mmol/L
?
表7 部分小鼠体重(±s)

表7 部分小鼠体重(±s)
?
金雀花提取溶液灌胃3周降脂后,空白组、阳性对照组、金雀花组体重与高血脂组体重差异具有统计学意义(P<0.01)。空白组与阳性对照组、金雀花各浓度组体重变化无差异,不具有统计学意义(P>0.05)。小鼠体重变化结果见表8。
表8 灌胃后小鼠的体重变化(±s)

表8 灌胃后小鼠的体重变化(±s)
?
2.3 TC、TG、LDL-C
由表9可知,金雀花各组、阳性对照组经方差分析,血清总胆固醇均下降,与高血脂对照组相比,其F值分别为24.02,61.26,20.70和8.23,差异均有统计学意义(P<0.01)。0.583 g/mL金雀花组的总胆固醇水平下降率更高,TC降低水平与其余各金雀花组之间不存在明显差异,即P>0.05。
表9 各组小鼠的TC、TG、LDL-C水平(±s)单位:mmol/L

表9 各组小鼠的TC、TG、LDL-C水平(±s)单位:mmol/L
?
金雀花各组、阳性对照组经方差分析,甘油三酯和LDL-C均下降,与高血脂对照组相比,甘油三酯的F值分别为108.28,110.68,30.12和25.89;LDL-C的F值为168.537,187.711,140.02和99.28。差异均有统计学意义(P<0.01),其中0.583 g/mL金雀花组甘油三酯水平、LDL-C水平下降率更高,更接近于阳性对照组,与其余2组金雀花组之间不存在明显差异,即P>0.05。
2.4 高密度脂蛋白(HDL-C)
由表10可知,阳性对照组、金雀花各浓度组其HDL-C与高血脂症对比HDL-C均升高,其F值分别为0.063,1.144 5,0.796,1.017和0.377,差异均有统计学意义(P<0.05)。阳性对照组升高HDL-C效果明显更优,但0.583 g/mL金雀花组效果接近于阳性对照组,说明抗动脉粥样硬化、预防冠心病的能力与其余各组相比更强。
表10 各组小鼠的HDL-C水平(±s) 单位:mmol/L

表10 各组小鼠的HDL-C水平(±s) 单位:mmol/L
?
2.5 葡萄糖(GLU)
由表11可见,因高脂血症极易引发其他并发症,如糖尿病[9],根据降脂后,金雀花各组与高脂血症组相比,F值为4.602,0.649和1.444,差异均无统计学意义,即(P>0.05)。但阳性对照组与高脂血症组经方差分析,F=3.116,P<0.05,即差异具有统计学意义。提示金雀花各组虽然可使高血脂症小鼠的葡萄糖水平下降,但是降低效果不如阳性对照组显著。
表11 各组小鼠的GLU水平(±s) 单位:mmol/L

表11 各组小鼠的GLU水平(±s) 单位:mmol/L
?
2.6 小鼠肝脏系数
表12 各组小鼠的肝脏系数(±s) 单位:%
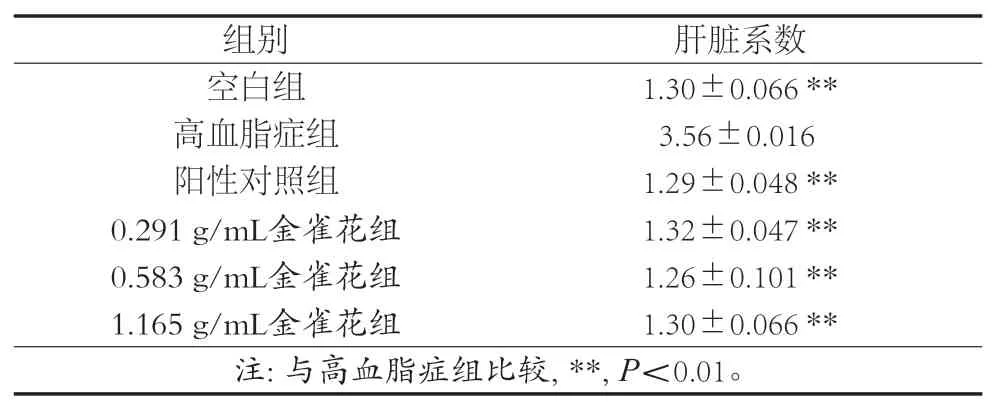
表12 各组小鼠的肝脏系数(±s) 单位:%
?
脏器指数可反映脏器的健康状况,小鼠长期接触高脂乳剂,可导致肝脏脂质积累及病变,这一变化可以通过肝脏系数来反映[10]。从肝脏系数的分析来看,金雀花各组、阳性对照组与高血脂症组对比,肝脏系数显著降低,差异具有统计学意义(P<0.01)。
3 讨论与结论
试验表明,金雀花水提物组与高血脂模型组相比,金雀花组显著地降低高血脂小鼠血清中的TC、TG、LDL-C含量,金雀花水提物酚酸类、黄酮类2种成分有效地影响脂肪的生成和代谢,对于降低血脂具有重要意义。
通过高脂乳剂诱导,高血脂组小鼠的体重、肝脏系数、葡萄糖与空白组相比显著上升。在灌胃金雀花水提物后,小鼠的体重与肝脏系数显著下降。由此可知,金雀花的作用机理可能在一定程度上逆转了诱导的肝脏损伤,但是葡萄糖的水平虽有显著下降,但仍未达到正常水平,其原因可能与灌胃试剂的配方、金雀花提取物的浓度有关,具体原因还有待进一步研究。
试验进行线叶金雀花的提取,通过正交试验优化乙醇溶液和水溶液提取方案,通过水溶液提取得到最佳提取方案,中浓度组提取物与其余浓度组相比,降低血清中的TC、TG、HDL-C和肝脏系数更为显著,更接近阳性对照组与空白组,结果表明,中浓度组调节血脂的作用较为突出。
金雀花作为食品、药物在调节血脂和心血管疾病方面有着可观的前景,作为降脂药物具有一定的安全性和优越性,在我国的医疗保健领域有着探索意义,后续将对金雀花降血脂的作用机理进行进一步研究。

