基于响应面法的花豇豆酯酶提取工艺
马月琼,陈守慧,魏新林
上海交通大学农业与生物学院,上海食品安全工程技术研究中心(上海 200240)
联合国预测,到2050年全球人口可达到92亿。随着人口密度的增加,食物的需求也在不断地增加。因此,对于提高作物及农产品的产量,需要引起全世界的重点关注,粮食产量增加的前提是农业的大力发展。农药是保护农作物产量和质量最重要的工具。在世界范围内,我国是最大的农药产地,其使用量位居首位,每年产量可达50多万 t,农药的种类约1 100种[1],全球每年使用的化学农药约300万 t[2]。有研究表明,在全球范围内的农作物种植过程中,若不使用农药,全球农作物总产量损失的10%~40%是由病虫害造成的[3]。农药是一把双刃剑:一方面,农药的使用具有防治病虫害、使农作物稳产和高产、增加农民收入的好处;另一方面,在农业生产中,农药残留是使用农药后必不可少的一种现象,亦是不能忽视的重要问题。农药是有毒、易残留的化学物质,大部分具有稳定性较高、半衰期长[4]的特点。国家及相关部门虽然对农药进行管控,但事实上执行力度尚且不够,对于农药的过分依赖或者不合理使用导致农产品中农药残留问题极其严重,自然环境也会受到严重污染,与此同时对人体健康和生态环境均带来极大的危害[5]。据报道,在每年各省市场监督管理局发布的食品抽检报告中,其不合格食品涉及的问题主要包括农兽药残留超标、食品添加剂超标、微生物污染和重金属超标。其他国家也会因我国食品的农药残留超标问题选择拒绝进口并召回含农残的食品。
酶抑制法根据酶源的不同可分为动物酯酶抑制法和植物酯酶抑制法。动物酯酶一般来源于动物的脑组织和血液中[6-7]。而植物酯酶广泛存在于各种作物中,包括小麦、玉米和不同豆类作物等。与动物酯酶相比,植物酯酶具有来源丰富、取材方便、提取步骤简单快捷、成本低、易于保存等优势,因此自20世纪80年代以来,研究者开始逐渐地用植物酯酶代替动物酯酶。试验以总酯酶活力和比活力为考核指标,对面粉、麦麸和13种植物种子中提取的植物酯酶进行筛选,选取适宜的植物酶源,并采用单因素试验和响应面试验结合的方法对植物酯酶的提取条件进行优化,为植物酯酶的有效提取和深入研究花豇豆酯酶用于农药残留的检测提供参考,为寻求新的植物酯酶源提供依据。
1 材料与方法
1.1 材料与试剂
小麦面粉、小麦(普洱市思茅区魏晓兰百货店);玉米、红芸豆、花豇豆、麦麸、黑小麦、小麦仁、生白芝麻、荞麦、蚕豆、绿豆、青豌豆、大黑豆、扁豆(河南省虞城县兴艺商贸有限公司);α-乙酸萘酯、α-萘酚、固蓝B盐、十二烷基磺酸钠(SDS)、丙酮(分析纯,国药集团化学试剂有限公司);牛血清蛋白(分析纯,上海泰坦科技股份有限公司)。
1.2 仪器与设备
TU-1810紫外可见分光光度计(北京普析通用仪器有限责任公司);Dynamica高速冷冻离心机(上海驭锘实业有限公司);HWS-26电热恒温水浴锅(上海一恒科学仪器有限公司);524G恒温磁力搅拌器(上海梅颖浦仪器仪表制造有限公司);FW100高速万能粉碎机(天津市泰斯特仪器有限公司);电热鼓风干燥箱(上海一恒科学仪器有限公司);ST5000实验室pH计(常州奥豪斯仪器有限公司);BSA3202S电子天平(北京赛多利斯科学仪器有限公司)。
1.3 方法
1.3.1 植物酯酶粗酶液的制备
将植物种子清洗干净,晒干后粉碎3次后备用。准确称取一定量的样品加入到250 mL锥形瓶中,按1∶5(g/mL)的料液比加入0.1 mol/L pH 6.4的磷酸盐缓冲液,混合均匀后,在恒温磁力搅拌器上充分振荡1 h,经4层纱布过滤,将滤液倒入离心管,放于冷冻离心机中,在4 ℃条件下以8 000 r/min的速率离心10 min,收集上清液即为植物酯酶粗酶液,置于-4 ℃下保存备用。
1.3.2 试验方法
1.3.2.1α-萘酚标准曲线的制作[8]
配制浓度1 mmol/L的α-萘酚无水乙醇标准溶液,取8支试管,用移液枪分别准确吸取0,10,20,30,40,50,60和70 μL的α-萘酚无水乙醇标准溶液于试管中,依次加入0.1 mol/L pH 6.4的磷酸盐缓冲液至3 mL,混合均匀,分别加入0.5 mL固蓝B盐溶液,再次充分混合后放于30 ℃恒温水浴锅中保温10 min,取200 μL于96孔板中,在595 nm处测定吸光度(A595),以不加α-萘酚的溶液作空白,每组试验重复3次。以α-萘酚标准溶液浓度为横坐标(X),吸光度为纵坐标(Y),作图可得最佳标准曲线,建立回归方程,该标准曲线的斜率按式(1)计算。
式中:K为α-萘酚标准曲线的斜率;Ai为反应液在595 nm处的吸光度(A);Ci为α-萘酚溶液浓度;n为α-萘酚标准曲线的浓度点数。
1.3.2.2 总酯酶活力的测定[9]
取10 mL试管,依次加入1.950 mL浓度0.04 mol/L、pH 6.4磷酸盐缓冲溶液、50 μL浓度16 mmol/L的α-乙酸萘酯丙酮溶液和0.5 mL稀释一定倍数后的酶液,充分振荡使试管内的溶液混合均匀,将试管放入30 ℃恒温水浴锅中,开始计时,反应15 min后取出试管,加入0.5 mL固蓝B 盐溶液于试管中,振荡混匀后放入30 ℃恒温水浴锅中,开始计时,10 min后取出试管,用移液枪吸取200 μL于96孔板中,采用紫外可见分光光度计,在波长595 nm处测其溶液的吸光度,每组试验重复3次。用磷酸盐缓冲溶液作对照,根据式(2)计算总酯酶活力。
式中:E为每毫升酶液的总酯酶活力,U/mL;D为酶液的稀释倍数;K为α-萘酚标准曲线的斜率;A595为波长在595 nm处的吸光度;V0为体系的终体积,mL;T表示反应时间,min;V1为所用酶液的体积,mL;U为酶活力单位,1 U表示在一定条件下,每分钟分解得到1 μmolα-萘酚所需要的酶量。
1.3.2.3 蛋白含量的测定
标准曲线的制作:选用牛血清蛋白作为标准蛋白,绘制标准曲线,参照Bradford[10]的考马斯亮蓝G-250法测定蛋白质含量。使用牛血清蛋白配制质量浓度100 μg/mL的蛋白标准溶液,0,20,40,60和80 μg/mL的蛋白标准溶液可用100 μg/mL的蛋白标准溶液直接稀释即可,取6支试管,每支试管加入0.1 mL BSA溶液和1 mL考马斯亮蓝G-250后,充分振荡,在常温条件下反应3~5 min后,取200 μL于96孔板中,在595 nm处测定吸光度A595,每组试验重复3次。以蒸馏水作空白。以BSA质量浓度(mg/mL)为横坐标(X),吸光度A595为纵坐标(Y),作图可得最佳标准曲线,建立回归方程。
1.3.2.4 比活力的测定
比活力的测定参照文献[11],比活力(U/mg)按式(3)计算。
1.3.3 单因素试验设计
1.3.3.1 料液比对酶活力的影响
将植物种子粉碎后准确称取10 g于250 mL锥形瓶中,以0.1 mol/L pH 6.4的磷酸盐缓冲液作为提取液,分别以1∶4,1∶5,1∶6,1∶7和1∶8(g/mL)的料液比向锥形瓶中加入磷酸盐缓冲液对花豇豆酯酶进行提取,混合均匀后,在恒温磁力搅拌器上充分搅拌1 h,经4层纱布过滤,将滤液倒入离心管,放于冷冻离心机中,在4 ℃条件下以8 000 r/min的速率离心10 min,收集粗酶液,按照1.3.2.2的方法对总酯酶活力进行测定。
1.3.3.2 提取液pH对酶活力的影响
配制浓度为0.1 mol/L的磷酸盐缓冲液,pH分别为6.0,6.5,7.0,7.5,8.0,8.5和9.0。将植物种子粉碎后准确称取10 g于250 mL锥形瓶中,按料液比1∶5(g/mL)向锥形瓶中分别加入以上不同pH的磷酸盐缓冲液对花豇豆酯酶进行提取,混合均匀后,在恒温磁力搅拌器上充分搅拌1 h,再经4层纱布过滤,将滤液倒入离心管,然后放于冷冻离心机中,在4 ℃条件下以8 000 r/min的速度离心10 min,收集粗酶液,按照1.3.2.2的方法对总酯酶活力进行测定。
1.3.3.3 浸提时间对酶活力的影响
将植物种子粉碎后准确称取10 g于250 mL锥形瓶中,按料液比1∶5(g/mL)加入0.1 mol/L pH 6.4的磷酸盐缓冲液,混合均匀后,在恒温磁力搅拌器上分别搅拌0.5,1.0,2.0,4.0,6.0,8.0,12.0和18 h后,经4层纱布过滤,将滤液倒入离心管,放于冷冻离心机中,在4 ℃条件下以8 000 r/min的速度离心10 min,收集粗酶液,按照1.3.2.2的方法对总酯酶活力进行测定。
1.3.3.4 离心速率对酶活力的影响
将植物种子粉碎后准确称取10 g于250 mL锥形瓶中,按料液比1∶5(g/mL)加入0.1 mol/L pH 6.4的磷酸盐缓冲液,混合均匀后,在恒温磁力搅拌器上充分搅拌1 h,经4层纱布过滤,将滤液倒入离心管,放于冷冻离心机中,在4 ℃条件下,离心速率设置为2 000,4 000,6 000,8 000,10 000和12 000 r/min,离心10 min后,收集粗酶液,按照1.3.2.2的方法对总酯酶活力进行测定。
1.3.4 Box-Behnken试验设计
在单因素试验的基础上,确定各因素的最佳水平范围,采用响应面中心组合试验设计,研究各参数对酯酶总活力的影响规律,并得到最佳提取条件。以料液比(A)、提取液pH(B)、浸提时间(C)和离心速率(D)为自变量,酶活力作为响应值,其因素水平编码见表1。

表1 响应面试验因子水平及编码
1.3.5 数据处理
采用SPSS 22.0数据分析软件对数据进行显著性分析。使用Origin 8.5软件对数据进行统计分析并绘制图表,采用Design-Expert 11进行响应面分析。
2 结果与分析
2.1 α-萘酚及蛋白质含量的标准曲线
α-乙酸萘酯经植物酯酶催化水解产生α-萘酚和乙酸,α-萘酚和显色剂固蓝B盐发生反应,生成紫红色的偶氮化合物和盐酸。如图1所示,以α-萘酚标准溶液浓度为横坐标(X),吸光度为纵坐标(Y),绘制得到的α-萘酚标准曲线图,斜率为K,结合α-萘酚含量的标准曲线和总酯酶活力的计算公式就可以计算出相应植物酯酶的总活力。α-萘酚标准曲线的相关系数为0.996 63,线性关系表现良好。

图1 α-萘酚的标准曲线
根据植物酯酶的比活力计算公式,需测定总蛋白含量。试验采用考马斯亮蓝G-250法测定蛋白质含量,牛血清蛋白作为标准蛋白,绘制得到的标准曲线如图2所示,相关系数为0.997 55,具有良好的线性关系,符合试验使用。

图2 蛋白质的标准曲线
2.2 不同植物酶源总酯酶活力和比活力的比较
试验选取的酶源材料有面粉、麦麸及13种植物种子,测定并比较其总酯酶活力和比活力,结果如图3所示。通过方差分析,结果显示植物酯酶广泛存在于面粉、麦麸和其他13种植物种子中。由此可以看出花豇豆酯酶的总酯酶活力和比活力极显著高于其他14种植物酯酶,花豇豆的总酯酶活力是面粉的21.718倍、蚕豆的30.644倍。其比活力是面粉的5.587倍、蚕豆的27.379倍。其中,玉米的总酯酶活力最小,蚕豆酯酶的比活力最小。综合考虑,试验选择花豇豆作为最佳植物酯酶酶源。

图3 不同植物酶源
2.3 单因素试验结果与分析
2.3.1 料液比对酶活力的影响
比较不同料液比对于花豇豆酯酶提取效果的影响,由图4可知,随着料液比从1∶4(g/mL)到1∶8(g/mL)的变化,即提取液用量不断增加,相当于对花豇豆酯酶的稀释倍数不断增大,总酯酶活力呈现先增大后持续降低再上升的变化趋势,料液比1∶5(g/mL)时,总酯酶活力达到最大值,提取效果最佳。由此可以判断,料液比太低时,花豇豆酯酶不能充分地溶解于提取液中,从而导致提取不完全,总酯酶活力会偏低,继续增加提取液用量,花豇豆酯酶的总酶活力会随之增大,料液比超过1∶5(g/mL)时,提取液用量过多会导致酯酶量减少,并且料液比过大会产生试剂和能源的浪费。因此,综合考虑,最佳料液比为1∶5(g/mL)。

图4 料液比对花豇豆酯酶总活力的影响
2.3.2 提取液pH对酶活力的影响
对比pH 6.0~9.0的范围内对花豇豆酯酶提取的效果。不同提取液pH对总活力的影响如图5所示。随着提取液pH增大,花豇豆酯酶的总活力先呈现升高的趋势。pH 8.0时,总活力达到最大值。继续提高pH,总酯酶活力呈现下降趋势。在酸性或强碱性条件下,酶的构象和稳定性均会受到较大影响,易造成酶蛋白的变形或聚集等,从而使得酶的活性减弱。因此,提取液最佳pH为8.0。

图5 提取液pH对花豇豆酯酶总活力的影响
2.3.3 浸提时间对酶活力的影响
在0.5~18 h的浸提时间范围内进行花豇豆酯酶提取效果的比较。不同浸提时间对总活力的影响如图6所示。提取时间小于2 h时,随着浸提时间延长,花豇豆的总酯酶活力也在不断增大。超过2 h后,花豇豆的总酯酶活力先下降到达最低值后又开始上升。但浸提时间过长,再加后续酯酶的分离纯化导致时间成本太高,因此,综合考虑,选择合适的浸提时间使得酯酶充分溶出即可,故选取2 h作为花豇豆酯酶的最佳浸提时间。
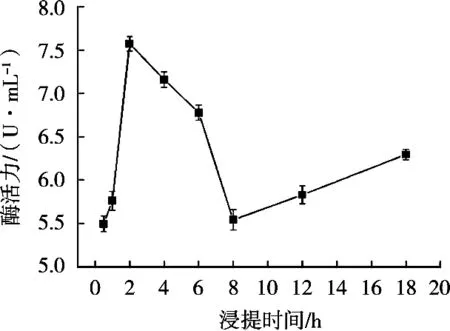
图6 浸提时间对花豇豆酯酶总活力的影响
2.3.4 离心速率对酶活力的影响
在2 000~12 000 r/min的离心速率范围内进行花豇豆酯酶提取效果的比较。不同离心速率对总活力的影响如图7所示。离心速率在6 000~10 000 r/min的范围内,花豇豆酯酶的总酯酶活力具有极显著的变化。转速小于8 000 r/min时,提高转速,酯酶总活力相应地提高。转速大于8 000 r/min时,提高转速,酯酶总活力又出现下降趋势。因此,选取8 000 r/min作为花豇豆酯酶的最佳离心速率。

图7 离心速率对花豇豆酯酶总活力的影响
2.4 响应面试验结果与分析
2.4.1 模型建立与数据分析
基于单因素试验的分析结果,根据Box-Benhnken中心组合设计四因素三水平的响应面分析试验,试验方案根据表1的因子与水平设计,利用Design-Expert 11软件将试验结果进行二次多项式回归拟合,试验结果见表2。
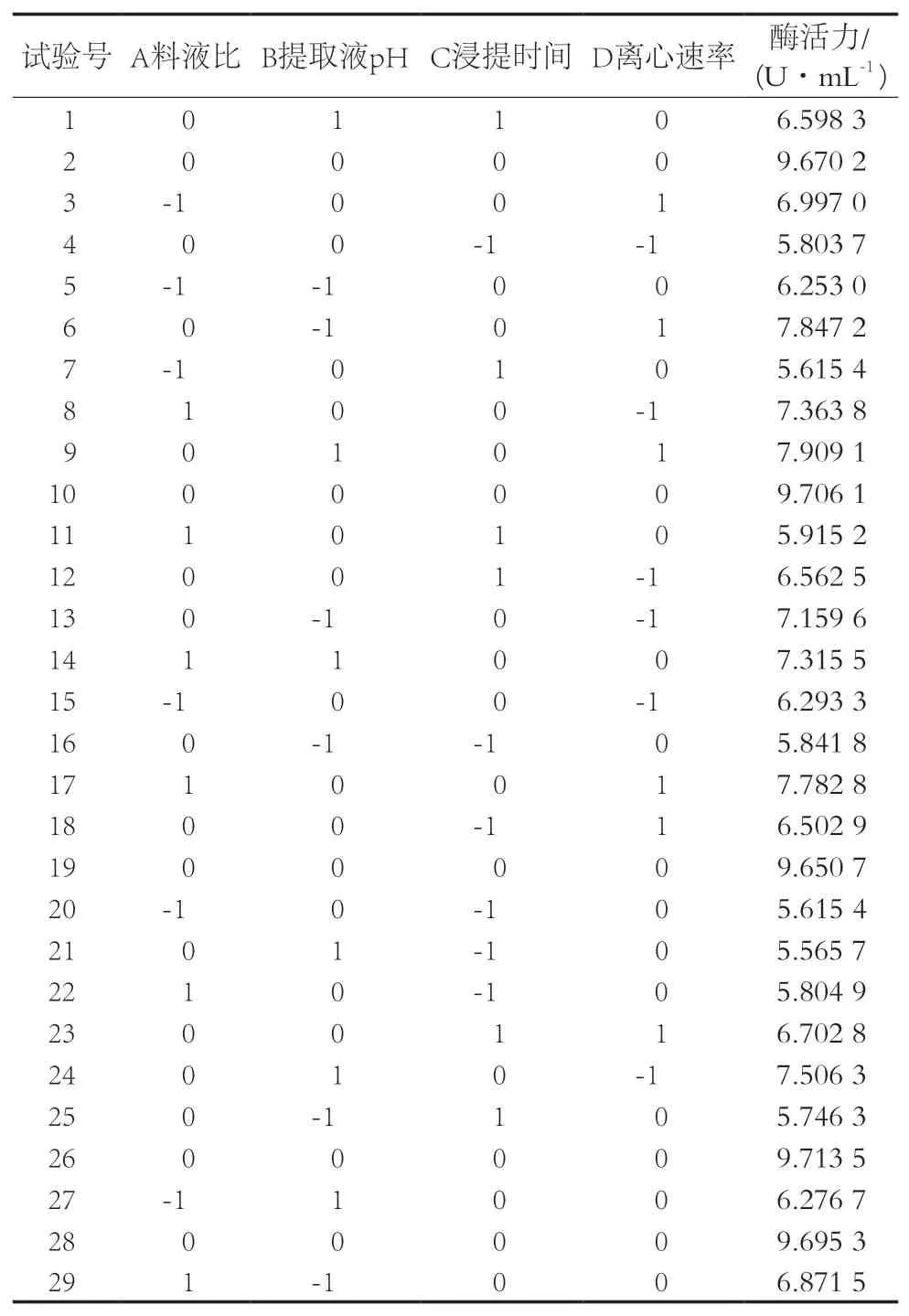
表2 响应面优化试验设计及结果
得到花豇豆酯酶总活力对料液比(A)、提取液pH(B)、浸提时间(C)和离心速率(D)的二次多项式回归方程:酶活力=-10.09+0.369 7A+0.180 9B+0.254 1C+0.222 4D+0.105 1AB-0.228 7AC-0.071 2AD+0.269 7BC-0.071 2BD-0.143 9CD-1.74A2-1.27B2-2.88C2-0.823 4D2。回归模型方差分析见表3。
应用方差分析对模型的显著性进行评价,响应值酶活力的方差分析结果如表3所示。在模型的建立过程中,若出现影响不显著的项会直接删除,P值反映模型中每一项的显著性,P<0.01说明影响极显著,P<0.05说明影响显著,P>0.05说明影响不显著。该模型中的A、B、C、D、AC、BC、CD均为极显著,说明试验因素对酶活力不是简单的线性关系,方程回归显著。
模型F=2 086.27,P<0.000 1,表明建立的模型具有极高的有效性。方程失拟项(Lack of fit)F=3.64,P=0.112 2>0.05,不显著,说明该模型没有失拟现象,模型合适。由表3可知,花豇豆酯酶提取效果的显著性大小顺序为A>C>D>B,即料液比>浸提时间>离心速率>提取液pH。该模型的R2=0.999 5,Radj2=0.999 0,两者非常接近,预测值和试验值高度相关,说明该模型能够解释99.90%的响应值变化,模型拟合的效果较好。

表3 试验结果的方差分析及显著性检查

接表3
2.4.2 响应面分析
等高线的形状可以直观地反映出两因素交互作用对花豇豆酯酶活力影响的大小,圆形表明交互作用不显著,椭圆形表明交互作用显著。根据对所模型的分析结果可知,主要影响花豇豆酯酶酶活的因素是料液比(A)和浸提时间(C)。图8显示料液比和浸提时间对花豇豆酯酶酶活交互作用的结果,可以直观看出两者交互作用显著。
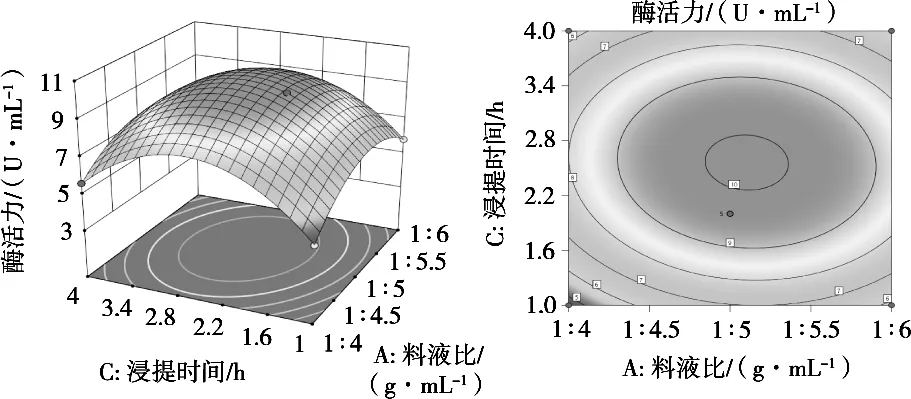
图8 料液比和浸提时间交互作用的响应面及等高线图
2.4.3 验证试验
根据Box-Behnken中心组合试验所得的结果和多项式回归方程,可以得到花豇豆酯酶的最佳提取工艺条件:料液比1∶5.326(g/mL)、提取液pH 8.138、浸提时间2.434 h、离心速率7 648.768 r/min。该条件下酶活力的预测值为9.515 U/mL。结合实际操作的可行性,将提取工艺条件调整为料液比1∶5(g/mL)、提取液pH 8、浸提时间2 h、离心速率8 000 r/min。在此条件下进行3次验证性试验,酶活力的实际值为9.081 U/mL,非常接近预测值,说明该模型可靠性较高,可以较好地预测花豇豆酯酶的实际酶活。
3 结论
根据对玉米、麦麸、生白芝麻、黑小麦、蚕豆、荞麦、面粉、小麦、小麦仁、大黑豆、青豌豆、扁豆、红芸豆、绿豆和花豇豆中提取的植物酯酶的总酶活力和比活力的比较,得出花豇豆为最佳植物酶源。以单因素试验的结果为基础,用响应面法对花豇豆酯酶的提取条件进行优化,建立料液比、提取液pH、浸提时间和离心速率对酶活力二次回归方程模型。经验证,模型的可靠性较高,可较好地预测花豇豆酯酶的实际酶活。结合单因素试验、响应面试验和验证试验,确定植物酯酶最佳提取条件:料液比1∶5(g/mL)、提取液pH 8、浸提时间2 h、离心速率8 000 r/min。在此最佳提取条件下酶活力为9.081 U/mL,与预测值较为接近。

