烟草烟雾暴露的人支气管上皮细胞铁死亡情况观察及其机制
贺红霞,周金玲,金明
湖北民族大学附属荆门市第一人民医院呼吸与危重症医学科,湖北荆门 448000
慢性阻塞性肺疾病(COPD)是一种以持续气流受限为特征的常见肺部疾病,烟草烟雾暴露是COPD发病危险因素之一[1]。烟草烟雾中含有大量活性氧(ROS)[2],ROS导致的氧化应激紊乱是COPD主要发病机制之一[3]。支气管上皮细胞(BEC)作为呼吸道的重要保护屏障,受到吸烟过程中释放的大量ROS和氧化产物攻击,导致细胞内氧化/抗氧化失衡,直接造成BEC损伤,在COPD发病机制中起重要作用[4]。同时,烟草烟雾暴露增加了BEC发生多种调节性细胞死亡(RCD)的风险,相关研究显示,长期烟雾暴露可诱发BEC发生凋亡、坏死等多种RCD[5-6]。铁死亡是一种新定义的RCD,不同于传统的凋亡和坏死,铁死亡是一种以游离二价铁超载与磷脂过氧化介导Fenton反应共同参与的新型RCD[7]。铁稳态的破坏会导致机体氧化应激和组织损伤,诱发铁死亡,其已被发现参与调控炎性肠病[8]、心肌病[9]等多系统疾病的发生发展。既往研究显示,在吸烟者的肺组织中发现了包括铁在内的多种颗粒物质过量沉积[10]。基于此,我们提出科学假设:烟草烟雾暴露可能通过诱导细胞铁超载和氧化还原紊乱,触发BEC铁死亡,从而参与COPD发生发展。2021年1月—2022年6月,本研究围绕上述假设进行实验,探讨烟草烟雾暴露对体外培养的人BEC铁死亡的影响及其作用机制。现报告如下。
1 材料与方法
1.1 主要材料 正常人BEC(BEAS-2B)购自中科院上海细胞库。细胞爬片、6孔板、12孔板和96孔板购自中国耐思,聚偏二氟乙烯(PVDF)膜、0.2 μm过滤器购自美国Millipore。0.25%胰酶、DMEM高糖培养基和胎牛血清购自美国Gibco-BRL,还原型谷胱甘肽(GSH)检测试剂盒购自美国Sigma,蛋白酶抑制剂购自美国Roche Diagnostics,DAPI染色液、RI和ROS探针购自美国Invitrogen,4%多聚甲醛溶液、抗体稀释液、免疫染色封闭液、抗荧光淬灭封片剂、RIPA裂解液购自上海碧云天,HRP标记的FITC标记山羊抗兔Alexa Fluor 488®(A-11034)、FITC标记山羊抗鼠 Alexa Fluor 594®(A-11032)荧光二抗、磷酸酶抑制剂(Cocktail 100×)、Western blotting洗脱液和蛋白marker购自美国Thermo Fisher Scientific,EdU试剂盒购自中国锐博,铁死亡抑制剂(Fer-1)、凋亡抑制剂(Z-VAD-FMK)、细胞坏死抑制剂(Nec-1)购自美国Selleck,CCK-8试剂盒购自日本Dojindo,逆转录试剂盒、SYBR®Green实时荧光定量PCR预混液购自中国大连宝生,铁离子检测试剂购自美国Abcam,铁死亡相关因子谷胱甘肽过氧化酶4(GPx4)、铁蛋白重链1(FTH1)及环加氧酶2(Ptgs2)一抗购自美国Abcam。二氧化碳培养箱购自日本SANYO,荧光倒置显微镜购自德国Leica,普通PCR扩增仪购自美国Labnet,qPCR仪、mini垂直电泳系统、蛋白快速转膜仪、凝胶成像系统购自美国Bio-Rad,分光光度仪购自美国BioTek-Epoch2,FACSAria流式细胞仪购自美国BD Biosciences,透射电镜购自日本JEOL。
1.2 细胞培养 使用含10%胎牛血清、200 U/mL青霉素及200 U/mL链霉素的完全DMEM高糖培养基培养人支气管上皮细胞BEAS-2B,每2~3 d更换培养基,待细胞融合度述80%~90%时,弃掉培养基,灭菌PBS清洗1次,吸净PBS,加入0.25%胰酶1 mL,37 ℃培养箱消化1~2 min,将细胞移至显微镜下观察其形态变化,如细胞出现收缩、变圆或移动时,弃掉胰酶,加入2 mL完全培养基吹打,使细胞团分散、悬浮,传代培养;待细胞稳定传代3代后,取对数生长期的BEAS-2B细胞用于实验。
1.3 烟草烟雾提取物(CSE)培养基制备 某品牌香烟,每只烟含焦油13 mg、一氧化碳17 mg、尼古丁1.2 mg。参考WIRTZ等[11]CSE制备方法进行操作:点燃香烟,去滤嘴,安放于抽吸装置上,使烟雾通过10 mL无血清DMEM培养基,每支香烟燃烧2 min。当10支香烟产生的烟雾通过该培养基后停止抽吸,经0.22 μm过滤器过滤后即为CSE培养基。分光光度仪于320 nm波长下测定光密度(OD)值,定义此OD值的CSE培养基浓度为100%,根据后续实验需要将CSE稀释至所需浓度。
1.4 不同浓度CSE对BEAS-2B细胞铁死亡的影响观察
1.4.1 细胞分组与处理 取对数生长期的BEAS-2B细胞培养24 h后,分为对照组、0.5% CSE组、1.0%CSE组及2.0% CSE组,分别使用不同浓度的CSE(0、0.5%、1.0%和2.0%)处理24 h,用于后续实验。
1.4.2 细胞增殖活性观察 ①细胞增殖能力:采用EdU染色。取不同浓度CSE处理后的各组细胞,参照EdU试剂盒操作说明书进行抗荧光淬灭剂封片后,荧光显微镜下观察并拍照,EdU阳性细胞数越多说明细胞增殖能力越强。②细胞活性:采用CCK-8法。取不同浓度CSE处理后的各组细胞,按3 000/孔的接种到96孔板,将混有CCK-8试剂的培养基(CCK-8试剂∶培养基按1∶10充分混合)加入每个孔,37 ℃孵育2 h,分光光度仪在450 nm波长下读取各孔OD值,每组设置6个复孔。
1.4.3 细胞Fe2+水平检测 采用比色法。取不同浓度CSE处理后的各组细胞,预冷PBS清洗1次,加入铁离子分析缓冲液裂解细胞,裂解产物中加入铁还原抑制剂减少Fe3+向Fe2+转换,混合均匀后室温反应30 min。加入Fe2+检测探针充分混合,60 ℃条件下反应30 min。分光光度仪在593 nm波长下读取OD值。
1.4.4 细胞氧化还原情况观察 ①细胞ROS水平:采用流式细胞术。取不同浓度CSE处理后的各组细胞,加入ROS荧光探针(1∶2 000),37 ℃避光孵育30 min。收集细胞于15 ml离心管,PBS离心洗涤1次,500 μL PBS重悬,40 μm细胞过滤器过滤细胞悬液,流式细胞仪检测各组细胞荧光ROS强度,Flowjo流式软件分析数据。②细胞GSH水平:采用比色法。取不同浓度CSE处理后的各组细胞,用含1 mmol/L EDTA的50 mmol/L MES缓冲液均质化。4 ℃、10 000 γ/min离心10 min,上清液分别与GSH检测工作液和标准品混合,室温下反应25 min。使用分光光度仪在412 nm波长下读取OD值,每组设置3个复孔。
1.4.5 细胞铁死亡相关因子FTH1、Ptgs2、GPx4 mRNA及蛋白观察 ①mRNA:采用q-PCR法。取不同浓度CSE处理后的各组细胞,TRIzol法提取细胞总RNA,逆转录生成cDNA,使用q-PCR定量分析结果。引物序列:FTH1上游为5'-ATCTGGCTTGGCGGAATAT-3',下游为 5'-TCAAAGACAACACCTGGGTA-3';Ptgs2 上 游 为 5'-TCAAGTCCCTGAGCATCTAC-3',下游为 5'-CATTCCTACCACCAGCAACC-3';GPx4上游为5'-GAGGCAAGACCGAAGTAAACTAC-3',下游为 5'-CCGAACTGGTTACACGGGAA-3';内参β-actin上游为5'-GAGCCTCGCCTTTGCCGATCC-3',下游为 5'-CGATGCCGTGCTCGATGGGG-3'。循环条件:95 ℃ 10 min,95 ℃ 15 s,60 ℃ 15 s,72 ℃ 30 s,共 40个循环。以 β-actin为内参,按 2-ΔΔCt法计算FTH1、Ptgs2、GPx4 mRNA相对表达量。②蛋白:采用Western blotting法。取不同浓度CSE处理后的各组细胞,弃掉培养基,用4 ℃预冷处理的PBS清洗细胞,向6孔板每孔加入预冷的RIPA裂解液200 μL置于冰上裂解细胞获取细胞总蛋白。BCA法测定所获样本蛋白浓度,加入Western blotting 5×蛋白上样缓冲液,充分混匀,接着加入上述混合物5%体积的β-巯基乙醇,充分混合后的蛋白样品置于金属加热器,100 ℃、5 min使蛋白样品充分变性。所的样品依次经SDS-PAGE凝胶电泳、转膜、牛奶封闭,加入Ptgs2、FTH1、GPx4一抗(1∶2 000)4 ℃摇床孵育过夜;次日TBST洗膜,加入HRP标记的二抗(1∶4 000)室温摇床孵育2 h,TBST洗膜;ECL发光液滴加到膜条带上,用Bio-Rad凝胶成像系统显影,Image J图像分析软件统计分析结果,β-actin作为等量蛋白上样对照。
1.4.6 细胞死亡情况观察 采用碘化丙啶染色。取不同浓度CSE处理后的各组细胞爬片,加入碘化丙啶染色工作液,室温避光染色5 min,PBS清洗爬片细胞(注意避光),抗荧光淬灭剂封片后,荧光显微镜观察、拍照,观察细胞死亡情况。
1.4.7 细胞线粒体结构观察 采用透射电镜。收集对照组、2.0% CSE组细胞于2 mL离心管,PBS离心洗涤1次,弃掉培养基,加入4 ℃预冷的戊二醛溶液400 μL,室温放置1 h后转至4 ℃,次日通过透射电镜观察细胞线粒体结构。
1.5 铁死亡抑制剂Fer-1对CSE诱导BEAS-2B细胞铁死亡的影响观察
1.5.1 细胞处理 取对数生长期的BEAS-2B细胞培养24 h,分为Fer-1组、Nec-1组、Z-VAD-FMK组及CSE组,分别给予铁死亡抑制剂Fer-1、坏死抑制剂Nec-1、凋亡抑制剂Z-VAD-FMK及不加试剂预处理2 h后,加入2.0% CSE培养基处理24 h,用于后续实验。
1.5.2 Fer-1对CSE诱导BEAS-2B细胞活性的影响观察 取各组细胞,采用CCK-8法观察细胞活性,方法同“1.4.2”。
1.5.3 Fer-1对CSE诱导BEAS-2B细胞Fe2+水平及氧化还原的影响观察 取Fer-1组、CSE组细胞,比色法检测细胞Fe2+水平,方法同“1.4.3”;采用流式细胞术检测细胞ROS水平,ELISA法检测细胞GSH水平,方法同“1.4.4”。
1.5.4 Fer-1对CSE诱导BEAS-2B细胞FTH1、Ptgs2、GPx4 mRNA及蛋白的影响观察 取Fer-1组、CSE组细胞,采用q-PCR法检测细胞FTH1、Ptgs2、GPx4 mRNA,采用Western blotting法检测细胞FTH1、Ptgs2、GPx4蛋白,方法同“1.4.5”。
1.5.5 Fer-1对CSE诱导BEAS-2B细胞死亡的影响观察 取Fer-1组、CSE组细胞,采用碘化丙啶染色观察细胞死亡情况,方法同“1.4.6”。
1.6 统计学方法 采用SPSS20.0统计软件。计量资料采用Shapiro-Wilk法进行正态性检验,符合正态分布且方差齐性的资料以±s表示,多组间比较采用单因素方差分析,两组间比较采用t检验。P<0.05为差异有统计学意义。
2 结果
2.1 不同浓度CSE对BEAS-2B细胞增殖活性的影响 对照组、0.5% CSE组、1.0% CSE组、2.0% CSE组 EdU 阳性细胞数分别为(10.600 ± 0.548)、(5.810 ± 0.837)、(3.011 ± 0.707)、(1.026 ±0.447)个,OD 值分别为 1.117 ± 0.034、0.797 ±0.062、0.532 ± 0.027、0.220 ± 0.030,EdU 阳性细胞数、OD值对照组>0.5% CSE组>1.0% CSE组>2.0% CSE组(P均<0.05)。
2.2 不同浓度CSE对BEAS-2B细胞Fe2+水平的影响 对照组、0.5% CSE组、1.0% CSE组、2.0% CSE组细胞 Fe2+水平分别为 0.225 ± 0.047、0.602 ±0.043、1.176 ± 0.124、2.101 ± 0.163,细胞 Fe2+水平对照组<0.5% CSE组<1.0% CSE组<2.0% CSE组(P均<0.05)。
2.3 不同浓度CSE对BEAS-2B细胞氧化还原的影响 对照组、0.5% CSE组、1.0% CSE组、2.0% CSE组细胞 ROS 水平分别为 1.013 ± 0.041、2.077 ±0.044、2.912 ± 0.027、4.381 ± 0.045,GSH水平分别为 1.154 ± 0.089、0.821 ± 0.065、0.581 ± 0.050、0.328 ± 0.042,细胞ROS水平对照组<0.5% CSE组<1.0% CSE组<2.0% CSE组,GSH水平对照组>0.5%CSE组>1.0% CSE组>2.0% CSE组(P均<0.05)。
2.4 不同浓度CSE对BEAS-2B细胞FTH1、Ptgs2、GPx4 mRNA及蛋白的影响 见表1。
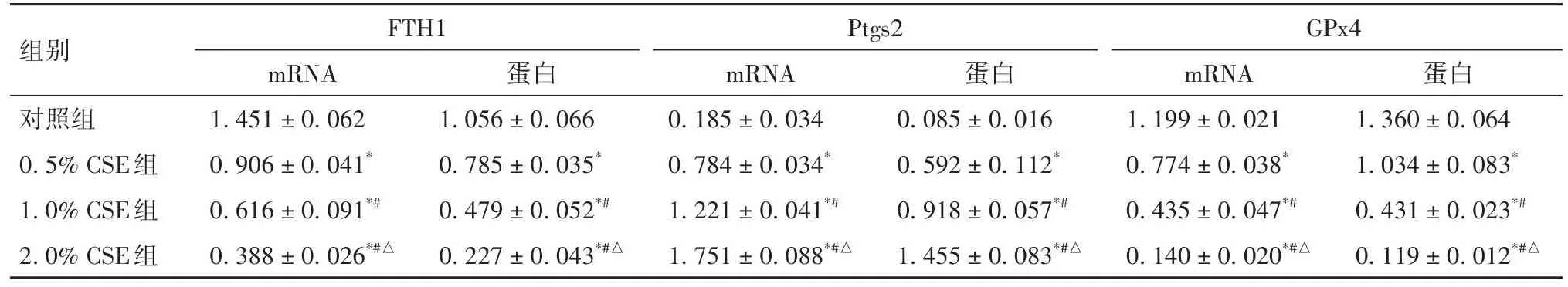
表1 不同浓度CSE对BEAS-2B细胞FTH1、Ptgs2、GPx4mRNA及蛋白的影响(-x ± s)
2.5 不同浓度CSE对BEAS-2B细胞死亡的影响碘化丙啶染色显示,对照组、0.5% CSE组、1.0%CSE组、2.0% CSE组阳性细胞数分别为(1.500 ±0.577)、(10.750 ± 0.957)、(16.510 ± 1.291)、(33.250 ± 2.062)个,阳性细胞数对照组<0.5% CSE组<1.0% CSE组<2.0% CSE组(P均<0.05)。
2.6 CSE对BEAS-2B细胞线粒体结构的影响 透射电镜结果显示,BEAS-2B细胞经2.0% CSE处理后出现线粒体萎缩变小,线粒体双层膜密度增高,线粒体脊减少甚至消失等典型铁死亡线粒体超微结构改变。见OSID码图1。
2.7 Fer-1对CSE诱导BEAS-2B细胞铁死亡的影响
2.7.1 Fer-1对CSE诱导BEAS-2B细胞活性的影响 Fer-1组、Nec-1组、Z-VAD-FMK组、CSE组OD值分别为 0.596 ± 0.029、0.372 ± 0.018、0.371 ±0.007、0.364 ± 0.041,OD 值 Fer-1组>Nec-1组、ZVAD-FMK组、CSE组(P均<0.05),Nec-1组、Z-VADFMK组、CSE组OD值比较差异无统计学意义。
2.7.2 Fer-1对CSE诱导BEAS-2B细胞Fe2+水平及氧化还原的影响 见表2。
表2 Fer-1对CSE诱导BEAS-2B细胞Fe2+、ROS、GSH水平的影响(±s)

表2 Fer-1对CSE诱导BEAS-2B细胞Fe2+、ROS、GSH水平的影响(±s)
注:与CSE组比较,*P<0.05。
组别CSE组Fer-1组Fe2+1.980 ± 0.080 0.699 ± 0.067*ROS 2.834 ± 0.015 1.977 ± 0.017*GSH 0.342 ± 0.084 0.612 ± 0.072*
2.7.3 Fer-1对CSE诱导BEAS-2B细胞FTH1、Ptgs2、GPx4 mRNA及蛋白的影响 见表3。

表3 Fer-1对CSE诱导BEAS-2B细胞FTH1、Ptgs2、GPx4 mRNA及蛋白表达的影响(-x ± s)
2.7.4 Fer-1对CSE诱导BEAS-2B细胞死亡的影响 碘化丙啶染色显示,CSE组、Fer-1组阳性细胞数分别为(35.500 ± 1.291)、(23.750 ± 0.957)个,阳性细胞数Fer-1组低于CSE组(P<0.05)。
3 讨论
COPD是一个重要的全球公共卫生问题,吸烟是COPD的主要危险因素之一[12],长期慢性烟雾暴露所致的炎症因子异常反应被认为是COPD发病机制中重要的一部分[1-2]。烟草烟雾暴露导致气道慢性炎症、黏液生成增加、肺组织破坏和小气道改造,这些病理生理过程在很大程度上导致气道气流阻塞,推动COPD的持续进展[13]。
铁死亡是一种新发现的以铁依赖性脂质过氧化为特征的RCD方式,细胞线粒体缩小、线粒体脊断裂及无染色质凝集等铁死亡特征性线粒体超微结构改变使其区别于坏死、凋亡等RCD[7]。铁死亡已被发现涉及多种疾病的发生发展,如参与调控炎性肠病[8]、心肌病[9]等疾病,而其是否参与调控COPD的发生发展过程则不是十分明确。
BEC是呼吸道抵御吸入性环境损伤的第一道防线,也是许多呼吸道病毒的攻击目标[4]。既往研究显示,烟草烟雾会损害人原代小气道上皮细胞Toll样受体3(TLR3)的裂解,导致抗病毒药物功效受损[14]。而烟草烟雾是如何影响BEC功能的,仍不完全清楚。作为呼吸道重要的保护屏障,BEC在内、外源性氧化应激状态下可分泌GSH等多种抗氧化物质以适应短时期的氧化损伤状态[15]。烟草烟雾中含有大量的ROS,长期烟草烟雾暴露可通过ROS介导氧化应激反应造成细胞损伤,导致支气管上皮细胞氧化/抗氧化失衡,造成肺实质和气道壁的不可逆损伤[2]。
铁作为一种微量元素,参与了机体许多重要的生理过程,如线体粒呼吸、DNA合成、细胞分裂和血红蛋白合成等[16]。铁蛋白是由铁蛋白轻链(FTL)和重链(FTH1)两个亚基以不同比例组合而成的蛋白复合物,是细胞内铁储存的主要蛋白。FTH1作为铁蛋白的亚基之一,具有亚铁氧化酶活性,是结合铁所必需的。细胞FTH1基因缺失导致细胞储铁能力下降,增加了细胞铁池游离铁水平,显著提高了细胞铁死亡的敏感性[17];反之,铁蛋白表达增加(如在多种肿瘤细胞中)能提高细胞对氧化应激的抗性,降低细胞铁死亡,从而促进肿瘤细胞的生长[18]。因此,铁稳态的维持对机体生理生化过程至关重要,而细胞内铁的异常累积将会诱发细胞铁死亡。CHEN等[19]研究显示,青蒿素化合物能够通过调节IRP-IRE轴上调细胞内游离铁水平,诱发肿瘤细胞铁死亡。LIU等[20]发现,转录调控因子Nupr1可通过介导脂质运载蛋白2(LCN2)表达上调,减少细胞内铁积累,从而减缓铁死亡发生。
既往研究显示,ROS介导的铁蛋白降解过度能够通过释放铁离子,触发细胞Fenton反应和脂质过氧化,诱导细胞铁死亡[7]。本研究结果显示,BEAS-2B细胞抗氧化指标GSH水平随着CSE浓度增高而下调;与之相反,CSE呈浓度依赖性的上调BEAS-2B细胞ROS及Fe2+水平。q-PCR及Western blotting可见随着CSE浓度增高,BEAS-2B细胞GPx4、FTH1 mRNA及蛋白表达降低,Ptgs2 mRNA及蛋白表达升高。同时,CSE暴露诱导的BEAS-2B细胞出现典型的铁死亡线粒体超微结构改变。而铁死亡抑制剂Fer-1能有效逆转BEAS-2B细胞活性下降,降低细胞内Fe2+、ROS水平,增高GSH水平,并使GPx4、FTH1 mRNA及蛋白表达回升,Ptgs2 mRNA及蛋白表达降低。结合上述结果我们分析,CSE暴露触发BEAS-2B细胞铁死亡可能与其诱导细胞铁蛋白FTH1降解过度,释放铁离子以及GSH等氧化还原物质急剧消耗引起BEAS-2B细胞氧化还原紊乱有关。
综上所述,CSE能够通过上调BEAS-2B细胞内Fe2+水平、加快GSH耗竭,触发细胞内氧化还原紊乱,从而诱导BEAS-2B细胞铁死亡。BEC的凋亡和坏死性死亡已被证实在COPD发病机制中发挥着重要作用[5-6],但在我们的研究中,除铁死亡抑制剂Fer-1外,无论是坏死抑制剂Nec-1还是凋亡抑制剂ZVAD-FMK均未显示出对CSE诱导的BEAS-2B细胞死亡有明显的抑制作用。导致这种差异的原因可能为不同剂量CSE在不同时间节点上所触发的RCD类型不同,因此很难明确究竟是哪一种RCD占据CSE调控BEAS-2B细胞死亡的主导地位。但我们的研究仍然表明,在目前CSE诱导BEAS-2B细胞死亡的研究中,至少部分归因于CSE诱导BEAS-2B细胞铁超载和氧化还原紊乱触发其铁死亡。

