西昌某奶牛场乳房炎病原菌的分离鉴定及药敏试验
杨克利,周美琪,张涛,邹宏,何晓露,韦汉群,张文丽,郝桂英*
(1.西昌学院动物科学学院,四川 西昌 615013;2.凉山彝族自治州农业科学研究院,四川 西昌 615000;3.西昌市农业农村局,四川 西昌 615000)
0 引言
奶牛乳房炎(bovine mastitis)是奶牛乳腺组织受到物理、化学因素刺激或病原微生物感染后发生的炎症反应,是奶牛常见的一种多发性疾病。该病可导致奶牛产奶量下降,影响乳制品品质,严重时可使奶牛泌乳机能丧失,最终使患牛淘汰,给奶牛养殖业造成巨大的经济损失[1]。
引起奶牛乳房炎的病原菌达150余种,其中肺炎克雷伯菌(Klebsiellapneumonia)是肠杆菌科、克雷伯菌属中常见的致奶牛乳房炎环境病原菌之一,其引发的乳房炎症状尤为严重,具有发病急、死淘率高、产奶量大幅下降、抗生素治疗效果不佳等特点[2]。我国黑龙江、辽宁、山东、河南[3]、甘肃[4]、宁夏[5]、江苏[6]、陕西[7]、上海[8]、广东、安徽、山西、浙江[9]、河北[10]、内蒙古[11]、四川[12]、湖北[13]、云南[14]和湖南[15]多地均有从奶牛乳房炎病例或生牛乳中分离到该菌的报道,并且其造成的全身性感染甚至可以导致奶牛的急性死亡[16]。因此,肺炎克雷伯菌引起的动物感染及其潜在的公共卫生安全危害引起了科研人员越来越多的关注。
2023年4月,四川省凉山彝族自治州西昌市某奶牛场有3头奶牛在产后7 d内出现了以乳房炎为主要特征的症状,病牛精神沉郁、喜卧、体温升高、食欲不佳、呼吸加快、流少量浓稠鼻涕、排淡黄色稀便。触摸其乳房有硬块,乳房或乳头肿胀,乳汁呈水样,部分乳中带血。症状严重的1头奶牛在发病第2 天死亡。对死亡奶牛进行剖检,可见肺脏、肋胸膜出血,肝脏、脾脏出血,真胃黏膜、肠黏膜出血,空肠有水样黄色内容物。为查明导致该病发生的主要致病菌,本研究对该奶牛场发病未死亡的2头奶牛的乳样进行了细菌的分离培养和鉴定、药敏试验等,以期为该奶牛场科学防治奶牛乳房炎提供依据。
1 材料与方法
1.1 乳样
采集西昌某奶牛场经临床诊断为乳房炎的奶牛乳样2份。清洗消毒病牛乳头,弃去前3把奶,采集20~30 mL乳汁于灭菌离心管中,标记好采样日期、牛号后置于带冰盒的采样箱内,迅速带回实验室4 ℃保存,24 h内分别进行细菌培养。
1.2 主要试剂与仪器
主要试剂:麦康凯琼脂培养基、营养琼脂培养基、营养肉汤、革兰氏染色试剂均购自北京索莱宝科技有限公司;细菌微量生化管、药敏纸片(恩诺沙星、诺氟沙星、红霉素、头孢比肟、头孢他啶、妥布霉素、氨苄西林、庆大霉素、阿莫西林和新霉素)均购自杭州微生物试剂有限公司;细菌基因组DNA提取试剂盒购自天根生化科技(北京)有限公司;2×Easy Taq PCR Super Mix、Trans2K DNA Marker、GelStain核酸染料购自北京全式金生物科技有限公司。
主要仪器:超净工作台(SJ-CJ-2D型,苏洁医疗器械(苏州)有限公司);高速冷冻离心机(5810R,eppendorf);PCR仪(Nexus GSX,eppendorf);凝胶成像系统(Molecular Imager®Gel DocTMXR+,BIORAD);核酸电泳仪(JY600E,北京君意电泳仪科技有限公司);恒温生化培养箱(LRH-250,上海一恒科学仪器有限公司);显微镜(Motic BA200,麦克奥迪实业集团有限公司)。
1.3 实验动物
体质量15~20 g的小白鼠8只,供致病性试验使用。
1.4 细菌的分离纯化
将1.1采集的2份待检乳样在超净工作台中分别取1 000 μL到灭菌的EP管中,8 000 r/min离心3 min,弃去上层800 μL液体,将剩余的乳液混匀后,吸取上述混悬液分别接种到麦康凯琼脂培养基上,37 ℃培养24 h后观察菌落生长情况[7]。挑取疑似菌落进行革兰氏染色,观察菌体形态及染色特性;然后挑取疑似单菌落接种于营养肉汤中纯化培养。
1.5 生化鉴定
将纯化培养后的菌液分别接种于葡萄糖、乳糖、蔗糖、阿拉伯糖、甘露醇、硫化氢、尿素、枸橼酸盐、尿素酶生化管以及氧化酶试纸,37 ℃培养24 h,观察其生化反应特性[13]。
1.6 分子生物学鉴定
1.6.1 细菌DNA的提取
无菌条件下吸取1.4中纯化培养的菌液1 mL,10 000 r/min离心1 min,弃去上清液,参照细菌基因组DNA提取试剂盒说明书提取细菌基因组DNA。
1.6.2 PCR检测及送检测序
先用khe基因特异性引物[5]进行PCR检测,再用细菌16S rRNA通用引物对有目的条带的阳性菌株进行PCR扩增。
khe基因引物序列分别为khe-F:5'-ATG AAA CGA CCT GAT TGC ATT CGC-3',khe-R:5'-TTA CTT TTC CGC GGC TTA CCG TC-3'。16S rRNA通用引物序列分别为:27F:5'-AGA GTT TGA TCM TGG CTC AG-3',1492R:5'- TAC GGY TAC CTT GTT ACG ACT T-3'。引物序列均由生工生物工程(成都)股份有限公司合成。
PCR反应条件:(1)khe基因:95 ℃预变性3 min;94 ℃变性25 s,58 ℃退火45 s,72 ℃延伸1 min,共35个循环;72 ℃延伸5 min。目的条带约480 bp。(2)16S rRNA基因:95 ℃预变性5 min;95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸90 s,共35个循环;72 ℃延伸5 min。目的片段约1 500 bp。ddH2O作阴性对照。
PCR扩增产物分别用1%琼脂糖凝胶进行电泳,待电泳结束后,通过凝胶成像系统观察电泳结果。将PCR阳性产物送生工生物工程(成都)股份有限公司进行双向测序。
1.6.3 序列分析
通过BLAST软件比对确定待测细菌,同时检索GenBank收录的肺炎克雷伯菌khe基因序列和肺炎克雷伯菌、产酸克雷伯菌(Klebsiellaoxytoca)与大肠埃希氏菌(Escherichiacoli)16S rRNA基因序列并下载,用DNAstar中的MegAlign程序进行序列同源性分析。
1.7 药敏试验
采用K-B琼脂平板扩散法对分离纯化的菌株进行药敏试验。将纯化培养的菌液加到营养琼脂培养基上并涂布均匀,在超净工作台内晾2 min后,用镊子无菌取药敏纸片放置在涂布好细菌的培养基上,不同纸片相距15~20 mm。37 ℃培养24 h后用直尺测量抑菌圈的直径,记录数据。
依据马越等[17]的报道结果判定分离菌对抗菌药物的敏感性:抑制圈>15 mm为高度敏感(S);抑制圈10~15 mm为中度敏感(I);抑制圈<10 mm为耐药(R)。
1.8 小鼠致病性试验
将分离纯化的菌株菌液浓度调节约为1×108CFU/mL,每株菌接种4只小白鼠,腹腔注射0.2 mL/只,对照组小白鼠接种营养肉汤0.2 mL/只。每天观察小鼠的临床症状,记录死亡数,72 h后处死全部存活小鼠。无菌采集心脏、肝脏、脾脏用于分离细菌,对分离菌进行染色、镜检、生化试验,并使用肺炎克雷伯菌khe基因特异性引物进行分子鉴定。
2 结果与分析
2.1 肺炎克雷伯菌的菌落形态
从2份乳样中分离到1株疑似肺炎克雷伯菌菌株,命名为XC1分离菌株。菌株在麦康凯琼脂培养基上形成粉红色、圆形、光滑、边缘整齐、湿润、黏稠的菌落(图1),用接种环挑取菌落有明显的拉丝现象,与高兴等[18]报道的肺炎克雷伯菌菌落形态相似。
图1 麦康凯培养基上的菌落
2.2 肺炎克雷伯菌的菌体形态
镜检菌体为革兰氏阴性的粗短杆菌,呈单个、成对或短链状排列(图2),与田维嘉[19]报道的肺炎克雷伯菌菌体形态相似。

图2 革兰氏染色的菌体(×1 000倍)
2.3 肺炎克雷伯菌的生化鉴定
分离菌株发酵葡萄糖、乳糖、蔗糖、阿拉伯糖和甘露醇,产酸或产酸产气;分解尿素;不产生硫化氢;枸橼酸盐、氧化酶阴性;尿素酶阳性。与刘冬霞[20]报道的肺炎克雷伯菌生化结果基本一致。
2.4 肺炎克雷伯菌的分子生物学鉴定
电泳结果显示,XC1分离菌株可扩增出khe基因目的条带,与预期目的片段大小基本一致(图3)。

图3 肺炎克雷伯菌khe基因PCR电泳结果
XC1分离菌株及接种小白鼠心脏中分离的菌液(XC1-1菌液)、肝脏中分离的菌液(XC1-2菌液)、脾脏中分离的菌液(XC1-3菌液)的khe基因测序序列长度均为454 bp,核苷酸同源性为100%,与肺炎克雷伯菌参考序列同源性为99.6%~99.8%(图4);XC1分离菌株16S rRNA基因测序序列长度为1 411 bp,与肺炎克雷伯菌参考序列同源性为99.7%~100%,与产酸克雷伯菌(K.oxytoca)参考序列同源性为97.1%~98.1%,与大肠埃希氏菌(E.coli)参考序列同源性为96.5%(图5)。因此,khe基因和16S rRNA基因均确定XC1分离菌株为肺炎克雷伯菌。

图4 肺炎克雷伯菌khe基因序列同源性比对结果

图5 肺炎克雷伯菌16S rRNA基因序列同源性比对结果
2.5 药敏试验结果
XC1分离菌株对恩诺沙星、诺氟沙星、头孢比肟和头孢他啶高度敏感;对妥布霉素、庆大霉素和新霉素中度敏感;对红霉素、氨苄西林和阿莫西林耐药(表1)。
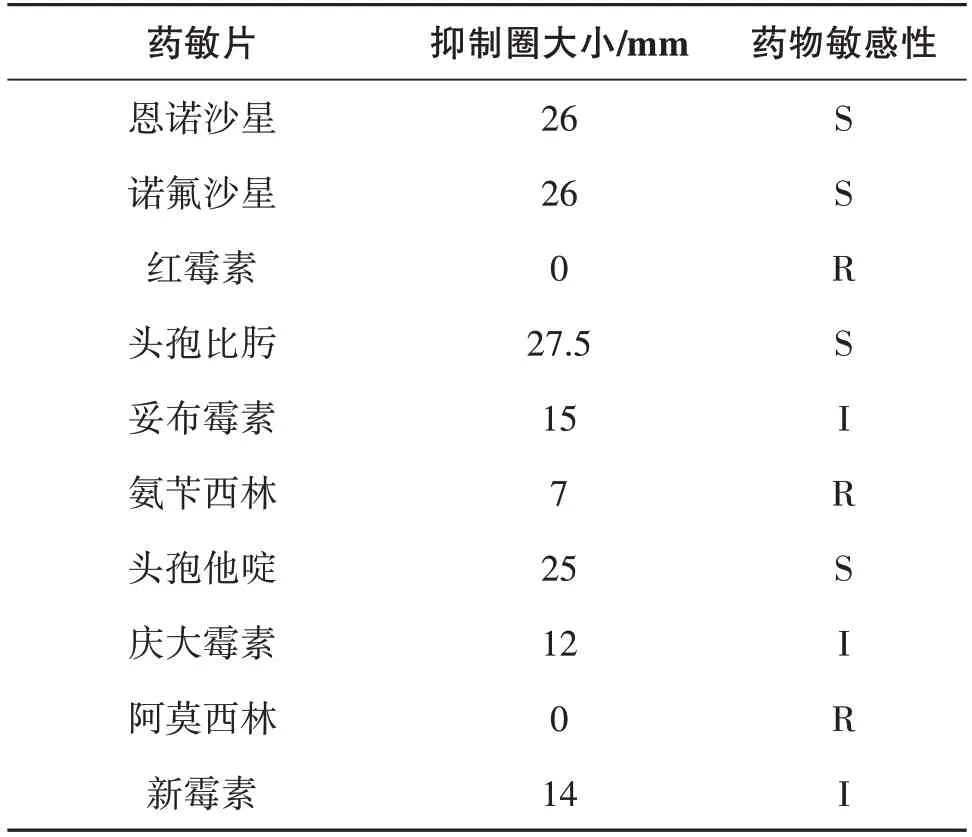
表1 药敏试验结果
2.6 小鼠致病性试验
XC1分离菌株组小白鼠在接种第1天出现精神沉郁、蜷缩一角;第2天出现腹泻、排血便;第3天全部死亡。剖检发现死亡小白鼠胸腔有积液,肝脏出血,肠臌气,直肠末端有血液。对照组小白鼠精神正常,全部存活。剖检无明显病变。
感染小鼠心脏、肝脏、脾脏等组织中分离的细菌为革兰氏阴性、较粗短的直杆菌,生化试验结果与XC1分离菌株一致,PCR检测均在约480 bp处出现特异性条带(图3)。对照组未分离出细菌。小鼠致病性试验表明XC1分离菌株具有较强的毒力。
3 讨论与结论
3.1 讨论
牛群品种、饲养管理、地域环境、季节气候等的不同,会影响奶牛乳房炎的发生率以及病原菌种类。肺炎克雷伯菌(K.pneumoniae)作为我国常见的奶牛乳房炎环境性致病革兰氏阴性菌之一,不同地方分离率有差异。Gao等[3]报道黑龙江、辽宁、河北、山东、河南、天津、北京等21省161个大型奶牛场(>500头)K.pneumoniae平均分离率为13.0%;冯小慧等[8]报道上海和河北患病牛乳K.pneumoniae分离率分别为18%(18/100)和14%(14/100);曹菲菲等[9]报道福建、江苏、广州、河北、安徽、山西、内蒙古、浙江等地区的11个规模化牧场K.pneumoniae平均分离率为14.55%(119/818);Gao等[21]报道我国13省123个奶牛场临床型乳房炎奶样K.pneumoniae平均分离率为51.5%(124/241);He等[22]报道山东、黑龙江和河北3家规模化奶牛场临床型乳房炎奶样K.pneumoniae平均分离率为2.9%(183/6301);石玉祥等[10]报道河北某大规模奶牛场K.pneumoniae分离率为18.4%(45/245);Cheng等[23]报道中国南北部2个奶牛场K.pneumoniae平均分离率为27.0%(365/1 354);Yang等[24]报道江苏、山东生乳K.pneumoniae分离率分别为7.8%(65/830)和0.4%(1/233);吴香云[13]报道湖北省5个奶牛场K.pneumoniae平均分离率为26.9%(239/887),临床乳房炎和隐性乳房炎牛乳K.pneumoniae分离率分别为25.4%(35/138)和24.5%(12/49);高兴等[18]报道全国大型规模化牧场乳房炎奶样K.pneumoniae分离率约11%(212/2 000),说明全国各地奶牛场的卫生防护措施参差不齐。
奶源安全问题是食品安全问题的重中之重,受到人们的广泛关注。乳汁微生物鉴定常被认为是乳房炎诊断的“金标准”,但肺炎克雷伯菌与大肠埃希氏菌形态相似,难以区别。由于khe基因只在肺炎克雷伯菌中检出,因此,khe基因可作鉴定该菌的特异性基因[5]。16S rRNA基因由于片段大小适中,能体现出不同种属细菌间的差别,现常应用于细菌分类鉴定。因此,本试验通过细菌形态学观察、生化鉴定、分子生物学鉴定、小鼠致病性试验等对分离菌株进行鉴定,确定该场奶牛乳房炎与肺炎克雷伯菌感染有关,这与张明国等[25]、周国燕等[12,26]的研究结果不完全一致,这些研究认为葡萄球菌为凉山州奶牛乳房炎优势菌。药敏试验结果显示,XC1分离菌株对头孢比肟、恩诺沙星、诺氟沙星和头孢他啶4种药物敏感,对红霉素、氨苄西林和阿莫西林3种药物耐药。近年来,各地区奶牛乳房炎源K.pneumoniae耐药率和耐药谱均存在差异,甚至出现多重耐药的现象[27-28]。张颖欣等[2]报道国内13省耐药型K.pneumoniae流行率约为13.7%。曹菲菲等[9]报道分离自奶牛乳房炎的119株K.pneumoniae对氨苄西林的耐药率达到了94.96%。He等[22]报道分离自奶牛乳房炎的183株K.pneumoniae对复方新诺明的耐药率均在90.0%以上,显著高于其他药物的耐药率(25.0%以下);对多西环素中等耐药(15.4%~25.0%);对庆大霉素、氟苯尼考、环丙沙星、头孢曲松、替加环素、阿莫西林/克拉维酸钾和卡那霉素表现出较低水平耐药(1.0%~7.7%),其中环丙沙星、替加环素、阿莫西林/克拉维酸钾和卡那霉素维持在1.0%左右的低耐药率,而对美罗培南和多黏菌素尚未耐药。K.pneumoniae可产生水解头孢菌素的超广谱β-内酰胺酶,且编码基因可以通过质粒分布在奶牛场的细菌中[29],为临床治疗K.pneumoniae引起的奶牛乳房炎带来困难。因此,在生产中应积极开展肺炎克雷伯菌的分子流行病学调查,及时监控该菌的流行趋势。在临床治疗中,应加强对该菌耐药性的监测,规范治疗流程,减少抗生素的误用和滥用,从而减少耐药菌株的产生和传播,以免引起公共卫生安全危害。
3.2 结论
本研究通过细菌形态学观察、生化试验、分子生物学方法对乳房炎乳样进行细菌分离鉴定,分离出1株肺炎克雷伯菌,命名为XC1分离菌株;小鼠致病性试验表明XC1分离菌株具有较强的毒力,证明该场奶牛乳房炎与肺炎克雷伯菌感染有关。药敏试验结果表明XC1分离菌株对临床常用的抗生素存在不同程度的耐药性,其中对红霉素、氨苄西林和阿莫西林耐药。研究结果可为该奶牛场防治乳房炎提供参考。

