CT联合MRI在陈旧性脑梗死相关脑皮质层状坏死诊断中的应用
杜春梅,丁长青(通信作者)
(1沛县人民医院影像科 江苏 徐州 221600)
(2丰县人民医院影像科 江苏 徐州 221700)
皮质层状坏死(cortical laminar necrosis,CLN)是指由于缺氧损伤导致的大脑皮层神经元的选择性坏死。在慢性期,CLN的特点是MRI图像上出现皮质结构的萎缩,伴病变区皮层脑回样T1WI高信号[1]。CLN的病因以脑梗死最为常见[2-3],其典型的MRI T1WI高信号多在2周后出现,1月后MRI部分序列信号特征更为明显[4]。CLN的出现多提示患者预后不良[2]。因此,客观评估陈旧性梗死相关CLN的影像学CT及MRI特征对于正确膀胱预后具有重要意义。相对于急性期及亚急性期梗死的多形性影像学表现,陈旧性梗死灶图像更趋于稳定,应用影像学成像手段评价此期相关的CLN,具有更好的一致性。本文选取2021年5月—2022年9月沛县人民医院及丰县人民医院收治的80例陈旧性脑梗死相关脑皮质层状坏死患者进行研究,报道如下。
1 资料与方法
1.1 一般资料
选取2021年5月—2022年9月沛县人民医院及丰县人民医院收治的80例陈旧性脑梗死相关脑皮质层状坏死患者,其中男48例,女32例,年龄43~94岁,平均(73.62±0.47)岁。71(88.75%)例患者病程中期出现病情相对稳定一段时间后又出现以认知障碍为主的症状加重。本研究获得院医学伦理学委员会批准(沛人医伦理2022019),患者本人或其监护人知情同意并签署知情同意书。
纳入标准:①患者有明确的脑梗死病史且经影像学检查证实,本次影像学检查距梗死发病1月以上,平均(45.00±3.27)d;②患者均行CT、MRI检查,且检查间隔≤3 d;③CLN均经CT及MRI联合影像学检查及临床随访做出的最终诊断结果证实。排除标准:①有出血性梗死病史者;②双侧梗死患者;③影像学检查手段不全、图像伪影较大影响诊断者;④合并颅脑创伤、烟雾病、乳酸等中毒、颅内感染、低血糖、代谢紊乱、抗肿瘤或免疫抑制治疗等其他可致CLN的病因;⑤临床资料不完整者。
1.2 方法
患者均进行CT(采用飞利浦Prospeed 16排及64 排)、MRI(采用飞利浦Achieva 1.5T及3.0T,西门子Pioneer 3.0T)检查。患者均取仰卧位,CT以OM线为基线,扫描自颅顶至枕骨大孔下缘,CT扫描参数:电压120 kV,电流200 mAs,层厚/层距:6 mm/6 mm,矩阵:512×512。MRI采用专用相控阵线圈,层厚/层间距:6.0 mm/1.0 mm,MRI行常规平扫轴位T1WI(TR/TE:480~500 ms/15~18 ms)、T2WI(TR/TE:3 800~4 200 ms/90~120 ms)、FLAIR(TR/TE:6 500~7 000 ms/130~150 ms,翻转角15°)、DWI(b值分别为 0、1 000 s/mm2)矢状位T2WI(TR/TE:4 000 ms/110 ms)扫描。
由两位高年资诊断医师采用双盲法读片,意见不一致时,协商一致。
1.3 观察指标
以联合影像学检查及临床随访做出的最终诊断结果为标准,重点观察CLN病变位置、CT平扫密度特点及MRI各序列信号强度。以陈旧性梗死区皮质表面脑回样/条带状CT高密度或T1WI高信号为CLN阳性判定标准。
1.4 统计学方法
采用SPSS 22.0统计软件分析数据。符合正态分布的计量资料以均数±标准差(± s)表示,采用t检验;计数资料以频数(n)、百分率(%)表示,采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 影像学表现特征
患者的影像学阳性征象为陈旧性梗死区皮质表面脑回样/条带状异常密度或信号,其中在CT平扫上为高密度(n=74,92.5%),MRI平扫T1WI为高信号(n=80,100.0%),T2WI为 低 信 号(n=80,100.0%),FLAIR为高信号(n=62,77.5%)或等高混杂信号(n=18,22.5%),DWI为高信号(n=59,73.75%)或等高混杂信号(n=21,26.25%)。28(35%)例为单脑叶或小面积脑梗死,其中顶叶11例,枕叶9例,颞叶5例,额叶3例,MRI上显示的层状坏死病灶范围也多较CT大(见图1)。52(65%)例为多脑叶或大面积脑梗死,主要为大脑中动脉供血区梗死,累及额顶叶为主,CT显示的层状坏死病灶范围多较MRI大(见图2)。所有病例皮层下白质未受累及,均伴梗死区域邻近大脑皮层萎缩。
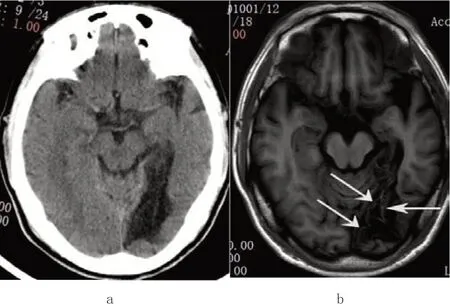
图1 70岁男性左侧枕叶陈旧性梗死伴层状坏死患者的图像

图2 79岁女性右侧大脑中动脉陈旧性梗死伴层状坏死患者的图像
2.2 CT及MRI检出情况
MRI对病灶的总体检出率高于CT检查,差异有统计学意义(P<0.05)。MRI对单脑叶或小面积脑梗死病灶的检出率高于CT检查,差异有统计学意义(P<0.05)。对于多脑叶或大面积脑梗死,MRI及CT均能检测出层状坏死病灶,差异不显著。见表1。

表1 CT及MRI对CLN的检出情况比较 单位:例
3 讨论
CLN是一种主要选择性累及皮质的第3~5层(第3层为主)的永久性缺血坏死形式,代谢不活跃的白质通常不被累及。多出现于梗死或其他颅内病变的第2周至2年内,病理及影像学主要表现与神经元损伤坏死、胶质细胞增生、变性蛋白堆积及含脂巨噬细胞沉积相对应,而不是继发于梗死等病变的出血性转化[5]。脑梗死引起者最多,重度颅脑损伤次之,自发性脑出血位、缺血缺氧性脑病、偏头痛性梗死、颅脑术后、低血糖、癫痫持续状态、免疫抑制和抗肿瘤治疗、烟雾病、颅内感染、中毒、代谢紊乱、自身免疫性疾病可致CLN[4-6]。脑梗死后CLN的主要累及大脑中动脉供血区的额顶叶梗死区皮质(本文65%)报道最多[2],其发生可能与局部脑血管自动调节异常所致的皮质血流高灌注有关[7]。
脑梗死相关的CLN的临床特点是患者病情相对稳定一段时间后、又出现以认知障碍为主的症状加重(本文88.75%)。既往认为本症较为少见,多为案例报道。但随着影像科及神经科等专科医师认识的不断提高,本症的报道有明显增多的趋势。因本症鲜有尸体解剖进行病理性诊断,而主要由影像学CT及MRI成像手段进行诊断。MRI是对CLN进行无创诊断的最准确方法。CLN病变在急性期难以凭借神经症状和常规MRI进行诊断特别。在亚急性或慢性期,T1WI典型的皮质脑回样高信号病变通常在临床发病后2周才出现,此征象的出现,多提示神经系统并发症和永久性脑损伤的风险较高。与尸检相关的病理学-放射学研究,发现与亚急性/慢性期MRI上的T1WI高信号,与皮质存在坏死碎片及含脂巨噬细胞相关,但无出血或钙化的证据[8]。有学者应用磁敏感加权成像(susceptibility weighted imaging,SWI)研究,发现T1WI高信号区多非出血性病变,也不符合血管、骨或伪影等信号改变[9]。不同于蛛网膜下腔出血在CT上短期复查线状高密度可消失,CLN病变的高密度可长期存在[4,10]。
本研究结果显示,对于陈旧性梗死相关的CLN,MRI对病灶的总体检出率高于CT,差异有统计学意义(P<0.05);MRI对单脑叶或小面积脑梗死病灶的检出率高于CT检查,差异有统计学意义(P<0.05);对于多脑叶或大面积脑梗死,MRI及CT均能检测出层状坏死病灶(P>0.05)。在病变范围的显示上,CT及MRI有一定差异。因此,联合CT及MRI两种影像学检查手段,可较为全面评估本症,值得临床应用。
本研究不足之处:本研究为回顾性研究,纳入的病人数量较少;未行CLN病变演变的动态影像学分析;纳入病例虽均为陈旧性梗死病例,但收集到的病例梗死部位及梗死时段未能完全一致;患者个体差异也会影响CLN的出现与否、出现时间及病变范围;也未能对CT及MRI各序列显示的CLN病变区域进行量化分析。

