好氧性嗜甲烷菌生物能供给与调控的研究进展
侯千姿,郭心怡,焦子悦,费强,2
(1 西安交通大学化学工程与技术学院,陕西 西安 710049;2 陕西省能源化工过程强化重点实验室,陕西 西安 710049)
作为一种温室气体,甲烷的全球变暖潜力值(20年期计算)是二氧化碳的86倍[1],即每排放一个当量的甲烷气体,等同于排放86个当量的二氧化碳气体。目前多项科研成果都表明全球甲烷排放量和浓度正在快速增加[2−3]。在第26届联合国气候变化大会期间,中美两国共同发布了《中美关于在21 世纪20年代强化气候行动的格拉斯哥联合宣言》,强调了甲烷排放治理的重要性和紧迫性。甲烷的有效减排在短期内可延缓气候变暖速率,而作为重要的资源和能源,甲烷的合理利用途径也亟待拓展。
生物制造是利用生物体机能进行物质加工与合成的一种绿色生产方式[4],有助于减少废物排放和工业经济对生态环境的影响,是国家《“十四五”生物经济发展规划》确立的生物经济战略性新兴产业发展方向[5]。甲烷的生物转化拓展了甲烷的绿色利用途径,在生物制造中占据重要地位[6]。嗜甲烷菌能在好氧或厌氧的条件下,以甲烷作为唯一碳源和能源进行生长和代谢。相比于较难实现纯培养的厌氧性嗜甲烷菌,好氧性嗜甲烷菌对全球甲烷消除的贡献率高达10%~20%[7],且易培养和适合基因操作。好氧性嗜甲烷菌主要分为γ−变形菌门(Ⅰ型和Ⅹ型)、α−变形菌门(Ⅱ型)和疣微菌门三类,利用体内的甲烷单加氧化酶(Methane monooxygenase,MMO)实现甲烷的氧化,并进一步通过单磷酸核酮糖循环(Ribulose monophosphate, RuMP)、丝氨酸循环(Serine cycle)或卡尔文循环(Calvin−Benson−Bassham cycle, CBB cycle)等关键代谢途径实现碳同化[8]。
近年来,围绕好氧性嗜甲烷菌开发和优化了该菌株遗传操作工具[9−10],通过通量平衡分析(Flux balance analysis,FBA)和对代谢通路节点的理性改造已实现甲烷生物转化合成单细胞蛋白、乳酸、黏康酸和2,3−丁二醇等化学品[11−15]。然而,如何调控和优化甲烷转化过程中的还原力和能量供给,已成为提高代谢通量的关键。本文围绕底物水平磷酸化和氧化磷酸化两个关键途径分析了好氧性嗜甲烷菌的能量代谢网络,然后重点论述了生物能供给及碳-氮代谢通量调控的相关研究进展,最后探讨和展望了好氧性嗜甲烷菌在能量代谢调控方面所面临的挑战和机遇。
1 好氧性嗜甲烷菌的能量代谢途径
作为一种原核微生物,好氧性嗜甲烷菌可通过底物水平磷酸化和氧化磷酸化完成能量供给和代谢,其体内同时存在己糖二磷酸(Embden−Meyerhof−Parnas,EMP)途径和2−酮−3−脱氧−6−磷酸葡糖酸(Entner−Doudoroff,ED)途径两种糖酵解(Glycolysis)途径[16],以及一个完整的三羧酸循环(Tricarboxylic acid cycle, TCA)[17−20]。在底物水平磷酸化途径中释放的还原型辅酶Ⅰ(Nicotinamide adenine dinucleotide,NADH)和还原型黄素二核苷酸(Flavine adenine dinucleotide, reduced,FADH2)随后经氧化磷酸化作用,形成水分子并将释放出的能量合成ATP[21]。好氧性嗜甲烷菌中各能量代谢途径中每氧化一分子果糖−6−磷酸(Fructose−6−phosphate,F6P)所生成的还原力和ATP的分子数如表1所示。
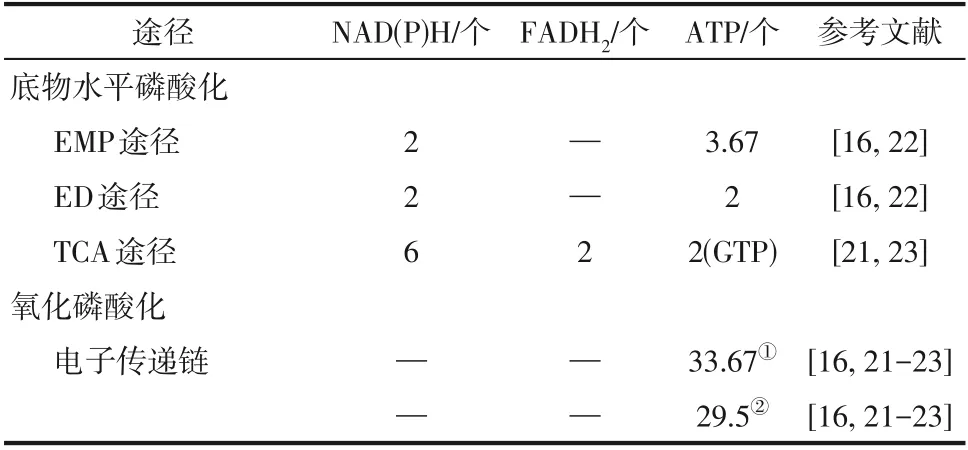
表1 好氧性嗜甲烷菌能量代谢途径的产能概况
1.1 底物水平磷酸化
1.1.1 糖酵解
不同于大多数以糖为碳源的微生物,好氧性嗜甲烷菌的糖酵解途径是不完整的,其EMP途径和ED途径都没有初始的糖磷酸化的参与,而是通过F6P与单磷酸核酮糖循环连接。依赖焦磷酸盐(PPi)的EMP途径是一种更有效的节能途径,可以产生更多的净ATP[24](图1)。F6P首先转化为果糖−1,6−二磷酸(Fructose 1,6−bisphosphate,FBP),随后经醛缩酶裂解为3−磷酸甘油醛(Glyceraldehyde−3−phosphate,GAP)和磷酸二羟基丙酮(Dihydroxyacetone phosphate,DAP),后者可以异构化为GAP,最终被转化为丙酮酸(Pyruvate)。而在ED途径中,F6P相继通过葡萄糖−6−磷酸(Glucose−6−Phosphate,G6P)和6−磷酸葡糖酸(6−phosphogluconate, 6PG)转化为2−酮−3−脱氧−6−磷酸葡萄糖酸(2−keto−3−deoxy−6−phosphogluconate,KDPG),接着经KDPG醛缩酶裂解为GAP 和丙酮酸,其中GAP 可继续进入到EMP途径的第二阶段,进一步转化为丙酮酸[25]。
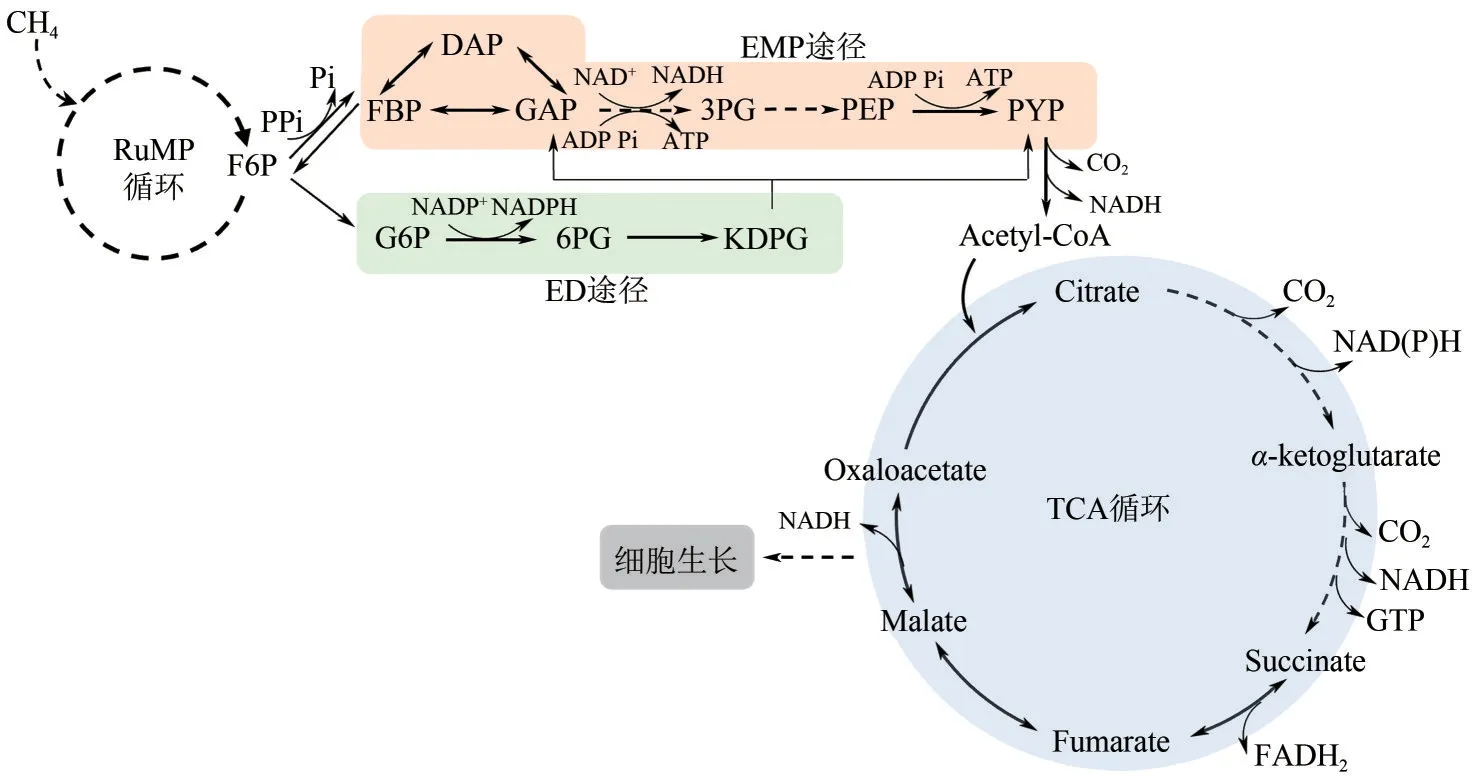
图1 好氧性嗜甲烷菌的底物水平磷酸化途径
在不同类型的好氧性嗜甲烷菌中,EMP 和ED途径略有不同。Ⅰ型嗜甲烷菌Methylomicrobium alcaliphilum20Z的转录组分析表明编码糖酵解途径酶的转录本丰度比ED途径高2~10倍,细胞中75%的丙酮酸来自PPi介导的EMP途径,而仅有25%来自ED 途径[24]。13C 标记[26]和基因组尺度代谢模型模拟[27]均表明EMP途径在Ⅰ型嗜甲烷菌Methylomicrobium buryatense5GB1C 的代谢中起主导作用,其能量代谢分析表明,当调小EMP与ED的通量比时,细菌生长速度会因能量失衡急剧下降。相比于EMP途径,ED 途径具有产能速率快的优势,对维持M.buryatense5GB1C的生长亦至关重要[16],但其在维持M. buryatense5GB1C正常生长和功能代谢方面的机制尚未被解析。X 型嗜甲烷菌Methylococcus capsulatusstr. Bath的基因组代谢模型预测显示ED途径是主要的碳同化途径,在0.37h-1的最优生长条件下,ED与EMP的通量比率最高可达10.9∶1[28]。
1.1.2 TCA循环
TCA循环是微生物体内高效的产能代谢通路,也是能量代谢的枢纽,好氧微生物中约95%的ATP来自TCA循环和氧化磷酸化[29]。由于好氧性嗜甲烷菌能够从还原型一碳化合物的氧化过程中获得能量,因此其TCA循环产生的能量被认为主要用于生物合成[30]。
在Ⅰ和Ⅹ型嗜甲烷菌中,TCA循环与EMP和ED途径的耦联是通过后者的终产物丙酮酸氧化脱羧形成的乙酰辅酶A实现(图1)。核心代谢物的13C标记表明,当M. buryatense5GB1以甲烷作为唯一的碳源和能源时,TCA循环约占苹果酸从头合成总通量的45%,这对于维持菌体生长至关重要[23];当以甲醇为碳源时,此时TCA循环主要在从头生物合成过程中发挥重要作用[31]。此外,M.buryatense5GB1中存在将α−酮戊二酸转化为琥珀酰辅酶A 的α−酮戊二酸脱氢酶复合体、α−酮戊二酸铁氧还蛋白氧化还原酶和α−酮戊二酸脱羧酶,编码三种酶的基因表达水平与其他TCA循环基因相似[30],但M. buryatense5GB1的TCA循环通量微弱,仅占细胞总能量产量的20%左右[26]。M. alcaliphilum20Z和Methylosinus trichosporiumOB3b中参与TCA循环的苹果酸脱氢酶(Malatedehydrogenase,MDH)的体外酶动力学分析表明,前者更倾向于催化苹果酸盐氧化生成草酰乙酸(Oxaloacetic acid,OAA)从而满足其对耐盐渗透保护剂天冬氨酸的需求,而后者对草酰乙酸的还原效果较好[32]。Ⅱ型嗜甲烷菌M. trichosporiumOB3b 是利用丝氨酸途径形成C2和C3化合物作为初级中间代谢物实现甲烷的碳同化,通过草酰乙酸和苹果酸(Malate)与TCA循环相耦联,与I型嗜甲烷菌相比,有较高碳通量的TCA循环[25]。苹果酸脱氢酶在不同类型好氧性嗜甲烷菌产生必要生物合成代谢物的特定途径中很好地适应了它的代谢作用。此外,两种MDH的生化特性也反应了在嗜甲烷菌中TCA 循环主要完成合成代谢功能[30,32]。而Ⅹ型嗜甲烷菌M. capsulatusBath的TCA循环并非在甲烷氧化条件下进行,由于缺乏实验证据,尚无法对其TCA循环进行推测和分析[17]。
1.2 氧化磷酸化
目前认为好氧性嗜甲烷菌的生物氧化模型由NADH脱氢酶、细胞色素bc1型复合体和氧依赖末端电子受体组成[33]。好氧性嗜甲烷菌利用可溶的细胞质MMO(sMMO)或颗粒状的膜相关MMO(pMMO)实现甲烷氧化。相比于sMMO,pMMO 对甲烷有着较高的亲和力,同时参与甲烷转化和辅酶再生过程。pMMO 可能通过醌池与细胞色素bc1复合体上的电子传递链耦合,电子经过NADH脱氢酶和醌池传递至pMMO,但pMMO的生理电子供体尚未被解析[34−35]。pMMO催化的甲烷氧化过程存在三种可能的电子传递模式。① 氧化还原臂模式:NADH经过电子传递链的复合体Ⅰ生成泛醌(UQH2)作为电子供体驱动甲烷氧化,甲醇脱氢酶通过细胞色素c将电子直接传递至复合物Ⅳ,产生质子动力和ATP;② 直接耦合模式:以细胞色素c作为甲烷氧化的电子供体,甲醇脱氢酶直接将电子传递给pMMO;③ 向上电子转移模式:甲醇氧化产生的电子发生从细胞色素c到UQH2的反向电子流动,部分驱动甲烷氧化(图2)[36−37]。

图2 好氧性嗜甲烷菌的甲烷氧化过程的三种电子传递模式
目前,主要基于基因组尺度代谢模型的通量平衡分析研究好氧性嗜甲烷菌甲烷氧化过程,这为揭示不同类型好氧性嗜甲烷菌的电子传递机制提供了理论指导。Ⅰ型嗜甲烷菌M. buryatense5GB1 的甲烷氧化由甲醇氧化提供电子,来自NADH衍生的电子驱动的甲烷氧化仅占20%,M. alcaliphilum20ZR以细胞色素c为甲烷氧化的电子供体时能够获得最优的生长速率[19,38]。X型嗜甲烷菌M. capsulatusBath虽然能以直接耦合或向上电子转移两种模式驱动甲烷氧化,但电子传递效率较低[39]。此外,Ⅱ型嗜甲烷菌Methylocystis hirsutaCSC1 和Methylocystissp.SC2 的甲烷氧化是与呼吸链中复合体I 相耦合的氧化还原臂模式[40],该模式也有助于M. trichosporiumOB3b 和Methylocystis parvusOBBP 在甲烷氧化时获得最高的氧气/甲烷消耗比[36,41]。以上结果表明,好氧性嗜甲烷菌的甲烷氧化效率与天然电子传递速率相耦联,但由于基因组尺度代谢模型存在局限性和不确定性,相关偶联模式仍需整合代谢工程进行探究。
2 好氧性嗜甲烷菌中能量供给与碳/氮代谢
2.1 能量供给与碳代谢
好氧性嗜甲烷菌利用甲烷和甲醇为碳源生长时,生长速率相似,但具有显著的代谢差异。Fu等[31]利用代谢组学和13C 同位素标记对M. buryatense5GB1在甲醇上生长的核心碳代谢进行了研究,发现与甲烷相比M. buryatense5GB1的TCA 循环是不完整的,其EMP与ED途径的通量比减小,丝氨酸循环的碳通量和甲酸盐的分泌显著增加。Sugden等[42]比较了M. albumBG8以甲烷和甲醇为碳源生长的转录组和代谢组特征,结果表明,在甲醇培养下M. albumBG8 的ED 途径和氧化戊糖磷酸途径(pentose phosphate pathway,PPP)基因表达显著上调,TCA循环的代谢物含量降低,NADH 脱氢酶基因表达显著下调。Nguyen 等[43]研究发现在甲醇上生长时M. alcaliphilum20Z的RuMP途径通量较甲烷显著降低,四氢甲烷蝶呤途径(Tetrahydromethanopterin,H4MPT)和四氢叶酸途径(Tetrahydrofolate,H4F)通量显著增加,部分丝氨酸循环的基因表达上调。以上研究表明,当碳源由甲烷切换至甲醇时,好氧性嗜甲烷菌氧化甲醇产生的一个电子直接进入电子传递链生成ATP,其通过调控与能量供给相关的碳代谢的通量分布和基因表达水平减少其他代谢途径的NADH和ATP生成(如底物水平磷酸化途径、甲酸脱氢酶和NADH 脱氢酶),维持胞内的氧化还原的平衡[37]。此外,甲醛的同化和氧化可能是一个灵活的代谢节点(图3),在甲醇培养下H4MPT 途径和部分丝氨酸循环代谢活性的提高,不仅缓解了甲醛积累对好氧性嗜甲烷菌的毒性,还为C1底物高效转化为乙酰辅酶A提供了一种替代策略[44]。

图3 好氧性嗜甲烷菌的碳代谢
好氧性嗜甲烷菌转化1mol甲烷消耗1.1~1.5mol的氧气,同时需要2mol电子和2mol质子的参与。因此,甲烷氧化效率与CH4/O2比以及能量供给水平相关。Hu 等[45]分析了不同CH4/O2的供气比对M. buryatense5GB1生长和基因转录水平的影响,发现当CH4/O2供应摩尔比为0.93时最有利于M. buryatense5GB1的生长,其胞内的NADH/NAD+值比0.58 和5.24 高,丙酮酸浓度和pMMO 酶活性达到最高,EMP 途径和TCA循环相关基因表达上调。在最佳CH4/O2比的培养条件下,好氧性嗜甲烷菌的底物水平磷酸化途径基因的高效表达为pMMO 提供了充足的还原力,从而提高了甲烷的氧化效率和胞内的碳通量,促进细胞生长。Tentori 等[46]研究了在底物限制条件下M. albumBG8转录组水平的变化,发现在甲烷限制和氧限制下分别筛选到444 和282 个差异表达基因(DEGs),这些DEGs 主要富集在能量生产和转换的代谢通路。Gilman 等[47]研究表明在氧胁迫下M. buryatense5GB1C调控与电子传递链和氧化还原反应相关基因的表达水平,保持发酵和呼吸代谢相结合的最佳代谢状态。
基于好氧性嗜甲烷菌在不同碳源和CH4/O2比培养下转录组学和代谢组的研究,明确了其能量供应与碳代谢通量的互作关系,为理性改造好氧性嗜甲烷菌的碳流和能量流生产高还原性化合物提供了丰富的基因靶点。
2.2 能量供给与氮代谢
好氧性嗜甲烷菌能利用硝酸盐、氯化铵、尿素等氮源进行生长[48],在不同的氮源培养下其生物能供给具有不同特点。Sugden等[42]研究表明相比于硝酸盐,以氯化铵为氮源时,M.albumBG8的氧化磷酸化和TCA循环途径有较多转录本和代谢物,羟胺脱氢酶(haoAB)、多药与毒物外排家族和ABC 型多药物转运系统等外排泵相关的基因表达上调。高水平的能量供给可能有助于菌株快速解除羟胺积累对细胞的毒性,促进细胞的生长和代谢。
嗜甲烷菌有功能性完整的固氮系统,包括固氮结构基因和调控基因[19,49](图4)。Cui等[50]研究了自然湿地中挺水植物根部的固氮作用,发现补充CH4(体积分数5%)能显著促进挺水植物根系固氮,后续基于cDNA的nifH基因测序分析表明,Methylosinus(Ⅱ型嗜甲烷菌)的固氮作用促进了挺水植物根系中CH4氧化依赖的氮固定,验证了好氧性嗜甲烷菌在自然湿地中减少CH4排放和固定N2促进植物生长的潜在作用。生物固氮是高耗能过程,一分子氮气还原成两个氨分子至少需要8个电子和16个ATP[51],充沛的能量供给网络是保障好氧性嗜甲烷菌高效固氮和维持正常生长代谢的必要条件。基于转录组测序的好氧性嗜甲烷菌的氮代谢特征分析表明其固氮能力与能量供给息息相关,也为全面了解好氧性嗜甲烷菌的固氮功能奠定了基础。Guo 等[52]分析了转录因子NifA对M. buryatense5GB1固氮作用的调控,发现与NifA 缺失突变体相比,野生菌株中编码固氮酶结构、固氮酶辅因子生物合成和电子传递的基因显著上调,表明NifA不仅在固氮酶的组成和表达中发挥重要作用,还能调控能量供应,从而促进嗜甲烷菌对氮气的固定。Hu 等[45]研究发现当碳氧原子供应比为0.93时,M. buryatense5GB1的生物固氮活性被激发,其与生物固氮和能量代谢相关的基因显著上调。
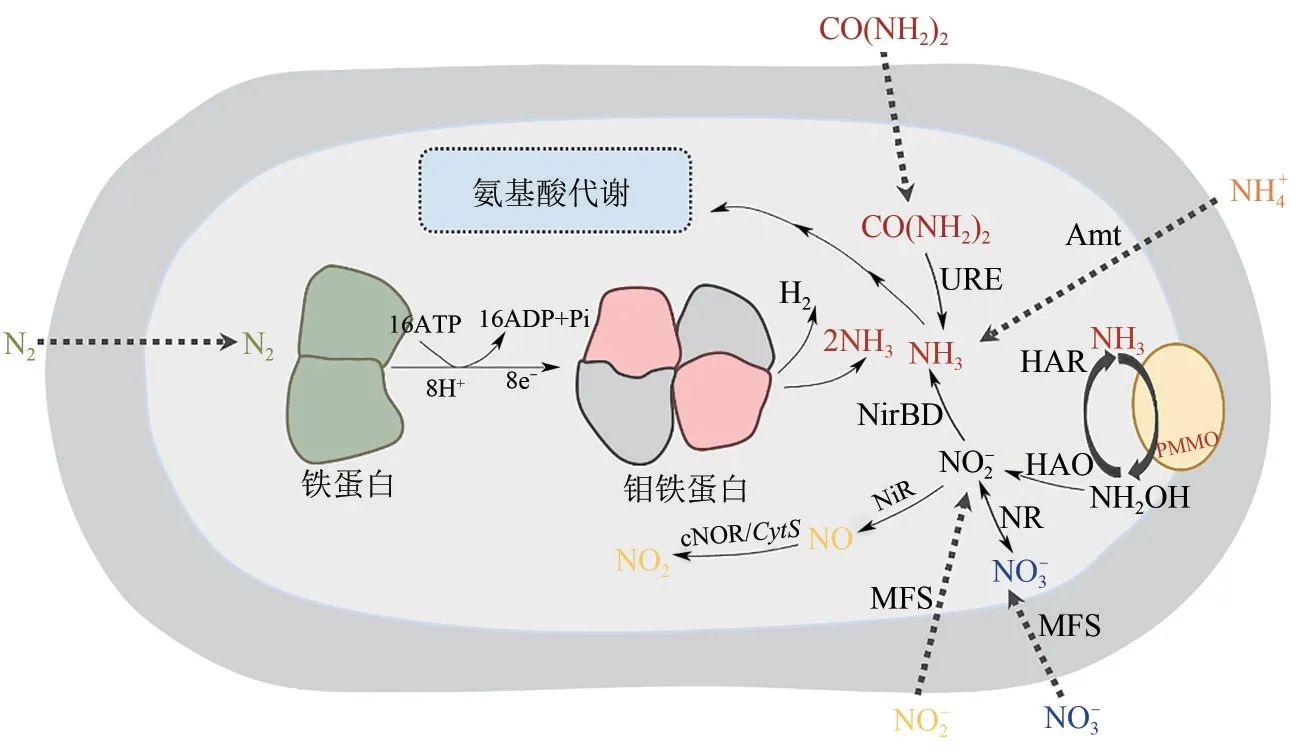
图4 好氧性嗜甲烷菌的氮代谢
目前,关于好氧性嗜甲烷菌固氮功能的研究相对较少,其固氮级联调控机制、固氮体系与能量供给的匹配关系均需要深入研究,以实现好氧性嗜甲烷菌高效固定氮气进行生长和代谢。
3 结语
现阶段,基于基因组尺度代谢网络模型、高通量组学分析技术和代谢工程改造等工具的相关研究初步探索了好氧性嗜甲烷菌的能量代谢与碳−氮代谢之间的协同调控。以上研究表明,围绕好氧性嗜甲烷菌生物能的强化和再分配,建立能量供给与目标代谢流的动态关联,为有效克服关键代谢瓶颈,提高好氧性嗜甲烷菌的甲烷氧化效率和固氮能力提供思路和方法。然而,目前好氧性嗜甲烷菌中pMMO的生理电子供体尚未确定,有关甲烷氧化机制的实验验证至今也未见报道,难以通过人工策略有效地强化甲烷的氧化过程。此外,利用代谢工程方法验证基于基因组尺度代谢网络模型的碳−氮代谢通量平衡分析的研究相对较少。因此,强化好氧性嗜甲烷菌的能量供给网络仍然面临诸多问题和挑战。
未来,对于好氧性嗜甲烷菌的能量和还原力供给方面,可以研究胞内底物水平磷酸化相关途径的能量供给脉络,优化能量代谢路径,强化产能效率。同时,借助胞外能量来源,构建基于生物-光敏剂杂化系统的胞外人工电子传递路径,为甲烷单加氧酶提供额外的电子,提高好氧性嗜甲烷菌的甲烷氧化效率。还可以补充以木质纤维素为原料的生物质糖辅助碳源,进一步强化能量流与碳流。探究碳-氮代谢网络的调节及生物能供给强化,为加快好氧性嗜甲烷菌实现高效转化甲烷和氮气生产高附加值化学品提供了可行的研究策略。

