模拟煤炭气化废水中苯酚的微生物降解
付佳,谌伦建,徐冰,2,华绍烽,李从强,杨明坤,邢宝林,2,仪桂云,2
(1 河南理工大学化学化工学院,河南省煤炭绿色转化重点实验室,河南 焦作 454003;2 煤炭安全生产与清洁高效利用省部共建协同创新中心,河南 焦作 454003)
煤炭气化是煤炭清洁利用的一种重要方式[1−2],但气化产生的废水可能对环境造成污染[3]。苯酚是固定床气化废水中的主要有机污染物之一[4],其自然降解性差[5],含苯酚及其衍生物的废水大量排放将导致生态环境日趋恶化,严重危害水生生物、人类以及动植物安全[6−7],故含酚废水的处理受到广泛关注和研究。
含酚废水的主要处理方法有物理法、化学法和生物法等三大类[8−9],具体的技术手段包括吸附法、膜分离技术、溶剂萃取法、高级氧化法、电化学处理法、光催化法以及生物降解技术等[10−16]。物理法和化学法处理工艺较复杂,费用昂贵,易造成二次污染[17]。生物降解技术具有经济性好、效率高、环境友好等特点,是目前较为成熟的水处理手段之一[18]。有研究表明假单胞菌属(Pseudonomonassp.)[19]、芽孢杆菌属(Bacillussp.)[20]、不动杆菌属(Acinetobactersp.)[21]、红球菌属(Rhodococcussp.)[22]、放线菌的诺卡氏菌(Nocardiasp.)[23]和真菌的酵母菌属(Yeastsp.)[24]等具备降解苯酚的能力。微生物对苯酚的降解受酸碱度、温度、苯酚浓度和重金属种类及其含量等因素的影响[25]。当前大多研究涉及的废水成分简单,组成相对稳定,但实际煤化工废水,尤其是煤气化废水,不仅含有苯酚、萘等多种难降解有机污染物,还含有重金属[26]、氨氮等无机污染物[27],因此煤气化废水的微生物处理更为复杂,培养驯化适于煤化工废水的高效降解菌株对污染水的治理尤为重要。
Panigrahy等[28]从焦化废水中分离出NS1细菌,经90h处理,该菌株几乎可完全降解1500mg/L的苯酚。叶子兰等[29]从某化工厂废水中分离出Y_1细菌,经36h处理,苯酚浓度从1100mg/L降至110mg/L,其降解率可达90%。Abarian等[30]研究了扎兰德煤焦油矿的苯酚降解菌的生长情况,并驯化筛选出的菌株P42和P53能够降解1800mg/L的苯酚。上述研究均表明相关环境样本可以作为煤化工废水生物修复目的菌株的来源。
基于此,本文以煤气化废水和焦化废水为菌源,以苯酚为单一碳源,经多次驯化,筛选了2种降解苯酚的好氧菌,考察温度、pH、摇床转速、重金属离子等对菌株降解苯酚的影响,探讨苯酚的微生物降解机理,并研究模拟煤炭气化废水的微生物修复效果,研究成果可为煤气化废水微生物修复用工程菌的驯化筛选、生长特性及废水的净化修复研究提供理论依据。
1 材料和方法
1.1 材料
菌源取自某焦化厂废水和气化厂废水。苯酚,分析纯,天津大茂化学试剂厂。实验用水为无菌水,实验用无机盐培养基、微量元素溶液及牛肉膏蛋白胨的组成如下。
无机盐(MSM)培养基的组成:K2HPO40.5g/L、KH2PO40.5g/L、NaCl 0.2g/L、FeSO4·7H2O 0.01g/L、MgSO4·7H2O 0.5g/L、CaCl20.1g/L、MnSO40.01g/L、NH4NO31g/L。
微量元素溶液的组成:FeSO4·7H2O 1g/L、MgSO41g/L,并用NaOH及HCl调至pH为7.0±0.1。
牛肉膏蛋白胨(LB)培养基的组成:牛肉膏3.0g/L、蛋白胨10.0g/L、NaCl 5.0g/L,固体培养基添加琼脂粉15~20g/L。
模拟煤炭气化实验用煤为新疆烟煤,模拟气化实验的步骤:称取400g粒径为5~10mm的新疆烟煤煤样于固定床气化炉的气化室内,在常压条件下,900℃气化4h,水蒸气的流量为10mL/min,生成的煤气经去离子水洗涤后放空。气化结束后,收集洗涤水,并在4℃冰箱中保存备用。
1.2 苯酚降解菌的驯化、分离和纯化
首先,分别取焦化废水(JHFS)和气化废水(QHFS)样品各10mL,加入到苯酚含量为500mg/L的无机盐培养基中,在pH为7.0、摇床转速160r/min、30℃条件下培养,然后以10%的转接量分别接种到苯酚含量为800mg/L、1000mg/L、1200mg/L、1500mg/L、2000mg/L 的无机盐培养基中,培养条件同上,取最后一轮富集液配制成10−1、10−2、10−3……10−8梯度的稀释液,再取10−6、10−7、10−8稀释液各200μL涂布在含苯酚无机盐固体培养基平板上进行培养,观察菌落的生长情况,挑选清晰可见的单菌落,利用LB固体培养基进行多次划线分离纯化,并对这些菌株进行编号,图1是菌株驯化分离的流程。将纯化好的菌株经LB 液体培养基活化培养后,按10%接种量接种到含500mg/L苯酚的无机盐培养基进行苯酚降解实验,48h后取样测定苯酚含量的变化,选取降解效果最佳的菌株进行鉴定。
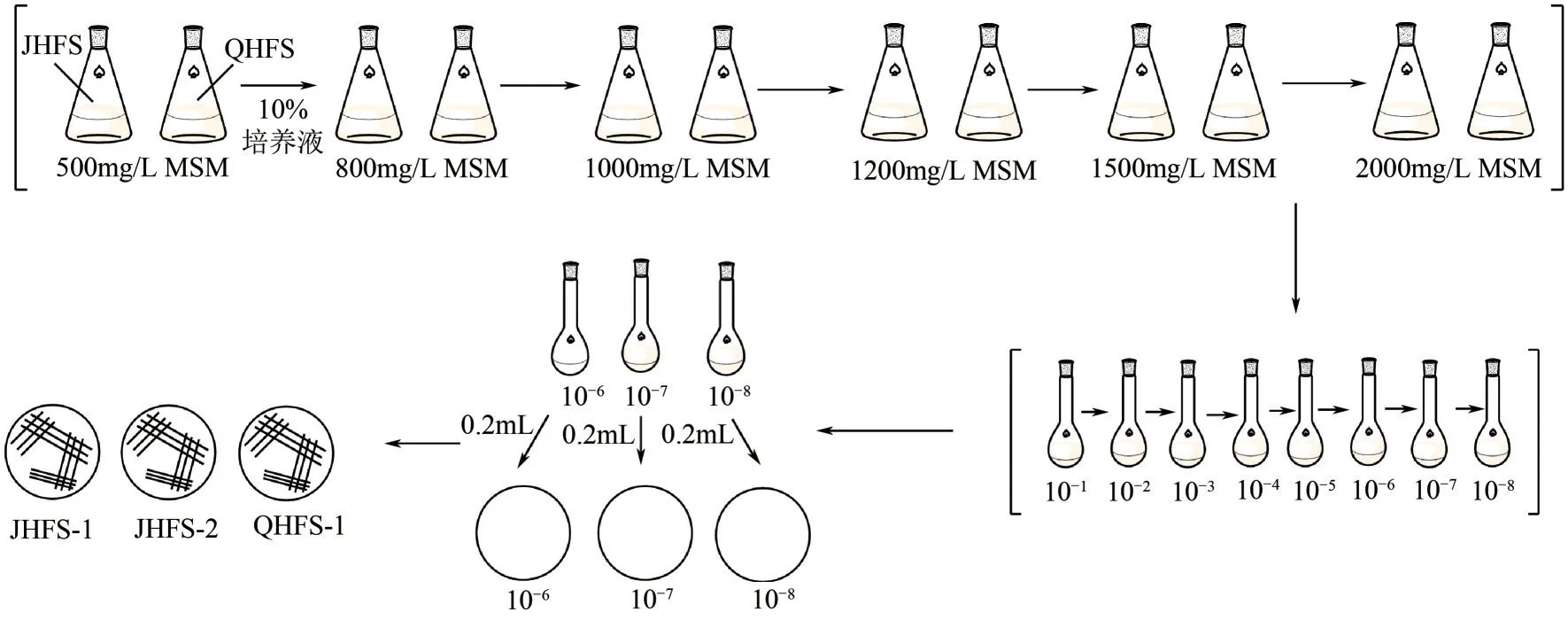
图1 苯酚降解菌的驯化分离流程
1.3 苯酚降解菌的鉴定
根据16S rDNA 基因序列分析,结合形态学、生理生化特征等对筛选到的苯酚降解菌进行鉴定。首先在LB 固体培养基上对菌株进行平板划线,于30℃恒温培养24h后观察菌落形态特征。挑取少量菌体进行染色,并利用光学显微镜观察菌体形态,参考《常见细菌系统鉴定手册》对菌株进行生理生化特征分析。同时,对筛选出的菌株进行16S rDNA 测序鉴定,根据测定结果,采用N−J法(MEGA7.0)进行序列比对,并构建系统进化树。
1.4 苯酚标准曲线的绘制
通过紫外-可见分光光度计(GE,UV−7000,USA)测定在270nm处0~150mg/L苯酚的吸光度值,根据浓度和吸光度值绘制苯酚标准曲线,拟合方程为y=0.0151x+0.0086,R2=0.9998。根据标准曲线方程,计算待测溶液中的苯酚含量。
1.5 苯酚的降解
1.5.1 种子液的制备
从LB 固体平板上挑取降解菌JHFS−1 的单菌落,并将其接种到LB 液体培养基中,在pH=7.0、160r/min、35℃条件下孵化过夜,然后离心收集菌体,用pH=7.4的磷酸盐缓冲溶液(PBS)洗涤,PBS洗涤后的菌体制成OD600=1.0±0.1种子液,用于后续降解苯酚。
1.5.2 实验条件对JHFS−1降解苯酚的影响
本部分实验选用OD600=1.0±0.1 的JHFS−1 为初始菌液,初始培养条件为:接种量=10%、苯酚初始浓度500mg/L、pH=7.0、温度35℃、转速160r/min,采用单因素变量法研究不同苯酚初始浓度、温度、pH、接种量、摇床转速、NaCl浓度和重金属离子对JHFS−1降解苯酚能力的影响。
1.6 降解中间产物的检测
为研究苯酚的微生物降解途径,实验过程中需要对降解中间产物进行检测。采用一定量的二氯甲烷萃取代谢物,经0.22μm滤膜过滤后,用气相色谱-质谱联用仪(GC−MS,Agilent,890A−5975C,USA)进行分析。色谱柱为DB−WAX(30.0m×250μm,0.25μm),扫描质量范围为35~500u(1u≈1.66×10-27kg)。采用Thermo Scientific Nicolet iS20红外光谱仪,在4000~400cm−1的扫描范围内对冷冻干燥的中间产物样品进行傅里叶变换红外吸收光谱(FTIR)分析。
1.7 苯酚降解菌对煤气洗涤水的降解
实验用模拟气化废水取自实验室进行的新疆烟煤的模拟固定床气化,微生物降解煤气洗涤水的实验装置同文献[31]。将一定量的苯酚降解菌接种于煤气洗涤水中,空气通气流量为20mL/(min·L),反应温度为37℃。每隔一定时间取一定量的水样,采用elementar vario TOC select 总有机碳(TOC)分析仪测定煤气洗涤水中的TOC值。
2 结果与讨论
2.1 苯酚降解菌株的驯化、筛选及鉴定
焦化废水(JHFS)和气化废水(QHFS)菌源经苯酚浓度为500~2000mg/L 的MSM 培养基驯化,结果如图2所示。由图2可知,随着苯酚初始浓度增加,溶液中苯酚的降解时间延长,当苯酚初始浓度为500mg/L时,经过24h基本上完全降解;初始浓度增加到1000mg/L时,降解时间至少需要72h;初始浓度为1200mg/L时,降解时间至少162h,说明初始浓度增大,在菌株及其他条件不变的情况下苯酚降解越困难。从焦化废水和气化废水中菌株驯化效果来看,焦化废水中菌株降解苯酚的速度明显快于气化废水,尤其是在高苯酚浓度条件下,焦化废水中的菌株降解效果显著优于气化废水中的菌株。
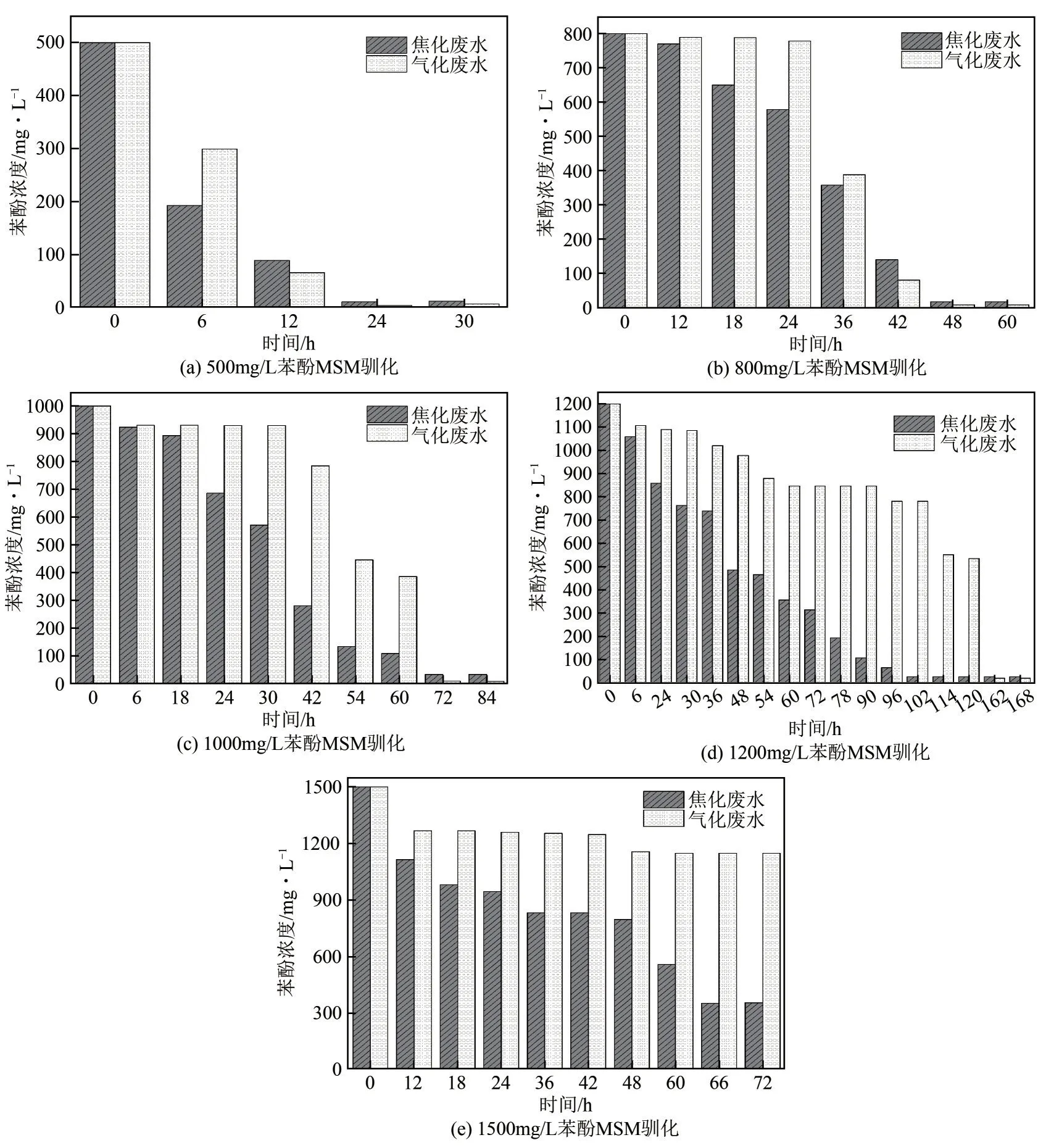
图2 JHFS和QHFS在不同苯酚浓度条件下的驯化阶段
为筛选苯酚高效降解菌种,将2 种废液用500mg/L苯酚MSM培养基进行进一步驯化。经过3次48h驯化后,焦化废水和气化废水中菌株对苯酚的降解率均可达到95%左右,如图3所示。
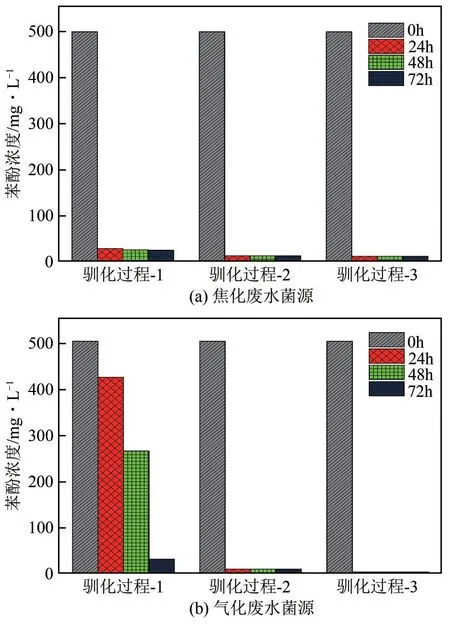
图3 3次驯化过程中焦化废水菌源和气化废水菌源对苯酚的降解效果
经过分离筛选,从焦化废水得到两株单菌落JHFS−1、JHFS−2,从气化废水得到1株单菌落QHFS−1。分别将3株菌株和混合菌按1∶1∶1投加到苯酚浓度为500mg/L、800mg/L、1000mg/L 的MSM 培养基中进行培养,测定其对苯酚的降解效果,并根据生长量绘制其生长曲线,如图4和图5所示。
由图4可知,菌株JHFS−1、QHFS−1在实验条件下具有优良的降解效果,对1000mg/L苯酚的降解效果可以达到95%左右。混合菌对800mg/L苯酚的降解率可达80%以上,但对超过800mg/L的苯酚降解率仅10%左右。JHFS−2对苯酚基本没有降解效果。

图4 3种菌株及混合菌株对苯酚的降解效果
从图5可知,菌株JHFS−1、QHFS−1生长曲线相似,经过短暂的延滞期(0~5h)后进入快速生长的对数生长期(5~29h),然后进入稳定生长期。JHFS−2生长曲线总体上与JHFS−1相似,但生长缓慢,OD600较小。
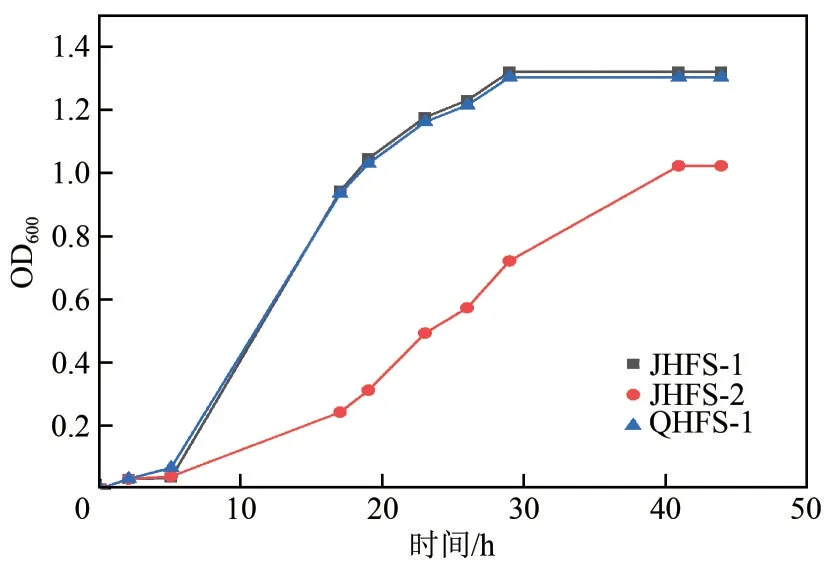
图5 菌株JHFS−1、JHFS−2以及QHFS−1的生长曲线(LB培养基)
将降解苯酚效果最好、菌株生长量最大的JHFS−1作为后续实验用菌株。经过LB 固体培养基培养24h后,菌株JHFS−1在LB平板上形成较小型菌落,菌落呈乳白色、圆形,表面有些许凸起(图6)。
图6 菌株JHFS−1在LB平板上形成的菌落
表1是菌株JHFS−1的生理生化试验结果。菌株JHFS−1的革兰氏染色反应、淀粉水解酶试验、甲基红试验、吲哚试验、硝酸盐还原试验、明胶液化试验等试验结果均为阴性,Voges−Proskauer(V−P)试验、氧化酶试验、过氧化氢酶试验结果均为阳性。
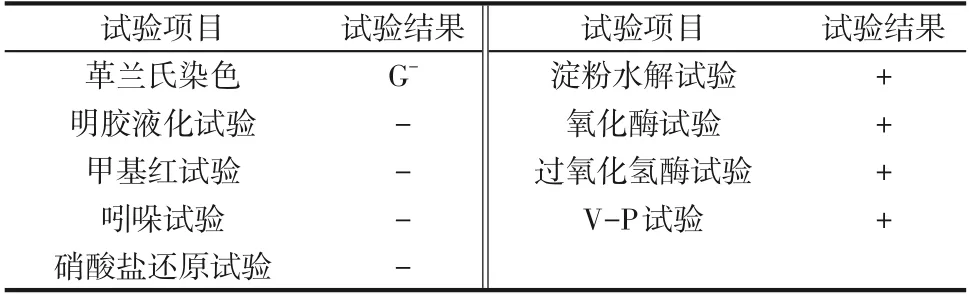
表1 菌株JHFS-1生理生化试验结果
对菌株JHFS−1的16S rDNA进行PCR扩增并进行测序,利用BLAST 进行序列相似性对比,鉴定所筛选的菌株为醋酸钙不动杆菌Acinetobacter calcoaceticus,该菌株基于16S rDNA 系统发育进化树如图7所示。
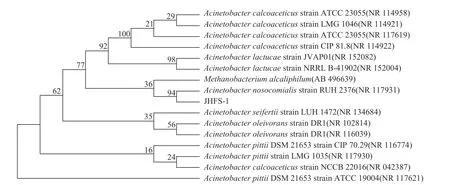
图7 基于16S rDNA 基因序列构建的菌株JHFS−1 系统发育树
2.2 影响JHFS-1降解苯酚的主要因素
2.2.1 苯酚初始浓度
图8是苯酚初始浓度与降解率之间的关系。由图8 可知,当苯酚浓度在100~800mg/L 范围内,经36h 后苯酚降解率均在90%以上;当苯酚浓度为1000mg/L 时,经过48h 后苯酚的降解率也可达到90.90%。从菌株生长情况看(图9),随着培养时间的延长,菌株的生长量增大,但苯酚浓度较低,最终的OD600 值也较低,可能是因为苯酚量不能满足菌株生长需要所致;当苯酚浓度过高(如超过1200mg/L),菌株仅在初始阶段有微量生长,且OD600 很低,可能是苯酚对菌株JHFS−1 发生毒害抑制作用影响其生长;最佳的苯酚初始浓度为500~800mg/L。
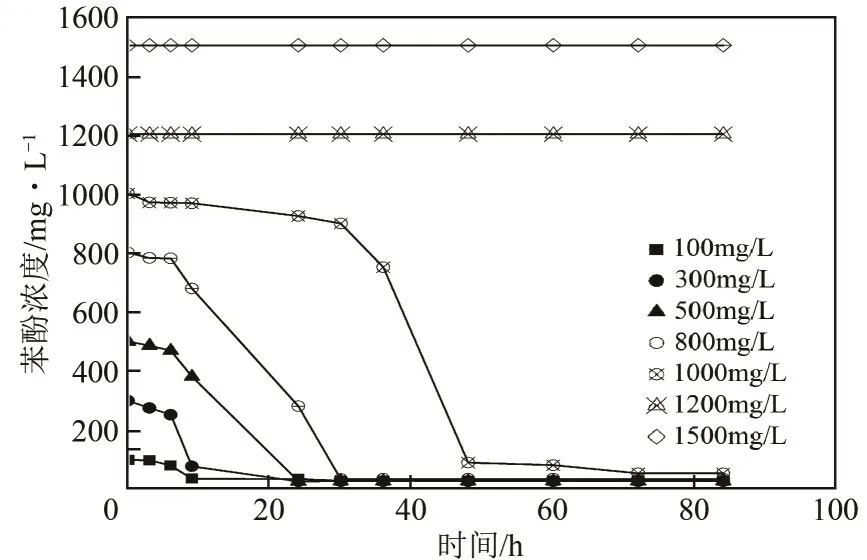
图8 苯酚初始浓度对JHFS−1降解效果的影响
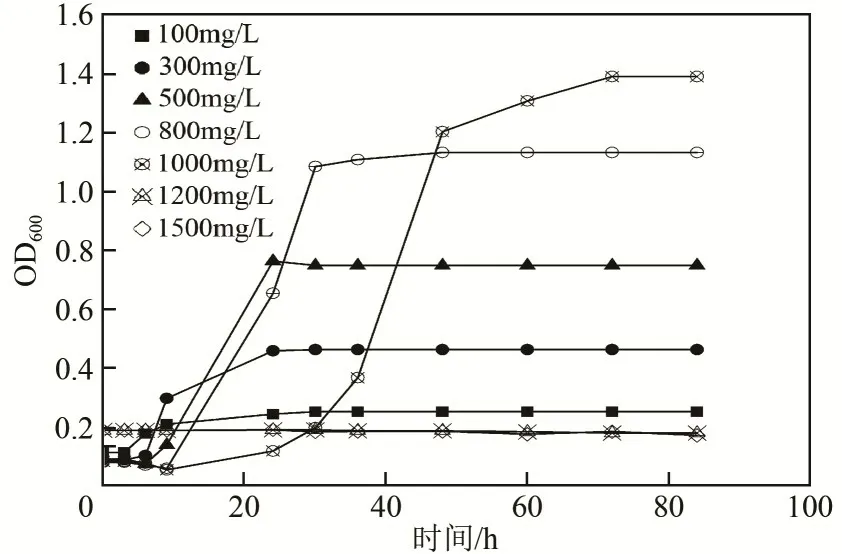
图9 苯酚初始浓度对JHFS−1生长的影响
2.2.2 温度
图10是环境温度与苯酚(初始浓度为500mg/L)降解率的关系。由图10可知,在温度低于45℃条件下,不同温度对应的苯酚降解率变化趋势一致,且在100h内其降解率均可达90%左右。但温度为30℃时降解速度最快,经过36h其降解率为90.93%,其次是38℃和35℃,说明该菌株降解苯酚的适宜温度为25~40℃,最佳温度30℃。
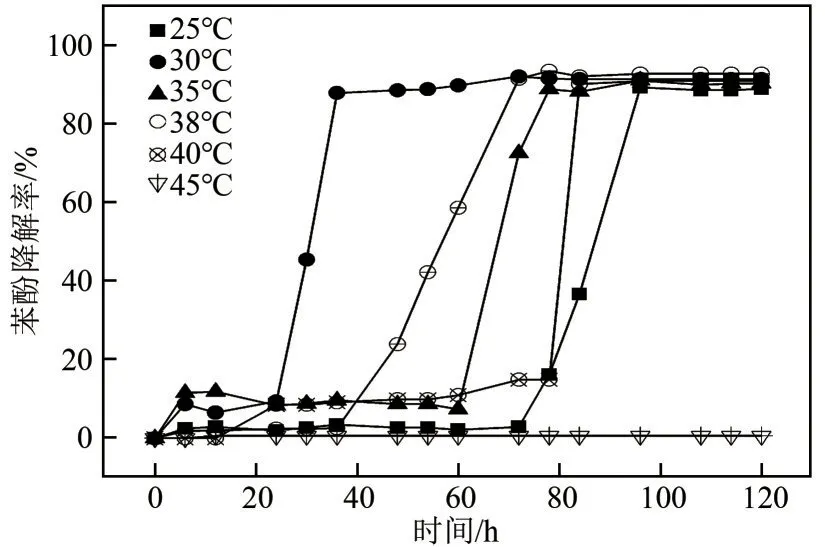
图10 温度对JHFS−1降解苯酚的影响
2.2.3 pH
实验考察了pH为4~9范围内JHFS−1对苯酚的降解效果,如图11所示。pH对该菌株降解苯酚的影响不大,在偏酸性(pH为4~6)条件下降解率为80%左右,pH 9.0时降解率最低也可达70.35%。

图11 pH对JHFS−1降解苯酚的影响
2.2.4 接种量
图12 是接种量与苯酚降解率的关系。由图12可知,在实验条件下除接种量1%以外,接种量对苯酚最终降解率影响不大,接种量为4%~16%范围内其降解率均在90%左右,但对降解效率有较明显影响。接种量为4%时,经过84h才能达到最大降解率(85.97%);接种量为13%时,只需54h时就达到最大降解率(89.55%);接种量为16%时,达到最大降解率所需的时间比接种量为13%时稍有延迟。1%的接种量基本上没有降解效果,可能是菌株量太少,且受到苯酚毒性抑制作用而不能生长。
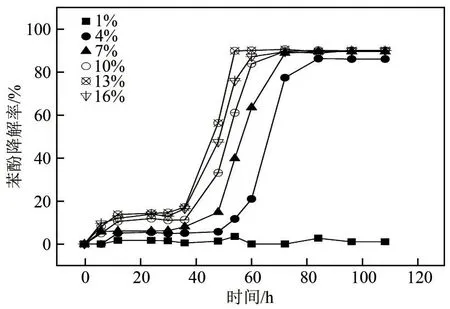
图12 接种量对JHFS−1降解苯酚的影响
2.2.5 摇床转速
由于培养筛选的菌株属于好氧菌,采用摇床为其提供所需氧分,摇床转速与苯酚降解率之间的关系如图13所示。由图13可知,摇床转速为40r/min时,JHFS−1 对苯酚没有降解效果,其余条件下苯酚的最大降解率基本上都在90%左右,说明摇床转速对苯酚的降解率影响不大,但对降解效率有一定的影响。当转速从80r/min 增加到120r/min 时,降解效率有显著提高,120r/min 与200r/min 的苯酚降解率和降解效率相差不大,可以认为最佳转速为120r/min。JHFS−1 菌为好氧菌,当摇床转速为40r/min时,供氧量满足不了JHFS−1菌对氧的需求,因此不能有效降解苯酚;随着摇床转速增加,溶解氧增多为菌株提供了良好的生长代谢环境,因而降解效果增强。
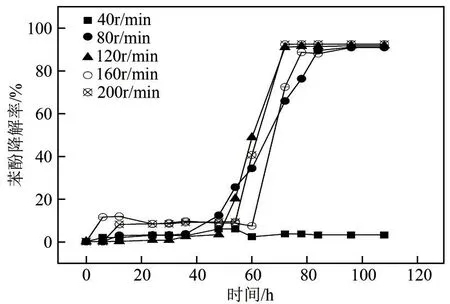
图13 摇床转速对JHFS−1降解苯酚的影响
2.2.6 NaCl浓度煤气化或焦化废水中均含有大量的盐,盐浓度较高会导致细胞内外渗透压的变化,微生物物质吸收过程受干扰阻断,甚至使微生物中毒,进而引起菌体死亡。选取NaCl作为盐类代表性物质,考察NaCl浓度对JHFS−1降解苯酚的影响,结果如图14所示。由图14可知,添加1%的NaCl时,苯酚的降解率最高,达64.69%,比不添加NaCl时降低了25.12个百分点;当NaCl 添加量增加到2%及以上,其降解率不足30%,说明NaCl对JHFS−1生长和降解苯酚有显著的抑制作用。
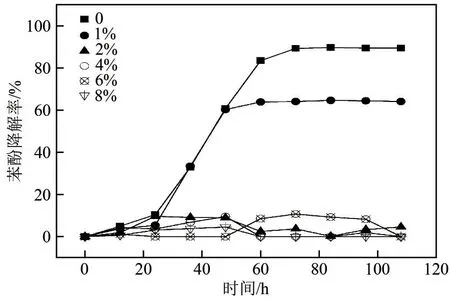
图14 NaCl浓度对 JHFS−1降解苯酚的影响
2.2.7 Cu2+和Mn2+浓度
微生物是利用其产生的酶催化污染物进行降解,某些金属离子是酶的激活剂,但也有部分金属离子会破坏酶的蛋白结构,进而使酶失去活性。煤气化或焦化废水中含有大量金属离子,选取煤气化废水中具有代表性的Cu2+、Mn2+为对象,探讨重金属离子对JHFS−1降解苯酚的影响。
图15是Cu2+、Mn2+对JHFS−1降解苯酚的影响。由图15(a)可知,Cu2+对JHFS−1 降解苯酚的影响主要是降低苯酚的降解效率:不含Cu2+时,达到最大降解率需24h,当含有Cu2+时,达到最大降解率需48h;同时,Cu2+浓度较低时,对苯酚的降解率影响不大,但当Cu2+浓度增加到100mg/L 时,苯酚降解率降低显著,经48h降解后其降解率仅为76.91%,说明Cu2+对JHFS−1 降解苯酚有一定的抑制作用。Mn2+对JHFS−1 降解苯酚具有一定的促进作用:Mn2+为50mg/L 时,菌株JHFS−1 对苯酚的降解率可达到94.22%;当Mn2+浓度为10mg/L、25mg/L、100mg/L时,经48h 降解,苯酚的降解率分别为92.11%、93.13%、93.26%,均比没有Mn2+存在时的降解率(92.03%)稍高。
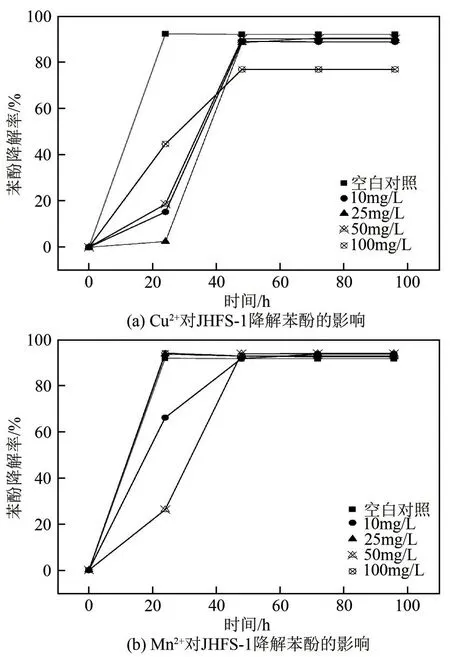
图15 重金属离子对JHFS−1降解苯酚的影响
2.3 JHFS-1降解苯酚机理
采用GC−MS、FTIR对JHFS−1降解苯酚的中间产物进行分析,根据中间产物变化推测其降解机理。
(1)JHFS−1降解苯酚中间产物的GC−MS分析
采用GC−MS 对苯酚不同降解时间的中间产物进行分析,经0h、24h、36h及48h降解后的总离子流图如图16 所示。质谱数据采用MS 数据库NIST11和保留时间进行定性,其主要代表性中间产物列于表2~表5。
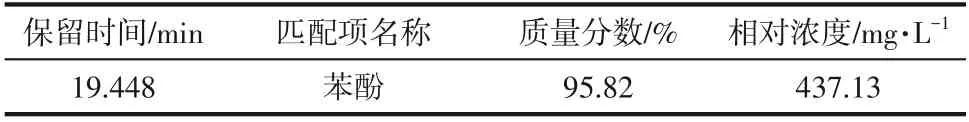
表2 苯酚降解0h过程产物
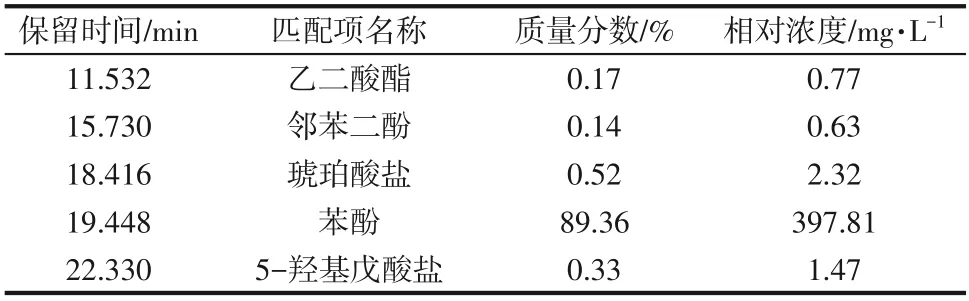
表3 苯酚降解24h过程产物

表4 苯酚降解36h过程产物
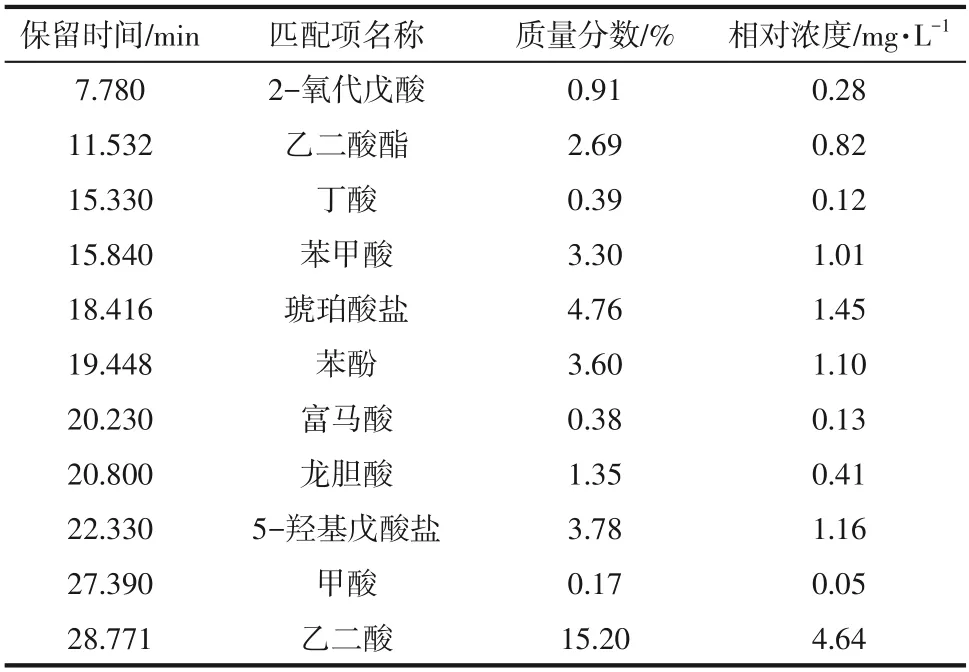
表5 苯酚降解48h过程产物
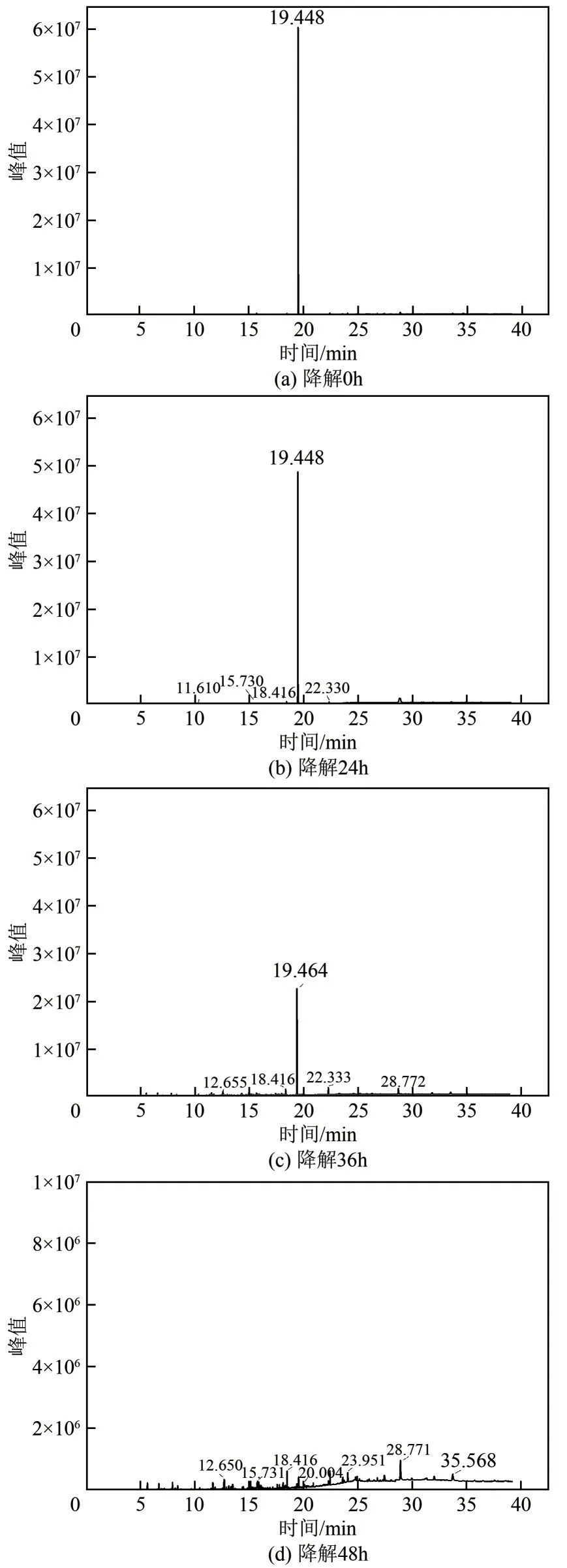
图16 JHFS−1降解苯酚的GC−MS总离子流图
图16(c)上停留时间11.532min、18.416min 和22.330min 分别对应为乙二酸酯、琥珀酸盐和5−羟基戊酸盐类物质,结合菌株的生长曲线(图5)可知,随着苯酚的降解,24~36h 相对浓度先呈现上升的趋势,随着反应进行至48h,菌株OD600值趋于稳定,表明菌株此时停止降解底物,过程产物会随着反应的停止而呈现下降趋势。因此,上述物质可能是苯酚降解的末端产物。
在苯酚经过24h降解的样品中,检测到邻苯二酚(对应停留时间为15.730min的峰),但在经过36h和48h降解的样品中没有检测到邻苯二酚,这表明该化合物是苯酚降解的初始中间产物。在降解48h时样品中检测到2−氧代戊酸、甲酸、乙二酸、丁酸和富马酸酯,这些产物是苯酚开环降解的产物。苯甲酸和龙胆酸可能为另一种降解途径的中间产物。
(2)JHFS−1降解苯酚的FTIR分析
图17是苯酚降解中间产物的FTIR 图谱,结合上述GC−MS分析结果,图17(a)中1385.32cm−1尖锐峰表示存在苯环(苯环拉伸),说明含有苯酚;图17(b)中1765.54cm−1尖锐峰表示存在羟基官能团,说明可能含有邻苯二酚等中间产物;图17(b)、(c)中1663.47~1664.08cm−1代表了C= = O 基团的存在,表明可能存在2-羟基黏糠酸半醛;图17(a)~(c)中3236.48~3237.39cm−1为不饱和的C—H 伸缩振动峰或者是—OH 伸缩峰位置,也表明有不饱和基团存在,可能为双键或炔烃或芳烃及羟基。

图17 苯酚降解中间产物的FTIR分析
(3)JHFS−1降解苯酚的机理
根据JHFS−1降解苯酚过程中间产物的GC−MS分析和FTIR 分析,微生物降解苯酚的可能途径如图18所示。其中,羟基化途径(如降解途径Ⅰ和Ⅱ)是主要途径,羧基化途径(途径Ⅲ)是次降解途,降解途径Ⅰ、Ⅱ的产物量积累较多且具有高度的同步性,表明两种途径共存,途径Ⅰ、Ⅱ是苯酚加羟基生成邻苯二酚后开环裂解,最终分别生成甲酸、丙酸、丁酸、乙二酸、琥珀酸和乙酰辅酶A。此外,从表5可以看出,只有在48h的样品中检测到苯甲酸。在降解36h时,降解途径Ⅰ、Ⅱ的产物积累随着反应进行达到高峰,由于产物积累,羟基化途径的降解速率受到抑制,这可能刺激了苯酚的第3种降解途径。由于苯甲酸的含量较低,且只存在于苯酚降解的后期,说明降解途径Ⅲ为次降解途径,途径Ⅲ将苯酚转化为苯甲酸,并进入苯甲酸降解路径。
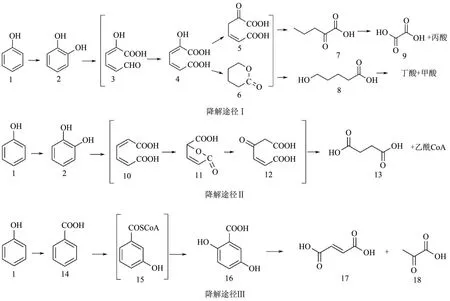
图18 JHFS−1降解苯酚的途径
2.4 JHFS-1对煤气洗涤水的降解效果
将JHFS−1游离菌株按照上述实验条件投加到模拟固定床气化煤气洗涤水中(TOC值为278.83mg/L),间隔一定时间取样,并测定水样的TOC值及菌株生长量的变化,结果如图19所示。从图19可以看出,在整个降解过程中TOC呈现下降趋势,经过JHFS−1降解72h,煤气化废水中TOC浓度降低为115.92mg/L,降解率达到58.43%,此后TOC 值基本保持不变。从菌株生长量(OD600)的变化曲线可以看出,随着处理时间的延长,JHFS−1 菌株逐渐消耗煤气化废水中的有机物,菌株也不断生长,经过72h降解后,细菌生长逐渐衰减,可能是溶液中有机物数量不足所致。菌株的生长趋势与煤气化废水中TOC的变化能较好地对应起来。另外,煤气洗涤水中含有的多种重金属离子可能影响菌株对有机污染物的降解,致使TOC 降解率不太高,但仍达到58.43%,研究也说明该菌株一定程度上可以处理有机和无机污染物共存的煤气洗涤水。
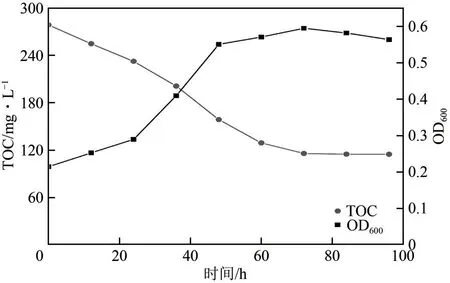
图19 JHFS−1对煤气洗涤水中TOC的降解及生长曲线
3 结论
(1)以焦化废水和气化废水为菌源,苯酚为唯一碳源,采用无机盐培养基进行培养驯化,驯化筛选出苯酚高效降解菌株JHFS−1,经生理生化实验分析和基因测序,确定JHFS−1 为醋酸钙不动杆菌(Acinetobacter calcoaceticus)。该菌株对苯酚(初始浓度为500mg/L)的降解率可达94.31%。
(2)根据苯酚降解中间产物的GC−MS 和FTIR分析,研究发现JHFS−1对苯酚的降解途径有3种:主要遵从羟基化途径,苯酚加羟基生成邻苯二酚,然后开环裂解;次降解途径为羧基化途径,苯酚羧基化生成苯甲酸,继续降解为富马酸和丙酮酸。
(3)JHFS−1 菌对模拟固定床气化煤气洗涤水中有机污染物具有较好的处理效果,TOC降解率可达58.43%。

