UBED与PEID治疗L5/S1椎间盘突出症的临床效果研究*
高 速,周 新,陆 慧△,袁 婷,权正学
(1.重庆大学附属江津医院骨科,重庆 402260;2.重庆大学附属江津医院呼吸与危重症医学科,重庆 402260;3.重庆医科大学附属第一医院骨科,重庆 400016)
腰椎间盘突出症(LDH)好发于L4/L5、L5/S1节段,以腰腿痛为主要临床表现。在保守治疗无效的情况下,通常需要考虑手术治疗。随着微创技术的不断发展,经皮内镜腰椎间盘切除术(PELD)已成为治疗LDH的首选术式[1]。根据手术入路不同,PELD又分为经皮椎间孔入路椎间盘切除术(PETD)与经皮椎板间入路椎间盘切除术(PEID)。然而,对于L5/S1椎间盘突出症,由于受到肥大横突及高位髂嵴的影响,经侧路椎间孔穿刺较为困难,因此PEID逐渐成为该节段微创治疗的主流术式[2]。SOLIMAN等[3]于2013年采用单侧双通道内镜下椎间盘切除术(UBED)治疗43例LDH,取得满意疗效。经过不断发展与改良,该技术日趋成熟,现已广泛应用于治疗各种腰椎退行性疾病[4]。UBED和PEID的手术入路、操作原理类似,虽然各自已被证实安全有效,但两者之间缺乏直接的对比研究报道。本研究回顾性分析了2020年1月至2021年6月重庆大学附属江津医院采用上述2种微创术式治疗56例L5/S1椎间盘突出症的临床疗效,现报道如下。
1 资料与方法
1.1 一般资料
选取2020年1月至2021年6月重庆大学附属江津医院的56例患者纳入研究,根据手术方式将其分为UBED组(26例)和PEID组(30例)。2组患者术前一般资料比较,差异均无统计学意义(P>0.05),见表1。本研究经重庆大学附属江津医院医学伦理委员会审核批准,并由患者或其家属签署知情同意书。纳入标准:(1)单节段L5/S1椎间盘突出症;(2)具有典型的腰腿痛或麻木症状,且症状与体征、影像学检查结果相符合;(3)经正规保守治疗至少3个月无效。排除标准:(1)腰椎动力位片提示伴有腰椎不稳或腰椎滑脱;(2)复发性或多节段LDH;(3)极外侧型LDH;(4)严重腰椎管狭窄;(5)既往有腰椎手术史。
1.2 方法
两组手术均由同一主刀医生完成,麻醉方式选择全身麻醉;手术体位均采用标准俯卧位,轻度屈髋屈膝以增加椎板间隙,腹部悬空。
1.2.1UBED组手术方法
C臂透视定位L5/S1椎间隙在正位片上的皮肤投影线及手术侧L5、S1椎弓根内缘连线,两线交点的头尾侧各约1.5 cm画横向手术切口线,通常头端为观察通道,尾端为工作通道。沿着切口线依次切开皮肤、皮下组织及腰背筋膜,逐级扩张并钝性分离软组织,构建观察通道和工作通道,观察通道置入关节镜系统,工作通道置入等离子射频电刀。再次C臂透视,确认两个通道的前方交点位置无误后,开始清理椎板间隙表面的软组织,显露同侧上下椎板及下关节突,交替使用镜下磨钻和枪钳去除部分L5椎板下缘、S1椎板上缘骨质,显露黄韧带头尾端附着点。仔细松解分离硬膜囊和黄韧带粘连后咬除黄韧带,暴露硬膜囊,沿硬膜囊及S1神经根外侧减压,必要时去除部分关节突关节内侧缘骨质,充分显露S1神经根,神经剥离子分离神经根周围软组织并仔细止血。经操作通道置入L型神经拉钩牵开神经根后用髓核钳摘除突出的椎间盘组织。减压完成后探查硬膜囊、神经根无受压,再次射频止血,纤维环破口皱缩成形。仔细检查见椎管内无活动性出血后撤出操作器械,逐层缝合筋膜及皮肤。
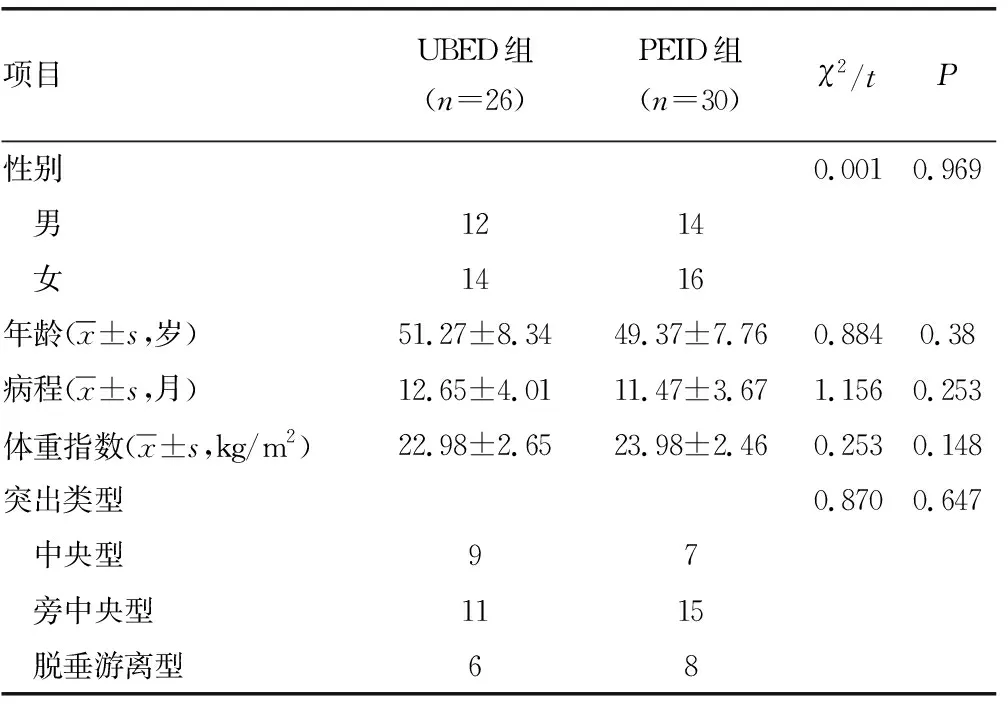
表1 术前两组患者一般资料比较
1.2.2PEID组手术方法
C臂透视定位L5/S1椎板间隙,以棘突中线旁开1.0~1.5 cm处作长约0.8 cm的纵形切口,切开腰背筋膜,置入铅笔头状的扩张导管至黄韧带表面,逐级扩张后安装工作套管。再次C臂透视,确认位置无误后,取出扩张管置入脊柱内镜系统,镜下以髓核钳和射频电极清理黄韧带表面的纤维脂肪组织。用篮钳在靠近下关节突下内缘处的黄韧带上咬开破口,工作套管顺势伸入黄韧带破口并紧贴下关节突内侧缘旋转进入椎管内,暴露硬膜囊及S1神经根,通过调整工作套管探查并摘除突出的髓核组织,确保神经根肩上及腋下充分松解,射频止血,纤维环破口皱缩成形。再次检查见S1神经根松弛、硬膜囊恢复搏动、椎管内无活动性出血后拔出工作套管,缝合切口。
1.3 术后处理
术后两组常规给予营养神经、缓解神经根水肿、止痛、护胃等处理;麻醉苏醒后开始指导患者行直腿抬高训练及腰背肌功能锻炼;术后第2天可佩戴腰围适当下床活动。若无特殊,术后3 d出院;术后1个月内避免弯腰负重及重体力活动。
1.4 观察指标
(1)围手术期指标:手术时间、术中出血量、术中C臂透视次数、住院时间。(2)术前、术后1 d、术后3 d血清肌酸激酶(CK)、C-反应蛋白(CRP)水平。(3)分别在术前、术后1周、术后1个月、末次随访时采用视觉模拟量表(VAS)评估腰腿痛改善情况;采用Oswestry功能障碍指数(ODI)[5]及日本骨科学会(JOA)评分评估腰椎功能恢复状况;末次随访时采用改良MacNab[6]标准评价临床疗效优良率,优良率=(优的患者例数+良的患者例数)/该组患者总例数×100%。(4)并发症发生情况。
1.5 统计学处理
2 结 果
2.1 两组一般临床指标比较
PEID组手术时间、术中出血量少于UBED组(P<0.05),但术中透视次数、住院时间比较,差异无统计学意义(P>0.05),见表2。

表2 两组一般临床指标比较
2.2 两组各时间点血清CK、CRP水平比较
两组术后1、3 d血清CK、CRP水平均较本组术前升高,差异有统计学意义(P<0.05);术后相应时间点组间比较,PEID组的上述血清学指标水平均低于UBED组,差异有统计学意义(P<0.05),见表3。

表3 两组各时间点血清CK、CRP水平比较
2.3 两组随访结果分析
所有患者术后均获得至少12个月随访,平均(13.6±1.6)个月。2组患者术后腰痛VAS评分、腿痛VAS评分、ODI、JOA评分均较术前明显改善(P<0.05),但相应时间点组间比较,差异无统计学意义(P>0.05),见表4。末次随访时按改良MacNab标准对临床疗效进行评定,UBED组优18例,良6例,可2例,差0例,优良率为92.3%;PEID组优21例,良5例,可3例,差1例,优良率为86.7%;2组优良率比较,差异无统计学意义(校正χ2=0.061,P=0.805)。

表4 2组患者手术前后腰痛VAS评分、腿痛VAS评分、ODI、JOA评分比较
2.4 2组并发症发生情况比较
UBED组的总体并发症发生率为11.54%(3/26),PEID组为16.67%(5/30),差异无统计学意义(校正χ2=0.027,P=0.870),见表5。
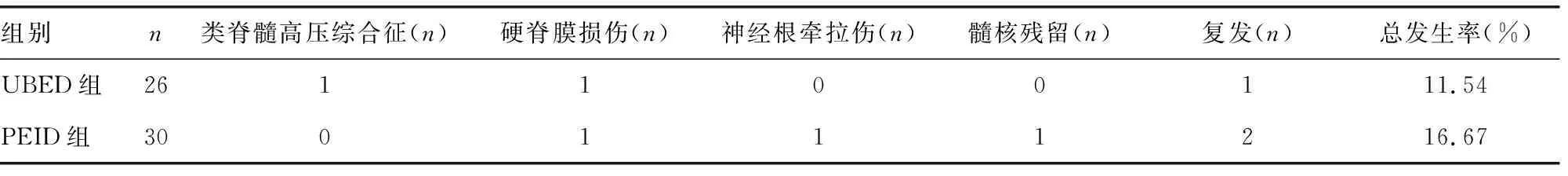
表5 2组并发症发生情况比较
2.5 UBED组典型病例
患者男,60岁,术前腰椎核磁共振成像(MRI)显示L5/S1腰椎间盘突出,伴左侧神经根受压;术后复查腰椎计算机断层扫描(CT)+三维重建显示突出髓核已有效摘除,椎板开窗大小合适,关节突关节保留完整。见图1。

A、B:术前腰椎MRI;C:术者通过双通道进行操作;D:探查见突出的髓核组织顶压S1神经根;E:髓核钳夹取突出的椎间盘组织;F:减压完成后的S1神经根;G、H:术后复查腰椎CT+三维重建。
3 讨 论
随着现代微创外科的快速发展,经皮脊柱内镜技术(PETD、PEID)逐渐替代传统开放手术,成为治疗LDH的首选[7]。在LDH好发的L5/S1节段,由于其解剖结构的特异性,椎间孔入路穿刺易受狭窄椎间孔、高位髂嵴及肥大横突的阻挡,而L5/S1椎板间隙恰好是各节段中最大的,因此,普遍研究认为PEID治疗L5/S1椎间盘突出症具有天然的解剖优势[8-9]。YAN等[10]通过回顾性分析153例L5/S1椎间盘突出症患者的临床资料,发现经椎板间入路和经椎间孔入路治疗L5/S1 LDH均可获得满意的临床疗效,但前者穿刺定位更快、手术时间更短、术中透视次数更少。UBED是近年发展起来的新兴脊柱微创技术,在治疗L5/S1椎间盘突出症时,UBED和PEID都是在水介质下通过后方椎板间隙入路行髓核摘除及神经根减压,虽然其操作步骤和手术原理类似,但两种微创术式在具体实施过程中却有其各自不同的临床特点。
本研究结果显示,两组术后各随访时间点的腰痛VAS评分、腿痛VAS评分、ODI和JOA评分均较术前明显改善(P<0.05),末次随访时按MacNab评分标准,2组手术优良率分别达到了92.3%和86.7%,差异无统计学意义(校正χ2=0.061,P=0.805)。研究结果表明UBED和PEID治疗L5/S1 LDH的临床疗效相当,与既往文献报道一致[11]。CK、CRP是评估肌肉损伤程度的血液指标,通常在术后24 h达到峰值,其水平高低与手术侵入性、手术时间和术中医源性组织损伤量有关[12-13]。虽然两组在术中C臂透视次数及住院时间方面比较差异无统计学意义(P>0.05),但UBED组手术时间、术中出血量、术后CK及CRP水平均多于PEID组(P<0.05)。分析原因在于,脊柱后侧没有天然解剖腔隙,而UBED技术需要建立两个通道,在逐级穿刺扩张并钝性分离肌肉组织完成“造腔”的过程中,对软组损伤相对更大。其次,UBED组术中需常规扩大椎板间隙,即要对L5椎板下缘、S1椎板上缘及内侧部分关节突进行成形,而PEID组大多勿需处理骨性结构,故导致UBED组的操作时间久、术中出血多。UBED在国内开展的时间相对较晚,目前大多医疗机构尚处于初步尝试及探索阶段,术者在学习曲线早期的操作熟练度、协调性、镜下方向感等方面均较已成熟的PEID差,这亦是造成本研究UBED组手术时间更长、术中出血更多的另一个重要因素。而手术时间和出血量的增加,势必会引起肌肉软组织损伤加重,术后CK及CRP水平更高。但随着UBED技术经验的累积,两者之间的上述指标差异会逐渐缩小,后期至少可与单通道技术持平。
并发症是评价手术安全性及是否值得临床推广应用的重要依据。虽然本研究两组均未发生大出血、椎管内血肿、神经根断裂、脊髓损伤、手术节段错误、椎间隙感染等严重并发症,但两组仍有不同程度的相关并发症出现。UBED组有1例术中突发四肢抽搐,心电监护显示血压升高、心律增快,考虑类脊髓高压综合征,立即予以暂停手术、关闭灌注系统及镇静等处理后,抽搐症状逐渐停止,血压、心率亦恢复正常,后续在严密监测生命体征的情况下尽快完成手术,术后患者诉颈项部疼痛不适,数天后缓解。PEID组有1例术后疼痛改善不明显,经积极保守治疗仍无效,复查MRI提示髓核残留,再次行开放髓核摘除手术。随访期间,UBED组和PEID组分别有1例和2例患者复发。总体并发症发生率UBED组为11.54%(3/26),PEID组为16.67%(5/30),差异无统计学意义(校正χ2=0.027,P=0.870),表明UBED和PEID都是安全性较高的微创髓核摘除术式。但由于本研究的样本量较少,统计学上评估并发症的能力有限,其准确性还有待多中心、大样本、前瞻性的随机对照研究来验证。
术者在对两种术式反复实践后认为:与单通道技术PEID比较,UBED具有明显的操作优势。首先,UBED采用两个相对独立且互不干扰的通道分别用于术野暴露和镜下操作,其手术视野和操作范围不受管道约束,术中通过磨除棘突根部部分骨质,内镜甚至可自由倾斜跨过中线到达对侧,实现“单侧入路双侧减压”,极大提高了操作的灵活性和工作效率,更拓宽了手术适应证范围。其次,由于关节镜镜头直径较小,可通过椎板间隙轻松置入椎管内并自由调整观察角度,方便全方位显示和完整摘除病变组织,有利于减少髓核残留及复发。同时,术中持续的生理盐水灌洗可抵消部分静脉压,椎管内出血减少,镜下视野清晰,术者对周围解剖结构的辨认更加准确,极大降低了误伤神经、硬脊膜的概率。此外,工作通道适用脊柱外科常规开放手术器械进行镜下操作,无须特殊微创工具,适合在基层医院开展。UBED的减压流程与传统开放手术类似,学习曲线相对平缓[14]。
如何更有效地规避或减少手术并发症、提高手术安全性,仍是脊柱外科医生发展方向。结合术者实践经验及相关文献报道,本研究团队分别总结出两种手术各自的注意事项。PEID的注意事项如下[15-17]:(1)术前需详细阅读影像学资料,明确髓核突出的类型、大小、位置及与相应神经根的解剖关系,以便指导术中精确穿刺定位和精准手术摘除;(2)穿刺需分步进行,先将穿刺针置入黄韧带表面,然后镜下直视“破黄”,再旋转工作套管进入椎管,切忌在C臂透视下经皮穿刺直接将工作套管置入椎管内的髓核突出位置,这会极大增加神经根及硬膜囊损伤风险;(3)术前严格把握手术适应证,PEID允许工作通道向头侧、尾侧大幅度倾斜,比较适用于旁中央型和脱垂游离型LDH,但因其左右方向调整有限,对于中央型LDH的处理有一定难度,而椎间孔型、极外侧型LDH则是PEID的禁忌;(4)手术结束时应充分探查S1神经根肩部、腋下,必要时可行侧隐窝减压,避免髓核残留。UBED的注意事项如下[18-21]:(1)保持镜下视野清晰是防止发生并发症的关键,而出血是导致手术视野模糊的主要原因,故术中可通过提前电凝止血、维持收缩压≤100 mm Hg(1 mm Hg=0.133 kPa)、保持灌洗液流出顺畅、骨蜡封闭骨创面等措施来控制出血;(2)因UBED技术需对上下椎板及部分关节突成形,而黄韧带作为硬膜和椎板之间的屏障,术中在骨性结构处理完成之前应予以保留,以保护下方的神经根和硬脊膜;(3)在保证手术视野清晰的前提下,尽量维持冲洗液低压、低速灌洗(悬挂的生理盐水水袋离地约150~160 cm、灌洗水压在30 mm Hg左右),预防类脊髓高压综合征;(4)术中根据需要截骨开窗,避免过多去除骨性结构,防止术后出现腰椎医源性不稳。
综上所述,UBED和PEID是两种安全、有效、可靠的微创椎间盘切除术式,治疗单纯L5/S1 LDH时,虽然PEID在手术时间、术中出血、肌肉软组织损伤方面略具优势,但UBED的镜下视野更广、操作更灵活、减压更彻底、手术适应证范围更宽,其不仅可以治疗各种类型的LDH,而且对于腰椎管狭窄症、腰椎滑脱等复杂的腰椎退行性疾病均有独特的治疗优势和价值,未来应用前景广阔。UBED作为单侧双通道技术的初级应用,笔者仍推荐在学习曲线早期更多地尝试选择UBED行单纯LDH治疗,以累积技术经验,为后期开展微创“单侧入路双侧减压”“镜下椎间融合”等高难度手术打下坚实基础。本研究不足之处在于样本量较小,随访时间较短,数据结论可能存在偏倚,远期临床疗效还有待多中心、大样本、前瞻性随机对照研究来论证。

