循环肿瘤细胞与胃癌患者临床病理特征及预后相关性分析*
王刘星,杨弘鑫,戴 礼,陈太春,梁百闯,王 黔,△
(1.贵州医科大学,贵阳 550001;2.鄂州市中心医院,湖北鄂州 436000;3.贵州医科大学附属医院胃肠外科,贵阳 550001)
胃癌是全球最常见的恶性肿瘤之一,全球每年新增胃癌病例数约为100万,死亡病例数约为80万,其发病率在所有恶性肿瘤中排名第5位,死亡率排名第3位[1]。在我国,胃癌的发病率和死亡率分别位于所有恶性肿瘤的第2位和第3位,远高于世界平均水平[2]。由于早期胃癌症状不典型,且我国高危人群胃癌筛查意识并不强烈,导致患者确诊时已是进展期胃癌或有远处转移,标准的D2手术治疗效果较差。复发和转移是导致胃癌术后低生存率的主要原因[3]。
循环肿瘤细胞(CTC)是原发灶和转移瘤之间衔接的重要“桥梁”,在肿瘤转移过程中发挥着重要作用。CTC从原发性或转移性肿瘤脱落,通过血液循环进行迁移。在迁移过程中,大多数CTC经过失巢凋亡、受到血流剪切应力的机械损伤及机体免疫细胞的消除,最终仅有<0.01%具有高转移潜能的CTC可以存活,发生远处转移,在远处器官中形成新肿瘤[4-7]。肿瘤的进展与上皮-间质转换(EMT)有关。EMT在CTC存在的各个过程中发挥着重要作用。CTC上皮标志物表达在EMT过程中会发生下调、甚至消失,根据EMT标志物的表达可将CTC分为上皮型[表达E钙黏着蛋白、上皮细胞黏附分子(EpCAM)、细胞角蛋白(CK)等]、间质型(表达N钙黏着蛋白、波形蛋白、snail蛋白等)、混合型(同时表达上皮和间质标志物)。与上皮型CTC比较,间质型CTC具有更强的侵袭转移能力,在肿瘤的转移过程起主要作用[8-10]。CTC是一种非侵入性液体活检方法,已在乳腺癌、结直肠癌等肿瘤中被证实与患者临床病理特征及预后有关[11-13]。而关于CTC在胃癌的应用,特别是CTC各表型在胃癌中的应用研究极少。本研究分析外周血中CTC数目及其表型与胃癌临床病理特征之间的相关性,探讨CTC及其分型作为判断胃癌预后标志物的可行性。现报道如下。
1 资料与方法
1.1 一般资料
选取2018年4月1日至2020年4月1日就诊于贵州医科大学附属医院胃肠外科并经病理确诊为胃癌的68例患者纳入研究,其中男34例,女34例,平均年龄(55.0±12.3)岁。纳入标准:(1)年龄18~80岁;(2)术前胃镜及活检证实为胃癌,行根治性胃癌切除术;(3)术前未行抗肿瘤药物治疗;(4)主要脏器功能基本正常;(5)东部肿瘤协作组(ECOG)评分为0~1分;(6)无严重并发症;(7)自愿参与并签署知情同意书。排除标准:(1)非根治性胃切除治疗的胃癌患者;(2)孕妇或哺乳期妇女;(3)主要脏器功能受损;(4)各种原因所致活动性出血的患者;(5)患有严重的急慢性疾病;(6)有严重感染性疾病;(7)临床病理资料不全或失访。
1.2 外周血CTC检测及CTC鉴定
CTC检测:术前当天清晨7:00,空腹采集5 mL外周血,采用新的CTC分离富集技术分离,鉴定胃癌患者外周血中的CTC。样本采集:准备乙二胺四乙酸(EDTA)抗凝采血管、样本保存管和样本采集连通器;使用8号采血针和EDTA抗凝采血管采集5 mL外周血;血样采集后,将EDTA抗凝采血管上下颠倒混匀10次;揭开样本采集连通器上的灰色标签;将EDTA抗凝采血管插入孔内,使孔中针头刺穿采血管橡胶塞;揭开样本采集连通器上的红色标签;将样本保存管插入孔内,使孔中针头刺穿样本保存管橡胶塞,EDTA抗凝采血管内的血液将自动输入样本保存管内;待样本保存管内的液面不再上升后,拔出样本保存管,上下颠倒混匀10次;室温放置30 min。CTC富集:离心去除上清液,固定剂固定8 min;通过真空歧管将过滤器与真空泵连接。将样本保存管中的液体转移至过滤器中。MRIA样本制备:甲醛溶液室温固定60 min。CTC鉴定和观察:采用多重RNA探针,固定后的滤膜样本使用磷酸缓冲盐溶液(PBS)洗涤3次。加入特异性生物标记探针EpCAM、CK8/18/19、间质型生物标记探针碱性螺旋-环-螺旋转录因子1(Twist)与波形蛋白(Vimentin),以及白细胞标志物CD45进行杂交,在40 ℃杂交反应3 h。未结合探针用1 000 μL洗脱液[0.1×SSC(Sigma公司,美国)]洗涤3次。加入100 μL预扩增液[30%马血清(Sigma公司,美国),1.5%十二烷基硫酸钠(Sigma公司,美国),3 mmol/L三羟甲基氨基甲烷盐酸盐(pH 8.0),0.5 fmol预扩增探针],置于40 ℃孵育30 min,进行信号扩大探针反应。将膜进行冷却,用1 000 μL洗脱液洗脱3次(0.1×SSC),然后与100 μL扩增溶液[30%马血清,1.5%十二烷基硫酸钠,3 mmol/L三羟甲基氨基甲烷盐酸盐(pH 8.0),1 fmol预扩增探针]在40 ℃孵育30 min。加入3种标记荧光蛋白,分别为荧光染料Alexa Fluor 594(用于标记上皮生物标记探针EpCAM、CK8/18/19),Alexa Fluor 488(间质型生物标记探针Vimentin和Twist)及Alexa Fluor 750(用于标记白细胞标志物CD45),置于40 ℃孵育30 min。用0.1×SSC进行洗脱,然后使用4′,6-二脒基-2-苯基吲哚(DAPI)进行细胞核染色5 min,在油镜(100×)下使用自动化荧光扫描显微镜,对样本进行观察。针对多种CTC特异性基因,通过不同颜色荧光信号,可进一步将CTC分型。其中Ⅰ型CTC显示为红色荧光信号点,Ⅲ型CTC显示为绿色荧光信号点,而Ⅱ型CTC同时显示红色荧光及绿色荧光信号点,表达Ⅰ型和Ⅲ型特异性基因。
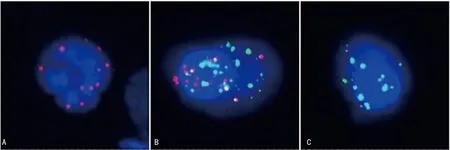
A:上皮型CTC图,显示红色荧光信号;B:混合型CTC图,显示红色和绿色混合荧光信号;C:间质型CTC图,显示绿色荧光信号。
1.3 随访及预后监测
定期对68例胃癌术后患者进行严格的随访。每3个月对出院的患者进行1次门诊或电话随访。末次随访时间为2021年12月20日,术后随访时间3~44个月,中位随访时间28个月,截至末次随访日期,共有35例患者存活,33例患者死亡。总体生存期(OS)定义为手术后至患者因任何原因所致死亡。时间以月为单位统计,详细记录患者术后组织病理学资料、随访资料。随访内容:血常规、尿常规、肝功能、肾功能、腹部彩色多普勒超声、计算机断层扫描(CT)、磁共振成像(MRI),胃镜、癌胚抗原、糖类抗原125(CA-125)及CA-199等。
1.4 统计学处理

2 结 果
2.1 CTC检测结果
根据既往文献[14-15]报道及本试验结果,将CTC≥2个视为检测结果阳性,CTC总数<2个视为检测结果阴性,将各亚型CTC≥1个视为检测结果阳性,各亚型CTC<1个视为检测结果阴性。依据该判断标准, 68例胃癌患者治疗前外周血中,CTC检出个数为0~80个,中位数为6个,CTC阳性患者56例,CTC阴性患者12例,阳性检出率为82.4%(56/68)。而间质型CTC检出个数为0~11个,中位数为1个,间质型CTC阳性患者35例,CTC阴性患者33例,阳性检出率为51.5%(35/68)。
2.2 CTC及其表型与胃癌临床病理特征之间的关系
胃癌患者治疗前外周血CTC阳性与其年龄、性别、体重指数(BMI)、ECOG评分、肿瘤部位、肿瘤分化程度、有无癌结节、神经侵犯、脉管侵犯、淋巴结转移均无明显相关;而与临床分期及浸润深度明显相关。见表1。胃癌患者治疗前外周血上皮型CTC阳性与其年龄、性别、BMI、ECOG评分、肿瘤部位、肿瘤分化程度、有无癌结节、神经侵犯、脉管侵犯、临床分期、浸润深度、淋巴结转移均无明显相关。胃癌患者治疗前外周血间质型CTC阳性与其年龄、性别、BMI、ECOG评分、肿瘤部位、肿瘤分化程度、神经侵犯、脉管侵犯、淋巴结转移均无明显相关;与有无癌结节、临床分期、肿瘤浸润深度明显相关。见表2。因混合型为上皮型和间质型复合形成,且各自所占比例不一,没有可比性,本研究不作比较。
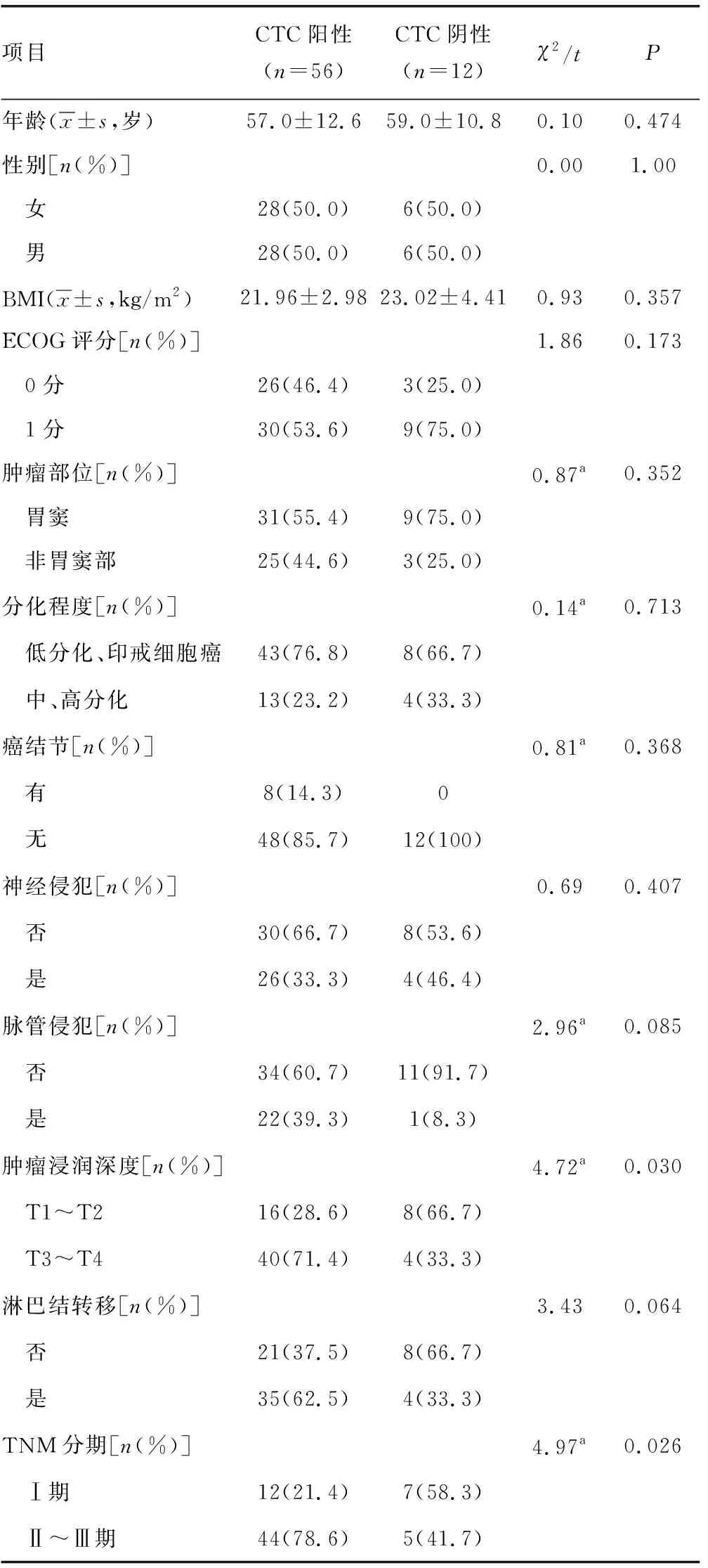
表1 CTC与胃癌临床病理特征之间的相关性
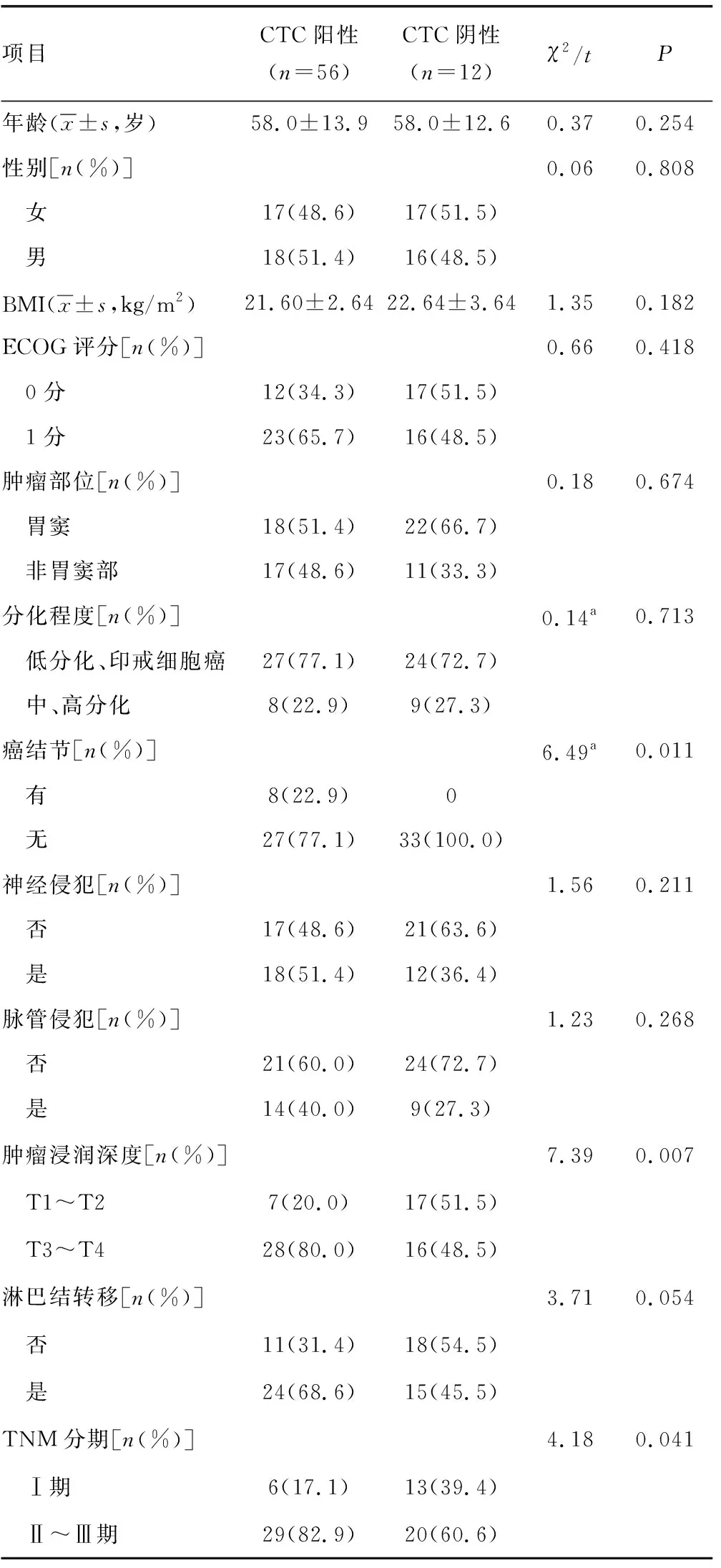
表2 间质型CTC与胃癌临床病理特征之间的相关性
2.3 CTC及其表型与胃癌术后总生存率的关系
CTC总数阴性组患者死亡率为8.3%(1/12),而CTC总数阳性组患者死亡率为57.1%(32/56)。CTC总数阴性组术后总生存率高于CTC总数阳性组,差异有统计学意义(P=0.004),见图2。上皮型CTC阴性组患者死亡率为33.3%(8/24),而上皮型CTC阳性组患者死亡率为56.8%(25/44)。上皮型CTC阴性组术后总生存率高于上皮型CTC阳性组,但差异无统计学意义(P=0.069),见图3。间质型CTC阴性组患者死亡率为21.2%(7/33),平均总生存时间为38.3个月[95%置信区间(95%CI)=34.3~42.3],间质型CTC阳性组患者死亡率为74.3%(26/35),平均总生存时间为19.2个月(95%CI=14.9~23.5)。间质型CTC阴性组术后总生存率高于间质型CTC阳性组,差异有统计学意义(P<0.001),见图4。

图2 胃癌患者CTC总数阴性组与阳性组术后
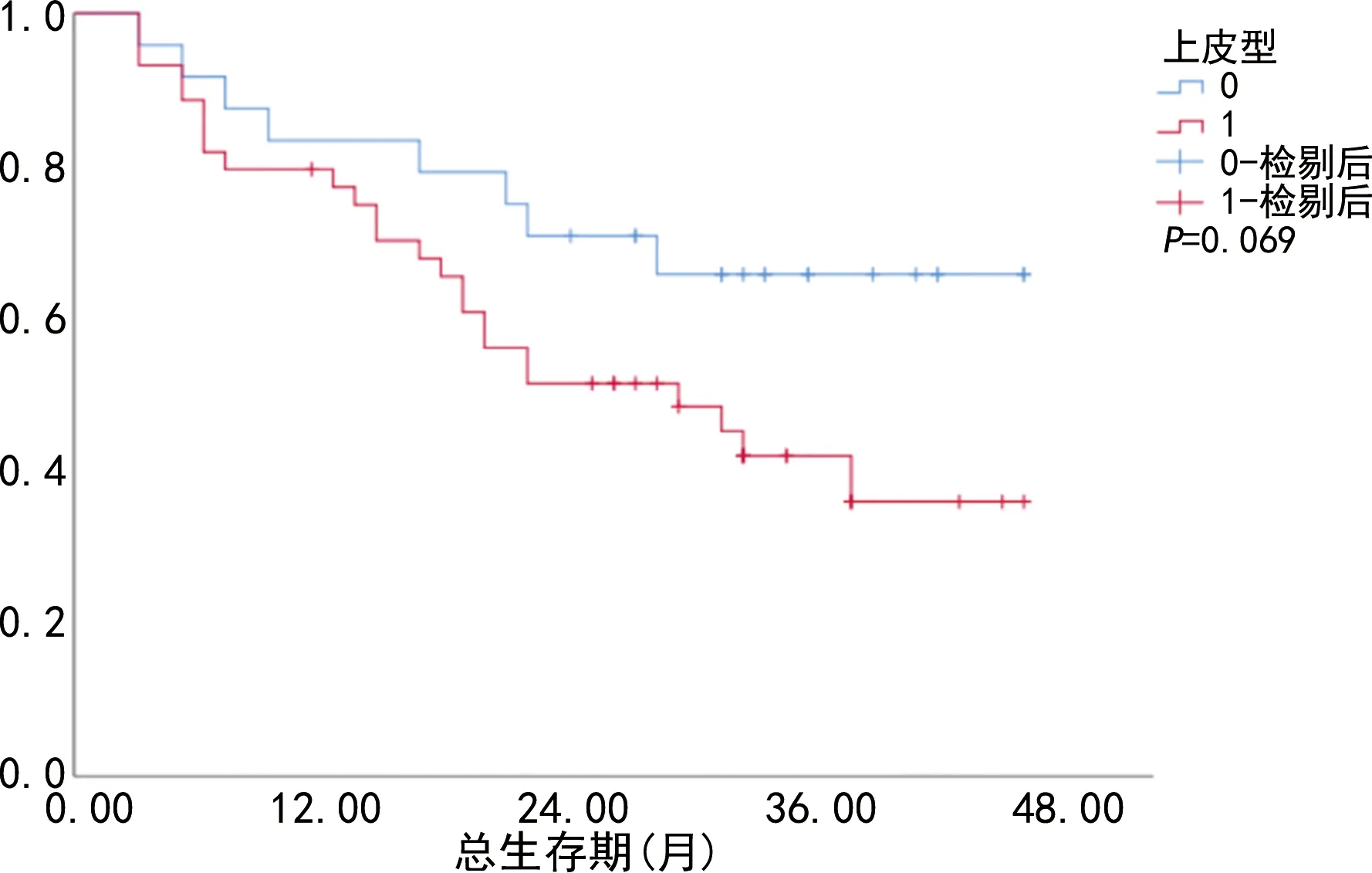
图3 胃癌患者上皮型CTC阴性组与阳性组术后
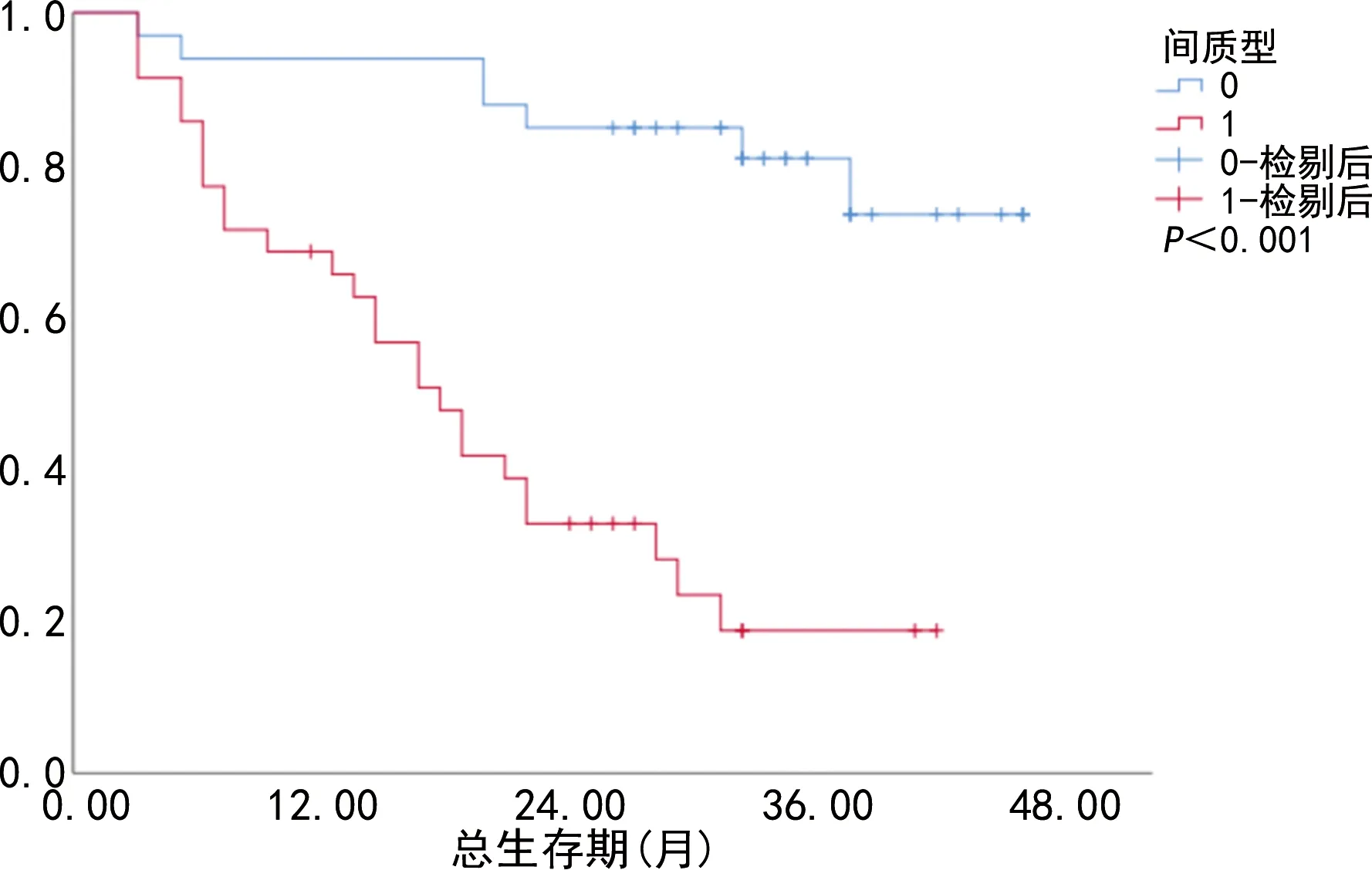
图4 胃癌患者间质型CTC阴性组与阳性组术后
3 讨 论
CTC检测是液体活检最主要的组成之一,也是推动肿瘤精准诊疗的新技术。与普通侵入式的组织活检及细胞学检查相比,CTC检测具有一系列优势,如标本获取容易、可反复检测等。与循环肿瘤核酸(ctDNA)比较,CTC作为完整的肿瘤细胞,可分析的内容多、获取的基因信息全面,是与组织活检一致性最高的液体活检手段[16];CTC也可以在体外进行肿瘤细胞的分析[17]。CTC在EMT的幅度上表现出了相当程度的表型异质性,但CTC各亚型在胃癌中的应用研究极少。本研究从CTC的EMT分型着手,探索CTC及其EMT分型与胃癌临床病理特征及预后的相关性。
既往有关于CTC与胃癌临床病理特征相关性的研究,但这些研究得出的结论不尽相同,但总体而言,大多研究认为CTC与胃癌患者的年龄、性别、BMI、肿瘤部位、肿瘤大小、肿瘤分化程度无明显相关性,而与胃癌的临床分期、肿瘤浸润深度、淋巴结转移情况有关[18-20]。本研究利用Canpatrol Ⅲ检测技术检测胃癌患者外周血中CTC[21-22],该技术采用生物纳米膜过滤法+多重mRNA荧光原位杂交方法,不依赖于生物标志物,避免阳性生物富集方法漏检已发生EMT转化表型的CTC,避免阴性生物富集方法漏检与白细胞相互作用的CTC。结果显示,CTC在Ⅰ期和Ⅱ~Ⅲ期胃癌患者中的检出率分别为63.2%和89.8%,差异有统计学意义(P<0.05)。为进一步探讨原发肿瘤浸润程度和淋巴结转移情况与CTC检出率有无相关性,本研究对TNM分期进一步细化,分析不同T分期和N分期与CTC检出率的关系。原发肿瘤为T1~T2和T3~T4期患者CTC检出率分别为66.7%和90.9%,两组间CTC检出率比较差异有统计学意义(P=0.030)。淋巴结转移与否的CTC检出率分别为72.4%和89.7%,但两组间比较差异无统计学意义(P=0.064)。这与HUANG等[23]的meta分析结果类似,该研究者纳入了包含2 566例胃癌患者的26项研究用于分析,发现CTC在Ⅰ/Ⅱ期患者中的检出率明显低于Ⅲ/Ⅳ期患者(OR=0.39,95%CI为0.23~0.67)。ZHENG等[24]同样发现,CTC阳性率和胃癌TNM分期、T分期明显相关。但杨艳丽等[25]研究发现,CTC与胃癌患者是否淋巴结转移明显相关(P=0.034),这与本研究结果相差较大。考虑产生这些结果的原因主要有:(1)CTC的检测方法不同,不同的检测方法会导致检验结果的敏感度和特异度均存在一定差异;(2)选择截断值存在一定差异;(3)研究样本数量存在差异。另一方面,间质型CTC比上皮型CTC具有更强的转移侵袭能力和耐药能力,故本研究进一步细化CTC各亚型与胃癌临床病理特征之间的相关性,发现间质型CTC检出同样与胃癌的TNM分期、T分期明显相关,而上皮型CTC的检出与胃癌的TNM分期、T分期无明显相关性,可能提示了间质型CTC在CTC各亚型中的重要性。
在肿瘤的转移中,EMT在促进静止肿瘤细胞的迁移和侵袭等部分具有关键作用[26]。在EMT的形成过程中,上皮细胞将失去上皮特性,出现间质特征,例如钙黏蛋白、Vimentin、Twist和纤维连接蛋白将过度表达,从而导致其侵袭能力增强[27]。已有证据表明,间质型CTC与转移性乳腺癌的治疗结果间存在关联[28]。HIRAIWA等[29]在44例胃癌患者的研究中发现,转移性疾病患者的CTC数量明显高于局限性疾病患者。但作者并未深入探讨各患者CTC分型及其数目。由于CTC具有异质性,仅进行CTC总计数的预测价值有限,有必要鉴定CTC各亚型的数量。此外,间质型CTC在胃癌中的预后价值极少被研究,也未发布相关指南或共识来指导其在胃癌临床实践中的应用。有研究发现,单纯的CTC检出并不能较好地预测肿瘤患者的疾病转归,间质型CTC的检出可能更加重要。一篇针对乳腺癌的研究发现[30],在接受治疗的乳腺癌缓解病例中,仍有部分患者CTC数量呈增多趋势,但间质型CTC却呈减少趋势,另有患者治疗后CTC数量呈减少趋势,但间质型CTC却呈增多趋势,最终疾病出现临床进展。这提示间质型CTC在预测乳腺癌预后中的重要作用。本研究中,上皮型CTC阴性组术后总生存率高于上皮型CTC阳性组,但差异无统计学意义(P=0.069);CTC总数阴性组术后总生存率高于CTC总数阳性组,差异有统计学意义(P=0.004);间质型CTC阴性组术后总生存率高于间质型CTC阳性组,差异有统计学意义(P<0.001)。死亡患者外周血间质型CTC计数高于存活患者,差异有统计学意义(P<0.001)。大多数CTC在外周血液循环中发生凋亡,从而被免疫系统清除,只有极少数CTC才能存活下来并形成转移,而这部分存活并形成转移的CTC绝大多数是间质型CTC或循环肿瘤微栓子(CTM)。由于CTC侵袭转移能力是由EMT赋予[31],因此,对CTC分型特别是间质型CTC进行检测,能更加精准地评估胃癌患者。
本研究利用Canpatrol Ⅲ CTC检测技术检测胃癌患者的CTC计数及其分型,分析了CTC及其表型的检出水平与胃癌临床病理特征的关系,比较了间质型CTC的检出与胃癌患者总生存期的关系。结果表明,CTC及间质型CTC可以作为胃癌辅助分期的指标,间质型CTC检出水平与胃癌患者的预后相关。但本研究样本量小,随访时间较短,还需对研究对象进行长期随访,有待下一步对CTC及其分型用于动态监测患者治疗有效性及疾病进展情况等方面的研究。

