封育对干热河谷Savanna植物群落种间关联性的影响
何光熊,史正涛,闫帮国,杨淏舟,孙毅,王艳丹,余建琳,和润莲,史亮涛,方海东*
(1.云南师范大学地理学部,云南 昆明 650500;2.云南省农业科学院热区生态农业研究所,云南 元谋 651300;3.云南干热河谷植物园,云南 元谋 651300;4.云南省元谋县金雷国家水土保持科技示范园,云南 元谋 651300)
封育通过人为划定特定空间和范围,实施围栏等保护措施,避免人为活动的强烈干扰,促进区域内生态系统的自然恢复,是陆地植物生态系统恢复的最重要措施之一[1-2]。种间关系通常用种间关联性和种间相关性来表示,定性或定量地描述群落及其物种的相似性及相互作用强度,是群落动态的基础,亦是群落结构和功能的重要组成部分[3-4]。研究表明,封育措施对植物群落种间关系有重要影响,进而作用于群落结构、演替等生态功能或进程。如围封6年后,温带半干旱典型草原群落优势种种间联结程度提高[4];大兴安岭东南麓的低山丘陵向西辽河平原过渡地带的草原,其放牧退化演替进程中,群落内主要植物种间的总体联结性在重牧阶段、过牧阶段为显著正关联,到极牧阶段则为无关联[5];内蒙古高原短花针茅(Stipa breviflora)荒漠草原中,物种间相对亲和性会因放牧制度的改变而改变,植物群落种间关系正联结强度表现为禁牧区>划区轮牧区>自由放牧区,负联结种对数的多少表现为禁牧区<划区轮牧区<自由放牧区[6],同时,伴随放牧强度的增加,短花针茅植物群落总体关联性呈现向正联结转变的趋势[7]。这些研究揭示了特定气候类型或区域草地群落组成及结构对封育措施的响应关系,为后续草地的管理或生态恢复措施的制定奠定了重要基础,成为理解区域植被生态系统恢复进程中群落构建规则与适应模式的重要手段。
我国西南干热河谷稀树灌草丛(Savanna)群落是一类独特的脆弱植被生态系统,受干热气候条件和强烈人为活动的影响,呈现植被-土壤协同退化特征,成为公认的植被修复困难地,封育成为该区域植被修复的重要措施。目前,闫帮国等[8]开展了封育对干热河谷稀树灌草丛植物叶片化学计量特征的影响研究,揭示了封育对干热河谷草地植物生态适应的重要作用。但整体上,封育对干热河谷植被修复的作用机理及其环境效应还未能充分揭示。前期研究发现,种间关系分析能有效表征典型Savanna群落特征,并反映出典型物种对当地气候等环境因子的响应[9]。因此,本研究以金沙江干热河谷典型Savanna群落植被带为研究对象,借助水土保持封育区的措施划分封育区及干扰区两种群落类型开展植被调查,在对比分析两地种间关系差异基础上:1)刻画封育措施下干热河谷稀树灌草丛物种的种间关系及其特征;2)明晰封育管理对干热河谷稀树灌草丛群落影响的物种结构及功能群基础,以期为区域内植被恢复策略及功能性植被构建措施的制定提供参考。
1 材料与方法
1.1 试验地概况
试验样地位于金沙江干热河谷典型区云南省元谋县境内(101°35′-102°06′E、25°23′-26°06′N),平均海拔1210 m,属南亚热带干热季风气候。光热资源充足,年均日照2670.4 h;年平均气温21℃,最高气温42℃,最低气温-0.8℃,≥10℃年积温7996℃;全年降水集中于5-10月,年均降水量613.8 mm,年均潜在蒸发量为3847.8 mm,达降水量的6~10倍,无霜期350 d。该区土壤为发育于第四纪元谋组红色风化壳母质的燥红土,土壤酸性强,全氮0.29~0.60 g·kg-1,全磷0.08~0.30 g·kg-1,全钾11.81~26.03 g·kg-1,碱解氮1.53~32.04 mg·kg-1,速效磷未检出,速效钾16.01~23.04 mg·kg-1,按国内土壤养分分级标准属中度或严重贫瘠[10]。区域主要物种为黄茅(Heteropogon contortus)、孔颖草(Bothriochloa pertusa)和拟金茅(Eulaliopsis binata)等禾本科牧草,杂以零星假杜鹃(Barleria cristata)、车桑子(又名明油子,Dodonaea viscosa)等中小型灌木,为典型的河谷萨瓦纳(Valley-Savanna)植被[11-12]。
1.2 研究方法
1.2.1 试验设计及优势种确定 干热河谷地区大面积的Savanna植被为区域利用光热资源发展农牧业奠定了坚实基础,但同时也加剧了区域植被退化及水土流失等问题。1999年云南省元谋县政府开展土壤侵蚀综合治理工程,设立了水土保持区,对金沙江干热河谷元谋段部分地区的植被进行了封育保护,这一过程同时将原先易受侵蚀及人类活动的大片的Savanna植被划分为封育区和非封育区。于2020年7-10月,在元谋县元马镇-黄瓜园镇海拔1000~1400 m的Savanna植被带(101°45′-101°53′E,25°37′-25°59′N)区域,以相关设备及标识为依据设封育区,并设1 m×1 m样方30个进行群落清查,区内群落物种主要以黄茅、拟金茅及橘草(Cymbopogon goeringii)为主,生长较为旺盛,形成较厚的草冠层和枯立物覆盖地表,其间生长其他物种,具有相对明显的垂直结构;在相同海拔地段毗邻封育区直线距离1 km以上的非封育典型地段设置干扰区作为对照,并设1 m×1 m样方33个开展群落清查,干扰区植被主要受放牧干扰等人为活动影响(主要是放牧山羊,频率约每2~4月1次),土壤侵蚀较为严重,区内植物以黄茅、孔颖草为主,草冠层较为稀疏,地表覆盖度相对较低,垂直结构不明显,群落清查时一半以上样方投影视角可见裸露地表。按方精云等[13]的方法和技术规范开展群落清查,清查时记录样方内物种数、个体数和物种盖度等,并分物种采集地上部分,分拣称量鲜生物量。本次调查共记录物种53个,其中封育区记录物种29个,非封育区记录物种44个。按公式(1)计算植物种重要值(important value,IV)。按封育区或干扰区物种累积生物量鲜重占调查区域累积生物量鲜重≥97%选取25个优势物种(表1)进行种间联结及种间相关分析。
式中:IV为某一植物种的重要值,BIOs表示某一物种的鲜生物量总和,BIOt表示所有物种的鲜生物量总和。
1.2.2 种间联结及种间相关分析 群落多物种间的总体关联性分析采用Schluter方差比率(variance ratio,VR)[14]表示,按公式(2)至公式(5)计算VR值,并采用统计量W来检验VR值偏离1的显著程度进行显著性检验[15-16];种对间的关联性采用χ2统计量测定,使用公式(6)计算χ2值并进行显著性检验[当χ2<χ2(0.05,2)=3.841时,种间关联不显著;当χ2(0.05,2)=3.841<χ2<χ2(0.01,2)=6.635时,种间关联显著;当χ2>χ2(0.01,2)=6.635时,种间关联极显著],具有显著关联的种对使用公式(7)计算Jaccard关联度指数(JI),判定种间联结程度[13,16];种间相关性采用Spearman秩相关系数rs(i,k)[17]表示,将重要值数据秩化后转变为秩向量,使用公式(8)计算得到Spearman秩相关系数rs(i,k)。具体步骤及计算方法与文献[9]相同。
式中:VR值为群落内植物种间的总体联结指数,ST为所有样方物种数的方差,σT为所有物种出现频度的方差,S为总物种数,N为总样方数,Pi为物种i出现的频度,Tj为样方j内出现的所研究物种的总数,ni为物种i出现的样方数,t为样方中种的平均值。
式中:N为样方数,a表示2个物种均出现的样方数,b和c表示一个物种出现而另一个物种不出现的样方数,d表示两个物种均未出现的样方数。
式中:rs(i,k)表示Spearman秩相关系数,N为样方数,dj表示物种i和k在样方j中重要值秩序的差分集合(dj=xijxkj,1≤i≤N)。
1.3 数据统计与分析
物种生物量及重要值等数据的平均值及标准差计算使用Microsoft office excel 2016;群落水平及种对水平的种间关联性分析过程中的方差比率(VR)、χ2统计量、Jaccard关联度指数(JI)和Spearman秩相关系数rs(i,k)计算使用R[18]软件工具包spaa[19]和igraph[20];半矩阵图绘制使用CorelDRAW X4 SP2,网络图绘制使用R[18]软件工具包igraph[20]。
2 结果与分析
2.1 封育对群落结构的影响
群落清查结果显示,黄茅等25个物种的鲜生物量总和占调查样方总生物量的97.0%以上,是区域草地群落的优势物种,该25个物种鲜生物量总和占封育区或干扰区调查样方总生物量的比例也达到97.0%以上,可系统反映试验中封育区和干扰区的群落特征。总体来看,封育区与干扰区群落中各优势种有明显差别,封育区样方中仅含有区域25个优势物种中的17个,样方平均物种数为4.4种,物种数变量为3.83种,较干扰区具有较少的物种数和相对较高的物种变量(干扰区含有区域25个优势物种中的22个,样方平均物种数为5.1种,物种数变量为3.36种,表1和表2);封育区孔颖草(Bp)、单叶木蓝(Il)、三芒草(Aa)等土著物种减少甚至消失,未发现多花百日菊(Zp)等外来物种及蒲公英(Tm)等杂草类物种;生物量组成上,橘草(Cg)和拟金茅(Eb)所占比例明显高于干扰区,而黄茅(Hc)优势度明显低于干扰区。表明封育有助于橘草(Cg)、拟金茅(Eb)等物种生长,形成多个建群种占优势的群落,促进假杜鹃(Bc)、清香木(Pw)和地檀香(Gf)等一些木质化程度较高的物种留存,减少黄茅(Hc)、三芒草(Aa)等先锋物种,多花百日菊(Zp)、羽芒菊(Tp)等外来种及蒲公英(Tm)等杂草类的出现,导致群落组成及结构发生明显变化。

表1 优势物种的鲜生物量及重要值Table 1 Fresh biomass and important value of dominant species
2.2 封育对群落种间关系的影响
分析结果表明:干热河谷稀树灌草丛群落水平种间联结以正联结为主,封育区草地群落优势物种总体联结指数VR=1.677>1,物种间呈现极显著正联结[W=50.301>=42.557>=49.588];干扰区草地群落优势物种总体联结指数VR=1.235>1,呈现不显著的正联结[W=40.765<=46.194<=53.486](表2)。表明封育加强了群落内不同物种在空间上的联结性,群落内物种联系更加紧密。

表2 封育区和干扰区群落水平的种间联结Table 2 Interspecific association at community level in enclosed and disturbed sites
2.3 封育对植物种对间关系的影响
采用物种出现-不出现建立优势物种关联矩阵(0,1矩阵)进行χ2检验。结果表明(图1):封育区17个物种构成的136个种对中,呈现显著关联的种对有4对,占总种对数的2.9%,均为正联结种对,其中,蔓草虫豆(Cs)-丁癸草(Zg),车桑子(Dv)-叶下珠(Pu)为极显著正联结(P<0.01),飞扬草(Eh)-矛叶荩草(Al),飞扬草(Eh)-香薷(Ec)为显著正联结(P<0.05);干扰区22个物种构成的231个种对中,呈现显著关联的种对有13对,占总种对数的5.6%,其中,极显著正联结(P<0.01)的种对10对,三芒草(Aa)-兔耳草(Ch),三芒草(Aa)-臭灵丹(Lp),三芒草(Aa)-卷柏(St),三芒草(Aa)-虱子草(Tb),兔耳草(Ch)-臭灵丹(Lp),兔耳草(Ch)-卷柏(St),兔耳草(Ch)-虱子草(Tb),臭灵丹(Lp)-卷柏(St),臭灵丹(Lp)-虱子草(Tb),卷柏(St)-虱子草(Tb),显著正联结(P<0.05)的种对2对,为羽芒菊(Tp)-孔颖草(Bp),羽芒菊(Tp)-蔓草虫豆(Cs),显著负联结(P<0.05)的种对1对,为羽芒菊(Tp)-车桑子(Dv)。表明封育有抑制群落优势物种共同出现的趋势。

图1 封育区与干扰区25个优势种间χ2半矩阵Fig.1 Semi-matrix of χ2 test of interspecific association for 25 dominant species in enclosed and disturbed sites
依据25个优势物种(封育区包含17个优势物种,干扰区包含22个物种)的共同出现百分率计算Jaccard指数,结果显示(图2):封育区17个物种构成的136个种对中,JI=0的种对有46对,占总种对数的33.8%;0<JI≤0.3的种对有76对,占总种对数的55.9%,0.3<JI≤0.6的种对有13对,占总种对数的9.6%,JI>0.6的种对1对,占总种对数的0.7%;干扰区22个物种构成的231个种对中,JI=0的种对有103对,占总种对数的44.6%;0<JI≤0.3的种对有110对,占总种对数的47.6%;0.3<JI≤0.6的种对有16对,占总种对数的6.9%,JI>0.6的种对仅2对,占总种对数的0.9%。相比较而言,封育区及干扰区25个优势物种种对间Jaccard指数均较小,表明干热河谷草地群落优势物种具有独立分布的特点,该结果与χ2检验的结果相类似;同时,封育区优势物种种间0<JI≤0.3、0.3<JI≤0.6及JI>0.6的种对数均少于干扰区,而JI=0的种对数多于干扰区,表明封育措施有减少干热河谷草地群落优势物种共同出现的趋势。

图2 封育区与干扰区25个优势种间Jaccard指数半矩阵图Fig.2 Semi-matrix of Jaccard’s association index for 25 dominant species in enclosed and disturbed sites
Spearman秩相关分析结果表明(图3):封育区17个优势植物种间相关性呈显著和极显著相关的种对15对,占总种对数的11.0%,包含显著和极显著正相关种对11对,显著和极显著负相关种对4对,分别占总种对数的8.1%和2.9%;呈极显著相关的种对6对,占总种对数的4.4%,包含极显著正相关种对5对,极显著负相关种对1对,分别占总对数的3.7%和0.7%;其中,极显著正相关种对为矛叶荩草(Al)-香薷(Ec),矛叶荩草(Al)-飞扬草(Eh),矛叶荩草(Al)-羽芒菊(Tp),假杜鹃(Bc)-丁癸草(Zg),车桑子(Dv)-叶下珠(Pu),极显著负相关的种对为香薷(Ec)-黄茅(Hc)。干扰区22个优势植物种间呈显著和极显著相关的种对21对,占总种对数的9.1%,包含显著和极显著正相关种对17对,显著和极显著负相关种对4对,分别占总种对数的7.4%和1.7%;呈极显著相关的种对7对,占总种对数的3.0%,包含极显著正相关种对6对,极显著负相关种对1对,分别占总对数的2.6%和0.4%;其中,极显著正相关种对为三芒草(Aa)-单叶木蓝(Il),三芒草(Aa)-虱子草(Tb),矛叶荩草(Al)-荛花(Wc),单叶木蓝(Il)-虱子草(Tb),香薷(Ec)-卷柏(St),卷柏(St)-蒲公英(Tm)。相比较而言,封育区优势物种种对间呈显著相关及极显著相关种对数较干扰区少,但占总种对数的比例均较干扰区高;同时,封育区优势物种种对间呈显著正相关关系种对数占总种对数的比例和呈显著负相关关系种对数占总种对数的比例均高于干扰区。表明封育会导致干热河谷草地群落中优势物种间相关关系的作用加强,并表现出优势物种间正负相关关系同时加强的特点。
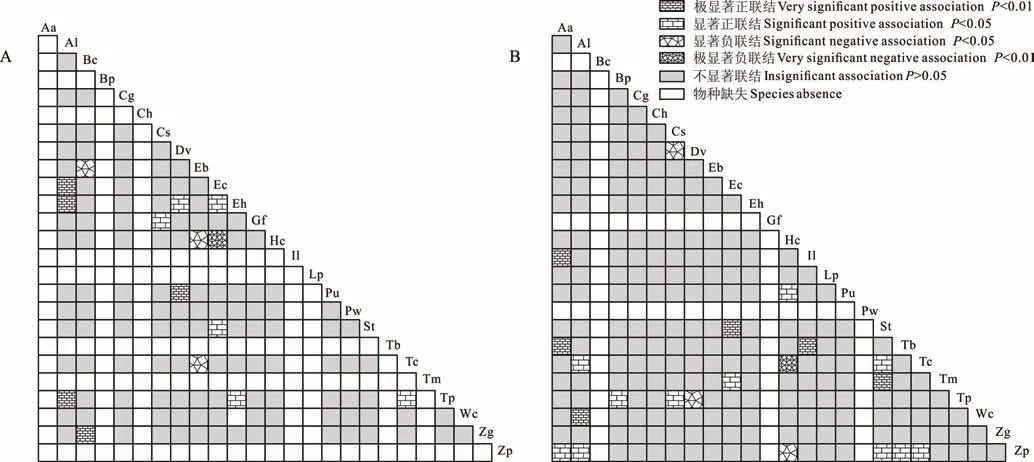
图3 封育区与干扰区25个优势种间Spearman秩相关系数半矩阵图Fig.3 Semi-matrix of Spearman’s rank correlation coefficients for 25 dominant species in enclosed and disturbed sites
以上分析结果表明:封育区和干扰区优势物种种间联结性均较强,均以正联结关系为主,但二者间具有明显区别。从植物功能群来看,封育区组成主要种间关系物种是蔓草虫豆、车桑子、假杜鹃等物种,表现出促进豆科物种、木质化物种、乡土物种间形成正联结关系的趋势,干扰区组成主要种间关系物种是三芒草、蒲公英等,多为一年生物种、杂草类物种和外来物种间形成正联结关系,表明干热河谷群落优势物种关系对封育措施具有差异性响应特征。此外,相较于干扰区,封育区一年生物种、杂草类物种和外来物种等功能类群的相对缺乏,是造成比较分析中封育区草地群落优势物种共同出现率低于干扰区的主要原因。因此,封育措施对干热河谷草地群落的影响可能通过对植物功能群的塑造来实现。
2.4 封育对群落结构关系的影响
基于相同种组内物种间具有显著正相关关系,不同种组内物种间具有显著负相关关系的原则,分别绘制25个优势种在封育区及干扰区草地群落中Spearman秩相关关系网络星座图,对研究区生态种组异同进行比较分析(图4和表3)。结果显示:封育区17个优势物种可分为7个生态种组,其中物种数最多的一组包含9个物种,占分析物种数的52.9%,有4个物种保持相对独立关系,占分析物种数的23.5%;干扰区22个优势物种可分为10个生态种组,其中物种数最多的一组包含10个物种,占分析物种数的45.5%,有7个物种保持相对独立关系,占分析物种数的31.8%。表明封育会强化草地群落种间的相互作用导致生态种组减少,并抑制某些物种的出现。从群落生物量贡献来看(图4,气泡大小表示),封育区黄茅(Hc)、拟金茅(Eb)和橘草(Cg)3个物种分别贡献28.58%、29.40%和23.12%,占群落总生物量81.10%,成为封育区群落的重要标志种、建群种,而干扰区明显呈现单优势种现象,仅黄茅(Hc)1个物种生物量就超过群落总生物量一半,达群落总生物量的55.8%。一般认为由多个优势种占主导地位的群落具有更高的稳定性和抗干扰能力,因此推断封育措施在促进Savanna植被稳定性方面具有重要作用。从生态种组的构成来看,封育区和干扰区种组都以多年生优势禾草为背景,镶嵌分布木质化程度较高的小灌木和草本(表3的第4种组),这一种组使得两类样地植被都在外貌上形成层次感较强的,物种组成较为丰富的“灌木草丛”结构。同时,区别于干扰区,封育区出现乔木种组(表3的第1种组),相当数量的清香木等乔木树种的出现使Savanna植被“稀树灌草丛”的特征更趋明显,群落结构更趋完善。表明封育对促进Savanna植被正向演替具有重要作用。

表3 封育区与干扰区生态种组划分及种组特征Table 3 Ecological groups classification and traits of disturbed and enclosed site

图4 封育区及干扰区25个优势种Spearman秩相关关系及生态种组结构星座图Fig.4 Constellation diagram of Spearman’s rank correlations and ecological group compositions for 25 dominant species in enclosed and disturbed sites
3 讨论与结论
一般认为,在胁迫环境(如干旱、高寒或盐沼地带)中,植物间正相互作用更为普遍,这是由于这些环境中同种或不同种相邻植物间通过相互荫蔽降低高温、遮挡抵御强风、增加水分等资源的获取、形成协同防御抵抗动物采食等策略,改善了局部生存环境而发生聚集[21-22]。例如,封育加强了内蒙古太仆寺旗温带半干旱草原群落总体种间正相互作用[4];三江平原毛苔草(Carex lasiocarpa)群落的总体种间关联性均表现为显著正关联,且随着群落演替进程其种间正关联占主导的地位不发生变化[23]。本研究发现,封育20年(1999-2020年)后干热河谷Savanna群落种间关系呈现极显著正关联,这是由于:1)群落中共存的物种是植物间正负相互作用的结果[16,24]。干热河谷稀树灌草丛群落中,封育区优势物种间正相互作用(显著或极显著正联结或正相关种对数的比例较高,图1~3)较干扰区强;2)种间关系分析是对种群之间竞争的结果或群落现状的描述,具有明显的时空特质[16-17]。如三江平原毛苔草群落的总体种间关联性排列为1983年>1973年>2003年,呈现出明显的起伏及关联性减弱的趋势[23]。本研究结果显示,封育区草地群落优势物种总体联结呈现极显著的正联结(联结指数VR=1.677>1,表2),Spearman秩相关分析显示,封育区和干扰区种对间均以正相关关系为主,区别在于封育显著加强了当地多年生优势物种间的相互关系,而干扰区则有利于一年生物种、杂草类物种和外来物种间形成紧密的相互关系,该结论表明封育同时加强了某些物种间正向或负向的(如促生或相害)相互作用,并通过长期相互适应形成相互作用间的“平衡”,使群落整体水平的种间联结关系呈现显著正关联的状态。由于种间关系的分析不能揭示这种“平衡”机制的形成,也不能解释引起这种“平衡”机制的内在驱动机理[15-16]。因此,封育作为干热河谷功能型植被恢复的重要手段,其具体措施及关键环节的掌控还需要进一步的深入研究。
除环境和生物因素外,取样尺度及取样量也会影响种间关系的分析结果。有研究表明,在较大尺度内,环境异质性对种间关联起主要作用,而在较小尺度内,种间竞争则起主导作用;另一方面,取样尺度过大,种间关系多为正联结,过小则不能包含个体较大的两个物种,容易形成负联结[17,25-26]。在研究取样过程中,种群内不同种对间的正负联结数相差不大,计算得到的正联结种对数和负联结种对数占总种对比例的比值为1,或趋近于1,说明取样尺度合理有效[16]。本研究中,封育区和干扰区优势物种种间联结或种间相关性均以正联结关系为主,表明取样尺度可能过大,但Spearman秩相关分析结果显示封育区和干扰区具有显著相关关系的种对数分别占总种对数的比例接近1,表明该取样尺度能够准确反映封育区和干扰区植被的分布状况,可用于分析比较区域种间关系。在合适的取样尺度下,取样量主要通过优势物种的特征值影响种间关系的分析结果。本研究中,研究区1 m×1 m尺度样方中平均含有6~7个物种,且优势物种累加生物量均达到样方总生物量90%以上,因此,按照植被调查规范[13,15],结合干热河谷草地调查经验值设计取样量为n≥30样方,能满足试验比较需求。
种对间的相互作用是群落总体种间联结关系形成的基础。通常,不同物种或个体间由于生境改善(habitat amelioration)和资源富集(resource enrichment)的作用形成正相互作用[24,27-28],而通过有效资源的竞争形成负相互作用[29]。封育的主要作用是通过减少放牧等干扰,给植物提供相对稳定的环境,进而促进植被的正向演替[30-31]。在这个过程中,物种间的联结程度逐渐增强,物种间达显著相关的种对所占比例呈逐渐增加的趋势[4,23,32-33]。本研究中,χ2检验结果显示,施行封育后群落中17个优势种间关联显著的种对为4对,且4对均为正联结,Spearman秩相关分析结果也显示出相似的特征,17个优势种间关联显著的种对为15对,其中11对为正联结。相较于干扰区(22个物种,χ2检验结果为12个种对正联结,Spearman秩相关分析结果为17个种对正联结),群落中正相互作用的种对数占总种对数比例有维持或明显增加的趋势。干热河谷区域气候常年干燥炎热,水土流失严重[34],在这种生境群落中的不同个体或物种间能通过护理作用(nurse effects)改善生境条件[32],减缓强光及高温灼伤,并协同防御适应水土流失等胁迫因子[35-37],从而形成种对间正联结效应。另一方面,该区域土壤薄瘠,干旱缺水[8,38],对有限资源的竞争可能导致群落中优势物种种对间负联结效应增强。因此,推测封育区相对较少的干扰因素同时增强了气候因子及生境因子的效应,是导致植物种对间正负联结作用加强的主要原因。
本研究发现,封育区平均物种数较干扰区少。拟金茅是封育区群落最重要的物种之一,结合封育区拟金茅(Eb)重要值的变化情况,可知封育措施直接促进了干热河谷稀树灌草丛中拟金茅的优势地位。群落清查过程中发现,封育区的拟金茅呈现半球形覆盖在地表,在生长过程中逐渐形成冠状的枯立物层,年分解率降低。研究表明,封育导致凋落物的长期覆盖及分解速率差异引起的土壤养分变化是导致群落物种多样性降低的重要原因[39],而土壤性质是影响干热河谷植物-土壤养分反馈以及生物地球化学循环特征的重要因子[40]。因此,推测封育可能通过拟金茅难分解凋落物的累积效应直接减少了局域土壤的养分归还,对其他物种形成养分胁迫,导致封育区群落物种多样性(平均物种数)的减少。研究表明,群落物种多样性的维持与稳定和群落水土保持功能的形成和维持具有密切联系[41-43]。一方面,植物和凋落物层覆盖对地表的保护作用会降低土壤侵蚀,另一方面,覆盖作用亦会通过影响光照等因素造成一定范围内群落的物种多样性(平均物种数)降低,导致群落抗土壤侵蚀功能的低效[44]。因此,针对稀树灌草丛群落水土保持功能的发挥这一恢复目标而言,形成长效凋落物覆盖和保持植被多物种生长间存在某种权衡关系。若将封育作为干热河谷稀树灌草丛水土保持功能型植被构建的长效措施,其实践策略的制定有待进一步完善。
生态种组是群落生态习性相似的种的集合,能够更真实地反映群落和种群的关系,以及种群对环境和主导生态因素的适应[16]。不同生态种组对生境条件有不同的适应策略,分别占据不同的生态位,生态资源的利用方式也有显著差异[21,45-46],不同物种对环境的趋同适应会导致这些物种分布在相同的环境中,从而形成正联结。在局地群落中,物种对生态因子适应的种间差异、物种间相互关系和群落内可利用资源分配模式共同作用物种共存格局[47]。本研究中,封育区17个优势物种分属7个生态种组,而干扰区22个优势物种分属10个生态种组,表明封育措施导致相同或相似生态习性物种的聚集。相较封育区,干扰区除受到光热气候因素及土壤水分等资源要素的胁迫外,还受到放牧为主的人为干扰。由于放牧和踩踏等干扰会通过食草作用或疏松效应[48-49]对种群调节产生影响,推测干扰区生态种组数目的增加是放牧等人为干扰因素作用的结果。例如本研究中,封育区群落中以多年生禾本科物种占主导地位,长期的种间相互作用导致一年生三芒草的缺失,而在干扰区,一年生三芒草成为群落主要组成物种之一,除土壤侵蚀作用外,家畜的采食和践踏对群落“疏松”提供的潜在生存空间也是重要因素。由于群落生态种组的组成及结构变化对群落功能及稳定性维持的作用更为直接,对干热河谷生态种组的组成,在群落功能中的地位,及其在干旱炎热气候因子及缺水等因子胁迫下的动态变化特征,应当成为干热河谷区域功能性植被重建理论及实践的关键环节,而这一问题的解答还需要更多深入的研究,野外半控制长期试验应是必要且行之有效的方法。

