计算机模拟法探讨没药治疗骨肉瘤的作用机制
杨燕妮,勾伟颖,段辛威,李西海,陈友琴,马德尊,叶锦霞,付长龙,郑春松*
(1.福建中医药大学药学院,福建 福州 350122;2.福建中医药大学中西医结合研究院,福建 福州 350122;3.福建中医药大学中西医结合学院,福建 福州 350122;4.美国凯斯西储大学医学院,美国 俄亥俄州 44106;5.福建省中西医结合老年性疾病重点实验室,福建 福州 350122)
骨肉瘤(osteosarcoma,OS)是一种高发于青少年的常见原发性恶性骨肿瘤,具有发病率高、恶性度大、转移较早的特点[1]。目前西医治疗多采用手术治疗,辅以化疗等,但即使采用较强杀伤力的术前化疗方案,仍有20%~30%的患者疗效欠佳,表现为复发、转移和最终死亡。而且,在治疗过程中发现化疗药物对血液系统、胃肠道、肝脏、心脏、神经系统及泌尿系统等方面具有毒副作用[2]。因此,寻找安全、高效的药物来治疗OS 是急需解决的问题。
近年来,中医药在治疗OS 上发挥越来越重要的作用,有学者查阅了1979 年1 月—2014 年12 月中医诊疗OS 的文献,总结其用药规律,发现没药是OS 临床中使用频次高的活血化瘀中药[3]。现代药理研究表明,没药中天竺葵素(pelargonidin)、鞣花酸(ellagic acid)和槲皮素(quercetin)等化合物具有抑制OS 细胞增殖的作用,提示没药及其活性成分在治疗OS 方面有一定的开发价值[4-6]。但是,没药治疗OS 的具体作用机制未见相关报道。因此,本研究基于化学空间、相似度分析、网络药理学及分子对接的计算机模拟策略[7-8],探讨没药治疗OS 多成分、多靶点、多途径的整体调节作用机制,并将筛选出来的核心靶基因与对应的没药活性成分进行对接,以初步验证没药治疗OS 的主要成分和靶点,进而为其治疗OS 的后续实验提供方向,有助于没药的进一步开发和应用。
1 方 法
1.1 没药潜在及已报道活性成分数据集建立 利用中药系统药理学数据库及分析平台(TCMSP,https://tcmsp-e.com/)检索没药的化学成分[9],以口服生物利用度(oral bioavailability,OB)≥30%、类药性(drug likeness,DL)≥0.18 为阈值[7],筛选出其潜在活性成分。从中国知网数据库中检索具有抗OS作用的化合物,在Discovery Studio 2.0(简称DS 2.0)模拟平台[10],转化成三维分子结构,用MMFF 力场优化,分别建立没药潜在活性成分及已报道活性化合物的数据集sd 文件。
1.2 没药潜在及已报道活性成分数据集化学空间构建与分析 在DS QSAR 模块下,选择分子量、氢键受体数目、氢键给体数目、脂水分配系数和可旋转键数目等84 个分子描述符参数,分别构建没药和已报道活性成分数据集化合物的多维化学空间[11-12];利用主成分分析技术[13],降维到三维化学空间上。若两数据集中的化合物在化学空间上距离越近,代表具有相似作用的可能性越大[14],由此揭示没药治疗OS 的可能性。
1.3 没药潜在及已报道活性成分数据集的相似分子搜索 在DS Library Analysis 模块下,选择“Find Similar Molecular by Fingerprints”,以已报道活性成分数据集为Reference Ligands,以没药潜在活性成分数据集为Input Ligands,其余参数为缺省值。运行此Protocol,获得没药中与已报道活性成分结构特征相似的分子,以进一步确定没药治疗OS 的作用。
1.4 没药活性成分相关靶点与OS 疾病靶点收集 通过TCMSP 数据库获取没药活性成分对应的潜在靶点,利用DAVID 数据库的基因名称转换工具,将蛋白靶点转换为基因名,得到没药活性成分相关靶点基因。在GEO DataSets(https://www.ncbi.nlm.nih.gov/geo/)数据库中筛选出同时含有OS 与正常骨组织样本的基因芯片为GSE36004、GSE36001、GSE33383、GSE33382 和GSE14359,利用Log2 算法对基因表达数据进行整理,筛选出每个芯片中差异表达基因,同时在OMIM(https://www.omim.org/)、PharmGkb(https://www.pharmgkb.org/)、DrugBank(https://go.drugbank.com/)和GeneCards(https://www.genecards.org/)数据库中获取OS 疾病相关靶点,将上述数据库中的差异基因取并集,删除重复基因[15],作为OS 疾病基因集。
1.5 没药活性成分-OS 靶点作用网络构建 将没药活性成分的潜在靶基因与OS 疾病基因取交集,获得共同靶点,将共同靶点及其对应的没药活性成分导入Cytoscape 3.8.1 软件[16],构建没药活性成分-OS 靶点作用的网络。
1.6 蛋白质-蛋白质相互作用网络构建及核心靶点筛选 将“1.5”项下得到的交集基因导入STRING 11.5 数据库(https://cn.string-db.org/cgi/input)中,物种设置为“Homo sapiens”,选打分值高于0.9 的蛋白并除去网络中与其他靶点断开连接的节点,建立蛋白质-蛋白质相互作用(protein-protein interaction,PPI)网络,在Cytoscape 3.8.1 软件中对PPI 网络进行拓扑学分析[17],获得各节点介数中心性(betweenness centrality,BC)、接近中心性(closenness centrality,CC)、度中心(degree centrality,DC)、特征向量中心(eigenvector centrality,EC)、局部边联通性(local average centrality,LAC)和网络中心性(network centrality,NC)数值,以各拓扑学参数值均大于对应中位数值作为筛选条件[18],得到核心靶基因。
1.7 GO 和KEGG 富集分析 利用基于R 语言、面向基因组信息分析的Bioconductor 软件合集[19],对交集基因进行基因本体论(gene ontology,GO)和京都基因和基因组百科全书(Kyoto encyclopedia of genes genomes,KEGG)富集分析,设定阈值P<0.05,探索没药中各化合物作用潜在靶点的生物学功能及可能参与的代谢通路。
1.8 核心靶点的分子对接验证 选择“1.6”项下核心靶基因及其对应的活性成分进行分子对接[20],即在PubChem 数据库中查找没药活性成分的2D 化学结构,用ChemOffice 软件转化为3D 结构并进行能量最小化优化,保存为MOL2 格式。使用PBD 网站(https://www.rcsb.org/)下载靶蛋白的3D 结构,保存为pbd 格式,导入PyMol 2.4.1 软件中,删除水分子以及原配体,然后导入AutoDockTools 1.5.6 软件,对靶蛋白与药物小分子进行处理并转换为pdbqt 格式,并设置活性口袋(Grid Box)大小,运用Vina 进行分子对接,获取没药活性成分与靶蛋白的对接结果,用PyMol 软件打开查看对接图片结果,绘制结合模式图。
2 结 果
2.1 没药潜在活性成分筛选 根据筛选条件OB≥30%和DL≥0.18,从TCMSP 平台中筛选出没药有45 个潜在活性成分,其中有槲皮素、豆甾醇、鞣花酸等,见表1。

表 1 没药活性成分及其参数值
2.2 没药潜在及已报道活性成分数据集的化学空间和相似度分析 没药潜在活性成分数据集在化学空间上具有较好的分散性,与已报道活性成分数据集有相同或相近的化学空间,见图1。两者在分子量、氢键受体、氢键给体、脂水分配系数、环数目和可旋转键数方面,具有很大部分的重叠,见表2。
2.3 没药潜在及已报道活性成分数据集的相似分子搜索 以已报道活性成分数据集为参照配体,以Tanimoto相似系数为评价指标,从没药潜在活性成分数据集筛选出相似的分子MOL000098、MOL001001、MOL001126、MOL000358和MOL000449,相似度值分别为1、0.733、0.544、0.472 和0.466。
2.4 没药活性成分-靶点作用网络构建 在TCMSP数据库中收集到没药潜在活性成分对应的靶点基因共393 个;在OMIM、PharmGkb、DrugBank、GEO 和GeneCards 数据库中共得到5 114 个OS 疾病差异表达基因。取交集,得到共同靶点129个,在TCMSP中对应的没药潜在活性成分32 个,在Cyotoscape 3.8.1软件中构建没药活性成分-靶点作用网络,结果显示,网络中有161 个节点,283 条边;且有3 个化合物只作用1 个靶点,有8 个作用2 个靶点,有21 个作用3 个及以上靶点,见图2。
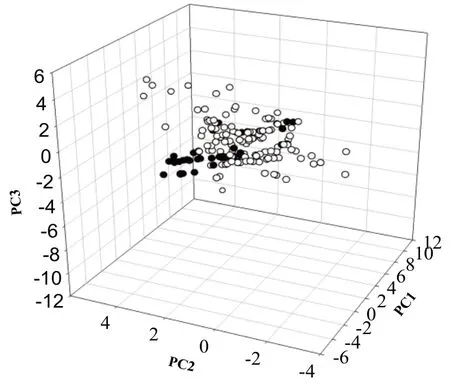
图1 没药潜在及已报道活性成分数据集的化学空间图
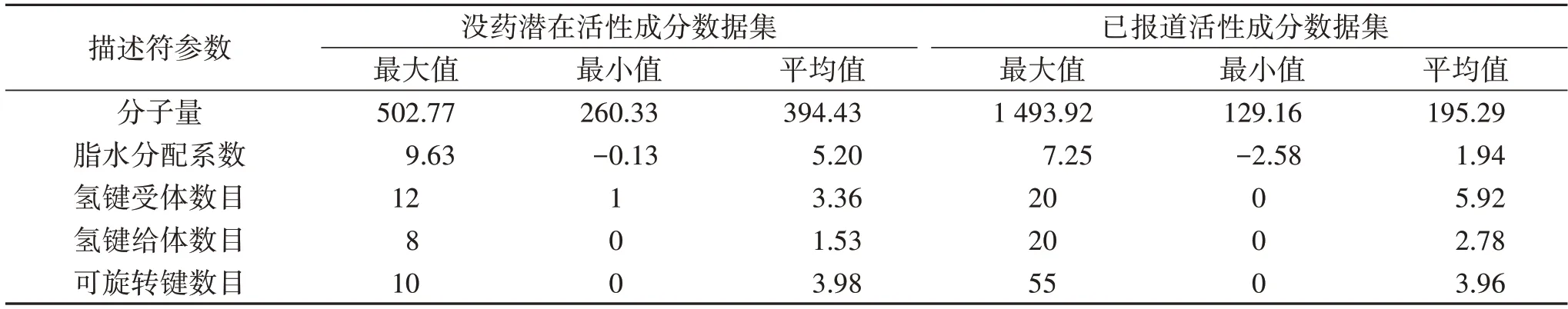
表2 没药潜在及已报道活性成分数据集的描述符值

图2 没药活性成分-交集靶点网络图
2.5 没药治疗OS 的PPI 网络构建及其核心靶点筛选 把129 个交集基因导入STRING 数据库中,得到没药治疗OS 的PPI 网络,结果显示,网络中有116 个节点,449 条边,见图3。在Cyotoscape 3.8.1软件中对119 个基因进行2 次网络拓扑学筛选,得到没药治疗OS 的8 个潜在核心基因,分别为Akt 丝氨酸/苏氨酸激酶(Akt serine/threonine kinase 1,Akt1)、丝裂原活化蛋白激酶(mitogen-activated protein kinase 1,MAPK1)、FOS 原癌基因(fos proto-oncogene,FOS)、热 休 克蛋 白90 α 家 族A 类 成员1(heat shock protein 90 alpha family class A member 1,HSP90AA1)、JUN 原 癌 基 因(Jun proto-oncogene,JUN)、雌激素受体相关受体1(estrogen receptor 1,ESR1)、RELA 原癌基因(RELA proto-oncogene,RELA)和MYC 原癌基因(MYC proto-oncogene,MYC),结果见图4。

图3 没药治疗骨肉瘤的蛋白质-蛋白质相互作用网络图
2.6 GO 和KEGG 富集分析
2.6.1 GO 功能富集分析 对129 个交集基因进行GO 富集分析,共有2 174 条结果,其中BP 共有1 987 条结果,主要集中在对药物的应答(response to drug)、辐射的应答(response to radiation)、化学应激(cellular response to chemical stress)、脂多糖的应答(response to lipopolysaccharide)、细菌来源分子的应答(response to molecule of bacterial origin)、金属离子的应答(response to metalion)、氧水平的应答(response to oxygen levels)、类固醇激素的应答(response to steroid hormone)、活性氧代谢过程(reactive oxygen species metabolic process)等;CC 共 有40 条结果,主要集中在膜筏(membrane raft)、膜微区(membrane microdomain)、细胞器外膜(organelle outer membrane)、外膜(outer membrane)、线粒体外膜(mitochondrial outer membrane)、丝氨酸/苏氨酸蛋白激酶复合物(serine/threonine protein kinase complex)、蛋白激酶复合物(protein kinase complex)、髓鞘(myelin sheath)等;MF 富集共有147 条结果,主要有DNA-转录因子结合(DNA-binding transcription factor binding)、RNA 聚合酶Ⅱ-特异性DNA-转录因子结合(RNA polymerase Ⅱ-specific dna-binding transcription factor binding)、泛素样蛋白连接酶结合(ubiquitin-like protein ligase binding)、泛素蛋白连接酶结合(ubiquitin protein ligase binding)、核受体活性配体激活(ligand-actived nuclear receptor activity)、转录因子活性(transcription factor activity)、丝氨酸水解酶活性(serine hydrolase activity)、类固醇激素受体活性(steroid hormone receptor activity)、转录共调节结合(transcription coregulator binding)、转录共激活剂结合(transcription coactivator binding)等。取各类富集分析前10 个结果作气泡图,见图5。
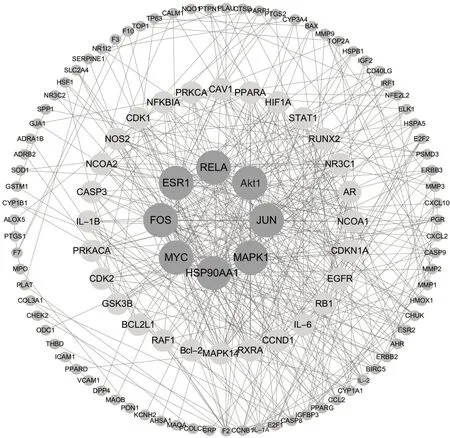
图4 没药治疗骨肉瘤的核心靶基因网络图
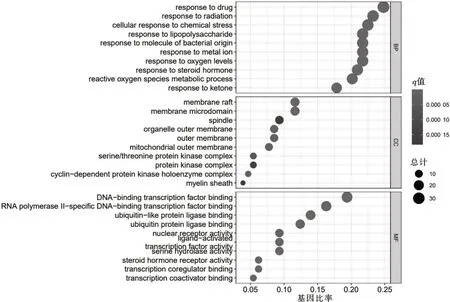
图5 没药GO 功能富集分析图
2.6.2 KEGG 富集分析 KEGG 富集分析有172 条信号通路,主要有脂质和动脉粥样硬化(lipid and atherosclerosis)、卡波西肉瘤相关化学致癌-受体活化(Kaposi sarcoma-associated chemical carcinogenesis-receptor activation)、疱疹病毒感染(herpesvirus infection)、人类巨细胞病毒感染(human cytomegalovirus infection)、乙型肝炎(hepatitis B)、前列腺癌(prostate cancer)、流体剪切应力和动脉粥样硬化(fluid shear stress and atherosclerosis)、丙 型 肝 炎(hepatitis C)、爱泼斯坦-巴尔病毒感染(Epstein-Barr virus infection)、糖尿病并发症中AGE-RAGE信号通路作用(AGE-RAGE signaling pathway in diabetic complications)、人T 细 胞 白 血 病 病 毒1 感 染(human T-cell leukemia virus 1 infection)、肿瘤坏死因子信号通路(TNF signaling pathway)、癌症中蛋白聚糖(proteoglycans in cancer)、IL-17 信号通路(IL-17 signaling pathway)、内分泌抵抗(endocrine resistance)、细胞衰老(cellular senescence)、雌激素信号通路(estrogen signaling pathway)细胞凋亡(apoptosis)、C-型凝集素受体信号通路(C-type lectin receptor signaling pathway)、p53 信 号(p53 signaling pathway)通路、慢性骨髓性白血病(chronic myeloid leukemia)以及肝细胞癌(hepatocellular carcinoma)、小细胞肺癌(small cell lung cancer)、乳腺癌(breast cancer)等癌症相关通路等,前30 条富集结果见图6。

图6 没药KEGG 富集分析结果图
2.7 分子对接 对8 个没药治疗OS 的核心靶点及其对应的活性成分进行分子对接,结果显示没药的化学成分与上述8 个核心靶点的结合能均<-4 kcal/mol,表现出良好的结合能力,见表3。
3 讨 论
中医学认为,血瘀日久致毒,瘀毒相互胶着,合而为害,蕴而生变,终成肉瘤,提示瘀血内阻为OS 的重要病机之一,治疗上可从活血化瘀论治[3]。而且,现代药理学研究也表明活血化瘀法可通过调节机体的HIF-1α、CD4+T 细胞发挥对荷骨肉瘤裸鼠的治疗作用[21]。因此,本文选择临床上治疗OS常用的活血化瘀药没药为研究对象,进一步探究其治疗OS 的机制。
本文先通过化学空间和相似度搜索技术,预测没药治疗OS 的可能性,根据化学空间理论,相似化学空间的化合物往往具有相似的药理活性[22],提示没药与已报道活性成分数据集有相同或相近的化学空间,即没药具有潜在抗OS 的作用。另外,相似度搜索发现没药中quercetin(MOL000098)、quercetin-3-O-β-D-glucuronide(MOL001001)等与已报道活性成分数据集具有相似的结构特征,根据“结构类似的化合物具有类似的生物活性”[23],揭示没药中存在抗OS 的活性化合物,为进一步研究没药治疗OS 的网络药理学机制提供新依据。
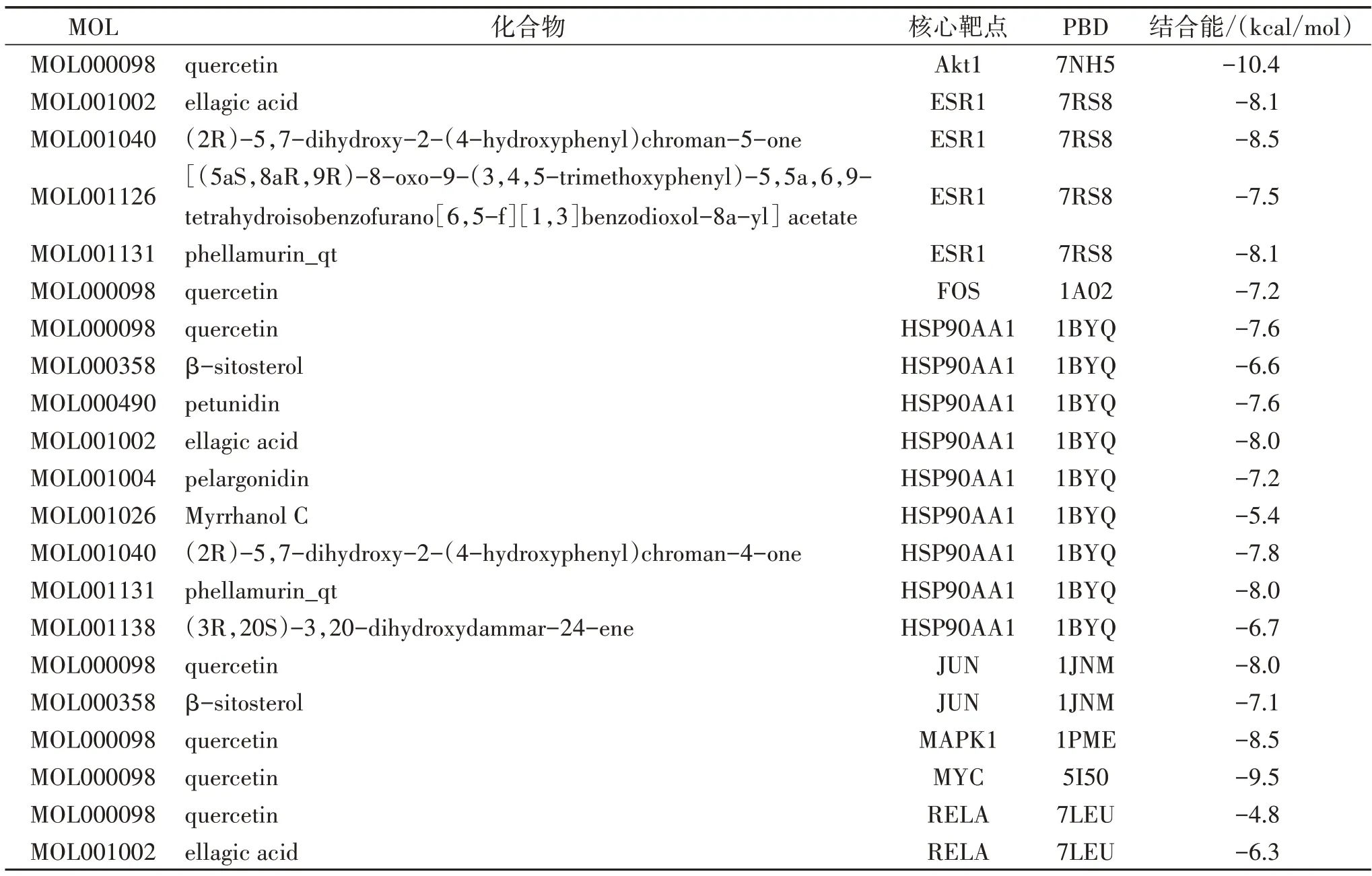
表3 没药活性成分与核心靶点分子对接结果
从没药治疗OS的活性成分-靶点网络得到32个活性成分,包括槲皮素(quercetin)、鞣花酸(ellagic acid)、β-谷甾醇(β-sitosterol)、天竺葵素(pelargonidin)等。文献报道,槲皮素能够影响骨肉瘤细胞增殖、凋亡、侵袭和化疗耐药的能力,起到抗OS 的作用[6];鞣花酸能抑制骨肉瘤细胞的生长、迁移和侵袭,并通过抑制c-Jun 的转录诱导G1 细胞周期阻滞[5];天竺葵素能通过诱导自噬、线粒体膜电位丧失、G2/M 细胞周期和下调PI3K/Akt 信号通路诱导人骨肉瘤细胞的抗肿瘤作用[4]。因此,没药可通过槲皮素、鞣花酸、天竺葵素等多成分治疗OS。
从没药治疗OS 的PPI 网络拓扑分析得到核心基因Akt1、MAPK1、FOS、HSP90AA1、JUN、ESR1、RELA、MYC。研究发现,上调Akt1的表达可促进OS的肺转移,下调AKT1 的表达可明显抑制MAT1 介导的骨肉瘤细胞迁移和侵袭的促进作用,抑制裸鼠移植瘤生长,减少转移性肺肿瘤的数量[24];HSP90AA1作为一种重要的自噬调节剂,抑制HSP90AA1 可减弱骨肉瘤细胞对化疗的自噬保护作用[25];MYC 高表达与OS转移及不良预后显著相关,降低MYC蛋白的表达,导致骨肉瘤细胞增殖、迁移等能力下降[26]。因此,没药可通过多个靶点影响骨肉瘤细胞的增殖、迁移和侵袭等。
通过KEGG 富集分析发现,没药活性成分治疗OS 的基因主要集中在TNF、IL-17、p53 和凋亡等信号通路。研究表明,TNF 通路参与调节细胞炎症反应、细胞生存、凋亡等重要生物过程,TNF 可以和其受体TNFR 结合,作用于下游信号NF-κB,TNF/NF-κB 信号通路被激活后,可以增加CRL4BDACF11的活性,提高P21Cip蛋白的表达水平,从而阻滞骨肉瘤细胞生长周期,发挥抑制OS 的作用[27-28];IL-17 信号通路与OS 呈负相关,与转移呈正相关[29];激活p53 信号通路可抑制骨肉瘤细胞增殖,促进骨肉瘤细胞凋亡[30-31]。因此,没药可通过多通路影响骨肉瘤细胞的增殖、凋亡等方面,发挥抗OS 的作用。
综上所述,本研究通过计算机模拟方法,初步预测没药治疗OS 的作用及其机制,从结果可知,没药可通过槲皮素、鞣花酸和天竺葵素等成分,作用于Akt1、JUN 和MYC 等靶点,在TNF 信号通路、IL-17 信号通路、p53 信号通路等参与下,抑制骨肉瘤细胞的增殖、迁移和侵袭等,发挥治疗OS 的作用,为后期实验进一步研究提供方向。

