高苯丙氨酸血症遗传分型与诊治
梁黎黎
上海交通大学医学院附属新华医院儿内分泌遗传科 上海市儿科医学研究所(上海 200092)
高苯丙氨酸血症(hyperphenylalaninemia,HPA)是因苯丙氨酸羟化酶(phenylalaninehydroxy 1 ase,PAH)或其辅酶四氢生物蝶呤(tetrahydrobiopterin,BH4)缺陷,导致血苯丙氨酸(pheny1a1anine,Phe)不能正常代谢、苯丙氨酸及其旁路代谢产物蓄积,进而引起脑损伤的一组疾病,如不治疗将出现智力低下、癫痫和行为问题。HPA为常染色体隐性遗传,在我国的患病率为1/10397[1]。根据缺陷酶的不同,治疗的核心为低Phe饮食疗法和/或神经递质药物补充治疗。随着新生儿筛查和防治技术的发展[2]、诊断和鉴别诊断方法的进步、治疗的规范和细化,HPA已逐渐成为可防可治的疾病。
1 HPA遗传背景与分类
人体摄入食物中蛋白质分解产生的Phe 在肝脏PAH 的作用下转化成酪氨酸,PAH 缺陷及其辅酶BH 4 合成缺陷可导致HPA,引起苯丙氨酸及其旁路代谢如苯丙酮酸、苯乙酸和苯乳酸在体内蓄积,通过血脑屏障后导致脑髓鞘发育不良或脱髓鞘等脑白质异常,引起神经系统损害。除PAH 外,BH 4 也是酪氨酸羟化酶及色氨酸羟化酶的辅酶,因此,BH 4 缺陷还会导致对应酶的产物,如多巴、5-羟色胺等神经递质减少,引起相应的神经系统症状[3]。在BH 4 生物合成的过程中,鸟苷三磷酸环化水解酶(GTPcyclohydrolase,GTPCH)作为第一步限速酶,催化尿苷三磷酸形成三磷酸二氢新蝶呤,后者在6-丙酮酰四氢蝶呤合成酶(6-pyruvoyl tetrahydropterinsynthase,PTPS)的催化下生成6-丙酮酰四氢蝶呤,6-丙酮酰四氢蝶呤在墨蝶呤还原酶(sepiapterinreductase,SR)的作用下生成BH4。此外另有两种酶,即蝶呤-4α-甲醇氨脱水酶(pterin-4αcarbinolaminedehydratase,PCD)、二氢蝶啶还原酶(dihydropteridinereductase,DHPR)参与维持BH4从芳香族氨基酸羟基化过程中产生的中间产物的再生过程(图1)。近年研究发现,DNAJC12作为PAH的分子伴侣,促进PAH 单体的正确聚集和折叠[4]。以上代谢过程中的酶对应的基因出现变异,均可导致HPA,以上7 个致病基因导致的HPA 均为常染色体隐性遗传[5]。自然病程中,HPA 患儿新生儿期多无临床症状。出生3~4 个月后逐渐表现发色变黄,皮肤变白,尿液、汗液呈鼠臭味,头围小,智力较同龄儿落后、癫痫发作、行为异常。BH4缺乏症患儿除表现PKU症状外,还可出现肌张力异常。
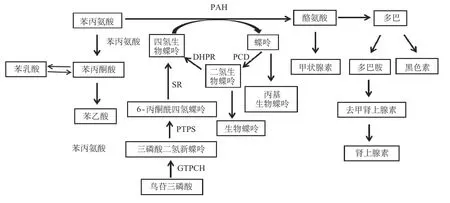
图1 苯丙氨酸代谢图
目前将血Phe浓度≥120μmo1/L(2 mg/dL)且血Phe与酪氨酸(tyrosine,Tyr)比值(Phe/Tyr)≥2.0的一组疾病统称为HPA[6]。根据不同的分类依据,HPA 可分为不同类型。①根据缺陷酶的不同,HPA可分为PAH 缺乏症和BH 4 缺乏症,以及分子伴侣DNAJC12缺陷(表1)。其中,BH4缺乏症包括DHPR缺乏症、PTPS 缺乏症、GTPCH 缺乏症、PCD 缺乏症和SR 缺乏症[5,7]。HPA 中约90%为PAH 缺陷所致[8],2000~2007年我国新生儿筛查资料显示,HPA中BH 4 缺乏症约占12.9%,其中PTPS 缺乏症占96%[9,10]。②根据治疗前血最高Phe浓度,PAH缺乏症可分为经典型苯丙酮尿症(phenylketonuria PKU);血Phe ≥1200 μmo 1/L;轻度PKU:血Phe 360~1 200μmo1/L;轻度HPA:血Phe 120~360μmo1/L[1]。③根据血Phe浓度对BH4的治疗反应分为BH4反应性和BH4无反应性PAH缺乏症。经BH4负荷后,任意时间点血Phe浓度较负荷前基础值下降≥30%者为BH 4 反应性,<30%者为BH 4 无反应性PAH 缺乏症[1,12]。
2 HPA诊断要点
目前国内绝大多数HPA 患儿通过新生儿筛查确诊。采集出生72 h(哺乳6~8次以上)的新生儿足跟血,滴于专用干血滤纸片,采用荧光法或串联质谱法(MS/MS)测定血Phe 浓度。需注意,早产、发热、感染、肠外营养、输血等因素可造成假阳性,蛋白摄入不足可导致假阴性。对于新生儿筛查或临床高危筛查血Phe 增高者,建议采用定量法同时测定血Phe、Tyr浓度,计算Phe/Tyr。筛查原标本血Phe浓度≥120μmo1/L,同时伴有Phe/Tyr≥2.0为阳性,需召回复查,复查仍阳性则需进行后续鉴别诊断[1,6],包括尿蝶呤谱分析、红细胞DHPR 活性测定和基因检测,以确定病因和分型。
尿蝶呤谱分析根据蝶呤合成过程中不同蝶呤的含量,从生化层面分析BH 4 合成过程中的缺陷酶;红细胞DHPR 活性测定可特异性诊断DHPR 缺乏症(表1)。而对于基因检测,可根据患儿Phe浓度等初步生化检测结果,选择7 个致病基因(表1)中的某个基因进行Sanger 测序,也可以直接选择下一代测序,如全外显子测序。需要注意的是,PAH基因除点突变外,尚有2%左右存在外显子缺失[13-14],对于此基因,无论选择Sanger测序还是全外显子测序,均需同步进行外显子缺失的检测,可采用多重连接探针扩增技术(multiplex ligation-dependent probe amplification,MLPA)进行。
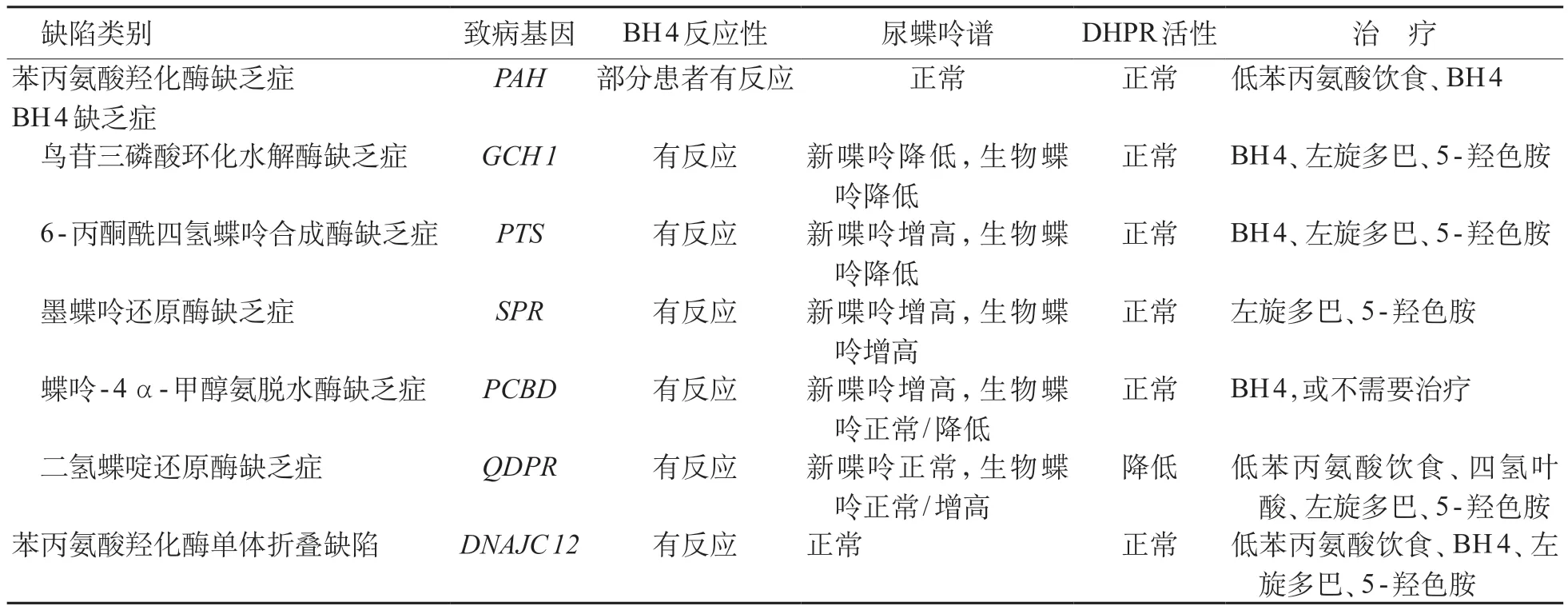
表1 高苯丙氨酸血症的疾病分类、致病基因、生化和治疗
除以上生化和基因检测之外,BH4负荷试验为BH4缺乏症的辅助诊断方法,也是判断HPA的BH4反应性的方法。试验前留取血Phe 和尿蝶呤标本,在服用BH 4 后的特定时间点多次留取标本检测血Phe 和尿蝶呤谱,以此判断是否为BH 4 缺乏症,以及患者对BH4的反应性,具体操作方法见文献[1]。与PAH缺乏症相比,BH4缺乏症患儿血Phe浓度在服BH4后下降迅速,降幅较大。其中,PTPS 缺乏症常在服药后2~6 小时迅速下降至正常,而DHPR 缺乏症下降相对缓慢[1]。如服用BH 4 后8~24 小时血Phe均下降30%以上,则为BH4反应性HPA;Phe下降不足30%,则为BH4无反应性HPA[15]。2021年日本BH4反应性HPA诊治指南提出,所有HPA患者,包括通过新生儿筛查诊断的PKU患者,都应该通过BH4给药进行鉴别诊断。一旦患者被诊断为对BH4反应性HPA,推荐使用BH 4 治疗,包括4 岁以下的患者[16]。
除以上生化和分子检测外,头颅影像学检查可辅助评估患儿脑损伤的程度。未经治疗的患儿可出现脑白质异常、髓鞘发育不良、脑萎缩、继发性癫痫[18]。对脑白质病变程度评估,MRI优于CT。磁共振波谱分析可评估PKU 患儿脑内Phe 浓度高低,但技术难度较高[18-19]。合并癫痫的患者,脑电图检查亦常提示异常。
3 HPA的治疗及展望
不同的国家HPA治疗时血Phe浓度的控制目标不同。美国提倡将Phe浓度终生控制于360 μmo1/L以下。欧洲建议12岁以下的患者需将Phe浓度控制于360 μmo 1/L 以下,12 岁以上的患者血Phe 浓度控制于600 μmo 1/L 以下即可。我国目前各年龄段血Phe浓度控制目标为:1岁以下120~240μmo1/L,1~12岁120~360μmo1/L,12岁以上120~600μmo1/L,孕妇患者120~360μmo1/L[1,6]。治疗过程中定期监测患儿智力水平、体格发育、血Phe 浓度,并进行营养评价,注意其他氨基酸、微量元素、多种维生素以及矿物质是否缺乏。药物治疗的患者,还需注意有无不良反应,需特别注意神经系统症状和消化系统症状。
PAH缺乏症及BH4缺乏症均为可治疗的遗传代谢病,需要多学科的综合管理,治疗主要包括饮食治疗和药物治疗。PAH 缺乏症侧重于饮食治疗,BH 4缺乏症侧重于药物治疗(表1)。
3.1 PAH缺乏症的常规治疗
3.1.1 饮食治疗 低Phe 饮食是PAH 缺乏症治疗和营养管理的核心。通过限制天然蛋白的摄入,控制血Phe浓度在推荐范围,同时保证营养全面以满足生长发育的需要。中华预防医学会2019年制定的PAH缺乏症饮食治疗与营养管理共识提出,在正常蛋白质摄入情况下,对于≤12 岁血Phe ≥360 μmol/L,以及>12 岁血Phe≥600 μmol/L的PAH缺乏症患者均应饮食治疗[6]。由于患者PAH 酶活性不同,对Phe耐受量存在个体差异,因此低Phe饮食需个体化地根据相应年龄段儿童每日蛋白质需要量、血Phe浓度、Phe耐受量、饮食嗜好等作相应调整[6,8]。
3.1.2 BH4治疗 对BH4反应型PAH缺乏症患儿,特别是饮食治疗依从性差者,可口服BH4 5~20mg/(kg·d),分2 次,或联合低Phe 饮食,可提高患儿对Phe的耐受量,适当增加天然蛋白质摄入量,改善生活质量及营养状况,提高治疗依从性[21]。女性患者如孕期Phe控制不佳,可引起胎儿脑发育障碍及多种畸形的发生,即“母源性PKU综合征”,对于孕期Phe未能控制于360μmo1/L以下的孕妇患者,日本学者也建议联合BH4治疗,以减少母源性PKU综合征的发生[22]。
3.2 BH4缺乏症的常规治疗
BH4缺乏症的治疗包括控制血Phe浓度及纠正神经递质水平异常。可按不同病因给予BH 4 或无Phe特殊饮食及神经递质前体治疗,强调终生治疗。
3.2.1 BH4或特殊饮食治疗 PTPS缺乏症、GTPCH缺乏症及PCD 缺乏症患者正常饮食情况下,口服BH4 2~10 mg/(kg·d),分2~4次[1,3]。DHPR缺乏症则需要更大剂量的四氢叶酸12~20 mg/(kg·d),并联合低Phe 饮食治疗,争取血Phe 浓度控制于120~240μmo1/L[1,3]。
3.2.2 神经递质前体等治疗 绝大多数PTPS缺乏症及DHPR缺乏症需要补充多巴及5-羟色氨酸。左旋多巴、5-羟色氨酸宜从小剂量开始,每周递增,剂量调整期间需密切监测患儿血Phe 浓度和肌张力。由于多巴剂量不足可导致泌乳素增高,故血清泌乳素亦可作为多巴剂量调节的参考指标[3]。
3.3 DNAJC12缺陷的治疗
近年来发现的PAH分子伴侣DNAJC12缺陷导致的HPA,其对BH 4 负荷试验有反应,尿蝶呤谱正常,治疗经验较少,通过病例治疗的经验得知,其治疗类同BH 4 缺乏症,对低苯丙氨酸饮食、BH 4 及神经递质治疗有效(表1)[5,23]。
3.4 HPA治疗展望
3.4.1 饮食治疗 HPA 患者的饮食限制过度容易造成蛋白质摄入不足,导致体内蛋白质合成减少和内源性蛋白质分解增加,进而造成血Phe浓度增高。此外,低Phe饮食结构下,50%以上的蛋白质来源于无Phe 特殊医学用途配方食品,而此类食品中的氨基酸为L-氨基酸。L-氨基酸比天然蛋白质的吸收和氧化速率快,体内生物利用率较低,故患者需额外补充20 %~40 %的蛋白量[8]。Phe是必需氨基酸,治疗过程中Phe 应满足摄入量要求,同时监测酪氨酸浓度。2019年发表的PAH饮食治疗与营养管理专家共识,借鉴了我国HPA治疗的临床实践和国内外最新的临床指南和共识,详细归纳了不同年龄PAH缺乏症患者每日Phe、Tyr和蛋白质的推荐摄入量[6]。
此外,患儿的能量需求、必需脂肪酸、维生素和矿物质的推荐摄入量与正常儿童一致[8,20,24]。但由于低Phe 饮食缺乏肉类、鱼虾类、坚果和乳制品等,故长链多不饱和脂肪酸、多种维生素(维生素B 12、维生素B6、维生素A、维生素D、叶酸等)、左卡尼汀、矿物质及微量元素的摄入量容易不足,故膳食中需要注意补充[6,20,25]。
3.4.2 药物治疗 由于长期的饮食治疗对患者生活质量存在影响,依从性随年龄下降而减低,其他治疗方法也在被积极研发,但总体临床使用经验尚有限,需要积累。
大分子中性氨基酸包括支链(缬氨酸、亮氨酸和异亮氨酸)、芳香族氨基酸(Phe、Tyr 和色氨酸)及组氨酸、苏氨酸和蛋氨酸。高血Phe 通过脑毛细血管上转运体的竞争性抑制,引起脑中神经递质前体氨基酸的缺失,神经递质合成减少,引起神经症状。已有研究证实,在补充大分子中性氨基酸后,HPA患者的神经心理学症状和脑电图异常情况得到改善[26],目前临床建议应用于不能严格饮食控制的12岁以上患者(孕妇除外)[20]。
苯丙氨酸氨解酶是一种植物中将苯丙氨酸脱氨为肉桂酸和氨的中间酶,用于人类HPA 的治疗,最初尝试的口服剂型疗效不佳,进一步通过克隆基因、体外表达并聚乙二醇修饰制成皮下注射的剂型,并在美国获得批准上市,用于血苯丙氨酸难于控制的成人患者。给药后患者血Phe 浓度大幅、持续减少,但过敏反应出现概率较高[27-28]。为减少过敏反应,有学者研究发现负载苯丙氨酸氨解酶的自体红细胞每周输注可有效降低HPA 小鼠Phe 浓度,并计划进行人类临床试验[5]。
糖巨肽是从乳清蛋白中提取出的一种天然的低苯丙氨酸蛋白质,其饱腹感和口感比传统的低Phe饮食更好,可提高患儿治疗的依从性[29]。Sepiapterin是BH 4 的前体,可以作为分子伴侣,刺激突变的PAH 残余的酶活性,降低血Phe浓度[5]。此外,基因疗法也处于临床前的试验和探索阶段,科学家正尝试将正常的PAH cDNA或PAH mRNA导入肝细胞,其有效性和安全性尚未公布[5]。
4 结语
HPA作为最常见的一类遗传代谢病,具有复杂的分子机制和疾病亚型。致病基因不同,Phe 浓度、BH4反应性、尿蝶呤谱及后续的治疗方案有显著差异。PAH 缺乏症侧重于饮食治疗,辅以药物治疗;而BH 4 缺乏症则以药物治疗为主,部分辅以饮食治疗。虽然绝大多数患者在新生儿筛查过程中已获诊断并早期启动饮食治疗防止脑损伤,但仍需通过生化和基因检测仔细甄别疾病分型,待分型明确后调整相应治疗,并长期规范随访,才能获得良好的预后。

