白芍总苷对雷公藤多苷治疗湿疹的增效减毒作用及机制 Δ
张明昊 ,王珍 ,高一盈 ,薛鹏坤 ,马伟洋 ,董文霞 ,马丽亚 ,张大伟 (.河南中医药大学医学院,郑州 450046;.河南中医药大学临床技能实训中心,郑州 450046;.河南中医药大学第三附属医院妇产科,郑州 450008)
湿疹是一种常见的炎症性皮肤病,发病率逐年升高,具有皮损对称分布、剧烈瘙痒、反复发作等特点[1]。目前,西医常以糖皮质激素类药物外用行局部治疗,或者使用H1受体拮抗剂行全身治疗,或者以糖皮质激素等免疫抑制剂行免疫治疗(严重者);患者接受上述药物治疗后,其症状虽能在短期内得以缓解,但难以有效治愈,且停药后易出现“反跳”现象并发生不良反应[2―3]。
雷公藤多苷(Tripterygium wilfordii polyglycoside,TWP)是提取自雷公藤Tripterygium wilfordii Hook. f.根部的脂溶性总苷,具有抗炎、抗肿瘤及调节免疫的作用[4]。白芍总苷(total glucosides of paeony,TGP)是提取自芍药Paeonia lactiflora Pall.的糖苷类物质,是中药白芍的有效成分,具有抗炎、抗氧化、保肝肾和调节免疫的作用,可用于湿疹的临床治疗[5]。本课题组前期研究发现,TWP(9.45 mg/kg)对湿疹模型大鼠有较好的干预作用,但会造成部分大鼠死亡[6]。该实验所用剂量是根据成人用量(105 mg/d)折算而得,结合文献报道的“成人口服TWP 60 mg/d连续1个月即会出现肝肾功能异常”[4],本课题组推测前期研究所用剂量致大鼠死亡可能与TWP的肝肾毒性有关。
p38丝裂原激活的蛋白激酶(p38 mitogen-activated protein kinase,p38 MAPK)通路是具有丝氨酸和酪氨酸双重磷酸化功能的蛋白激酶通路,参与炎症反应的调控及湿疹、皮炎等疾病的发生[7―8]。氧化应激在肝肾损伤过程中具有重要作用,超氧化物歧化酶(superoxide dismutase,SOD)等抗氧化酶耗竭将导致机体清除氧自由基的能力减弱,从而造成肝肾损伤[9]。考虑到抗炎是湿疹治疗的一个重要思路,而氧化应激与肝肾损伤密切相关,故本实验拟从p38 MAPK通路和抗氧化角度出发,基于TGP、TWP的抗炎作用和TGP的抗氧化、保肝肾作用,以临床常用湿疹治疗药物氯雷他定为阳性对照,探讨两药配伍后的抗炎增效和肝肾减毒作用,旨在为湿疹的临床治疗提供新的方向。
1 材料
1.1 主要仪器
本研究所用的主要仪器有SpectraMax iD3型酶标仪[美谷分子仪器(上海)有限公司],CX23型光学显微镜(日本Olympus公司),6300型化学发光仪(上海勤翔科学仪器有限公司),RM2235型石蜡切片机(德国Leica公司),YD-6D型组织包埋机、YD-A型组织摊片机、YD-B型组织烤片机(金华市科迪仪器设备有限公司),BV-2型垂直电泳仪、BT-2型转印电泳仪(武汉赛维尔生物科技有限公司)等。
1.2 主要药品与试剂
1.3 实验动物
健康雄性SD大鼠,8周龄,体质量180~200 g,购自郑州市惠济区华兴实验动物养殖场,动物生产许可证号为SCXK(豫)2019-0002。所有大鼠均分笼饲养于河南中医药大学医学机能实验室(室温20~22 ℃,相对湿度55%~60%,正常光照),并自由饮水、摄食。本实验方案获河南中医药大学实验动物伦理委员会批准(编号DWLL202201010),实验过程及动物处置严格遵守“3R”原则。
2 方法
2.1 分组、造模与给药
取雄性SD大鼠50只,适应性饲养1周后,脱其腹部及背部毛,裸露皮肤(面积2 cm×2 cm),以DNFB-丙酮橄榄油溶液(体积比4∶1,下同)100 μL涂抹于大鼠腹部脱毛区致敏,每天1次,连续2 d。首次致敏5 d后,以DNFB-丙酮橄榄油溶液100 μL涂抹于大鼠背部脱毛区激发,同时以DNFB-丙酮橄榄油溶液5 μL涂抹于大鼠右耳内外侧激发,每3天1次,共5次,以脱毛区出现红斑、水肿、脱屑为标准,建立湿疹大鼠模型[10]。将50只湿疹模型大鼠随机分为模型组、氯雷他定组、TWP组、TGP组和配伍组(TWP+TGP),每组10只;另取10只大鼠,作为正常组。氯雷他定、TWP、TGP成人(体质量70 kg)用量分别为10、105、1 800 mg,根据公式S大鼠/200g=0.018×S人/70 kg(S大鼠/200g、S人/70kg分别为大鼠、人用量),换算得大鼠氯雷他定、TWP、TGP的用量分别为0.9、9.45、162 mg/kg,故以此作为各药物组的给药剂量。上述药物均以0.1%羧甲基纤维素钠溶液为溶剂,制备相应混淆液并于首次致敏3 d后开始灌胃,各药物组大鼠的灌胃体积为10 mL/kg;正常组和模型组大鼠灌胃等体积0.1%羧甲基纤维素钠溶液,每天1次,连续21 d。
2.2 取材及处理
末次给药24 h后,称定各组大鼠体质量,并腹腔注射氨基甲酸乙酯1 g/kg进行麻醉,观察大鼠背部皮肤外观情况;于腹主动脉取血,以3 000 r/min离心10 min,取上清液于-80 ℃下保存;然后,沿耳基线剪下双耳,用8 mm打孔器在左右耳中部同一位置打孔取圆形耳片,称定质量;剖取大鼠背部皮肤组织,以生理盐水冲洗后分为2份,其中1份用4%中性甲醛溶液固定,1份用液氮速冻后于-80 ℃下保存;剖取大鼠肝脏、肾脏,以生理盐水清洗后用液氮速冻后于-80 ℃下保存。
2.3 大鼠一般情况观察与湿疹严重度评分
观察各组大鼠的一般情况并对其背部皮肤湿疹严重度进行评分。评分参考湿疹面积及严重度指数(eczema area and severity index,EASI)评分法[11]并略作改动,仅以红斑、水肿的变化情况来评估药物的干预效果,具体标准如下:红斑、水肿的严重程度均包括无、轻微、中度、中重度、重度,分别记0、1、2、3、4分;综合评分为红斑、水肿评分的总和。
2.4 大鼠耳肿胀度检测
称定各组大鼠圆形耳片的质量,并按下式计算耳肿胀度:耳肿胀度(mg)=右耳片质量(mg)-左耳片质量(mg)。
2.5 大鼠皮肤组织形态学观察
取“2.2”项下固定于中性甲醛溶液的背部皮肤组织,经梯度乙醇脱水、二甲苯透明、石蜡包埋后切片(4 μm),再经二甲苯脱蜡、苏木精-伊红(HE)染色、梯度乙醇脱水、二甲苯透明,以中性树胶封片,置于光学显微镜下观察皮肤组织病理学变化。大鼠背部皮肤病变程度评价参考Fukuda等[12]提出的组织病理学评分方法并略作改动,仅对表皮损伤、增厚、过度角化、真皮水肿和炎症5个方面进行评分,具体标准如下:上述5个方面的严重程度均包括相对正常、轻度、中度、中度到显著、显著,分别记0、1、2、3、4分;病理评分为表皮损伤、增厚、过度角化、真皮水肿、炎症程度评分的总和。
2.6 大鼠皮肤组织中p38 MAPK、p-p38 MAPK蛋白表达水平及p38 MAPK蛋白磷酸化水平检测
2.6.1 免疫组化实验 取“2.5”项下的皮肤组织切片,经二甲苯脱蜡、水化后,用柠檬酸盐缓冲液热修复8 min,待降至室温后依次用H2O2孵育(10 min)、磷酸盐缓冲液浸洗、山羊血清孵育(30 min),然后滴加p38 MAPK、pp38 MAPK一抗(稀释度均为1∶100),于4 ℃下孵育过夜。次日,将切片于37 ℃下复温30 min,滴加HRP标记的山羊抗兔IgG二抗(稀释度为1∶200)孵育20 min,用磷酸盐缓冲液浸洗,以DAB显色10 min;用水冲洗后,用苏木精复染3 min,经盐酸乙醇分化、水冲洗后,进行梯度乙醇脱水、二甲苯透明,以中性树胶封片,置于光学显微镜下观察。于400倍镜下随机选取1个视野,以棕黄色为阳性染色,采用Image-Pro Plus 6.0软件检测阳性染色区域的积分光密度(integrated optical density,IOD)值,以评价p38 MAPK、p-p38 MAPK蛋白的表达水平。
图书馆电子阅览室在运营过程中,若想保证网络账号的有效管理,就必须要在合法的前提下享受网络信息服务,要做好与电子邮件信息用户的沟通,为其提供更为便捷的网络服务,充分发挥电子阅览室的功能,并加强管理与监督工作。
2.6.2 Western blot实验 取“2.2”项下冻存的皮肤组织,加入含1%PMSF的RIPA裂解液,匀浆后,在4 ℃下以13 000 r/min离心15 min。取上清液,采用BCA蛋白定量法测定蛋白浓度。取蛋白样品以5×上样缓冲液稀释,并于100 ℃下加热50 min使变性。取变性蛋白适量,经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离后转移至聚偏二氟乙烯膜,以5%脱脂奶粉封闭2 h,加入p38 MAPK、p-p38 MAPK、β-actin一抗(稀释度分别为1∶1 000、1∶1 000、1∶3 000),于4 ℃下孵育过夜;以TBST溶液清洗5 min×3次,加入HRP标记的山羊抗兔IgG二抗(稀释度1∶1 000),于室温下孵育30 min;以TBST溶液清洗5 min×3次,用ECL显影。采用Image J 1.8.0软件分析条带灰度值,以p-p38 MAPK与p38 MAPK的灰度值比值(p-p38 MAPK/p38 MAPK)来表示p38 MAPK蛋白的磷酸化水平。
2.7 大鼠炎症、肝肾功能、氧化应激指标检测
取“2.2”项下各组大鼠的血清样品适量,使用酶标仪检测其血清中炎症因子(IL-4、IFN-γ)和肝肾功能指标(GPT、GOT、SCr、BUN)水平;取“2.2”项下各组大鼠的肝、肾组织50 mg,制备匀浆后,使用酶标仪检测其肝、肾组织中氧化应激指标(T-SOD、MDA)水平。严格按照试剂盒说明书方法操作。
2.8 统计学方法
采用SPSS 26.0软件对数据进行统计分析。计量资料均以±s表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验(方差齐)或Dunnett’s检验(方差不齐)。检验水准α=0.05。
3 结果
3.1 大鼠背部皮肤观察及湿疹严重度评分结果
正常组大鼠生存状态良好,皮肤光滑完整,未见明显异常;模型组大鼠背部造模区皮肤出现红肿、丘疹、水疱、糜烂和渗出等湿疹症状;各药物组大鼠背部造模区皮肤红肿、糜烂和渗出症状均有所改善,丘疹和水疱均呈不同程度消散,皮肤较模型组明显光滑。结果见图1。
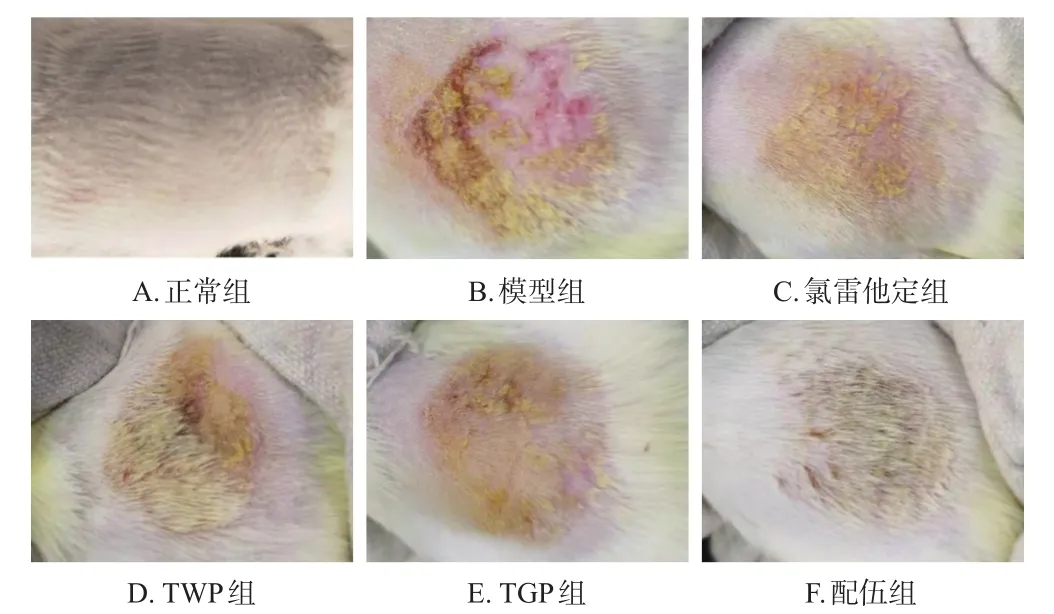
图1 各组大鼠背部皮肤形态图
与正常组比较,模型组大鼠背部皮肤的EASI评分显著升高(P<0.05);与模型组比较,各药物组大鼠背部皮肤的EASI评分均显著降低(P<0.05)。结果见表1。
表1 各组大鼠背部皮肤EASI评分、耳肿胀度、病理评分的检测结果(±s,n=10)
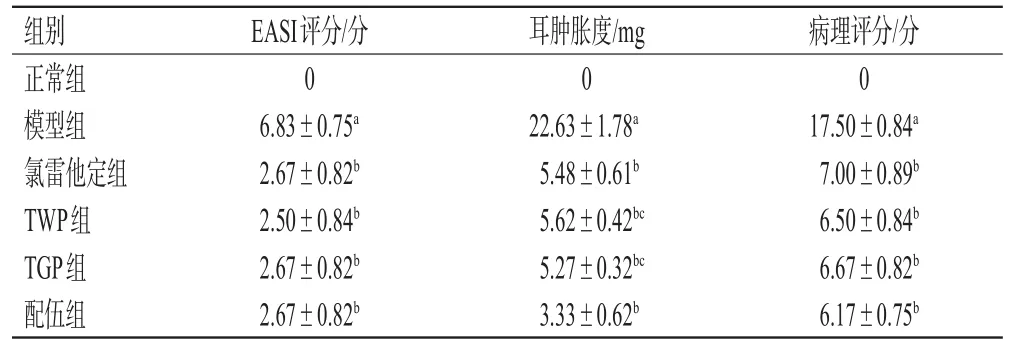
表1 各组大鼠背部皮肤EASI评分、耳肿胀度、病理评分的检测结果(±s,n=10)
a:与正常组比较,P<0.05;b:与模型组比较,P<0.05;c:与配伍组比较,P<0.05
组别正常组模型组氯雷他定组TWP组TGP组配伍组EASI评分/分0 6.83±0.75a 2.67±0.82b 2.50±0.84b 2.67±0.82b 2.67±0.82b耳肿胀度/mg 0 22.63±1.78a 5.48±0.61b 5.62±0.42bc 5.27±0.32bc 3.33±0.62b病理评分/分0 17.50±0.84a 7.00±0.89b 6.50±0.84b 6.67±0.82b 6.17±0.75b
3.2 大鼠耳肿胀度检测结果
与正常组比较,模型组大鼠的耳肿胀度显著升高(P<0.05);与模型组比较,各药物组大鼠的耳肿胀度均显著降低,且配伍组显著优于TWP、TGP组(P<0.05)。结果见表1。
3.3 大鼠背部皮肤组织形态学观察及病理评分结果
模型组大鼠背部皮肤表皮厚度较正常组明显增加,角化程度高,呈网状并伴有海绵样水肿,毛囊口可见角栓;真皮层可见血管轻度扩张、充血和炎症细胞浸润。氯雷他定组、TWP组、TGP组大鼠背部皮肤表皮均增厚,可见海绵样水肿,且TWP组、TGP组大鼠毛囊口可见角栓。配伍组大鼠背部皮肤表皮轻微增厚,未见海绵样水肿、空泡和炎症细胞浸润。结果见图2。
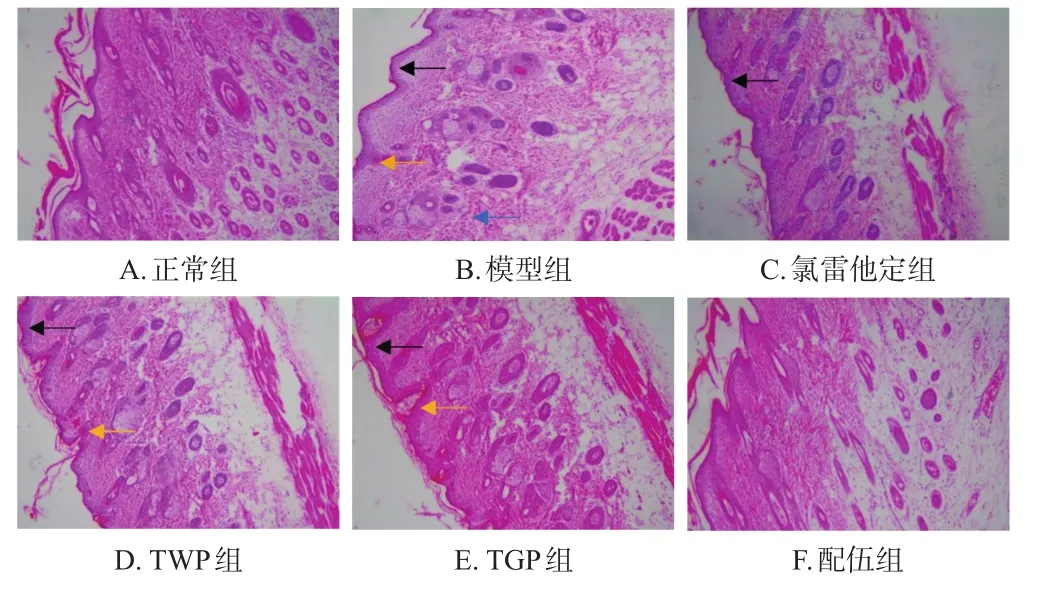
图2 各组大鼠背部皮肤组织病理形态显微图(HE染色,×400)
与正常组比较,模型组大鼠背部皮肤的病理评分显著升高(P<0.05);与模型组比较,各药物组大鼠背部皮肤的病理评分显著降低(P<0.05)。结果见表1。
3.4 大鼠皮肤组织中p38 MAPK、p-p38 MAPK蛋白表达水平及p38 MAPK蛋白磷酸化水平的检测结果
免疫组化实验结果显示,与正常组比较,模型组大鼠皮肤组织中p38 MAPK、p-p38 MAPK蛋白的表达水平均显著升高(P<0.05);与模型组比较,各药物组大鼠皮肤组织中p38 MAPK、p-p38 MAPK蛋白的表达水平均显著降低,且配伍组上述指标均显著低于TWP、TGP组(P<0.05)。结果见图3、表2。
表2 各组大鼠背部皮肤组织中p38 MAPK、p-p38 MAPK蛋白表达水平和p38 MAPK蛋白磷酸化水平的检测结果(±s,n=10)
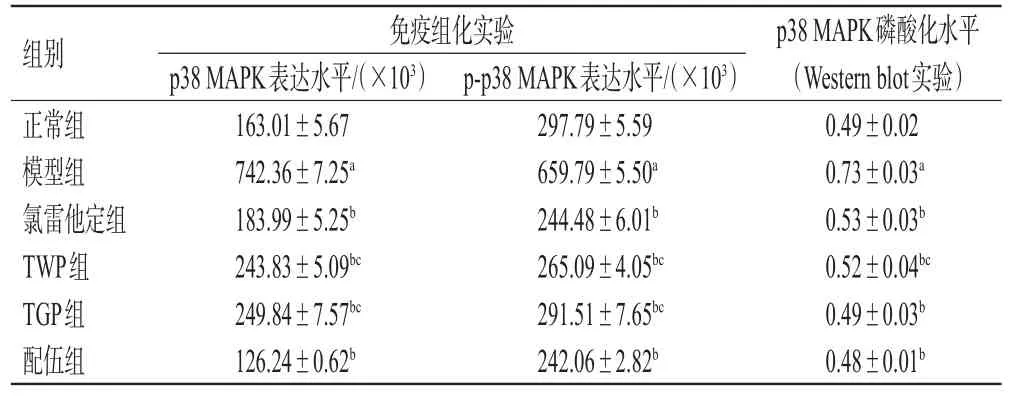
表2 各组大鼠背部皮肤组织中p38 MAPK、p-p38 MAPK蛋白表达水平和p38 MAPK蛋白磷酸化水平的检测结果(±s,n=10)
a:与正常组比较,P<0.05;b:与模型组比较,P<0.05;c:与配伍组比较,P<0.05
组别正常组模型组氯雷他定组TWP组TGP组配伍组p38 MAPK磷酸化水平(Western blot实验)0.49±0.02 0.73±0.03a 0.53±0.03b 0.52±0.04bc 0.49±0.03b 0.48±0.01b免疫组化实验p38 MAPK表达水平/(×103)163.01±5.67 742.36±7.25a 183.99±5.25b 243.83±5.09bc 249.84±7.57bc 126.24±0.62b p-p38 MAPK表达水平/(×103)297.79±5.59 659.79±5.50a 244.48±6.01b 265.09±4.05bc 291.51±7.65bc 242.06±2.82b

图3 各组大鼠背部皮肤组织中p38 MAPK、p-p38 MAPK蛋白表达的免疫组化图(×400)
Western blot实验结果显示,与正常组比较,模型组大鼠皮肤组织中p38 MAPK蛋白的磷酸化水平显著升高(P<0.05)。与模型组比较,各药物组大鼠皮肤组织中p38 MAPK蛋白的磷酸化水平均显著降低,且配伍组显著低于TWP组(P<0.05)。结果见图4、表2。
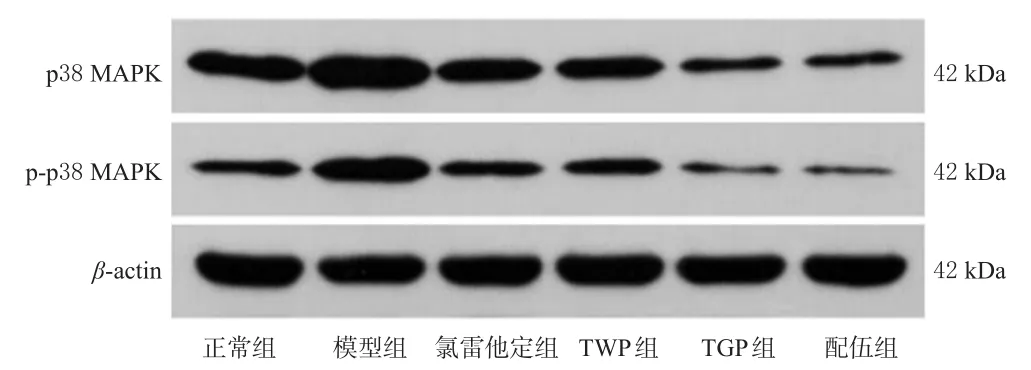
图4 各组大鼠背部皮肤组织中p38 MAPK、p-p38 MAPK蛋白表达的电泳图
3.5 大鼠炎症、肝肾功能、氧化应激指标的检测结果
与正常组比较,模型组大鼠血清中IL-4、IFN-γ水平均显著升高(P<0.05);与模型组比较,各药物组大鼠血清中IL-4、IFN-γ水平均显著降低(P<0.05)。结果见表3。
表3 各组大鼠血清中炎症指标的检测结果(±s,n=10,pg/mL)

表3 各组大鼠血清中炎症指标的检测结果(±s,n=10,pg/mL)
a:与正常组比较,P<0.05;b:与模型组比较,P<0.05
组别正常组模型组氯雷他定组TWP组TGP组配伍组IFN-γ 166.98±4.21 262.33±5.36a 147.54±4.58b 143.98±5.01b 141.60±5.93b 140.38±4.00b IL-4 57.99±7.01 207.77±7.38a 123.75±5.99b 120.06±3.58b 124.61±8.38b 125.97±6.81b
与正常组比较,TWP组大鼠血清中GPT、GOT、SCr水平和除正常组外的其余组大鼠血清中BUN水平均显著升高,TGP组大鼠血清中SCr水平显著降低(P<0.05);与模型组比较,TWP组大鼠血清中GPT、GOT、SCr、BUN水平均显著升高(P<0.05),TGP组大鼠血清中GOT、SCr水平和氯雷他定组大鼠血清中SCr水平均显著降低(P<0.05),且配伍组上述指标水平均介于TWP组、TGP组之间(P<0.05)。结果见表4。
表4 各组大鼠血清中GPT、GOT、SCr、BUN水平的检测结果(±s,n=10)
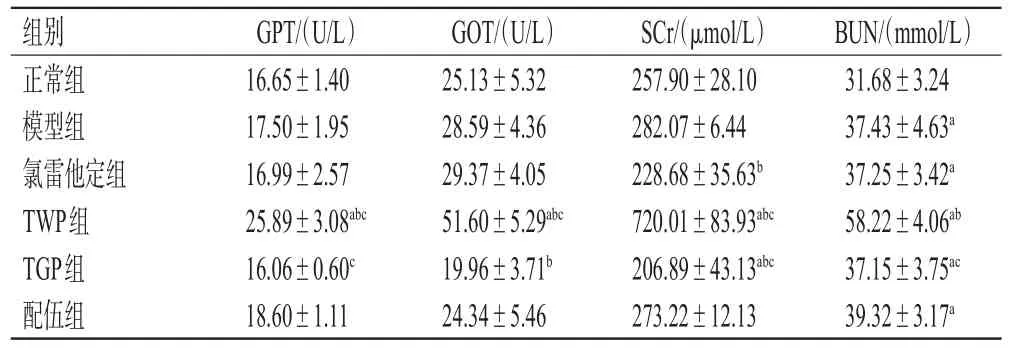
表4 各组大鼠血清中GPT、GOT、SCr、BUN水平的检测结果(±s,n=10)
a:与正常组比较,P<0.05;b:与模型组比较,P<0.05;c:与配伍组比较,P<0.05
组别正常组模型组氯雷他定组TWP组TGP组配伍组GPT/(U/L)16.65±1.40 17.50±1.95 16.99±2.57 25.89±3.08abc 16.06±0.60c 18.60±1.11 GOT/(U/L)25.13±5.32 28.59±4.36 29.37±4.05 51.60±5.29abc 19.96±3.71b 24.34±5.46 SCr/(μmol/L)257.90±28.10 282.07±6.44 228.68±35.63b 720.01±83.93abc 206.89±43.13abc 273.22±12.13 BUN/(mmol/L)31.68±3.24 37.43±4.63a 37.25±3.42a 58.22±4.06ab 37.15±3.75ac 39.32±3.17a
与正常组和模型组比较,TWP组和配伍组大鼠肝、肾组织中T-SOD水平均显著降低,MDA水平均显著升高(P<0.05);配伍组上述指标均介于TWP组、TGP组之间(P<0.05)。结果见表5。
表5 各组大鼠肝、肾组织中T-SOD、MDA水平的检测结果(±s,n=10)
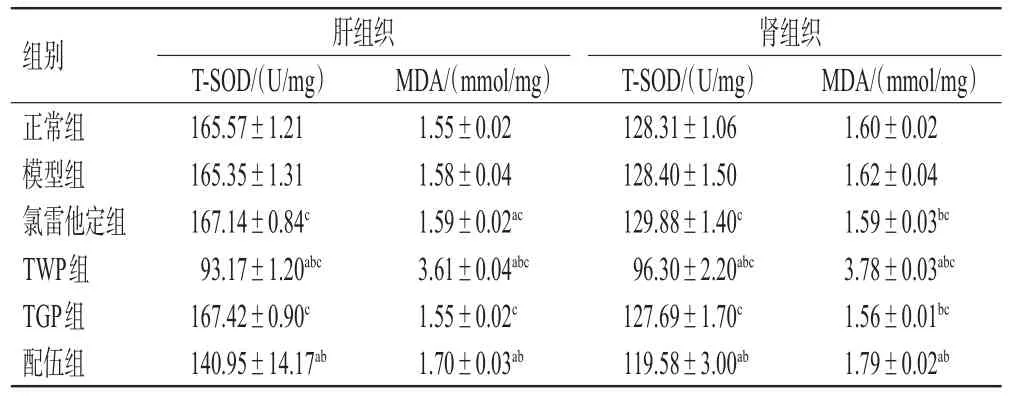
表5 各组大鼠肝、肾组织中T-SOD、MDA水平的检测结果(±s,n=10)
a:与正常组比较,P<0.05;b:与模型组比较,P<0.05;c:与配伍组比较,P<0.05
组别正常组模型组氯雷他定组TWP组TGP组配伍组MDA/(mmol/mg)1.55±0.02 1.58±0.04 1.59±0.02ac 3.61±0.04abc 1.55±0.02c 1.70±0.03ab肝组织T-SOD/(U/mg)165.57±1.21 165.35±1.31 167.14±0.84c 93.17±1.20abc 167.42±0.90c 140.95±14.17ab肾组织T-SOD/(U/mg)128.31±1.06 128.40±1.50 129.88±1.40c 96.30±2.20abc 127.69±1.70c 119.58±3.00ab MDA/(mmol/mg)1.60±0.02 1.62±0.04 1.59±0.03bc 3.78±0.03abc 1.56±0.01bc 1.79±0.02ab
4 讨论
湿疹是一种慢性过敏性皮肤病,以红肿、瘙痒、剥皮、皮肤增厚等为主要特征。现有研究认为,机体经皮肤接受抗原刺激后,再次接触相同抗原所致Ⅳ型变态反应与湿疹的发生密切相关[13―14]。本实验采用DNFB高浓度腹部致敏+低浓度背部、耳部激发的方式构建了大鼠湿疹模型[10],结果显示,湿疹模型大鼠耳肿胀度升高,表皮增厚且角化过度,真皮层可见炎症细胞浸润,表明造模成功。
研究指出,TWP可用于治疗自身免疫及皮炎、湿疹等疾病,TGP可用于治疗风湿性、免疫性疾病[4―5]。氯雷他定可通过抑制机体内炎症介质的释放而达到缓解湿疹症状的作用,是目前临床治疗湿疹的常用药物之一[15]。因此,本实验以此药为阳性对照来考量TWP、TGP及两药配伍对湿疹模型大鼠的干预作用。结果显示,TWP、TGP及两药配伍均能降低湿疹模型大鼠的EASI评分和耳肿胀度,并可使皮肤组织中海绵样水肿和炎症细胞浸润程度减轻,且配伍组大鼠耳肿胀度的改善更明显,表明TWP、TGP及两药配伍对湿疹模型大鼠的皮肤损伤均有较好的干预作用,且配伍组在耳肿胀度方面的干预效果优于TWP、TGP单用。
湿疹的发生与Th1/Th2细胞亚群分泌的细胞因子水平及其动态平衡有关,IL-4、IFN-γ作为Th1、Th2细胞的特征性因子,参与了湿疹的病理过程,并可反映Th1、Th2细胞免疫应答程度[16―17]。p38 MAPK通路是真核生物进化中相对保守的一条重要信号转导通路,可参与细胞分化、细胞凋亡及炎症反应等进程[8]。该通路的上游激酶首先磷酸化激活丝裂原激活的蛋白激酶激酶(mitogen-activated protein kinase kinase,MAPKK),活化的MAPKK可进一步磷酸化激活p38 MAPK;而p-p38 MAPK是重要的炎症调控因子,可与多种靶蛋白结合,参与皮炎、湿疹等多种炎症性疾病的发生过程[18―20]。本研究结果显示,湿疹发生时,大鼠体内IL-4、IFN-γ水平,p38 MAPK、p-p38 MAPK蛋白的表达水平和p38 MAPK蛋白的磷酸化水平均显著升高,提示IL-4、IFN-γ等促炎因子释放增加,p38 MAPK通路异常激活,大鼠皮肤炎症加重。经TWP、TGP及两药配伍干预后,大鼠上述指标均得以改善,且配伍组下调p38 MAPK、p-p38 MAPK蛋白表达及抑制p38 MAPK蛋白磷酸化的作用更明显,提示TWP和TGP可通过阻断p38 MAPK通路的激活来发挥抗炎作用,且两药配伍后抗炎作用有所叠加,这一抗炎增效与抑制促炎因子释放和阻断p38 MAPK通路激活有关。
TWP有明显的肝肾毒性,以肝、肾功能损伤为主要表现[4]。GPT和GOT是衡量肝脏功能的重要指标,SCr和BUN是衡量肾脏功能的重要指标[5],故本研究以血清GPT、GOT、SCr、BUN水平变化来考察TWP的肝肾毒性和配伍TGP的减毒作用。结果显示,TWP可使大鼠血清中GPT、GOT、SCr、BUN水平升高,提示其在干预过程中会导致大鼠出现不同程度的肝肾损伤;TGP可逆转TWP致GPT、GOT、SCr、BUN水平升高的情况,即可部分减弱TWP的肝肾损伤。
氧化应激是肝肾损伤的重要因素之一,SOD是一种重要的氧自由基清除剂,能保护肝、肾免受自由基的损伤;MDA是活性氧致脂质过氧化反应的终末产物,可在一定程度上反映组织的氧化损伤程度[9]。本研究结果显示,TWP可使大鼠肝、肾组织中T-SOD水平降低,MDA水平升高,提示TWP的肝、肾毒性可能与组织氧化应激水平的提升有关;TGP可逆转TWP引起的氧化应激损伤,使大鼠肝、肾组织中T-SOD水平升高,MDA水平降低,提示TGP配伍TWP可通过提升机体的抗氧化能力来减弱TWP的肝肾毒性。
综上所述,TGP配伍TWP对湿疹模型大鼠具有抗炎增效与肝肾减毒的作用,其机制可能与下调血清促炎因子的表达和抑制p38 MAPK通路的激活有关,可为两药配伍在湿疹治疗方面的深入开发利用提供实验依据。

