蓝刺头提取物对骨质疏松症模型大鼠的改善作用及代谢机制 Δ
董 馨 ,王佳琪 ,张秀艳 ,张仲尧 ,陆景坤 ,高建萍 ,薛培凤 (.内蒙古医科大学药学院,呼和浩特 000;.呼和浩特市蒙医中医医院药剂科,呼和浩特 00000;.内蒙古医科大学基础医学院,呼和浩特 0000)
骨质疏松症是一种骨代谢性疾病,多发于老年人与绝经后妇女,临床表现为骨微结构退化和骨密度降低,进而增加骨脆性,诱发骨骼变形、骨折、骨骼疼痛以及多脏器损伤等并发症[1]。而随着人口老龄化加剧,骨质疏松症的发病率已居慢性病第三位[2]。据相关调查显示,我国60岁以上人群骨质疏松症患病率达到36.0%,预计至2050年,我国骨质疏松症患者将达到2.02亿人[3]。而现有的骨质疏松症治疗药物存在副作用大、价格昂贵、患者依从性差等问题[4]。因此,积极开展对老年性骨质疏松症的预防与治疗,研发安全、有效、经济的抗骨质疏松新药意义重大。
蒙药蓝刺头Echinops sphaerocephalus Linn.为菊科多年生草本植物,具有接骨愈伤、壮骨之功效[5]。本课题组前期已对蓝刺头中化学成分及其对去势大鼠骨代谢、细胞因子的调控作用进行了初步研究,证实了蓝刺头提取物具有类雌激素样作用,能够有效防治绝经后期骨质疏松症[6―7]。但目前有关蓝刺头对D-半乳糖诱导的骨质疏松症是否有效,且如何起效尚不明确。本研究通过经典药理学指标研究蓝刺头对D-半乳糖诱导的骨质疏松症模型大鼠的疗效;同时借助代谢组学技术优势,探究大鼠的代谢变化,并通过差异代谢物与代谢通路分析探讨其代谢机制,以期为蓝刺头防治骨质疏松症提供参考。
1 材料
1.1 主要仪器
本研究所用主要仪器有Q-ExactiveTM组合型四极杆OrbitrapTM质谱仪、Ultimate 3000型高效液相色谱系统(美国Thermo Fisher Scientific公司),Milli-Q iq7000型超纯水系统(德国Merk公司),5424R型离心机(德国Eppendorf公司),EYELAN-1100型旋转蒸发器(上海爱朗仪器有限公司),Forma 900 Series型超低温冰箱(美国Thermo Scientific公司),Inveon MM型小动物正电子发射断层显像/X线计算机体层成像仪(positron emission tomography/computedtomography,PET/CT;德国Siemens公司),Spectra Max i3x型酶标仪[美谷分子仪器(上海)有限公司]。
1.2 主要药品与试剂
丙二醛(malondialdehyde,MDA)、超氧化物歧化酶(superoxide dismutase,SOD)、碱性磷酸酶(alkaline phosphatase,ALP)、羟脯氨酸(hydroxyproline,HYP)、总抗氧化能力(total antioxidant capacity,TAOC)检测试剂盒均购自武汉华联科生物技术有限公司,批号分别为ab119611、ab65445、GR201812-1、GR201833-3、ab118194;生理盐水(批号210803)、D-半乳糖(批号CG29133740)均购自呼和浩特市泽浩生物科技有限责任公司;骨疏康颗粒(阳性对照药,批号151002332,每袋装10 g)购自辽宁沃华康辰药业有限公司;液质联用级乙腈、甲酸均购自美国Thermo Fisher Scientific公司。蓝刺头药材于2020年8月采集自内蒙古武川县,经内蒙古医科大学药学院生药学教研室渠弼副教授鉴定为真品。
1.3 实验动物
雄性Wistar大鼠36只,体质量(200±20)g,12周龄,购自内蒙古医科大学实验动物研究中心,生产许可证号为SCXK(蒙)2015-0001。大鼠饲养于标准受控环境(相对湿度50%~60%,温度18~22 ℃,12 h昼夜交替,自由进食饮水)。动物实验经内蒙古医科大学医学伦理委员会批准(批准号为YKD2018056)。所有大鼠饲养1周后进行实验。
2 方法
2.1 药液的制备
取500 g 蓝刺头药材,加入6 000 mL蒸馏水,加热回流提取2次,每次30 min。将2次滤液合并,浓缩、冻干后得蓝刺头提取物冻干粉,经紫外分光光度法[8]测得其总酚酸含量为63.03 mg/g,于-20 ℃保存备用。使用时加入适量蒸馏水溶解得质量浓度为21 mg/mL的蓝刺头冻干粉药液(以蓝刺头提取物计);同时使用适量蒸馏水溶解骨疏康颗粒,得质量浓度为10.5 mg/mL的药液。
2.2 动物分组、造模与给药
采用数字随机分组法将36只大鼠分为6组,分别为空白组、模型组、骨疏康组和蓝刺头高、中、低剂量组,每组6只。空白组按5 mL/kg腹腔注射生理盐水,其余各组按120 mg/kg腹腔注射D-半乳糖,持续注射8周,建立骨质疏松症模型[9]。建模后,蓝刺头高、中、低剂量组分别按878、439、219.5 mg/kg(分别为临床等效剂量的4、2、1倍)灌胃蓝刺头冻干粉药液;骨疏康组按105.1 mg/kg(剂量为临床等效剂量)灌胃骨疏康药液;空白组与模型组灌胃等体积生理盐水。每日1次,连续给药8周。
2.3 取材
各组大鼠末次给药后,连续12 h禁食不禁水,然后麻醉,腹主动脉取血,置于5 mL采血管中,3 500 r/min离心10 min后分离血清,置于-80 ℃保存备用。将大鼠取血后处死,取右侧胫骨,剔除肌肉,用生理盐水冲洗干净,以保鲜膜和锡纸包裹后,分装在密封袋中并标记,置于-80 ℃保存备用。
2.4 血清中骨代谢与氧化应激指标含量的检测
采用酶联免疫吸附测定法,参照试剂盒说明书检测血清中骨代谢指标(HYP、ALP)及氧化应激指标(TAOC、SOD、MDA)的含量。
2.5 骨微结构的检测
采用PET/CT扫描各组大鼠右侧胫骨,并使用micro-CT骨分析软件进行分析,评价各组大鼠右侧胫骨密度(bone mineral density,BMD)、骨小梁厚度(trabecular thickness,Tb·Th)、骨小梁数量(trabecular number,Tb·N)、骨小梁间距(trabecular separation,Tb·Sp)。同时在感兴趣区域图像中测量胫骨中轴处皮质骨的骨体积分数(bone volume fraction,BVF)、骨表面积/骨体积比值(bone surface/bone volume,BS/BV)。
2.6 代谢组学研究
2.6.1 溶液的制备 (1)样本溶液:取出冻存的各组大鼠血清,于4 ℃下解冻。取200 μL血清样品,采用3倍体积甲醇进行蛋白沉淀。将血清与甲醇混合物涡旋5 min,于4 ℃下14 000 r/min离心10 min;随后取上清液,减压离心、浓缩干燥后,用100 μL甲醇复溶,涡旋5 min,14 000 r/min离心10 min,取上清液置于进样瓶中备用。(2)质量控制(quality control,QC)样本溶液:另分别吸取所有血清样本各10 μL混合为QC样本,处理方法同“2.6.1(1)”项下,取上清液置于进样瓶中备用。
2.6.2 色谱条件与质谱条件 (1)色谱条件:以Thermo Hypersil PFP(2.1 mm×100 mm,1.9 μm)为色谱柱进行分离,以0.1%甲酸溶液(A)-乙腈(B)为流动相进行梯度洗脱(0~1 min,2%B→5%B;1~10 min,5%B→46%B;10~20 min,46%B→80%B;20~35 min,80%B→100%B);柱温为35 ℃,进样量为5 μL,流速为0.3 mL/min。(2)质谱方法:采用电喷雾电离源,在full ms/dd ms2模式下进行数据采集。具体采集参数设置喷雾电压为3.5 V(+)/2.8 V(-),毛细管温度为400 °C(+)/350 °C(-),鞘气(N2)流速为40 psi(+)/35 psi(-),辅助气体(N2)流速为5 psi,S-lens RF水平为50.0,一级质谱扫描范围为m/z 100~1 100,二级质谱扫描范围为m/z 50~750。
2.6.3 分析方法稳定性与精密度考察 在样本分析过程中插入QC样本溶液进行分析,以QC样本溶液中在正、负离子模式下6个随机化合物保留时间和峰面积的RSD为指标评价分析方法的稳定性与精密度。
2.6.4 数据处理 液质联用仪采集的原始数据文件通过Discoverer Compound(CD)TM2.0软件进行峰识别、峰筛选、峰提出以及峰面积的自动计算,最终形成兼具化合物名称、保留时间、分子量、分子式、峰面积、mzCloud等信息的多维峰表。将上述峰表导入SIMCA-P 14.1软件进行正交偏最小二乘法-判别分析(orthogonal partial least squares-discriminant analysis,OPLS-DA),以变量投影重要性(variable importance in the project,VIP)值>1且P<0.05为标准,筛选各组间差异代谢物。同时借助PubChem(https://pubchem.ncbi.nlm.nih.gov/)、人类代谢组数据库(HMDB)(http://www.hmdb.ca/)以及化学标准品对上述差异代谢物进行结构鉴定。最终采用Metabo-Analyst(http://www.metaboanalyst.ca/)进行生物代谢通路分析。基于通路富集分析和通路拓扑分析,以-lg(P)值>2和通路影响阈值>0.05为标准,确定蓝刺头主要影响的代谢通路。
2.7 统计学分析
采用SPSS 19.0软件对组间的差异进行统计学分析,多组间比较采用单因素方差分析,组间两两比较采用Bonferroni法。检验水准α=0.05。
3 结果
3.1 各组大鼠血清中骨代谢及氧化应激指标含量的比较
与空白组相比,模型组大鼠血清中HYP、ALP、MDA含量均显著升高(P<0.05),TAOC与SOD含量均显著降低(P<0.05)。相较于模型组,给予高、中、低剂量的蓝刺头冻干粉药液及骨疏康药液可显著降低大鼠血清中HYP、ALP(蓝刺头低剂量组除外)、MDA含量(P<0.05),显著升高大鼠血清中TAOC(蓝刺头低剂量组除外)、SOD含量(P<0.05)。结果见图1。
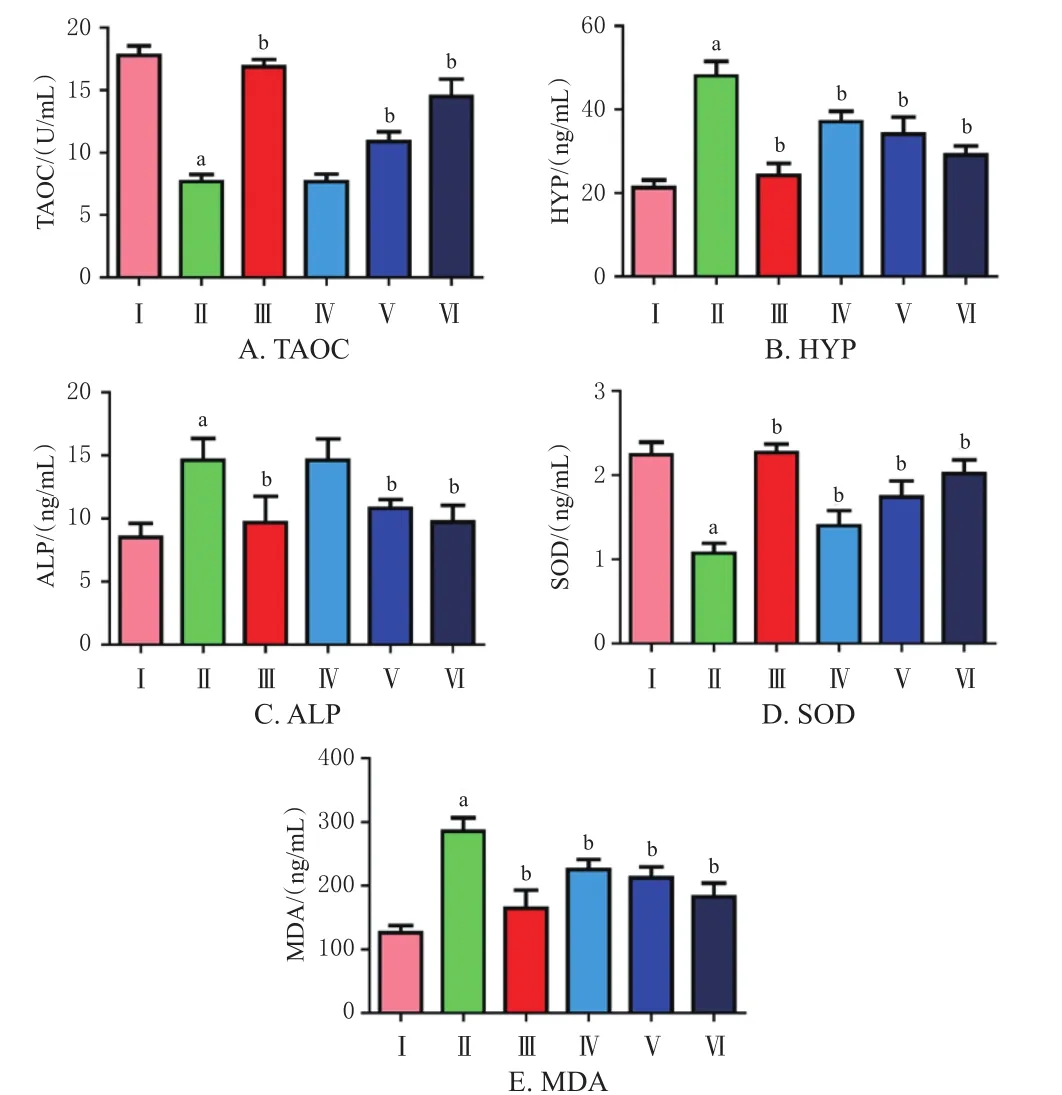
图1 各组大鼠骨代谢及氧化应激血清指标比较(n=6)
3.2 各组大鼠骨微结构变化比较
与空白组相比,模型组大鼠BS/BV、Tb·Sp水平均显著升高(P<0.05),BMD、BVF、Tb·Th、Tb·N水平均显著降低(P<0.05)。相较于模型组,给予高、中、低剂量的蓝刺头冻干粉药液及骨疏康药液可显著降低大鼠BS/BV、Tb·Sp水平(P<0.05),显著升高BMD、BVF、Tb·Th(骨疏康组除外)、Tb·N水平(P<0.05)。PET/CT结果显示,空白组大鼠胫骨内的骨小梁排列紧密、整齐,骨结构完整;模型组大鼠骨小梁间隙大,出现多处无骨连接的空洞。与模型组相比,骨疏康组和蓝刺头低、中、高剂量组大鼠的骨微结构得到明显改善,骨小梁结构紧凑,无骨连接的空洞得到修复。结果见图2、图3。
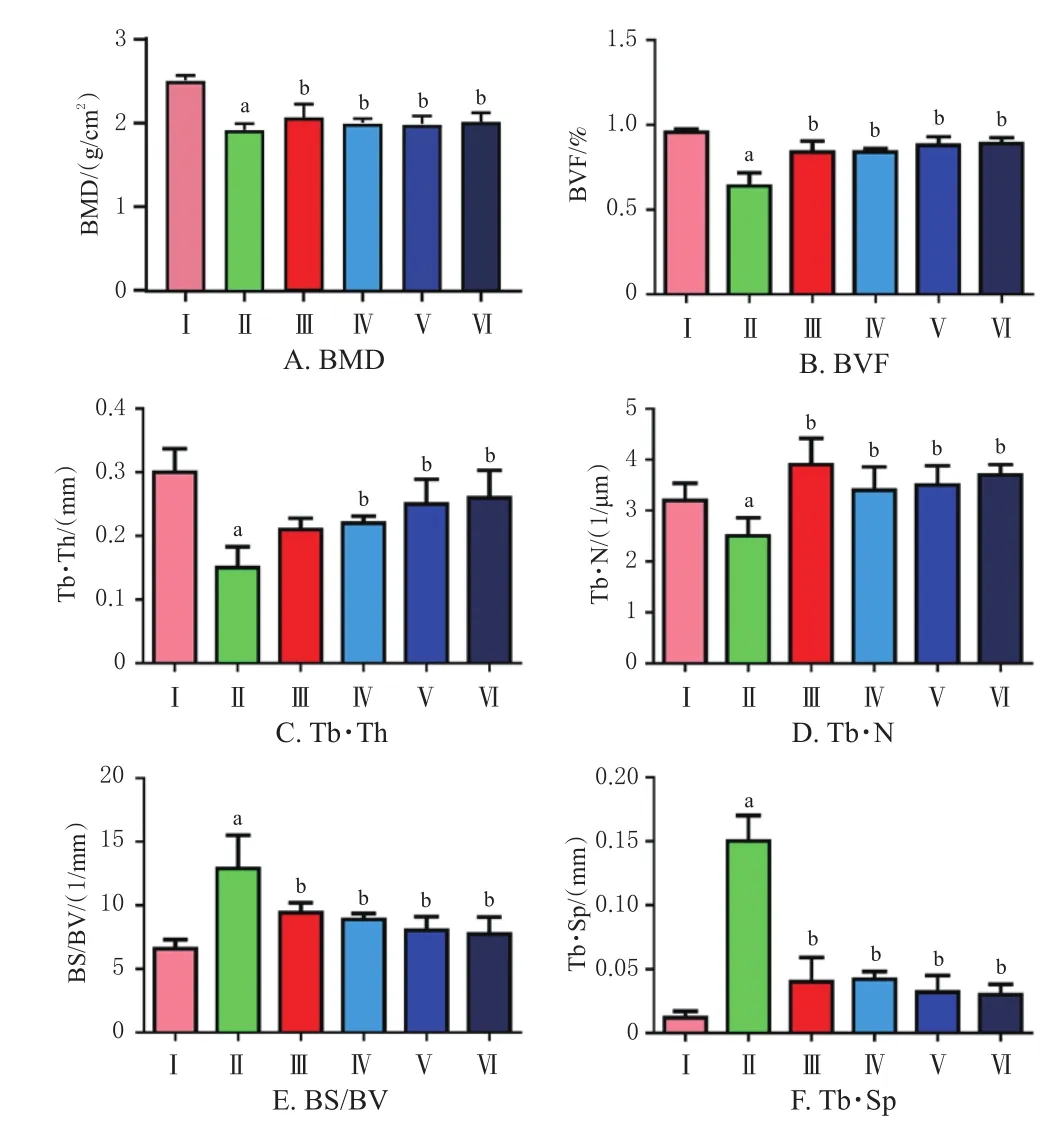
图2 各组大鼠骨微结构指标比较(n=6)

图3 各组大鼠胫骨micro-CT图
3.3 代谢组学分析结果
3.3.1 分析方法稳定性考察结果 如图4A中QC样本聚类良好,结果显示,6个化合物保留时间RSD为0.08%~0.77%、峰面积RSD为0.15%~1.12%,均小于2%,提示分析方法稳定性与精密度良好。
3.3.2 血清代谢轮廓分析 本研究采用OPLS-DA对数据进行分析,揭示组间差异及代谢轮廓。考虑药效与剂量两方面,由于蓝刺头低剂量有部分药效指标与模型组没有统计学差异,而蓝刺头高剂量是临床等效剂量4倍,剂量过高与临床研究不完全切合,因此折中选择蓝刺头中剂量进行比较。由各模式下得分图(图4A~C)可知,模型组与空白组可明显区分,表明两组间代谢物存在差异;蓝刺头中剂量组空间分布于二者之间,提示药物具有逆转D-半乳糖诱导损伤的作用。模型预测图(图略)显示,模型参数R2、Q2值分别不低于0.749、-0.298,且Q2值始终低于R2。此外,Q2回归线的截距小于0,提示该OPLS-DA模型未过度拟合,对样本预测能力良好[10]。
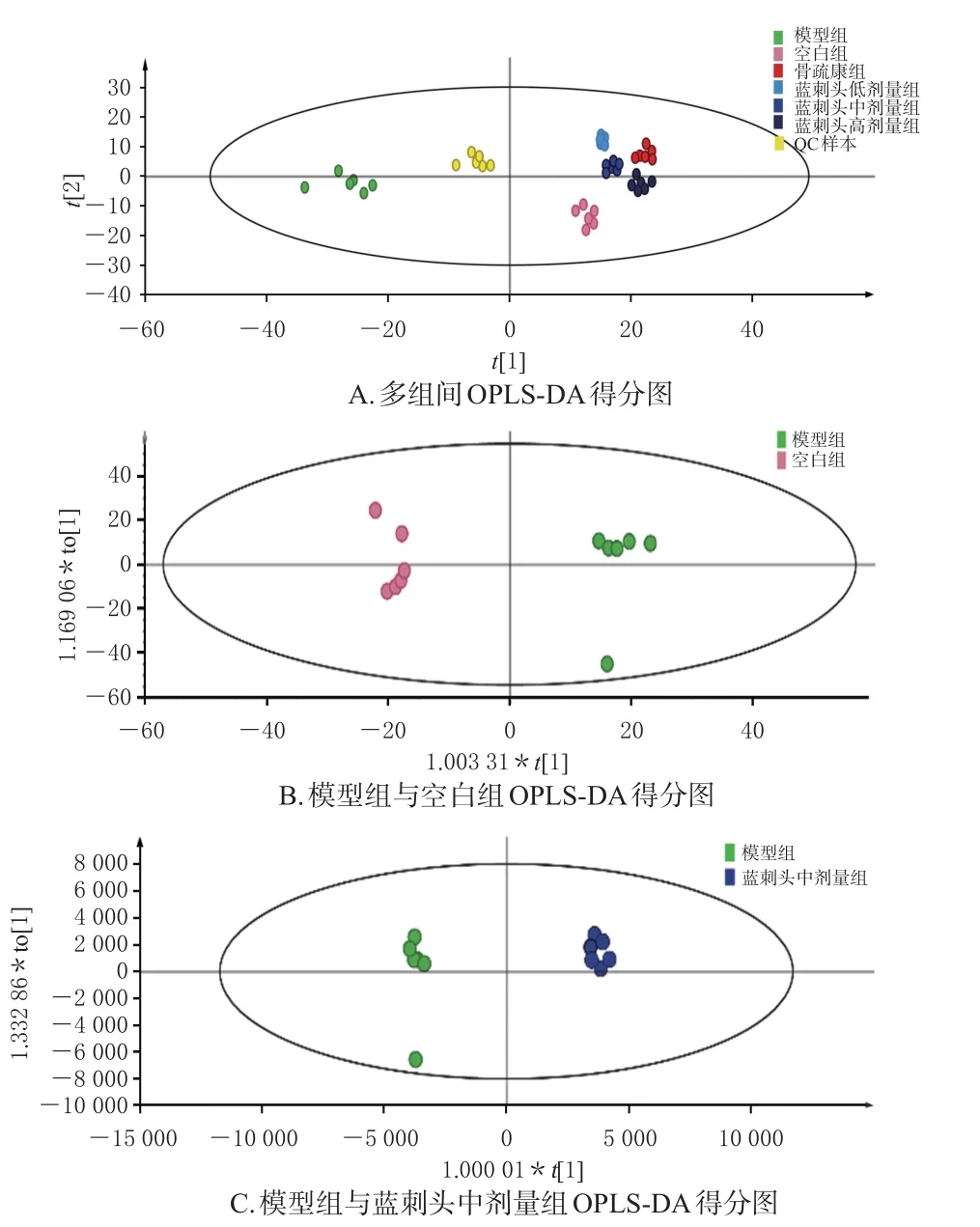
图4 不同组别OPLS-DA得分图
3.3.3 差异代谢物筛选与鉴定 结合上述OPLS-DA结果,以VIP值>1且P<0.05为筛选条件获得组间差异代谢物。并将差异代谢物峰的色谱信息与数据库、化学标准品比对,推测并鉴定差异代谢物的结构。最终获得蓝刺头用药后,大鼠血清中花生四烯酸、苯丙氨酸、酪氨酸、色氨酸、异亮氨酸、尿酸等18种代谢物发生显著变化,结果见表1。

表1 蓝刺头治疗D-半乳糖诱导骨质疏松的差异代谢物
3.3.4 代谢通路分析的结果 MetaboAnalyst通路分析结果显示,蓝刺头用药后共干预15条代谢通路,包括花生四烯酸代谢、苯丙氨酸代谢、酪氨酸代谢等。蓝刺头治疗骨质疏松症主要影响的代谢通路具体包括花生四烯酸代谢[-lg(P)=4.937,P=0.007 2]、苯丙氨酸代谢[-lg(P)=3.360,P=0.034 7]和酪氨酸代谢[-lg(P)=2.421 8,P=0.028 7]。结果见图5。
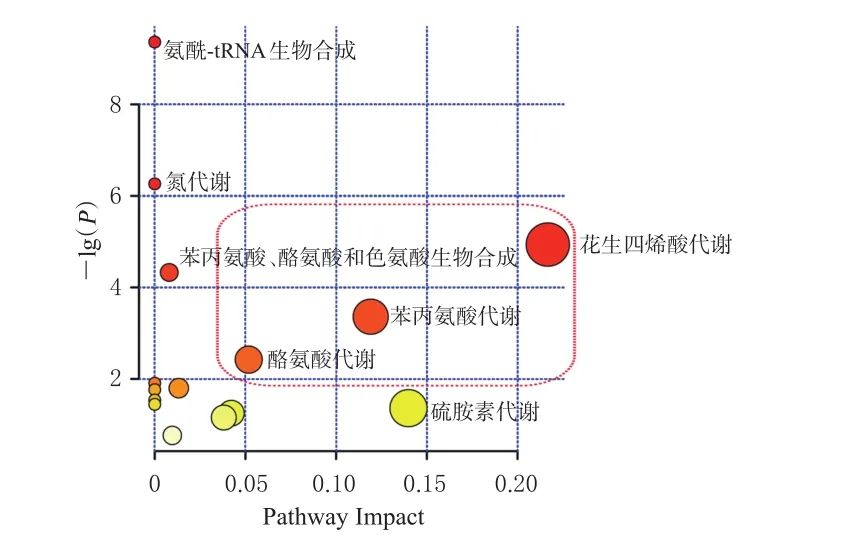
图5 蓝刺头提取物干预骨质疏松症的代谢通路分析
4 讨论
老年性骨质疏松症病因包括氧化应激损伤、维生素D缺乏、激素变化、缺乏运动的生活方式等。本研究选用D-半乳糖作为衰老诱导剂,通过氧化应激损伤诱发骨质疏松症,是多数老年性骨质疏松症的造模方法[11]。为明确模型大鼠细胞氧化应激损伤程度与衰老情况,采用MDA、SOD、TAOC为检测指标。相关研究表明,MDA含量反映了体内脂质过氧化的速度[12];血清中的SOD和TAOC含量反映机体抗氧化能力[13―14]。本研究实验结果显示,模型组血清中MDA含量较空白组显著升高,TAOC与SOD含量则较空白组显著降低,提示D-半乳糖诱导确能激活细胞氧化反应。而采用蓝刺头冻干粉药液干预后,模型大鼠体内氧化应激指标明显得到改善,说明蓝刺头具有一定抗氧化作用。
为进一步探究D-半乳糖诱导对大鼠骨代谢水平与骨微结构的影响,本研究检测了大鼠血清中ALP、HYP含量,并借助PET/CT检测不同组别大鼠骨微结构变化。ALP与HYP是反映骨形成和骨吸收平衡的重要标志物,若两者含量升高,说明骨吸收大于骨形成,则易诱发骨质疏松[15]。本次研究结果也证实了这一点,模型组大鼠体内ALP与HYP含量均显著高于空白组,说明模型组大鼠体内骨吸收速率快。此外,PET/CT检测结果显示,与空白组相比,模型组大鼠骨微结构出现一定程度恶化,如 Tb·Sp、BS/BV 均显著升高,BMD、BVF、Tb·Th、Tb·N均显著降低,进一步证实了骨质疏松症的形成。而蓝刺头冻干粉药液的干预则有利于上述不良情况的逆转,如给药后血清中ALP(蓝刺头低剂量组除外)、HYP含量和Tb·Sp、BS/BV均显著降低,BMD、BVF、Tb·Th、Tb·N均显著升高。这均是蓝刺头可以改善D-半乳糖诱导的骨质疏松症临床症状的有力证据。
此外,代谢组学研究结果显示,蓝刺头通过花生四烯酸、苯丙氨酸、二十二碳六烯酸等代谢物,进而调控花生四烯酸代谢、苯丙氨酸代谢等通路,发挥治疗D-半乳糖诱导的骨质疏松症作用。据相关研究报道,花生四烯酸与二十二碳六烯酸可破坏骨转化平衡,降低BMD;在骨质疏松病理状态下,花生四烯酸和二十二碳六烯酸水平较高[16]。本次研究结果也具有以上趋势,给予蓝刺头冻干粉药液后,以上代谢物水平得以下调,说明蓝刺头可通过降低体内花生四烯酸和二十二碳六烯酸水平,进而抑制骨转化平衡的破坏进程,维持骨骼组织内部稳态。苯丙氨酸和酪氨酸代谢是骨组织退化的另一个重要代谢途径[17]。苯丙氨酸可诱导氧化应激,且参与老年退行性疾病的病理进展过程[18]。本研究中D-半乳糖正是诱导机体氧化应激反应的原因,模型组大鼠体内苯丙氨酸和酪氨酸含量较空白组显著升高,提示D-半乳糖诱导的骨质疏松大鼠存在苯丙氨酸代谢紊乱。蓝刺头能够有效降低大鼠体内苯丙氨酸和酪氨酸水平,进而改善D-半乳糖诱导的苯丙氨酸和酪氨酸代谢紊乱。其他氨基酸,如色氨酸、异亮氨酸等,是蛋白质的基本组成部分,也是生命活动的重要物质。以往研究表明,机体长期缺乏色氨酸会导致血清素合成减少,进而导致BMD降低[19]。因此,本研究中色氨酸、异亮氨酸等的变化同样预示着D-半乳糖诱导后的骨代谢异常。蓝刺头则可通过改善色氨酸、异亮氨酸等代谢紊乱,从而抑制骨质疏松症的发展。
综上所述,蓝刺头提取物能够有效改善D-半乳糖诱导的氧化应激反应及骨微结构恶化,并通过干预花生四烯酸代谢、氨基酸代谢等途径起效。

