重组结核杆菌融合蛋白的临床综合评价 Δ
倪晓凤 ,刁 莎 ,何思颐 ,焦雪峰 ,程 晓 ,陈 哲 ,刘 峥 ,曾力楠 ,康德英 ,吴 斌 ,万朝敏 , ,应斌武 ,张 慧 ,赵荣生 ,缪丽燕 ,王 卓 ,李晓宇 0,刘茂柏 ,蔡本志 ,邱 峰 ,孙 峰 ,初乃惠 ,林明贵 ,沙巍 ,张伶俐 (.四川大学华西第二医院药学部/循证药学中心/国家药品监督管理局药物制剂体内外相关性技术研究重点实验室/出生缺陷与相关妇儿疾病教育部重点实验室,成都 00;.四川大学华西医院中国循证医学中心,成都 00;.上海交通大学医学院附属仁济医院药剂科,上海 00;.四川大学华西第二医院儿科,成都 00;.四川大学华西医院实验医学科,成都 00;.四川大学华西医院感染管理部,成都 00;.北京大学第三医院药剂科,北京 00;.苏州大学附属第一医院药学部,苏州00;.海军军医大学长海医院药学部,上海 00;0.复旦大学附属中山医院药剂科,上海 000;.福建医科大学附属协和医院药学部,福州 000;.哈尔滨医科大学附属第二医院药学部,哈尔滨00;.重庆医科大学附属第一医院药学部,重庆 000;.北京大学医药管理国际研究中心,北京00;.首都医科大学附属北京胸科医院结核科,北京 0;.清华大学附属北京清华长庚医院感染科,北京 0;.同济大学附属上海市肺科医院结核科,上海 00)
结核病是由结核分枝杆菌(Mycobacterium tuberculosis,MTB)感染引起的慢性传染病,是严重危害人民健康的全球性公共卫生问题。据WHO统计,2020年结核病已成为全球第13位死因,且在单一传染病中位列第2位[1―2]。我国结核病负担高居全球第2位,据2021年全球结核病报告统计,MTB感染人数约3.5亿,新发结核病患者84.2万,其中病死率为3.80%[2―4]。
人体感染MTB后是否发病,取决于MTB数量、毒性大小及人体免疫力。感染后约5%的感染者会在短时间内发展为活动性结核病(active tuberculosis,ATB),而约95%的感染者体内的MTB会进入长期潜伏状态,这又称为潜伏性结核感染(latent tuberculosis infection,LTBI)[5]。LTBI人群庞大,已成为新发结核病的巨大源头,因此有效识别LTBI对控制结核病具有重要意义。2015年,WHO提出将开展LTBI系统筛查和干预作为终止结核病的重要策略之一[6]。我国《高危人群结核分枝杆菌潜伏感染检测及预防性治疗专家共识》亦指出,加强LTBI者的主动发现、筛查结核病患者密切接触者,是降低LTBI者发病率的重要措施[7]。
目前LTBI的诊断缺乏金标准,只能通过免疫学方法辅助诊断。结核菌素纯蛋白衍生物(purified protein derivative of tuberculin,TB-PPD)是一种将结核菌素作为抗原来诱发机体发生迟发型变态反应的诊断药品,具有成本低、检测方法简单、无需复杂的设备仪器及专门的实验室等特点,是临床判断LTBI常用和传统的皮肤检测药品。重组结核杆菌融合蛋白(recombinant Mycobacterium tuberculosis fusion protein,EC)为一种新型结核皮肤检测药品,由高效表达结核杆菌ESAT6-CFP10基因的大肠埃希菌,经发酵、分离和纯化后制成。EC的检测是否较TB-PPD更具优势,目前尚缺乏其有效性、安全性、经济性、创新性、适宜性和可及性6个维度的研究。因此,本研究以TB-PPD为对照,对EC进行临床综合评价,旨在为遴选MTB感染诊断和结核病辅助诊断的皮肤检测药品提供证据。
1 资料与方法
1.1 专家组成员构成
专家组成员的学科专业需涵盖临床、药学、护理学、诊断学及方法学,且在结核病诊断或治疗领域具有临床经验或研究背景;职称为副高级及以上职称并兼顾地域分布。
1.2 纳入与排除标准
1.2.1 研究类型 本研究纳入的文献类型为临床综合评价相关的原始研究、指南、共识及规范等。
1.2.2 研究对象 本研究未限制纳入人群的年龄、性别和种族等。
1.2.3 干预措施 在有效性、安全性和经济学评价中,限制干预组患者为EC,对照组患者为TB-PPD;在适宜性、可及性和创新性评价中,未限制干预组和对照组患者的干预措施。
1.2.4 排除标准 本研究的排除标准为:(1)无法获取原文的文献;(2)重复发表的文献;(3)非中英文文献。
1.3 文献检索策略
计算机检索临床指南数据库(国际指南协会数据库,英国卫生与临床优化研究所数据库,苏格兰、加拿大、澳大利亚、新西兰和日本指南数据库,中国医脉通临床指南库)、Medline、the Cochrane Library、Embase、中国期刊全文数据库、中国生物医学文献数据库、万方数据库、维普网、卫生行政部门和行业协会的官方网站[国家卫生健康委(http://www.nhc.gov.cn/)、国家食品药品监督管理局(https://www.nmpa.gov.cn/)、中国防痨协会(http://www.cata1933.cn/)、全国团体标准信息平台(http://www.ttbz.org.cn/StandardManage/Detail/36819/)]。中文检索词为“重组结核分枝杆菌融合蛋白”“重组结核杆菌融合蛋白”“宜卡”“CFP10/ESAT6”;英文检索词为“recombinant Mycobacterium tuberculosis fusion protein”“CFP10/ESAT6”。检索时限均为建库或建站起至2022年2月。
1.4 资料提取与纳入文献质量评价
由2位研究者独立筛选文献,提取资料并交叉核对,若有争议,则通过讨论或与第3位研究者协商解决。提取资料包括:基本信息、患者基本特征、干预措施、结局指标、偏倚风险评价等。采用SYRCLE动物实验偏倚风险评估工具[8]评价动物实验研究的质量;采用诊断准确性试验质量评价工具(quality assessment of diagnostic accuracy studies,QUADAS-2)[9]评价诊断准确性研究的质量。
1.5 结局指标
1.5.1 有效性 采用系统评价法比较EC和TB-PPD的有效性。有效性结局指标包括:灵敏度、特异度、阳性似然比、阴性似然比。
1.5.2 安全性 安全性结局指标包括:上市前安全性为动物实验的毒理学评价结果;上市后安全性为不良反应类型及发生率。
1.5.3 经济性 以MTB感染的高危人群为目标人群,基于全社会角度,使用TreeAge Pro 2011软件,采用最小成本分析、成本-效果分析、成本-效用分析评价EC和TB-PPD的短期经济性;采用成本-效用分析评价长期经济性。药品成本数据来自米内网-中国医药信息数据库(https://www.menet.com.cn/),指标参数来自有效性指标的系统评价结果和相关参考文献。采用单因素敏感性分析及概率敏感性分析评估结果的稳定性。
1.5.4 适宜性、可及性和创新性 采用系统评价法初拟评价指标,采用改良德尔菲专家咨询法确定评价指标,根据指标内容和性质,通过检索文献、查询官网、查阅说明书、问卷调查等方法评价适宜性、可及性和创新性。
1.6 综合评分
利用专家评分法和乘积法确定各维度及指标权重。专家组成员根据研究结果,对EC和TB-PPD在各指标下的优劣进行评分,最终得到6个维度的综合评分=各指标评分×各指标权重;分值越高,表示该诊断药品在该维度越优[10]。
1.7 分析方法
采用Meta-Disc 1.4软件进行有效性的Meta分析;采用RevMan 5.3软件进行安全性的Meta分析;不能进行Meta分析的数据,采用描述性分析。
2 结果
2.1 有效性评价结果
共有 11 篇文献报道了有效性[7,11―20],其中标准 2部[11―12]、指南 2 部[7,13]、专家共识 3 篇[14―16],均推荐 EC 和TB-PPD用于MTB感染检测;1篇系统评价的结果显示,我国EC的灵敏度为 86.06%[95%CI(82.39%,89.07%)][17];3篇随机对照试验(randomized controlled trial,RCT)经Meta分析合并后的结果显示,不区分人群时,EC和TB-PPD的灵敏度、阴性似然比比较,差异均无统计学意义(P>0.05);EC的特异度、阳性似然比、诊断比值比、阳性预测值、阴性预测值均显著优于TB-PPD(P<0.05)[18―20]。结果见表1(详细结果见本团队已发表的文献[21])。

表1 不区分人群时EC和TB-PPD有效性的Meta分析结果
2.2 安全性评价结果
1 篇专家共识[14]、4 篇 RCT[18―20,22]报道了安全性。结果显示,EC和TB-PPD最常见的不良反应为注射部位瘙痒和疼痛,程度多为轻度,且未有严重不良反应发生(详细结果见本团队已发表的文献[21])。
2.3 经济性评价结果
2.3.1 短期经济性 最小成本分析结果显示,针对灵敏度及其衍生效果指标(实际发现患者例数、避免新发患者例数、漏诊率),EC组患者的成本(98元)显著低于TBPPD组(136.78元),EC组更经济。成本-效果分析结果显示,针对特异度及其衍生效果指标(误诊率),EC组患者的筛查总成本为980 000元、误诊率为5.88%,TB-PPD组患者的筛查总成本为1 367 800元、误诊率为59.27%;EC与TB-PPD相比,增量成本-效果比(incremental costeffectiveness ratio,ICER)为7 263.53元/%,即每减少1%误诊率,EC组患者可减少7 263.53元,EC属于绝对优势方案。敏感性分析结果显示,上述结果稳定。成本-效用分析(1年)结果显示,EC组患者的总成本为579.049 0元、质量调整寿命年(quality-adjusted life year,QALY)为0.991 5,TB-PPD组患者的总成本为1 539.267 0元、QALY为0.986 5。与TB-PPD组相比,EC组患者的成本更低、QALY更高,增量成本-效用比(incremental costutility ratio,ICUR)为-192 043.6元/QALY,即每增加1个QALY,EC组患者可减少192 043.6元,EC属于绝对优势方案。敏感性分析结果显示,上述结果稳定(另文待发表)。
2.3.2 长期经济性 成本-效用分析(以我国人均预期寿命年,即77年[23])结果显示,EC组患者的总成本为7 607.532 3元、QALY为9.464 5,TB-PPD组患者的总成本为15 430.520 5元、QALY为9.399 2;与TB-PPD组相比,EC组患者的成本更低、QALY更高,ICUR为-119 800.738 1元/QALY,即每增加1个QALY,EC组患者可减少119 800.738 1元,EC属于绝对优势方案。敏感性分析结果显示,上述结果稳定(另文待发表)。
2.4 创新性、适宜性和可及性评价结果
共确定24项指标,其中创新性指标6项,包括临床创新性3项和产业创新性3项;适宜性指标9项,包括技术适宜性4项和使用适宜性5项;可及性指标9项,包括价格指数1项、可负担性3项和可获得性5项。结果见表2。

表2 创新性、适宜性和可及性评价指标及评价方法
2.4.1 创新性 EC和TB-PPD均是我国结核病防治的重要手段。EC的抗原为MTB特异性抗原,不易发生交叉反应[24]。TB-PPD的抗原为与卡介苗和非MTB相同或相似的抗原,易发生交叉反应[25]。EC属于国家1类新药,并获国内发明专利授权(专利号:ZL201510617780.9);TB-PPD为我国改良研发而非自主研发产品[26]。
2.4.2 适宜性 EC和TB-PPD标签标注均完整。EC有3种规格(最小0.3 mL),适用于6个月及以上婴儿、儿童及65周岁以下成人;TB-PPD有2种规格(最小1.0 mL),适用于婴儿、儿童及成人。EC药品说明书详细列举了不良反应类型及发生率、药物相互作用、临床试验、药理毒理信息;TB-PPD药品说明书中未详细列举上述信息。EC用西林瓶包装,于2~8 ℃避光储存;TB-PPD用安瓿包装,于2~8 ℃避光储存。同时使用EC和TB-PPD的6家医院的调查问卷(共发放125份,共回收问卷125份,有效回收率为100%)结果显示,与TB-PPD相比,EC结果判读更容易、不良反应更易识别、处理难度更低、患者配合程度更高。
2.4.3 可及性 我国EC价格低于国际参考价格[27],而TB-PPD价格高于国际参考价格[28]。根据国家统计局发布的《2021年居民收入和消费支出情况》[29],EC药品支出占城市和农村家庭年人均可支配收入比例分别为0.21%、0.52%,TB-PPD分别为0.29%、0.72%。TB-PPD已纳入《国家基本药物目录(2018年版)》和《国家医疗保险目录(2018年版)》,EC未纳入。
2.5 各维度评价指标的综合评分结果
确定有效性、安全性、经济性、创新性、适宜性和可及性的权重分别为18.09%、17.97%、15.84%、15.37%、16.55%、16.19%。EC的灵敏度、特异度、阳性似然比、阴性似然比、诊断比值比、曲线下面积(area under the curve,AUC)、阳性预测值、阴性预测值、不良反应类型、不良反应发生率、短期经济性、长期经济性、临床创新性、产业创新性、技术适宜性、使用适宜性、价格指数评分均高于TB-PPD;两药的可负担性评分一致,EC的可获得性评分低于TB-PPD。结果见表3。
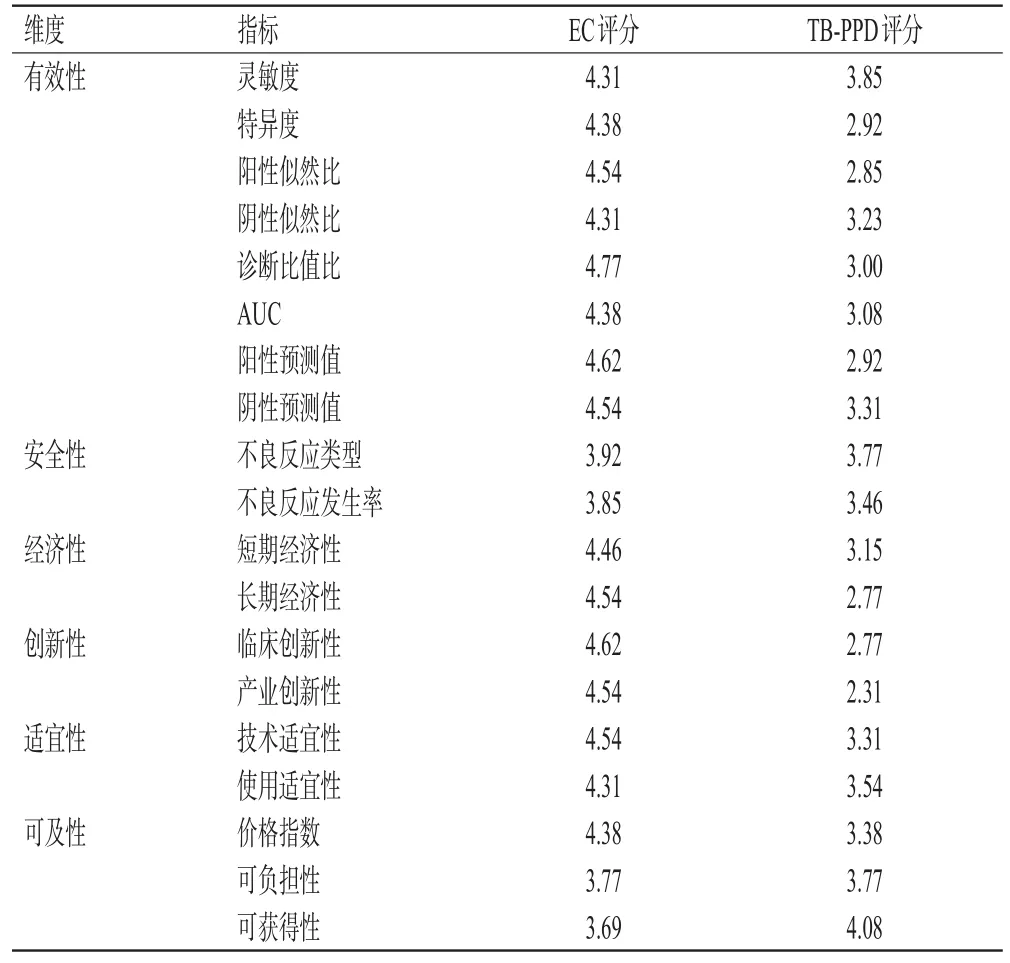
表3 EC和TB-PPD的各维度评价指标的评分结果
考虑权重后,EC的有效性(0.81 vs. 0.57)、安全性(0.70 vs. 0.57)、经济性(0.71 vs. 0.48)、创新性(0.70 vs.0.39)、适宜性(0.73 vs. 0.57)、可及性评分(0.64 vs. 0.61)及其综合评分(4.29 vs. 3.27)均高于TB-PPD。结果见图1。
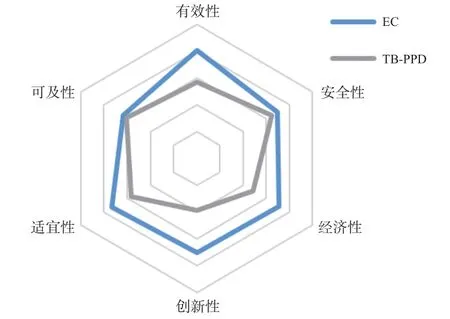
图1 EC和TB-PPD各维度的综合评分结果
3 讨论
在有效性方面,EC在特异度方面表现出一定优势,可有效减少因接种卡介苗或感染非MTB导致的假阳性概率。在安全性方面,EC与TB-PPD的安全性类似,均未见严重不良反应发生。在经济性方面,由于EC和TBPPD作为诊断药品的特性,故分为短期经济性评价和长期经济性评价,短期经济性仅考虑诊断效果,以直接评价诊断效果的灵敏度、特异度等及1年成本-效用为结局指标;长期经济性考虑诊断药品的本质是帮助患者及时接受治疗,诊断效果不同会导致患者接受诊疗的时间和转归不同,因此通过长期经济性评价可获得因诊断药品效果不同引起的全生命周期治疗转归差异。由于LTBI诊断暂无金标准,目前仅依赖于检测试剂结果判断机体是否感染MTB,这仍存在一定的误差。因EC灵敏度与TB-PPD相似,但EC特异度优于TB-PPD,故使用EC后被误诊的患者更少,因误诊导致的治疗成本更低,QALY更高,同时因EC具有较低的假阳性率而显示出了更低的成本与更高的健康收益,从而EC表现出更具经济性。在创新性、适宜性方面,由于EC属于国家1类新药并获得专利证书,加之 EC的药品说明书描述更全面、产品最小规格更接近单次人均用量,因此EC更具有创新性和适宜性。在可及性方面,EC的价格虽然更低,也在大多数基层医疗机构使用,但据全国医药经济信息网抽样调查显示,二级及以上医疗机构配备EC的仅1家,提示EC的可获得性不足[30]。
综上所述,EC作为国家1类新药,可用于MTB感染诊断、辅助结核病临床诊断,与TB-PPD均属于皮肤检验药品,具有无需抽血、无需仪器设备、操作便捷等特点;与TB-PPD相比,EC的有效性、安全性、经济性、创新性、适宜性和可及性均更优;但值得注意的是,EC应进一步改善可及性维度下的可获得性。本研究的局限性为:仅基于现有证据评价EC相较于TB-PPD的有效性、安全性、经济性、创新性、适宜性和可及性,因研究数量有限,尚无法针对不同人群开展亚组分析,无法开展基于原始研究的经济学评价,也无法获取TB-PPD的产能、生产和配送等数据,故所得结果存在一定局限性,后续尚待高质量的原始研究进一步证实。

