鉴别检测兔出血症病毒1型、2型双抗体夹心ELISA方法的建立及应用
陈兴继 魏后军 范志宇 胡波 宋艳华 陈萌萌 仇汝龙 葛雷 王芳


摘要:为实现对兔出血症病毒1型(RHDV1)和兔出血症病毒2型(RHDV2)的有效鉴别诊断,从而有效预防和控制兔出血症,将抗RHDV广谱单抗2A11作为捕获抗体包被于ELISA板,以HRP标记的抗RHDV1特异性单抗1D4、抗RHDV2特异性单抗6B3分别作为检测抗体,经条件优化,建立了鉴别检测兔出血症病毒1型、2型的双抗体夹心ELISA方法,并进行敏感性、特异性试验,对送检的60份兔肝脏样品用该双抗体夹心ELISA方法和RT-PCR方法进行检测,比较这2种方法的符合率。结果显示,该双抗体夹心ELISA方法的最佳工作条件为:捕获抗体浓度为 4 μg/mL,2种HRP标记的检测抗体的浓度均为0.5 μg/mL;判定标准为:以检测抗体HRP-1D4检测样品D值>0.195 判为RHDV1阳性,以检测抗体HRP-6B3检测样品D值>0.166判为RHDV2阳性;通过特异性和敏感性试验发现,该双抗体夹心ELISA方法具有较强特异性和较高敏感性。检测60份送检的兔肝脏样品,发现本方法与 RT-PCR 方法相比,检测RHDV1阳性样品的符合率为100%(9/9),RHDV2阳性样品的符合率为82.61%(19/23),阴性样品的符合率为87.5%(28/32),总符合率为93.33%(56/60),且该方法阳性样品检出率高于RT-PCR方法。本研究建立的双抗体夹心ELISA方法可有效地鉴别检测RHDV1和RHDV2这2种不同基因型的病毒,为兔出血症的流行病学研究提供有力的技术支撑。
关键词:兔出血症病毒;双抗体夹心ELISA;单抗;鉴别检测
中图分类号:S852.2 文献标志码:A
文章编号:1002-1302(2023)24-0161-07
兔出血症(rabbit hemorrhagic disease,RHD)是由兔出血症病毒(rabbit haemorrhagic disease virus,RHDV)引起的一类危及兔类健康的急性传染病,又被称为兔出血性肺炎、兔瘟,它的致死性极强,可以导致多个品种的兔子大面积死亡,典型症状包括全身实质器官的水肿、出血和瘀血等[1]。目前,RHDV有RHDV1(基因型GI.1)和RHDV2(基因型GI.2)2种基因型。1984年,中国江苏地区首次报道了RHDV1,并在全国大部分地区和全球范围内快速传播[2]。2010年,法国首次报道RHDV2[3],并蔓延传播至欧洲多个国家,研究发现,其已取代RHDV1成为优势基因型[4-5]。RHDV2感染宿主范围更广,除了家兔外,还感染野兔等啮齿类野生动物,且所有年龄阶段的家兔对其都易感,可导致2~3周龄幼兔死亡,且潜伏期更长。2020年笔者所在团队首先发现并报道了RHDV2在我国暴发[6-7]。感染RHDV1或RHDV2的家兔在临床表现上大致相同,常于感染后24~72 h死亡,最常见的病变为肝坏死、脾肿大、肺和气管充血和出血等[8];通过临床症状难以鉴别诊断。目前,针对兔出血症的临床诊断方法可以划分为2类:一类是病毒核酸检测,主要是RT-PCR[9]和qRT-PCR[10-11]等方法,具有操作简单、检测准确性较高的优势,但由于需要使用特殊的试剂、仪器以及专业的操作技术,使得应用受到了一定的局限,从而阻碍了基层及大规模临床样本的检测。另一类是抗原检测,主要是红细胞凝集试验[12]、胶体金试纸条[13]以及夹心ELISA[14-16]等方法,但这些方法并不能鉴别检测RHDV1、RHDV2。
双抗体夹心ELISA方法被广泛应用于动物疫病诊断中,具有高灵敏度和专一性,并且不需要预先纯化抗原。此外,操作简单,适用于基层和大批样品检测。本研究以RHDV广谱单抗捕获RHDV1、RHDV2,以HRP标记的RHDV1特异性单抗、RHDV2特异性单抗分别作为检测抗体,建立双抗体夹心ELISA方法用于快速鉴别检测RHDV1、RHDV2。
1 材料与方法
1.1 试验时间和地点
2022年10—12月于江苏省农业科学院兽医研究所家兔重大疫病防控创新团队实验室进行试验。
1.2 抗体及样品
笔者所在实验室制备:2株抗RHDV广谱单克隆抗体(1B8、2A11)、2株HRP标记的抗RHDV1特异性单克隆抗体(HRP-1D4、HRP-5F3)及2株HRP标记的抗RHDV2特异性单克隆抗体(HRP-6B3、HRP-4F1);笔者所在实验室保存健康兔肝脏样品和RHDV1、RHDV2、兔波氏杆菌(Bb)、兔巴氏杆菌(Pm)、兔A型产气荚膜梭菌(CpA)、肠炎沙门氏菌(Se)、轮状病毒(RV)感染死亡兔肝脏样品;送检的死亡兔肝脏样品来自四川省、山东省、河南省等各兔养殖场。
1.3 试剂
脱脂乳、BSA、干酪素钠和底物显色液(TMB)购自北京索莱宝公司;明胶购自北京金沙生物公司。
1.4 样品的处理
兔肝脏样品与PBS按质量体积比1 g ∶10 mL充分研磨制成匀浆,8 000 r/min离心15 min后取上清保存。
1.5 双抗体夹心ELISA方法的建立
1.5.1 抗体配对试验 将抗RHDV广谱单克隆抗体2A11和1B8分别作为捕获抗体用包被液(pH值9.6,0.05%碳酸盐缓冲液)稀释至8 μg/mL,加入100 μL/孔,4 ℃过夜,用PBST(pH值7.4,含0.05%Tween 20)洗涤3次,每次持续5 min,拍干;然后加入200 μL/孔封闭液(5%脱脂乳),37 ℃下作用2.0 h,用PBST洗涤3次,每次持续5 min,拍干;分别加入100 μL/孔兔出血症病毒1型、2型阳性肝脏研磨上清和阴性肝脏研磨上清,37 ℃作用 1.0 h,用PBST洗涤3次,每次持续5 min,拍干;然后分别加入 100 μL/孔用PBST稀释至1 μg/mL HRP标记的RHDV1检测抗体(HRP-1D4、HRP-5F3)、HRP标记的RHDV2检测抗体(HRP-6B3、HRP-4F1),37 ℃ 作用1.0 h,用PBST洗涤3次,每次持续 5 min,拍干;加入100 μL/孔底物显色液,37 ℃避光反应10 min,加入50 μL/孔終止液(2 mol/L H2SO4),置于酶标仪上测定D450 nm,其中阳性抗体的D450 nm用P表示,阴性用N表示。根据P(RHDV1)/N值及P(RHDV1)/P(RHDV2)值最大,确定鉴别检测RHDV1的抗体组合;根据P(RHDV2)/N值及P(RHDV2)/P(RHDV1)值最大,确定鉴别检测RHDV2的抗体组合。
1.5.2 肝脏样品的稀释倍数 按“1.5.1”节试验确定的抗体配对组合,用包被液将捕获抗体按照 8 μg/mL 进行包被,将RHDV1、RHDV2阳性肝脏和阴性肝脏分别按1 ∶10、1 ∶20、1 ∶40、1 ∶80进行稀释,然后分别加入稀释至1 μg/mL的HRP标记的RHDV1检测抗体和HRP标记的RHDV2检测抗体,最后用酶标仪测定D450 nm。根据用HRP标记的RHDV1检测抗体检测样品时,P(RHDV1)/N值及P(RHDV1)/P(RHDV2)值;以及用HRP标记的RHDV2检测抗体检测样品时,P(RHDV2)/N值及P(RHDV2)/P(RHDV1)值,综合确定肝脏样品最佳稀释倍数。
1.5.3 捕获抗体和检测抗体最适工作浓度的确定 采用方阵滴定法确定捕获抗体和检测抗体的最适工作浓度。用包被液将捕获抗体稀释至12、8、4、2 μg/mL,将RHDV1、RHDV2阳性肝脏和阴性肝脏分别按“1.5.2”节中确定的最佳稀释倍数稀释,用PBST将HRP标记的RHDV1检测抗体和HRP标记的RHDV2检测抗体稀释至1、0.5、0.25、0.125 μg/mL,最后用酶标仪测定D450 nm。选择P(RHDV1)/N值及P(RHDV1)/P(RHDV2)值最大的捕获抗体和检测抗体浓度作为检测RHDV1的最适工作浓度;选择P(RHDV2)/N值及P(RHDV2)/P(RHDV1)值最大的捕获抗体和检测抗体作为检测RHDV2的最适工作浓度。
1.5.4 最佳封闭液的确定 以上述试验确定的作用条件进行双抗体夹心ELISA,选择PBST稀释的5%脱脂乳、1%BSA、2%明胶、1%干酪素钠作为封闭液,37 ℃下作用2.0 h,根据用HRP标记的RHDV1检测抗体检测样品时,P(RHDV1)/N值及P(RHDV1)/P(RHDV2)值;以及用HRP標记的RHDV2检测抗体检测样品时,P(RHDV2)/N值及P(RHDV2)/P(RHDV1)值,综合确定合适的封闭液。
1.5.5 抗原最佳作用时间的确定
以上述试验确定的作用条件进行双抗体夹心ELISA,分别选择 37 ℃ 下0.5、1.0、1.5、2.0 h作为抗原作用时间,根据用HRP标记的RHDV1检测抗体检测样品时,P(RHDV1)/N值及P(RHDV1)/P(RHDV2)值;以及用HRP标记的RHDV2检测抗体检测样品时,P(RHDV2)/N值及P(RHDV2)/P(RHDV1)值,综合确定抗原作用时间。
1.5.6 检测抗体最佳作用时间的确定 以上述试验确定的作用条件进行双抗体夹心ELISA,分别选择37 ℃下40、60、90、120 min作为检测抗体作用时间,根据用HRP标记的RHDV1检测抗体检测样品时,P(RHDV1)/N值及P(RHDV1)/P(RHDV2)值;以及用HRP标记的RHDV2检测抗体检测样品时,P(RHDV2)/N值及P(RHDV2)/P(RHDV1) 值,综合确定检测抗体作用时间。
1.5.7 阴性和阳性标准的确定 用建立的双抗体夹心ELISA方法对30份RHDV阴性健康兔肝脏样品进行检测,测定D450 nm的平均值(x)和标准差(s),以“x+3s”作为阴性和阳性的分界线。
1.6 特异性试验
用建立的双抗体夹心ELISA方法检测RHDV1、RHDV2、兔波氏杆菌(Bb)、兔巴氏杆菌(Pm)、兔A型产气荚膜梭菌(CpA)、肠炎沙门氏菌(Se)、轮状病毒(RV)感染死亡兔肝脏样品,评价方法的特异性。
1.7 敏感性试验
将1 ∶10的RHDV1、RHDV2阳性样品倍比稀释至1 ∶20 480,用建立的双抗体夹心ELISA方法对不同稀释度样品测定D450 nm,同时将结果与红细胞凝集试验(HA)对比,从而确定所建立的检测方法的敏感性。
1.8 临床样品检测试验
对四川省、山东省、河南省各兔场送检的60份死亡兔肝脏样品用建立的双抗体夹心ELISA方法进行检测,同时用RT-PCR方法[9]进行检测,比较2种方法的符合率。
2 结果与分析
2.1 抗体配对试验
抗体配对试验结果(表1)显示,单克隆抗体2A11作为捕获抗体,HRP-1D4作为RHDV1检测抗体,P(RHDV1)/N值及P(RHDV1)/P(RHDV2)值最大;单克隆抗体2A11作为捕获抗体,HRP-6B3作为RHDV2检测抗体,P(RHDV2)/N值及P(RHDV1)/P(RHDV1)值最大。
2.2 双抗体夹心ELISA法的建立与优化
2.2.1 肝脏样品最佳稀释倍数的确定 以捕获抗体2A11、RHDV1检测抗体HRP-1D4、RHDV2检测抗体HRP-6B3,对1 ∶10、1 ∶]20、1 ∶40、1 ∶80稀释RHDV1、RHDV2阳性肝脏和阴性肝脏进行检测。结果显示,用RHDV1检测抗体HRP-1D4检测 1 ∶40 稀释的肝脏样品时,P(RHDV1)/N值及P(RHDV1)/P(RHDV2)值最大;用RHDV2检测抗体HRP-6B3检测1 ∶40稀释的肝脏样品时,P(RHDV2)/N值及P(RHDV2)/P(RHDV1)值最大。因此,确定肝脏样品最佳稀释倍数为1 ∶40(表2)。
2.2.2 捕获抗体和检测抗体最适工作浓度的确定 通过方阵滴定法确定捕获抗体和检测抗体的最适工作浓度。结果显示,捕获抗体2A11浓度为 8 μg/mL 或4 μg/mL,RHDV1检测抗体HRP-1D4浓度为0.5 μg/mL时,P(RHDV1)/N值及P(RHDV1)/P(RHDV2)值较大;捕获抗体2A11浓度为4 μg/mL、RHDV2检测抗体HRP-6B3浓度为0.5 μg/mL时,P(RHDV2)/N值及P(RHDV2)/P(RHDV1)值最大。综合考虑确定捕获抗体2A11浓度为4 μg/mL,检测抗体HRP-1D4、HRP-6B3浓度均为0.5 μg/mL(表3)。
2.2.3 最佳封闭液的确定 对比5%脱脂乳、1%BSA、2%明胶、1%干酪素钠作为封闭液的ELISA检测结果。用5%脱脂乳作为封闭液,以RHDV1检测抗体HRP-1D4检测样品时,P(RHDV1)/N值及P(RHDV1)/P(RHDV2)值最大;同时用5%脱脂乳作为封闭液,以RHDV2检测抗体HRP-6B3检测样品时,P(RHDV2)/N值及P(RHDV2)/P(RHDV1) 值最大。因此,确定最佳封闭液为5%脱脂乳(表4)。
2.2.4 最佳抗原作用时间的确定 对比抗原37 ℃下作用0.5、1.0、1.5、2.0 h 的ELISA检测结果。以RHDV1检测抗体HRP-1D4进行试验,抗原作用1.0 h时,P(RHDV1)/N值及P(RHDV1)/P(RHDV2)值最大;以RHDV2检测抗体HRP-6B3进行试验,抗原作用1.0 h或1.5 h时,P(RHDV2)/N值及P(RHDV2)/P(RHDV1)值较大。因此,综合考虑确定最佳抗原作用时间为1.0 h(表5)。
2.2.5 最佳检测抗体作用时间的确定 对比检测抗体37 ℃下作用40、60、90、120 min 的ELISA检测结果。RHDV1检测抗体HRP-1D4作用60 min或 90 min 时,P(RHDV1)/N值及P(RHDV1)/P(RHDV2) 值较大;RHDV2检测抗体HRP-6B3作用60 min时,P(RHDV2)/N值及P(RHDV2)/P(RHDV1)值最大。因此,综合考虑最佳检测抗体作用时间为60 min(表6)。
2.3 阴阳性临界值的确定
检测30份RHDV阴性的健康兔肝脏,检测抗体HRP-1D4检测样品平均值(x)為0.113,标准差(s)为0.027,阴性、阳性临界值为0.195,则待检样品D450 nm≥0.195判为RHDV1阳性,D450 nm<0.195判为RHDV1阴性;检测抗体HRP-6B3检测样品平均值(x)为0.093,标准差(s)为0.024,则待检样品D450 nm≥0.166判为RHDV2阳性,D450 nm<0.166判为RHDV2阴性。
2.4 试验的特异性
对兔常见病原样品用建立的双抗夹心ELISA方法进行检测,结果显示,检测RHDV1阳性样品为RHDV1阳性、RHDV2阴性,检测RHDV2阳性样品为RHDV2阳性、RHDV1阴性;检测兔波氏杆菌(Bb)、兔巴氏杆菌(Pm)、兔A型产气荚膜梭菌(CpA)、肠炎沙门氏菌(Se)、轮状病毒(RV)感染死亡兔肝脏样品,均为阴性,说明该方法特异性良好(表7)。
2.5 试验的敏感性
RHDV1型阳性样品HA效价为1 ∶2 560、1 ∶10 240 稀释时,双夹心ELISA检测结果为阳性,此后为阴性(图1)。RHDV2阳性样品HA效价为 1 ∶2 560、1 ∶5 120稀释时,双夹心ELISA检测结果为阳性,此后为阴性(图2)。与HA试验相比,所建立的ELISA方法具有较高的敏感性。
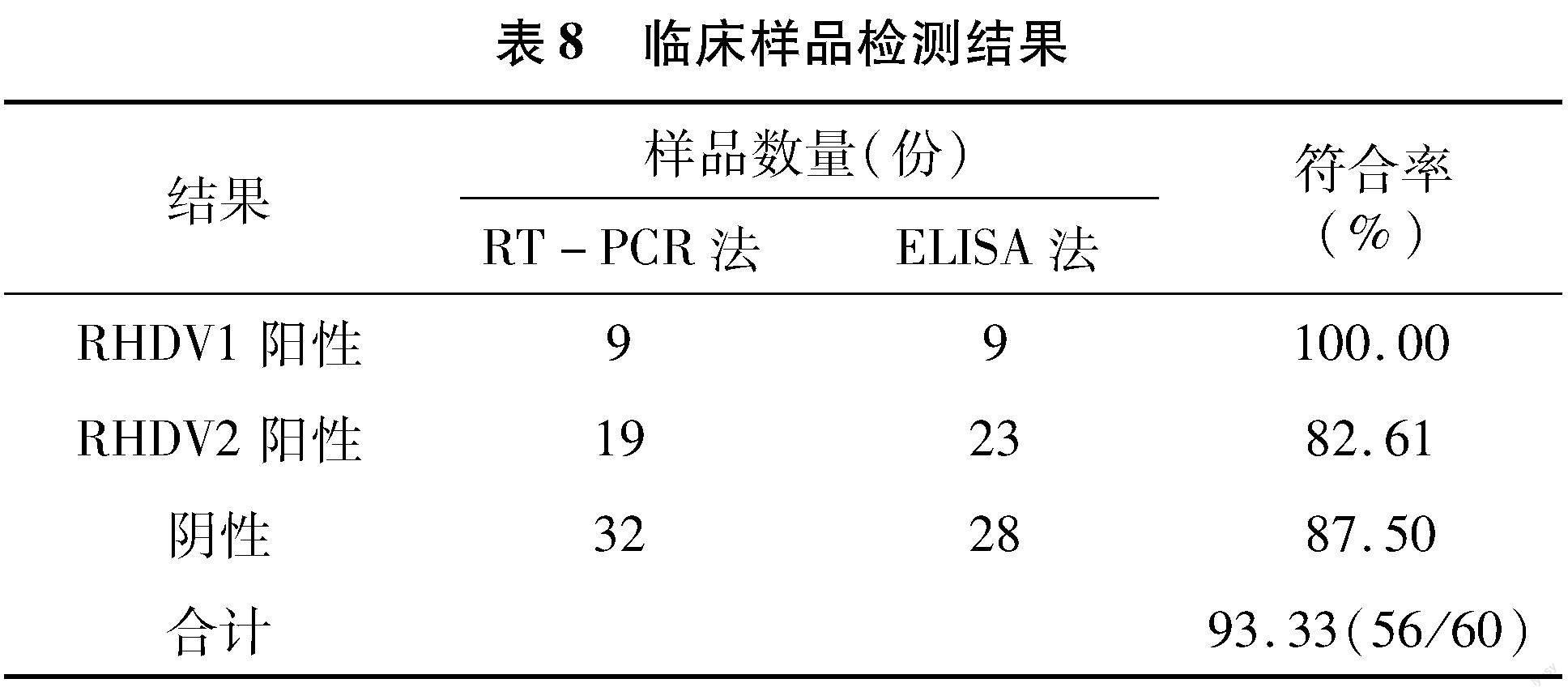
2.6 临床样品检测
对四川省、山东省、河南省各兔场送检的60份死亡兔肝脏样品用建立的双抗体夹心ELISA方法
进行检测,检测结果显示,RHDV1阳性样品9份,RHDV2阳性样品23份,阴性样品28份;RT-PCR方法检测结果显示,RHDV1阳性样品9份,RHDV2阳性样品19份,阴性样品32份。2种方法检测RHDV1阳性样品的符合率为100%(9/9),RHDV2阳性样品的符合率为82.61%(19/23),阴性样品的符合率为87.5%(28/32),总符合率为93.33%(56/60)(表8)。
3 讨论与结论
养兔业是我国畜牧业的重要组成部分,在养殖业中具有不可替代的地位,但RHD的发生与流行,给全球兔养殖业带来了严重威胁。2010年,RHDV2首次在法国报道。我国于2020年4月首次发现RHDV2。研究显示,RHDV1抗原制备的疫苗不能对RHDV2毒株提供有效的交叉保护作用[17],而国内尚无商品化的RHD2疫苗。本研究中采用建立的双抗体夹心ELISA法和RT-PCR方法[9]对2022年送检的死亡兔肝脏样品进行检测,发现RHDV2阳性样品明显多于RHDV1阳性样品,应引起重视;同时,RT-PCR对RHDV2的检出率低于双抗体夹心ELISA,推测可能是因为RT-PCR中扩增RHDV2基因序列的引物是参考法国毒株(GenBank:HE800529.1)设计,并不能很好地适用于国内流行毒株的检测,这需要对阳性样品中RHDV2的基因进行测序验证;也可能是单抗识别的表位在所有试验用毒株都存在。
目前,国内已建立的检测RHDV的双抗体夹心ELISA方法[15-16],使用的是用RHDV1的VP60蛋白作为免疫原制备的单抗,并不适用于RHDV1、RHDV2的鉴别检测;国外报道有特异性检测RHDV2的双抗体夹心ELISA方法[14],在检测临床样品时,需配合特异性检测RHDV1双抗体夹心ELISA方法,而且能否用于国内RHDV2流行毒株的检测需进一步确认。
本研究建立的双抗体夹心ELISA方法在试验中只需包被的同时,针对RHDV1和RHDV2的单克隆抗体2A11作为捕获抗体,分别以HRP标记的RHDV1型特异性单抗1D4、RHDV2型特异性单抗6B3作为检测抗体,提升了抗原抗体反应的特异性,从而减少了假阳性的发生。由于RHDV1与RHDV2感染引起的家兔临床症状极为相似,通过临床症状难以鉴别诊断,本试验建立的双夹心ELISA方法有效针对RHDV1与RHDV2进行鉴别诊断,极大方便了临床样品的大规模检测,而且该方法具备高敏感性、强特异性、易于操作等优点,为下一步开发鉴别检测RHDV1和RHDV2快速诊断试剂盒奠定了基础。
参考文献:
[1]Abrantes J,van der Loo W,Pendu J L,et al. Rabbit haemorrhagic disease (RHD) and rabbit haemorrhagic disease virus (RHDV):a review[J]. Vet Res,2012,43(1):12.
[2]Hu B,Wang F,Fan Z,et al. Recombination between G2 and G6 strains of rabbit hemorrhagic disease virus (RHDV) in China[J]. Arch Virol,2017,162(1):269-272.
[3]Gall-Reculé G L,Zwingelstein F,Boucher S,et al. Detection of a new variant of rabbit haemorrhagic disease virus in France[J]. The Veterinary Record,2011,168(5):137-138.
[4]Strive T,Piper M,Huang N,et al. Retrospective serological analysis reveals presence of the emerging lagovirus RHDV2 in Australia in wild rabbits at least five months prior to its first detection[J]. Transbound Emerg Dis,2020,67(2):822-833.
[5]Rouco C,Abrantes J,Serronha A,et al. Epidemiology of RHDV2 (Lagovirus europaeus/GI.2) in free-living wild European rabbits in Portugal[J]. Transbound Emerg Dis,2018,65(2):e373-e382.
[6]魏后军,胡 波,范志宇,等. 兔出血症病毒2型的分离鉴定与序列分析[J]. 江苏农业学报,2020,36(2):404-409.[HJ2.01mm]
[7]Hu B,Wei H,Fan Z,et al. Emergence of rabbit haemorrhagic disease virus 2 in China in 2020[J]. Vet Med Sci,2021,7(1):236-239.
[8]Abrantes J,Lopes A M. A Review on the methods used for the detection and diagnosis of rabbit hemorrhagic disease virus (RHDV)[J]. Microorganisms,2021,9(5):972.
[9]宋艳华,魏后军,范志宇,等. 兔出血症病毒经典毒株和变异毒株的RT-PCR鉴定[J]. 江苏农业学报,2016,32(5):1117-1121.
[10]肖跃强,孙培姣,周迎春,等. 鉴别RHDV与RHDV2荧光定量RT-PCR檢测方法的建立与应用[J]. 中国预防兽医学报,2021,43(5):512-520.
[11]陈萌萌,仇汝龙,范志宇,等. 兔出血症病毒2型TaqMan探针荧光定量RT-PCR检测方法的建立及应用[J]. 江苏农业学报,2021,37(6):1476-1480.
[12]范志宇,王 岚,王 芳,等. 醛化人“O”型红细胞的制备及其在兔出血症HA/HI试验中的应用[J]. 中国养兔杂志,2008,(11):20-25.
[13]蔡少平,王 芳,贾华敏,等. 兔出血症病毒胶体金免疫层析试纸条诊断方法的建立及初步应用[J]. 畜牧兽医学报,2012,43(11):1795-1801.
[14]Dalton K P,Podadera A,Granda V,et al. ELISA for detection of variant rabbit haemorrhagic disease virus RHDV2 antigen in liver extracts[J]. J Virol Methods,2018,251:38-42.
[15]郭慧敏,谭永贵,缪秋红,等. 双抗夹心ELISA检测兔出血症病毒抗原方法的建立及初步评估[J]. 中国动物传染病学报,2016,24(2):20-24.
[16]董 婷,王 芳,熊富强,等. 兔出血症病毒双夹心ELISA检测方法的建立[J]. 江苏农业学报,2011,27(3):571-576.
[17]宋艳华,胡 波,范志宇,等. 兔出血症病毒2型SC株VP60基因工程疫苗研制及其与传统兔出血症病毒疫苗的交叉保护作用[J]. 江苏农业科学,2022,50(16):50-54.

