过表达LrAN2基因对马铃薯中花青素和糖苷生物碱含量的影响
李红艳 李洁雅 李 响 叶广继,2,3,4,5,6 周 云,2,3,4,5,6 王 舰,2,3,4,5,6,*
过表达基因对马铃薯中花青素和糖苷生物碱含量的影响
李红艳1李洁雅1李 响1叶广继1,2,3,4,5,6周 云1,2,3,4,5,6王 舰1,2,3,4,5,6,*
1青海大学, 青海西宁 810016;2青海省农林科学院, 青海西宁 810016;3青海大学青藏高原生物技术教育部重点实验室, 青海西宁 810016;4青海省马铃薯育种重点实验室, 青海西宁 810016;5省部共建三江源生态与高原农牧业国家重点实验室, 青海西宁 810016;6青藏高原种质资源研究与利用实验室, 青海西宁 810016
目前对马铃薯(L)中MYB基因参与的花青素研究较为深入, 但对影响马铃薯品质和安全的糖苷生物碱(steroidal glycoalkaloids, SGAs)在不同组织中的变化规律及调控机制尚不完全清楚。是黑果枸杞()中的MYB基因, 与黑果枸杞果实中花青素的积累有关。本研究以野生型大西洋、2种转大西洋株系(LrAN2oe#66和LrAN2oe#200)为试验材料, 检测不同组织中的花青素和SGAs含量, 并对SGAs生物合成相关基因的表达量分析。pH示差法检测花青素发现, 仅在转基因植株(LrAN2oe#200)叶片中检测到一定量的花青素(12 mg 100 g–1FW)。高效液相色谱-串联质谱法检测SGAs发现, 3个材料不同组织SGAs含量变化为叶片>薯皮>薯肉。薯皮中的SGAs含量无显著性差异; 薯肉中LrAN2oe#66的SGAs含量较对照降低、LrAN2oe#200对照显著增加1.3倍, 但未超出安全标准(0.2 mg g–1FW); 叶片中LrAN2oe#66的SGAs含量较对照增加1倍、LrAN2oe#200较对照显著增加3.8倍。qRT-PCR分析基因表达量发现,和基因受到基因的调控在转基因植株中显著上调。本研究结果对马铃薯植株中花青素含量的积累具有指导意义, 为进一步解析马铃薯资源中花青素及SGAs的调控机制提供理论依据。
基因; 马铃薯; 花青素; 糖苷生物碱
糖苷生物碱(steroidal glycoalkaloids, SGAs)是茄科和百合科植物生长过程中产生的一类次生代谢有毒物[1-2], 是茄科植物的天然防御物质, 对植物真菌、细菌和病毒引起的病害具有抗性[3-4], 也可作为新药品开发的原料, 同时能够抵御取食昆虫的危害[5]。马铃薯块茎中低浓度的SGAs能够改善马铃薯的口感, 而浓度过高则产生苦涩的口味, 当浓度高于0.2 mg g–1鲜重(fresh weight, FW)时, 对动物和人类具有毒性[6-7]。SGAs的合成与促进呼吸作用的因素呈正相关, 凡是呼吸作用旺盛的植物组织, SGAs也更易于合成[8]。SGAs是通过甲羟戊酸途径合成的, 合成途径如图1, 3-羟基-3-甲基戊二酰辅酶A还原酶(HMGR)催化乙酰辅酶A形成甲羟戊酸、再经鲨烯合酶(SQS1)和鲨烯环氧酶(SQE1)催化合成法尼基焦磷酸, 产物被环丙烯醇合成酶(CAS)和羊毛甾醇合成酶(LAS)催化[9-11]。拟南芥基因()在马铃薯中的异位表达导致叶中SGAs含量增加, 块茎中SGAs含量降低[12]。环丙烯醇合成酶被甾醇侧链还原酶2 (SSR2)脱氧形成胆固醇和其他植物甾醇[13], 后者被甾醇C-24-甲基转移酶1 (SMT1)催化合成植物甾醇类物质[14]。胆固醇通过羟基化、氧化和糖基化修饰生成SGAs[15-16]。目前对转录因子调节SGAs合成的调控机制研究较少, 仅有过表达GAME9转录因子, 激活植物中、等基因的转录水平, 从而积累SGAs[17]。
MYB转录因子主要调控植物中苯丙烷代谢途径中黄酮、花青素及木质素等合成代谢过程, 是植物中最大的转录因子家族之一[18-19]。基因从黑枸杞中克隆得到, 该基因的高表达水平可能是黑枸杞中花青素积累的主要原因。MYB转录因子StMtf1在马铃薯块茎中特异性表达能够激活苯丙烷生物合成途径, 同时促进各种黄酮醇和花青素的累积, 降低块茎中总SGAs含量[20]。前人研究表明, MYB转录因子可能同时参与植物中甲羟戊酸途径和苯丙烷途径的调控, 但详尽的报道较少。基因在马铃薯中是否同时调控花青素和SGAs的合成值得进一步研究。
目前, 对马铃薯中SGAs的研究多集中在块茎中, SGAs在抗性方面的研究却鲜有报导。马铃薯作为重要粮菜兼用的作物, 植株叶片及表皮中含有一定量的SGAs能减轻植物病害而提高抗性。此外, 将马铃薯中的SGAs提取后可用于药理活性研究以利于马铃薯的综合开发应用。因此, 本试验以大西洋为材料, 通过在大西洋中过表达基因, 研究基因对马铃薯不同组织中SGAs的影响, 为创制叶片中SGAs含量高、抗性强的马铃薯资源提供理论参考。

图1 马铃薯SGAs生物合成途径
1 材料与方法
1.1 转基因材料的获得及采集
用于转化的载体PJAM1502:LrAN2由中国科学院西北高原生物研究所刘宝龙博士赠与。载体通过冻融法转化至农杆菌菌株GV3101。
选用野生型大西洋、2个转大西洋株系(LrAN2oe#66和LrAN2oe#200)为试验材料, 于2020年12月10日在青海省农林科学院生物技术研究所温室盆栽中种植, 每盆1株, 每个材料种10株。温室光照16 h/黑暗8 h。在块茎成熟期(2021年5月6日)取样, 选择长势一致的叶片和薯块作为试验样品用于后续试验, 3个生物学重复。
1.2 SGAs检测方法
1.2.1 标准溶液的配制 用40%的甲醇水溶液将α-茄碱(Solanine) (Sigma, 美国)和α-卡茄碱(Chaconine)标准品(Sigma, 美国)配制成400 ng mL–1的标准中间液, 再将标准中间液混合, 逐级稀释成25、50、100、200、300、400、500和600 ng mL–1的混合液, 过0.22 µm滤膜后, 4℃冰箱保存备用。
1.2.2 样品处理方法 取大西洋、转基因(LrAN2oe#66和LrAN2oe#200)的薯皮(约2 mm)、薯肉和叶片进行冷冻干燥后研磨。分别称取薯皮、薯肉和叶片样品粉末0.2 g, 加入5%的乙酸5 mL并混匀, 超声处理30 min, 7104´离心5 min, 收集上清液(稀释500倍或1000倍), 0.22 µm滤膜过滤, 待测。
使用高效液相色谱-串联质谱仪(Agilent 1260 Inifity II-Agilent 6470, 美国)检测α-茄碱和α-卡茄碱含量, 若样品浓度高于线性范围, 上清液继续稀释。
1.3 马铃薯薯皮和叶片花青素的提取及其含量测定
1.3.1 花青素提取 分别准确称取5 g马铃薯薯皮和叶片于50 mL棕色容量瓶中, 加入50 mL提取液(80%浓盐酸∶甲醇=4∶96, v/v)超声300 W、40℃条件下提取30 min后, 混匀取上清。
1.3.2 花青素含量用pH示差法检测 取1 mL上清液于10 mL离心管, 分别加入5 mL HCl-KCl (pH 1.0)和HAc-NaAc缓冲液(pH 4.5)稀释, 将2份样品液混匀放置20 min, 用分光光度计检测样品材料在530 nm和700 nm处的吸光度值。
花青素提取率(mg g–1)=(DA×MV×DF×V)/(m×ε×L)
式中,DA为吸光度,DA = (A530nm– A700nm) pH值1.0 – (A530nm– A700nm) pH值4.5; M为矢车菊素-3-0-葡萄糖苷的相对分子质量, 449.2 g mol–1; V为花青素提取液体积(mL); F为待测液稀释倍数; m为样品质量(g); ε为矢车菊素-3-0-葡萄糖苷的摩尔消光系数, 26,900 L (mol cm)–1; L为光径, 1 cm。
1.4 SGAs生物合成相关基因表达分析
1.4.1 引物设计及合成 糖苷生物碱生物合成所需的引物、、、、、、、、和, 由青海省农林科学院生物技术研究所提供, 由生物工程(上海)股份有限公司合成(表1)。

表1 试验所需引物序列
1.4.2 总RNA的提取及cDNA的合成 采用天根生化科技(北京)有限公司的TaKaRa提取试剂盒提取大西洋和LrAN2oe#200叶片、RNA prep Pure多糖多酚植物总RNA提取试剂盒提取薯皮、薯肉中的总RNA。
参照PrimeScript RT MasterMix (Perfect Real Time) (TaKaRa)说明书合成cDNA, 加样均在冰上进行。反应体系20 μL: 5× Prime Script RT Master Mix (Perfect Real Time) 4 μL, RNA体积等于1000除以RNA浓度, 用RNase Free ddH2O补充至20 μL。反应条件: 37℃ 15 min, 85℃ 3 s, 4℃无限循环。得到的cDNA溶液稀释至200 ng μL–1后, –20℃保存。
1.4.3 qRT-PCR检测 以反转录的cDNA为模板,为内参基因。反应体系20 μL: 2 μL cDNA模板、0.4 μL引物-F (10 µmol L–1)、0.4 μL引物-R (10 µmol L–1)、10 μL TB Green premix ExII、7.2 μL ddH2O。Real Time PCR反应程序为: 95℃ 30 s; 95℃ 10 s, 61℃ 32 s, 40个循环; 95℃ 60 s, 60℃ 60 s, 55℃ 10 s。
2 结果与分析
2.1 过表达LrAN2基因对马铃薯中花青素的影响
使用引物LrAN2-F和LrAN2-R检测阳性植株, 共获得了15株阳性转基因株系(图2)。过表达基因使不同马铃薯植块茎、叶片、薯皮均发生了表型变化, 薯皮和叶片变化较大, 薯皮由白色变为浅粉色, 叶片由绿色变为紫色。用pH示差法检测大西洋和转基因LrAN2oe#200薯皮和叶片中的花青素含量, 仅检测到转基因LrAN2oe#200叶片中积累了花青素, 为鲜重下12 mg 100 g-1(图3), 符合表型变化特征。本试验发现过表达基因增加了转基因叶片中的花青素含量, 薯皮仅有表型变化, 但难以检测到花青素, 表明基因诱导马铃薯中花青素的积累具有组织特异性。
2.2 过表达LrAN2基因对马铃薯不同组织中SGAs的影响
利用HPLC-MS/MS法检测了大西洋(Atlantic) 和转基因(LrAN2oe#66、LrAN2oe#200)薯皮、薯肉和叶片中的SGAs含量。平均值用LSD法多重比较发现, 3种试验材料叶片中的SGAs含量均高于薯皮和薯肉, 其中薯肉中的SGAs含量最少。薯皮中, 转基因植株和对照之间SGAs含量无显著性差异(图4-A)。薯肉中, LrAN2oe#66较对照的SGAs含量降低但无显著差异, 转基因LrAN2oe#200中SGAs含量较对照显著增加1.3倍(图4-B)。叶片中, 转基因植株中SGAs含量有所增加, 其中LrAN2oe#66 较对照增加1倍, LrAN2oe#200中SGAs积累最高, 较对照显著增加3.8倍(图4-C)。鉴于转基因LrAN2oe#66的SGAs含量与对照无显著性差异, 而转基因LrAN2oe#200的SGAs含量与对照有显著性差异。因此, 选用大西洋和转基因LrAN2oe#200为试验材料进行SGAs生物合成相关基因表达性分析。

图2 部分过表达LrAN2基因马铃薯
M: DL 2000 marker; Plasmid: LrAN2质粒; WT: 野生型。
M: DL 2000 marker; Plasmid: LrAN2 plasmid; WT: wild-type.

图3 大西洋(Atlantic)和转基因马铃薯的表型特征(A)、大西洋和LrAN2oe#200的花青素含量(B)
n.d.表示花青素含量为0 mg 100 g–1, 生物学重复= 3。
n.d. means the anthocyanin content is 0 mg 100 g–1, biological replicates= 3.
2.3 过表达LrAN2转基因对SGAs生物合成途径中相关基因的表达量影响
将提取的大西洋和转基因马铃薯LrAN2oe#200薯皮、薯肉和叶片中的RNA反转为cDNA, 利用qRT-PCR对SGAs生物合成途径中、、、、、、、、和10个基因的相对表达量进行分析。
相较于对照, 薯皮中,、、、和基因在LrAN2oe#200中的表达量显著上调, 其他基因的表达无规律性变化(图5); 薯肉中,基因在大西洋中显著上调, 其他基因均在LrAN2oe#200中显著上调(图6); 叶片中,、、、、、、和基因显著上调,和基因的相对表达量略有上调(图7)。就马铃薯而言, SGAs生物合成途径中和基因的表达量在转基因马铃薯不同组织中表达受到基因调控均上调, 与SGAs含量变化相关性高; 其他基因在转基因马铃薯不同组织中变化不一致, 说明基因的过表达可以组织特异性调节马铃薯中SGAs的生物合成途径中结构基因的表达。

图4 Atlantic、LrAN2oe#66、LrAN2oe#200薯皮(A)、薯肉(B)和叶片(C)中的SGAs含量
不同小写字母表示不同品种间SGAs的差异显著性(< 0.05)。
Different lowercase letters indicate significant difference in the contents of SGAs at< 0.05.

图5 SGAs生物合成相关基因在Atlantic和LrAN2oe#200薯皮中的表达量变化
不同小写字母表示不同品种间基因表达量的差异显著性(< 0.05)。
Different lowercase letters indicate significant differences in the relative expression levels among different varieties at< 0.05.
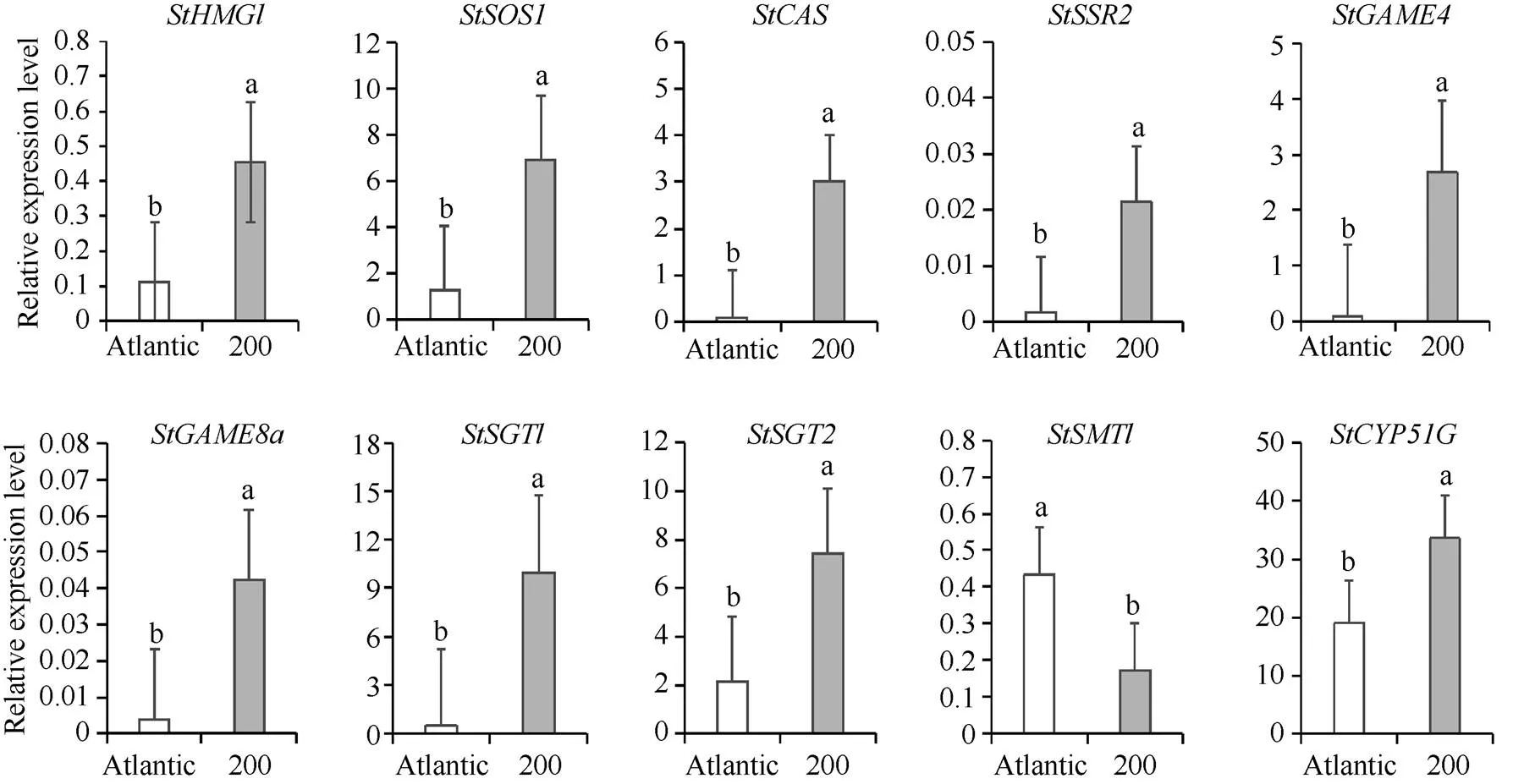
图6 SGAs生物合成相关基因在Atlantic和LrAN2oe#200薯肉中的表达量变化
不同小写字母表示不同品种间基因表达量的差异显著性(< 0.05)。
Different lowercase letters indicate significant differences in gene expression among different varieties at< 0.05.
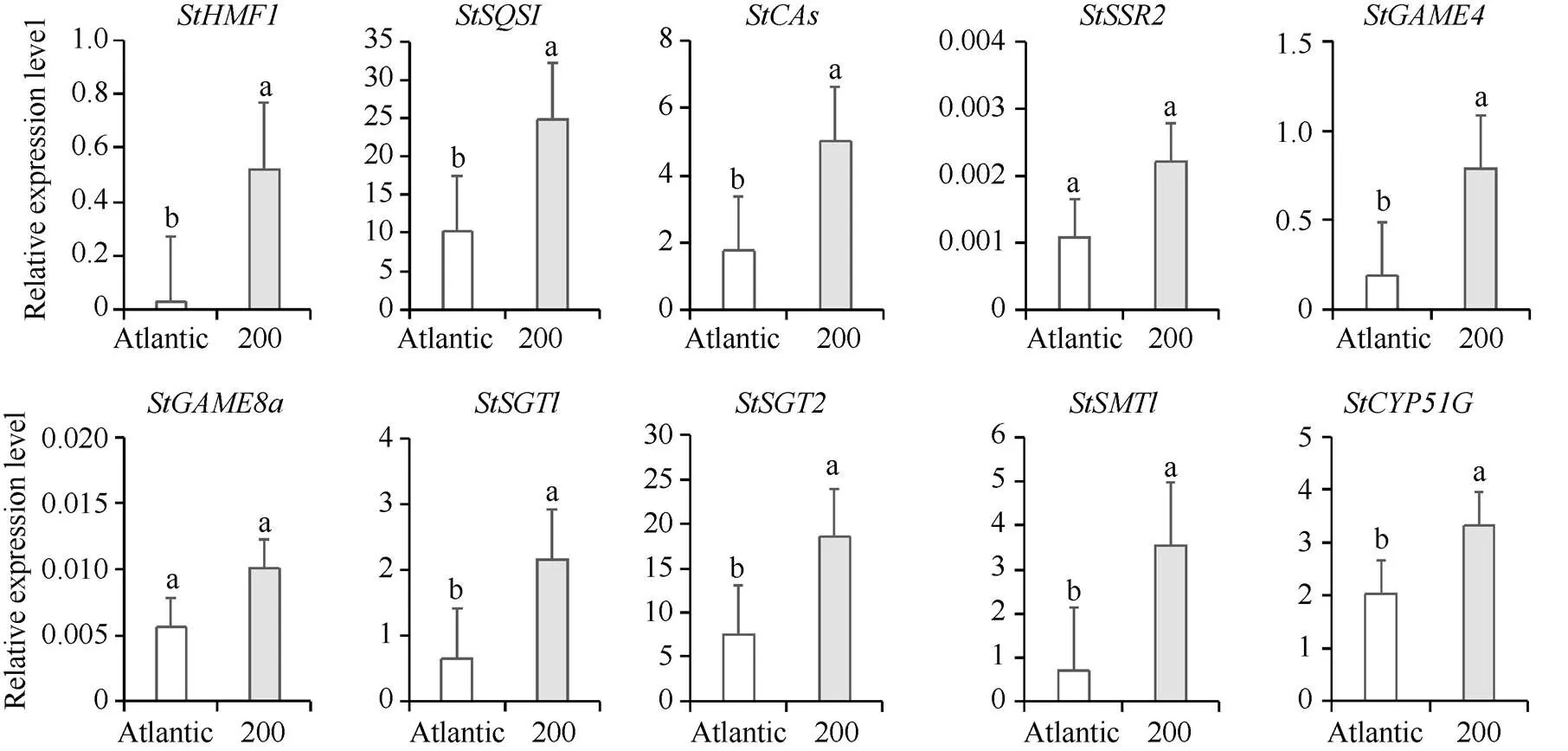
图7 SGAs生物合成相关基因在Atlantic和LrAN2oe#200叶片中的表达量变化
不同小写字母表示不同品种间基因表达量的差异显著性(< 0.05)。
Different lowercase letters indicate significant differences in gene expression among different varieties at< 0.05.
3 讨论
本研究证实了过表达基因对马铃薯中花青素和SGAs积累模式的组织特异性。罗香怡等[21]以番茄为试验材料, 检测到花青素含量和基因在叶片中的表达量最高。番茄与马铃薯同属茄科作物, 番茄中的花青素及SGAs含量与马铃薯中的花青素及SGAs含量变化有一定的相关性, 但本研究未做番茄相关的研究, 无法证实。研究发现, 在烟草中过表达基因诱导烟草所有组织中的花青素生物合成, 并且转基因烟草叶片中生物碱类物质含量降低[22]。超表达糖基转移酶TOGT (salicylate-and pathogen-inducible glucosyltransferase), 可促使烟草中苯基丙烷类物质的合成, 进而提高烟草的抗病性[23-24]。在本研究中, 过表达基因使转基因马铃薯叶片中的花青素含量增加, 与前人研究结果有一定差异, 推测烟草和马铃薯虽同属茄科, 但生长模式存在差异。过表达基因是否能积累马铃薯植株中的花青素含量, 具体原因本试验数据难以揭示。早期Rommens等[20]发现由pUbi7启动子驱动MYB转录因子StMtf1的表达积累了转基因马铃薯块茎中的花青素含量。转录因子StMtf1和LrAN2位于同一MYB家族, 其表达模式接近。
qRT-PCR分析发现, 过表达基因使马铃薯薯肉和叶片中大部分SGAs合成结构基因的表达量上调。和基因作为SGAs生物合成的限速酶, 分别调控α-茄碱和α-卡茄碱的合成过程, 本研究测得α-卡茄碱含量比α-茄碱含量高, 符合前人研究结果[25-26]。但表达量分析发现, 薯肉中,基因的表达量高于基因, 与SGAs含量变化不一致, 推测马铃薯材料的不同处理造成了试验结果的差异。此外, 部分基因的表达模式具有组织特异性。在植物组织中超表达糖基转移酶家族基因, 可提高作物的抗逆性[8]。和基因调控的SGAs合成途径中, 转基因马铃薯植株叶片中SGAs含量高, 具体表现哪一方面的抗性, 其原因有待解析。
CaMV 35S (花椰菜花叶病毒35S)是一种组成型启动子, 有助于推动转基因植物的组成型表达、阐明许多植物基因的功能并增进对植物过程的了解, 它广泛用于植物基因功能的研究[27]。然而35S promoter在植物各种组织细胞类型中具有一定的组织特异性, 偶尔呈现“补丁”表达模式[28]。本研究利用double 35S启动子驱动基因在马铃薯中过表达, 发现马铃薯中花青素和SGAs的积累均具有组织特异性, 未来需要进一步研究是过表达基因调控或是糖基转移酶家族基因调控花青素或SGAs的合成。
4 结论
本研究通过在不同马铃薯材料薯皮、薯肉和叶片中过表达基因, 花青素检测发现, 在马铃薯中过表达基因仅能提高转基因植株叶片中的花青素含量, 花青素的积累具有组织特异性; SGAs检测发现, 过表达基因提高了转基因马铃薯地上部叶片中的SGAs含量, 而3个材料薯肉中的SGAs含量未超出安全标准(0.2 mg g-1FW); qRT-PCR检测发现, 转基因马铃薯中,和基因均受基因的调控上调表达, 其他部分上调基因的表达模式具有组织特异性。
[1] 石娜, 何玉华. 糖苷生物碱的药理学及临床应用研究进展. 畜牧与饲料科学, 2018, 39(6): 78–80.
ShiN, He Y h. Progress in pharmacology and clinical application of glycoalkaloids., 2018, 39(6): 78–80 (in Chinese with English abstract).
[2] 梁克红, 卢林纲, 朱大洲, 朱宏. 马铃薯糖苷生物碱的研究进展. 食品研究与开发, 2017, 38(21): 195–199.
Liang K H, Lu L G, Zhu D Z, Zhu H. Research progress of potato glycoside alkaloids., 2017, 38(21): 195–199 (in Chinese with English abstract).
[3] Mohsenikia M, Farhangi B, Alizadeh A M, Khodayari H, Khodayari S, Khori V, Arjmand A Y, Vesovic M, Soleymani A, Najafi F. Therapeutic effects of dendrosomal solanine on a metastatic breast tumor., 2016, 148: 260–267.
[4] 李志文, 周宝利, 刘翔, 张平. 茄科植物体内糖苷生物碱的生理生态活性研究进展. 上海农业学报, 2011, 27(3): 129–134.
Li Z W, Zhou B L, Liu X, Zhang P. Research progress on the physiological and ecological activities of glycoalkaloids in Solanaceae., 2011, 27(3): 129–134 (in Chinese with English abstract).
[5] Sanford L L, Kobayashi R S, Deahl K L, Sinden S L. Diploid and tetraploid Solanum chacoense genotypes that synthesize leptine glycoalkaloids and deter feeding by Colorado potato beetle., 1997, 74: 15–21.
[6] 伍慧敏, 曾静, 李美, 刘德明, 杜宇, 熊兴耀, 曾建国. 液相色谱-质谱联用法检测马铃薯中α-茄碱含量. 食品科学, 2013, 34(24): 121–124.
Wu H m, Zeng J, Li M, Liu D M, Du Y, Xiong X Y, Zeng J G. Determination of α-solanine in potato by liquid chromatography-mass spectrometry., 2013, 34(24): 121–124 (in Chinese with English abstract).
[7] 任丹丹, 刘洋, 史晓梅, 孙大江, 王书雅, 谢云峰. 超高效液相色谱-串联质谱法测定马铃薯中α-茄碱和α-卡茄碱. 食品安全质量检测学报, 2019, 10: 8231–8235.
Ren D d, Liu Y, Shi X m, Sun D J, Wang S Y, Xie Y F. Determination of α-solanine and α-caconine in potato by ultra performance liquid chromatography-tandem mass spectrometry., 2019, 10: 8231–8235 (in Chinese with English abstract).
[8] 郭海霞, 张晶晶, 安然, 乔岩, 石文慧, 石菁, 张金文. 马铃薯地上部绿色组织中糖苷生物碱合成调控的研究. 园艺学报, 2017, 44: 1105–1115.
Guo H x, Zhang J j, An R, Qiao Y, Shi W H, Shi J, Zhang J W. Study on the regulation of glycoalkaloid synthesis in the aboveground green tissues of potato., 2017, 44: 1105–1115 (in Chinese with English abstract).
[9] Itkin M, Heinig U, Tzfadia O, Bhide A J, Shinde B, Cardenas P D, Bocobza S E, Unger T, Malitsky S, Finkers R, Tikunov Y, Bovy A, Chikate Y, Singh P, Rogachev I, Beekwilder J, Giri A P, Aharoni A. Biosynthesis of antinutritional alkaloids in solanaceous crops is mediated by clustered genes., 2013, 341: 175–179.
[10] Nakayasu M, Umemoto N, Ohyama K, Fujimoto Y, Lee H J, Watanabe B, Muranaka T, Saito K, Sugimoto Y, Mizutani M. A dioxygenase catalyzes steroid 16 α-hydroxylation in steroidal glycoalkaloid biosynthesis., 2017, 175: 120–133.
[11] Nes W D. Biosynthesis of cholesterol and other sterols., 2011, 111: 6423–6451.
[12] Kumar A, Fogelman E, Weissberg M, Tanami Z, Veilleux R E, Ginzberg I. Lanosterol synthase-like is involved with differential accumulation of steroidal glycoalkaloids in potato., 2017, 246: 1189–1202.
[13] Sawai S, Ohyama K, Yasumoto S, Seki H, Sakuma T, Yamamoto T, Takebayashi Y, Kojima M, Sakakibara H, Aoki T, Muranaka T, Saito K, Umemoto N. Sterol side chain reductase 2 is a key enzyme in the biosynthesis of cholesterol, the common precursor of toxic steroidal glycoalkaloids in potato., 2014, 26: 3763–3774.
[14] Arnqvist L, Dutta P C, Jonsson L, Sitbon F. Reduction of cholesterol and glycoalkaloid levels in transgenic potato plants by overexpression of a type 1 sterol methyltransferase cDNA., 2003, 131: 1792–1799.
[15] Sonawane P D, Heinig U, Panda S, Gilboa N S, Yona M, Kumar S P, Alkan N, Unger T, Bocobza S, Pliner M, Malitsky S, Tkachev M, Meir S, Rogachev I, Aharoni A. Short-chain dehydrogenase/reductase governs steroidal specialized metabolites structural diversity and toxicity in the genus., 2018, 115: E5419–E5428.
[16] 黄红苹, 郭华春, 王琼, 沈词专, 周晨. 云南马铃薯品种(系)块茎中的龙葵素含量测定. 中国农业科学, 2011, 44: 1512–1518.
Huang H p, Guo H c, Wang Q, Shen C Z, Zhou C. Determination of solanine content in tubers of Yunnan potato varieties (lines)., 2011, 44: 1512–1518 (in Chinese with English abstract).
[17] Cárdenas P, Sonawane P, Pollier J, Vanden Bossche R, Dewangan V, Weithorn E, Tal L, Meir S, Rogachev I, Malitsky S. GAME9 regulates the biosynthesis of steroidal alkaloids and upstream isoprenoids in the plant mevalonate pathway., 2016, 7: 10654.
[18] 许芸梅, 李玉梅, 贾玉鑫, 张春芝, 李灿辉, 黄三文, 祝光涛. 马铃薯红色薯肉调控基因的精细定位与候选基因分析. 中国农业科学, 2019, 52: 2678–2685.
Xu Y M, Li Y M, JiaY X, Zhang C Z, Li C H, Huang S W, Zhu G T. Fine mapping and candidate gene analysis of regulatory genes in potato red potato meat., 2016, 52: 2678–2685 (in Chinese with English abstract).
[19] Chhon S, Jeon J, Kim J, Park S U. Accumulation of anthocyanins through overexpression of AtPAP1 inLin. (Black Nightshade)., 2020, 10: 277.
[20] Rommens C M, Richael C M, Yan H, Navarre D A, Ye J, Krucker M, Swords K. Engineered native pathways for high kaempferol and caffeoylquinate production in potato., 2008, 6: 870–886.
[21] 罗香怡, 李云, 曹东, 魏乐, 宗渊, 刘宝龙. 枸杞MYB转录因子LrAN2在番茄中的过量表达分析. 西北农业学报, 2021, 30: 1374–1381.
Luo X Y, Li Y, Cao D, Wei L, Zong Y, Liu B L. Analysis of overexpression ofMYB transcription factor LrAN2 in tomato., 2021, 30: 1374–1381 (in Chinese with English abstract).
[22] Zong Y, Zhu X, Liu Z, Xi X, Li G, Cao D, Wei L, Li J, Liu B. Functional MYB transcription factor encoding geneis associated with anthocyanin biosynthesis inMurray., 2019, 19: 169.
[23] Chong J, Baltz R, Schmitt C, Beffa R, Fritig B, Saindrenan P. Downregulation of a pathogen-responsive tobacco UDP-Glc: phenylpropanoid glucosyltransferase reduces scopoletin glucoside accumulation, enhances oxidative stress, and weakens virus resistance., 2002, 14: 1093–1097.
[24] Gachon C, Baltz R, Saindrenan P. Over-expression of a scopoletin glucosyltransferase inleads to precocious lesion formation during the hypersensitive response to tobacco mosaic virus but does not affect virus resistance., 2004,54: 137–146.
[25] 谭继君, 伍小松. α-茄碱的生理功能及其在畜禽生产中的应用前景. 中国饲料, 2018, 4(17): 23–26.
Tan J J, Wu X S. Physiological function of α-solanine and its application prospect in livestock and poultry production., 2018, 4(17): 23–26 (in Chinese with English abstract).
[26] 商婷婷, 邝梦婷, 胡新喜, 熊兴耀, 陆英. HPLC-ELSD法同时测定马铃薯中α-茄碱和α-卡茄碱含量. 食品与机械, 2015, 31(4): 55–58.
Shang T T, Guang M T, Hu X X, Xiong X Y, Lu Y. Simultaneous determination of α-solanine and α-chaconine in potato by HPLC-ELSD., 2015, 31(4): 55–58 (in Chinese with English abstract).
[27] 郑海松, 谢晶琦, 孙娟娟, 叶永康, 操小栋. 转基因作物中CaMV35S序列信号双重放大的电化学基因传感方法. 分析测试学报, 2021, 40: 989–995.
Zheng H S, Xie J Q, Sun J J, Ye Y K, Cao X D. Electrochemical gene sensing method for double amplification of CaMV35S sequence signal in transgenic crops., 2021, 40: 989–995 (in Chinese with English abstract).
[28] Holtorf S, Apel K, Bohlmann H. Comparison of different constitutive and inducible promoters for the overexpression of transgenes in., 1995, 29: 637–646.
Effects of overexpression ofgene on contents of anthocyanins and glycoalkaloids in potato
LI Hong-Yan1, LI Jie-Ya1, LI Xiang1, YE Guang-Ji1,2,3,4,5,6, ZHOU Yun1,2,3,4,5,6, and WANG Jian1,2,3,4,5,6,*
1Qinghai University, Xining 810016, Qinghai, China;2Qinghai Academy of Agriculture and Forestry Sciences, Xining 810016, Qinghai, China;3Qinghai University Key Laboratory of Qinghai-Tibet Plateau Biotechnology of the Ministry of Education, Xining 810016, Qinghai, China;4Qinghai Provincial Key Laboratory of Potato Breeding, Xining 810016, Qinghai, China;5Provincial and Ministry Co-construction of the State Key Laboratory of Sanjiangyuan Ecology and Plateau Agriculture and Animal Husbandry, Xining 810016, Qinghai, China;6Laboratory for Research and Utilization of Qinghai Tibet Plateau Germplasm Resources, Xining 810016, Qinghai, China
At present, the research on the anthocyanins involved in the MYB gene inpotato (L.) is relatively in-depth, but the change rule and regulatory mechanism of the glycoalkaloids (steroidal glycoalkaloids, SGAs) in different tissues, which affect the quality and safety of potato, are still unclear., the MYB gene in, is associated with the accumulation of anthocyanins infruit. In this study, to detect the contents of anthocyanins and SGAs in different tissues, and to analyze the expression of genes related to SGA biosynthesis, wild-type Atlantic and two trans-Atlantic lines (LrAN2oe#66 and LrAN2oe#200) were used as the test materials. The detection of anthocyanins by pH differential method showed that only a certain number of anthocyanins (12 mg 100 g–1FW) were detected in the leaves of transgenic plants (LrAN2oe#200). The contents of SGAs by HPLC-TMS in different tissues of the three materials were as follows: leaves>potato skin>potato flesh. There was no significant difference in the contents of SGAs in potato peels. Compared with the control, the SGAs content of LrAN2oe#66 in potato flesh was lower than the control, and the SGAs content of LrAN2oe#200 was significantly increased by 1.3 times, but did not exceed the safety standard (0.2 mg g–1FW). The contents of SGAs in LrAN2oe#66 of leaves were increased by 1 times and LrAN2oe#200 was significantly increased by 3.8 times compared with the control.andgenes were significantly up-regulated in transgenic plants under the regulation ofgene by qRT-PCR. These results give a guiding significance for the accumulation of anthocyanins in potato plants and provide a theoretical basis for further analysis of the regulation mechanism of anthocyanins and SGAs in potato resources.
gene; potato; anthocyanin; glycoalkaloid
10.3724/SP.J.1006.2023.24082
本研究由财政部和农业农村部国家现代农业产业技术体系建设专项(CARS-9), 青海省科学自然基金项目-创新团队(2022-ZJ-902)和青海省创新平台建设专项(2022-ZJ-Y01)资助。
This study was supported by the China Agriculture Research System of MOF and MARA (CARS-9), the Qinghai Natural Science Foundation Program-Innovation Team (2022-ZJ-902), and the Qinghai Innovation Platform Construction Project (2022-ZJ-Y01).
王舰, E-mail: jianwang2197@163.com
E-mail: 1286068155@qq.com
2022-04-03;
2022-07-21;
2022-08-17.
URL: https://kns.cnki.net/kcms/detail/11.1809.S.20220816.1615.006.html
This is an open access article under the CC BY-NC-ND license (http://creativecommons.org/licenses/by-nc-nd/4.0/).

