L-硒-甲基硒代半胱氨酸的合成及中试工艺
廖 津, 杨佩玲, 李艺菲, 刘 珏, 戴扬晓, 郑 洁, 欧仕益, 周 华
(暨南大学 食品科学与工程系, 广东 广州 510632)
1 前 言
硒(Se)是人体不可或缺的微量元素[1],硒摄入量与疾病死亡率呈“U”型关系[2]。L-硒-甲基硒代半胱氨酸(L-SeMC)是国家食药局批准的新型食品营养补硒强化剂[3],具有促进伤口愈合[4]、改善阿尔兹海默症[5-6]、护肝、防癌抗癌[7-8]等生理活性。虽然该化合物在食用真菌[9-10]、大蒜和芥菜[11]等食物中均有分布,但因含量低,难以满足人们对优质硒源的日常需求。人工合成L-SeMC 是目前解决补硒缺口最现实的方式之一,目前报道的合成方法主要包括甲硒基乙醛法[12]、α-氨基丙烯酸加成法[13]、二溴丙腈取代法[14]和丝氨酸转化法[15]等。前3 种方法均以不带光学活性的化工试剂为起始原料,需要在最终步骤进行L和D构型的分离,分离成本高,产业化前景不明朗。丝氨酸转化法以自然界广泛存在的L-丝氨酸(L-Ser)为原料,本身具有光学活性,用其作为起始原料合成L-硒代胱氨酸(L-SeC2)后,再制备L-SeMC,不需额外的手性分离,操作简便;另外,原料丝氨酸属于大宗商品,价格低廉,原料与产品价差巨大,工业附加值显著,因而具有明显工业化潜力。
尽管如此,丝氨酸转化法至今仍未实现L-SeMC 的规模化生产,主要存在以下问题:(1)以丝氨酸为起始原料制备L-SeC2,需要使用易制毒试剂如氯化氢-二氧六环、丙酮以及易燃易爆的硼氢化钠等试剂,操作安全系数低,生产成本高;(2)目标产物L-SeMC 的合成,同样需采用易燃易爆的硼氢化钠作为还原剂,如在弱碱弱酸条件下,原料溶解不充分(L-SeC2不溶于弱碱);在强酸条件下,还原过程会消耗还原剂,同时产生大量氢气;在强碱条件下,硼氢化钠的还原性又受到抑制,难以快速完成反应。
针对上述问题,本研究提出具体改进方案:(1)采用二氧六环-水-氯化亚砜体系制备中间产物3-氯-L-丙氨酸盐酸盐,使操作更加方便;(2)以次硫酸氢钠甲醛/三乙酰氧基硼氢化钠为还原剂代替易燃易爆的硼氢化钠制备L-SeC2,改进后反应更温和安全,成本更加低廉;(3)以三乙酰氧基硼氢化钠((CH3COO)3BHNa)代替硼氢化钠还原L-SeC2,合成目标产物L-SeMC,改进后可以减少溶剂水的使用,降低分离能耗。基于上述方案,探讨关键工艺条件对合成产物产率的影响,并搭建规模化的合成装置,以评估该工艺的中试可行性,为L-SeMC 的产业化奠定基础。
2 实 验
2.1 实验材料与仪器
安捷伦5975E 质谱仪、安捷伦Infinity Lab LC/MSD HPLC-MS iQ 单四极杆液质联用系统、布鲁克AVANCEIII 核磁共振波谱仪(400M)、赛默飞GEN10S UV-VIS 紫外线可见光分光光度计、亚荣RE-52AA 旋转蒸发器。硒粉、锌粉为工业级,购自阿拉丁试剂有限公司,L-丝氨酸、氯化亚砜、三乙酰氧基硼氢化钠、硼氢化钠均为分析纯,购自上海毕得医药科技股份有限公司,二氧六环、NaOH、盐酸(质量分数:36%)等均为分析纯,购自天津大茂化学试剂厂。
2.2 实验方法
2.2.1 产物分析方法
质谱分析:正离子模式,毛细管电压为5 000 V,去溶剂电压为80 V,干燥气温度为500 ℃,气体流速为8.0 L·min-1,质谱扫描范围:50~200。
核磁分析:取15 mg样品,溶于盐酸溶液中,旋蒸抽干后加5 mL的氘代试剂(重水),然后用一次性注射器转移到核磁管中。将制备好的样品平稳放入核磁共振波谱仪中,得13C-NMR图、1H-NMR图。
2.2.2 合成路线
合成路线如图1 所示。
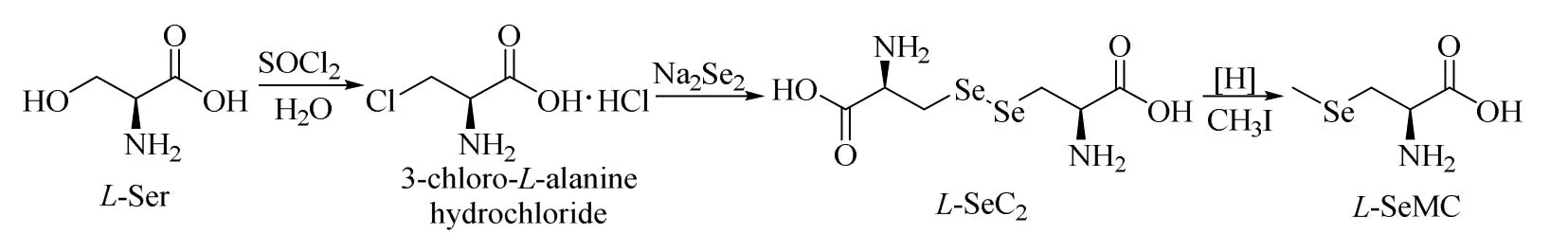
图1 L-硒-甲基硒代半胱氨酸的合成路线Fig.1 Synthetic route of L-SeMC
2.2.3 中试生产工艺流程以及设备
为将合成工艺应用于工业生产,设计并研发如图2 所示L-SeC2的中试生产流程以及对应设备。工艺流程如下:冷冻后的二氧六环(1)、吡啶(2)、氯化亚砜(3)和水(4)由3-氯-L-丙氨酸盐酸盐反应釜(13)充分混合,搅拌状态下在固体进料口(11)加入L-丝氨酸,反应中产生的气体进入安全瓶(5),其中的酸性废气被碱液瓶(6)吸收。反应结束后物料进入固液分离装置(14),滤液主要为二氧六环,进入回收罐(19),滤渣停留在装置内,经由蒸馏水缓慢冲洗溶解后进入储存罐(15)备用。硒粉、NaOH 和水在反应釜(16)中充分混合后,分批加入次硫酸氢钠甲醛/三乙酰氧基硼氢化钠制备二硒化二钠,加入调节好pH 的3-氯-L-丙氨酸盐酸盐溶液。反应结束后加盐酸调节pH,经过滤装置(20)进入沉降罐(17),滤液调中性析出L-SeC2后沉降数日,排出上清液,再次加入盐酸溶解L-SeC2,经过滤装置(21)进入重结晶罐(18),调中性后重结晶数日,排出上清液,湿润固体进入滚筒烘干机(22)烘干成品。

图2 中试生产工艺流程以及关键设备Fig.2 Schematic diagram of the pilot production line with key equipment
2.2.4 制备3-氯-L-丙氨酸盐酸盐的中试工艺条件
以实验室小试条件为基础,扩大100 倍物料用量:取200 mL 氯化亚砜(物质的量为2.753 6 mol)、少许吡啶与1.2 L 二氧六环于-18 ℃冷冻过夜后混合均匀,加入100 mL(5.555 6 mol)蒸馏水混合540 min,再加入600 mL 氯化亚砜(8.260 9 mol)搅拌状态下加入600 gL-丝氨酸(5.709 4 mol),于35 ℃搅拌1 800 min,过滤后白色滤渣为3-氯-L-丙氨酸盐酸盐,产率86.9 %,加入6 L 蒸馏水溶解备用。
产率计算公式为
式中:W1为3-氯-L-丙氨酸盐酸盐产率,%;m1、m2分别为产物中3-氯-L-丙氨酸盐酸盐、反应物中L-丝氨酸的质量,g;Mr1、Mr2分别为3-氯-L-丙氨酸盐酸盐、L-丝氨酸的相对分子质量。
采用质谱、核磁共振波谱仪确定产物结构。ESI-MSC(质荷比m/z):[M+H]+计算值为124.54,测定值为125.0;13C-NMR (75 MHz,CD3OD):化学位移δ为173.91,58.30,46.20,1H-NMR (300 MHz,CD3OD):δ为4.18 (1H),4.04~4.08(2H),与文献表征结果一致[16],确定产物为3-氯-L-丙氨酸。
2.2.5 制备L-SeC2的中试工艺条件
以实验室小试条件为基础扩大100 倍物料用量:
(1) 次硫酸氢钠甲醛法:称取300 g(3.799 4 mol)硒粉、250 g(6.250 0 mol)NaOH 与2 L 蒸馏水充分搅拌混合后,分批加入次硫酸氢钠甲醛350 g(2.271 1 mol),60 ℃搅拌反应60 min 后加300 g(1.875 1 mol)3-氯-L-丙氨酸盐酸盐(溶于1.5 L 蒸馏水,饱和NaOH 溶液调节pH=8)反应720 min 后滴加浓盐酸调pH<1,过滤得到滤液,以饱和NaOH 溶液调pH 至中性,析出黄色固体为L-SeC2(产率:59.9%)。
(2) 三乙酰氧基硼氢化钠法:称取300 g 硒粉、250 g NaOH 与1 L 蒸馏水充分搅拌混合后,分数次加入总量为300 g(1.415 5 mol)的三乙酰氧基硼氢化钠于25 ℃搅拌40 min,加入300 g 的3-氯-L-丙氨酸盐酸盐(溶于1.5 L 蒸馏水,饱和NaOH 溶液调节pH=8)搅拌720 min(产率:75.0%),其他步骤同上。
产率计算公式为
式中:W2为L-SeC2产率,%;m3、m4分别为产物中L-SeC2、反应物中3-氯-L-丙氨酸盐酸盐的质量,g;Mr3为L-SeC2的相对分子质量。
经质谱、核磁共振波谱仪检测MS:m/z[M+H]+计算值为335.10,测试值为335.10;13C-NMR (75 MHz,D2O)δ为170.68,53.19,26.96,1H-NMR (300 MHz,D2O)δ为4.31~4.33 (2H),3.48~3.51(2H),与文献表征结果基本一致[17],确定产物为L-SeC2。
2.2.6 紫外分光光度法监测L-SeC2质量浓度
称取纯品0.10 gL-SeC2置于100 mL 容量瓶,并用浓度为0.50 mol·L-1的NaOH 溶液定容,配制成质量浓度为1.00 g·L-1母液,随后按照比例稀释配制成0.10~0.50 g·L-1的L-SeC2标准溶液。以标准溶液溶剂作为空白对照,室温下在200~800 nm 波长范围内进行紫外可见扫描,得到最佳检测波长为305 nm,标准曲线方程为:y= 0.720 8x-0.001 5,相关系数R2=0.996 2,线性较好。
为验证检测方法的可靠性,将标准溶液稀释1×104倍后以液相色谱法进行检测,液相色谱条件为流动相:水和乙腈体积比为50:50,流速为0.20 mL·min-1,进样量为1.00 μL,无色谱柱,二通连接,检测器为紫外检测器,获得标准曲线为:y=2 120.157 2x+19.985 1,R2=0.999 1,线性较好。
2.2.7L-SeMC 的实验室制备
称取NaOH 1.00 g(0.025 0 mol),加入50 mL 蒸馏水搅拌溶解冷却后加入2.00 g(0.006 0 mol)L-SeC2,完全溶解后加入2.00 g(0.009 4 mol)三乙酰氧基硼氢化钠,搅拌至无色透明。加入碘甲烷(CH3I)1.5 mL(0.024 1 mol)和适量无水乙醇混合溶液,搅拌30 min 后滴加浓盐酸至pH<1,常温磁力搅拌30 min。将体系于60 ℃减压旋蒸除去滤剂,冷却后用30 mL 无水乙醇洗出产物并过滤,得到透明滤液为L-SeMC 盐酸盐溶液,白色滤渣为无机盐。加入吡啶中和滤液,白色固体析出,静置于4 ℃冰箱720 min 后过滤,用二氯甲烷洗涤滤饼,干燥得到纯白色固体为L-SeMC(产率:78.3%)。产率计算公式为
式中:W3为L-SeMC 产率,%;m5、m6分别为产物中L-SeMC、反应物中L-SeC2的质量,g;Mr4为L-SeMC的相对分子质量。
经质谱、核磁共振波谱仪检测MS,m/z[M+H]+计算值为183.08,测定值为184.0;13C-NMR (75 MHz,D2O)δ为173.00,53.58,24.76,4.39,1H-NMR (300 MHz,D2O)δ为3.97(1H),3.95~3.93(2H),3.04~3.01(3H),以上数据与文献基本一致[18],确定产物为L-SeMC。
3 结果与分析
3.1 中间体3-氯-L-丙氨酸盐酸盐的实验室制备与优化
3-氯-L-丙氨酸盐酸盐的合成,文献报道以二氧六环/氯化氢为溶剂,因氯化氢于二氧六环溶液中长时间储存会产生较多副反应且后处理繁琐,一般需要现制现用且反应后需加水淬灭,而后浓缩溶液,又需加丙酮析出产物,操作不便[19]。本研究提出以水为助剂替代文献中的氯化氢,可避免上述复杂操作,直接过滤即可获得产物。
体系中用水量是该法最关键的变量,优先考察水和氯化亚砜物质的量比对反应的影响,评价结果如图3(a)所示,水和氯化亚砜物质的量比为0.50:1.00 时产率最高,之后随着水的用量增加,产率下降。可能因为少量的水可以生成适量的氯化氢以及其他酸性物质,促进原料的溶解,并抑制羧基的氯化;过量则会和L-丝氨酸竞争氯化亚砜,从而导致产率下降[20]。
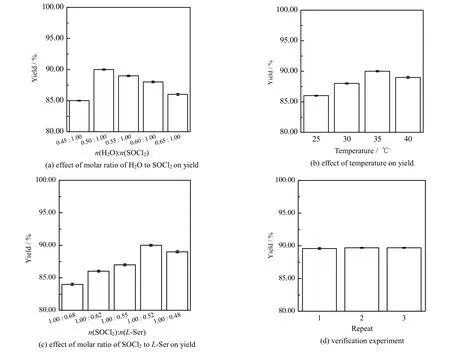
图3 关键因素对3-氯-L-丙氨酸盐酸盐的合成影响Fig.3 Effects of key factors on the yield of 3-chlorine-L-alanine hydrochloride
氯化反应温度是决定反应速度和产物收率的另一关键因素[21],见图3(b)。研究结果表明在25~40 ℃,随着温度的升高产率逐渐上升,在35 ℃达到峰值后,逐渐下降。过高的温度将导致反应体系变黑,产率大幅下降。
氯化亚砜和L-丝氨酸物质的量比对产率影响结果如图3(c)所示,当氯化亚砜用量加大时,与L-丝氨酸的接触增加,产率提升,当氯化亚砜和L-丝氨酸物质的量比达到1.00:0.52,可以获得最高产率,继续增加氯化亚砜的用量,副反应增加,产物收率下降。
综合以上结果,可以获得优化的 3-氯-L-丙氨酸盐酸盐的合成工艺为:制备复配溶剂系统n(H2O):n(SOCl2):n(L-Ser)=0.50:1.00:0.52,反应温度为35 ℃。在该工艺条件下进行了3 批重复实验以验证工艺的稳定性,结果如图3(d)所示,3 批重复实验的产率几乎相同,平均产率为89.7%,说明该工艺稳定可靠。
3.2 中间体L-SeC2 的实验室制备中还原剂评价与工艺优化
对于L-SeC2的合成,目前报道的方法主要是通过硼氢化钠还原硒粉后获得二硒化二钠溶液[22],然后与3-氯-L-丙氨酸盐酸盐反应获得目标产物[23]。但此法制备二硒化二钠溶液时反应剧烈,产生硒化氢气体,存在安全隐患。针对上述问题,本研究开发2 种不同的还原方法,分别为次硫酸氢钠甲醛、三乙酰氧基硼氢化钠还原法,并探索关键制备因素对目标产物L-SeC2产率的影响,结果如表1 所示。
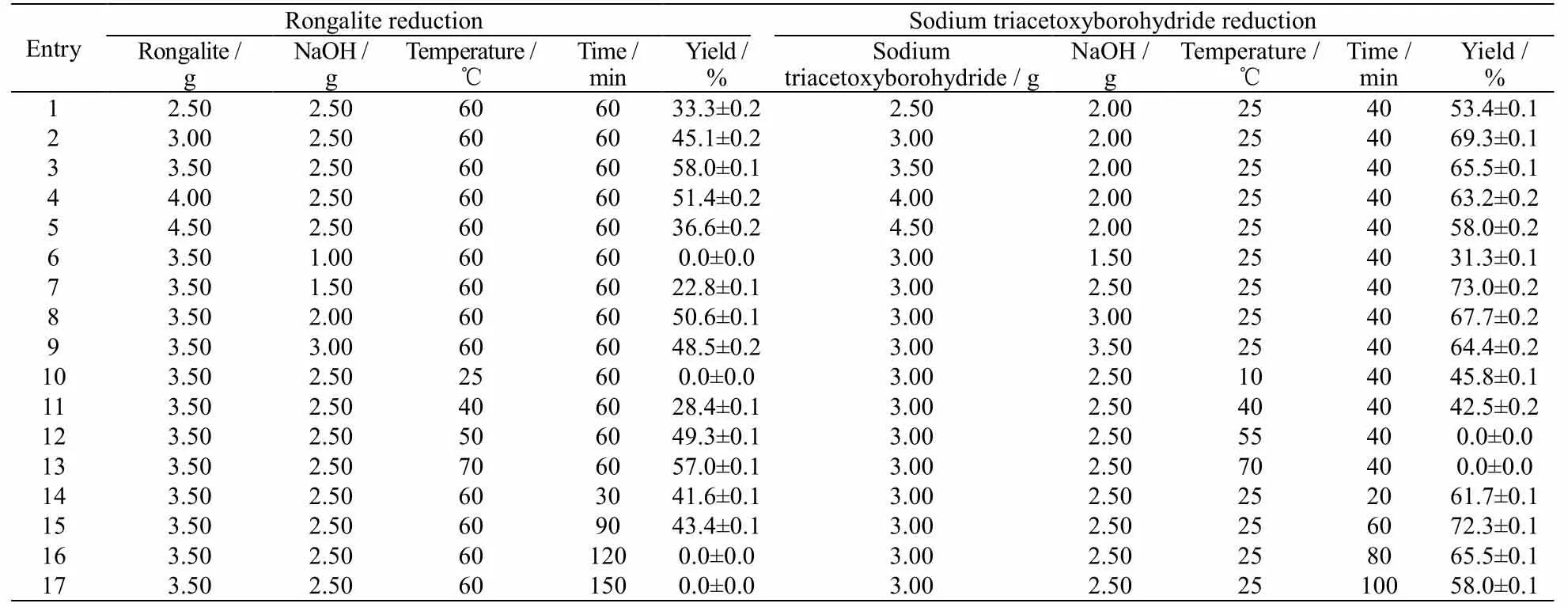
表1 2 种还原方法中关键因素对L-SeC2 产率的影响Table 1 Effects of key factors in the two methods on the yield of L-SeC2
硒粉与还原剂物质的量比对产物产率有关键性影响。当采用次硫酸氢钠甲醛还原法时,反应总体比较温和[24],随着次硫酸氢钠甲醛用量的增加,获得的二硒化二钠溶液更加透亮,加入3-氯-L-丙氨酸盐酸盐反应后,产物L-SeC2收率不断提高。当次硫酸氢钠甲醛用量为3.50 g(0.022 7 mol),即硒与次硫酸氢钠甲醛物质的量比为1.67:1.00 时,L-SeC2产率可以达到峰值(58.0%),然后逐渐下降。而采用三乙酰氧基硼氢化钠还原法,在三乙酰氧基硼氢化钠用量为3.00 g(0.014 2 mol)时,即硒与三乙酰氧基硼氢化钠物质的量比为2.68:1.00,获得最高产率69.3%。2 种方法的还原剂使用均不能过量,否则容易导致硒粉被过度还原,形成硒化钠等副产物。
另外,2 种还原方法均需要在碱性环境进行。充分的碱性环境可以中和反应生成的硒化氢气体。采用次硫酸氢钠甲醛还原法,氢氧化钠用量在1.00~2.50 g(0.025 0~0.062 5 mol)时L-SeC2产率随氢氧化钠用量的增加而提高,当次硫酸氢钠甲醛用量为3.50 g(0.022 7 mol),氢氧化钠用量为2.50 g(0.062 5 mol),即次硫酸氢钠甲醛与氢氧化钠物质的量比约为1.00:2.75 时,L-SeC2产率达到峰值(58.0%),随后逐渐下降。采用三乙酰氧基硼氢化钠还原法时,三乙酰氧基硼氢化钠与氢氧化钠物质的量比为1.00:4.41,L-SeC2产率达到峰值73.0%。适量的碱可以促进二硒化二钠的生成,但过量的碱将导致3-氯-L-丙氨酸盐酸盐中的氯原子被氢氧根进攻,生成副产物如丝氨酸等。
还原反应的温度同样非常关键。采用次硫酸氢钠甲醛还原法,基于其还原能力相对较弱的特性,适当提高反应温度有利于提高其反应速度。温度升高后,反应得到二硒化二钠溶液颜色更深,但透亮,悬浮颗粒少,加入3-氯-L-丙氨酸盐酸盐反应得到的L-SeC2产率更高,在60 ℃制备的二硒化二钠溶液可获得最高的L-SeC2产率58.0%。进一步提高温度会使次硫酸氢钠甲醛剧烈降解,释放出刺鼻气体,还原能力大幅下降,产率随之降低。而三乙酰氧基硼氢化钠则不同,因为还原性较强,对环境温度的依赖度不高,产率在25 ℃即可达到峰值73.0%。
另外,二硒化二钠不稳定,需要现制现用[25]。还原反应时间显得尤为重要。反应时间太短,硒不易充分还原,反应时间太长,还原剂完全消耗后,生成的二硒化二钠会在空气中再度被氧化生成单质硒。研究表明:次硫酸氢钠甲醛条件下制备二硒化二钠,控制还原时间为60 min 时,L-SeC2产率为58.0%;在三乙酰氧基硼氢化钠条件下,在20~40 min 时间段,产率逐渐升高;反应时间为 40 min 时,产率高达73.0%。
综上,最终确定L-SeC2的最佳合成条件为:(1) 次硫酸氢钠甲醛法:硒、次硫酸氢钠甲醛、氢氧化钠物质的量比为1.67:1.00:2.75,以水溶液为溶剂,制备二硒化二钠时反应温度为60 ℃、还原硒粉的时间为60 min,经3 批重复实验,平均产率为58.0 %。(2) 三乙酰氧基硼氢化钠法:硒、三乙酰氧基硼氢化钠、氢氧化钠物质的最比为2.68:1.00:4.41,以水溶液为溶剂,制备二硒化二钠时反应温度为25 ℃、还原硒粉的时间为40 min,3 批重复实验平均产率为73.0%。相同条件下,以硼氢化钠制备的L-SeC2最高产率仅为13.1%,原因在于碱性条件下硼氢化钠的水解受到了严重抑制,更换为中性条件后平均产率为69.4%。2 种不同的还原剂,试剂成本、反应产率和反应条件不完全一致,使用的场合自然也存在区别:次硫酸氢钠甲醛价格低,但产率偏低,综合而言,可能更适合比较大规模的生产;三乙酰氧基硼氢化钠价格高,产率也较高,可能更适合中等规模的生产。
3.3 目标产物L-SeMC 的实验室制备及其工艺优化
以L-SeC2为原料合成L-SeMC,必须先在还原剂的作用下使L-SeC2转化成L-硒代半胱氨酸(L-SeC)后再甲基化。但L-SeC 不稳定,极易被氧化重新生成L-SeC2。还原剂还原能力弱或者用量过少,则L-SeC2不能完全还原,另外,还原后不及时甲基化,L-SeC 则会被氧化生成L-SeC2,转化过程如图4 所示,所以,整个过程中还原剂的种类、用量和还原时间对目标产物的生成具有至关重要的影响。
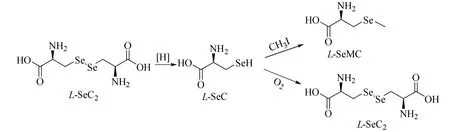
图4 L-SeC2 的转化Fig.4 Transformation of L-SeC2
3.3.1 还原剂种类对还原L-SeC2的影响
还原反应在该合成工艺中具有关键性作用。在有机化学合成中,常用的硼氢化钠是一种廉价且具备强还原能力的还原剂[26],此外,本研究首次引入锌粉以及三乙酰氧基硼氢化钠作为L-SeC2还原剂,其中锌粉还原操作简单,条件温和[27],三乙酰氧基硼氢化钠绿色无毒,反应可控[28]。
通过紫外分光光度法的检测,还原剂种类对还原L-SeC2的影响如图5 所示。在相同条件下,3 种还原剂作用下的L-SeC2质量浓度均有下降趋势,硼氢化钠作为还原剂时质量浓度下降最缓慢,测得其在30 min 时L-SeC2仅消耗了9.05%;锌粉在该合成条件下还原能力较好,在20 min 时质量浓度达到最低值,此时消耗了37.86% 的L-SeC2;而三乙酰氧基硼氢化钠在该合成条件下还原能力最好,在10 min 就已反应了45.80% 的L-SeC2。硼氢化钠强烈的还原能力没有在该反应条件下充分体现,这是因为在室温条件下5 %以上的NaOH 会抑制其水解,从而降低还原速度[29-30];而锌粉作为还原剂价格低廉,副产物少,相对安全,但作为固体与反应物接触不良,难以充分发挥其还原能力;所以本实验选择综合性能更优的三乙酰氧基硼氢化钠作为后续研究的还原剂。
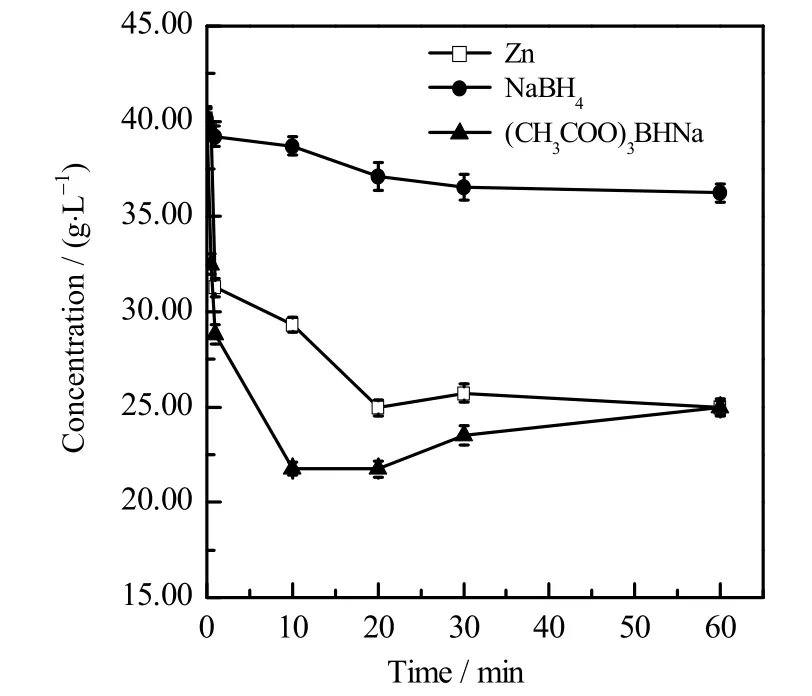
图5 还原剂种类对还原L-SeC2的影响Fig.5 Effects of reductant types on L-SeC2 reduction
3.3.2L-SeC2与还原剂物质的量比对还原L-SeC2的影响
L-SeC2与还原剂物质的量比对还原L-SeC2的影响如图6 所示。物质的量比为1.00:0.80 时,当反应进行到10 min 后,达到较低质量浓度((25.18±0.40) g·L-1),随后缓慢上升;当物质的量比为1.00:1.50 时,体系反应至5 min 时,L-SeC2达到较低质量浓度((17.69±0.36) g·L-1),并能维持一段时间;当物质的量比为1.00:3.00 时,仅需0.5 min 到达较低质量浓度((17.27±0.35) g·L-1)。如果在物质的量比为1.00:1.50 的体系中充分供氧,泵入空气5 min 后达到较低质量浓度((22.36±0.34) g·L-1),此时可观察到体系中开始析出黄色固体,随后L-SeC2的质量浓度开始回升。

图6 L-SeC2 与(CH₃COO)₃BHNa 物质的量比对还原L-SeC2 的影响Fig.6 Effects of L-SeC2 to (CH₃COO)₃BHNa molar ratio on L-SeC2 reduction
结果表明,L-SeC2与还原剂的不同物质的量比下反应,L-SeC2的质量浓度呈先下降后上升的趋势,还原剂不足或者过量都无法得到理想的还原效果,在1.00:(0.80~1.50)量比范围内,还原效果和用量呈正相关,而物质的量比为1.00:3.00 时,并未因还原剂的加量而强化还原效果,原因可能在于过量的三乙酰氧基硼氢化钠使体系的pH 值下降至中性,原料L-SeC2在中性条件不溶而析出,而推动L-SeC 向L-SeC2转化的化学平衡移动。所以,选择使用物质的量比约为1.00:1.50 的还原剂进行工艺合成。此外,体系大量接触空气也会导致还原效果不佳,进一步证实L-SeC2的还原时间不宜过长或大量接触空气。
3.3.3L-SeC2转化反应动力学过程
为探索反应时间对反应过程的影响,本研究探讨了该反应的动力学过程。其动力学方程如下:
式中:v为反应速度(g·L-1·s-1);K为反应速度常数;ρ为反应物质量浓度(g·L-1),r为反应级数,t为还原时间(s)。
若反应为一级反应,则根据式(4),有
先将式(5)积分,再改写成
式中:ρ1为L-SeC2质量浓度(g·L-1),ρ0为初始L-SeC2质量浓度(g·L-1)。称取2.00 g(0.006 0 mol)L-SeC2溶于50 mL 0.50 mol·L-1NaOH 溶液中,加入0.40 g(0.001 9 mol)三乙酰氧基硼氢化钠充分搅拌,并通过紫外分光光度法实时检测质量浓度,计算lgρ1。lgρ1和t的关系图如图7 所示。由图可得到lgρ1和t呈线性关系,符合一级反应动力学特征,其中,即K=0.001 6。所以该条件下还原反应动力学方程为
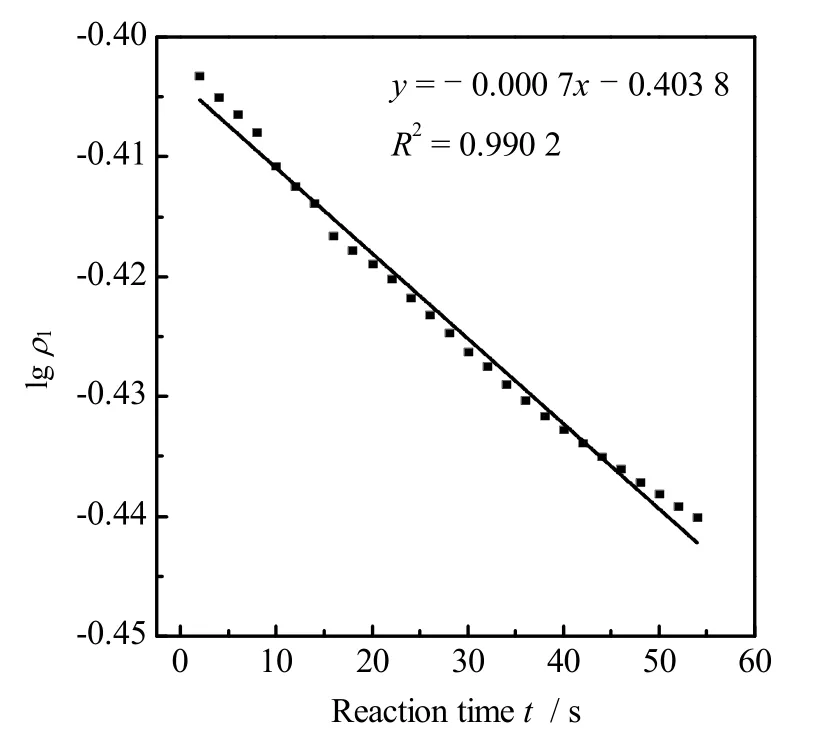
图7 lg ρ1 与t 的关系图Fig.7 Relationship between lg ρ1 and t
3.3.4 目标产物L-SeMC 的工艺条件优化
还原时间过短会导致L-SeC2还原不充分,时间过长则会使L-SeC 氧化回到L-SeC2。故考察还原时间为3~20 min对L-SeMC 产率的影响,还原用时5 min 时L-SeMC 产率达到峰值75.2%。随后选用常用的碘甲烷作为甲基化试剂[31],其用量和反应时间决定产物产率。当用量为0.75~1.50 mL时,L-SeMC 产率随着碘甲烷用量的增加而增加,而当L-SeC2与碘甲烷物质的量比为1.00:4.02 时达到峰值,继续增加碘甲烷的用量会导致副产物硒鎓盐的生成[28,32],大大降低产率;甲基化时间为30 min 时产率达到峰值(78.3%)。同样的,三乙酰氧基硼氢化钠物质的用量过少反应不充分,过多则会影响反应体系pH 值,带来负面影响,研究表明,当L-SeC2与三乙酰氧基硼氢化钠物质的量比为1.00:1.58 时,产率达到峰值(78.3%)。
合成L-SeMC 的工艺条件优化结果如表 2 所示。当制备L-SeMC 的还原时间为 5 min、n(L-SeC2):n(CH3I):n((CH3COO)3BHNa)=1.00:4.02:1.58、甲基化时间为30 min 时,产率达到峰值(78.3%) (碘甲烷需要在L-SeC2还原成无色透明溶液时及时添加,否则需要采用无氧操作)。对比其他还原剂最佳工艺的产率[33-34],使用三乙酰氧基硼氢化钠作为还原剂时,其产率占优势的同时还能够提供更可控、更温和、污染更小的还原环境。
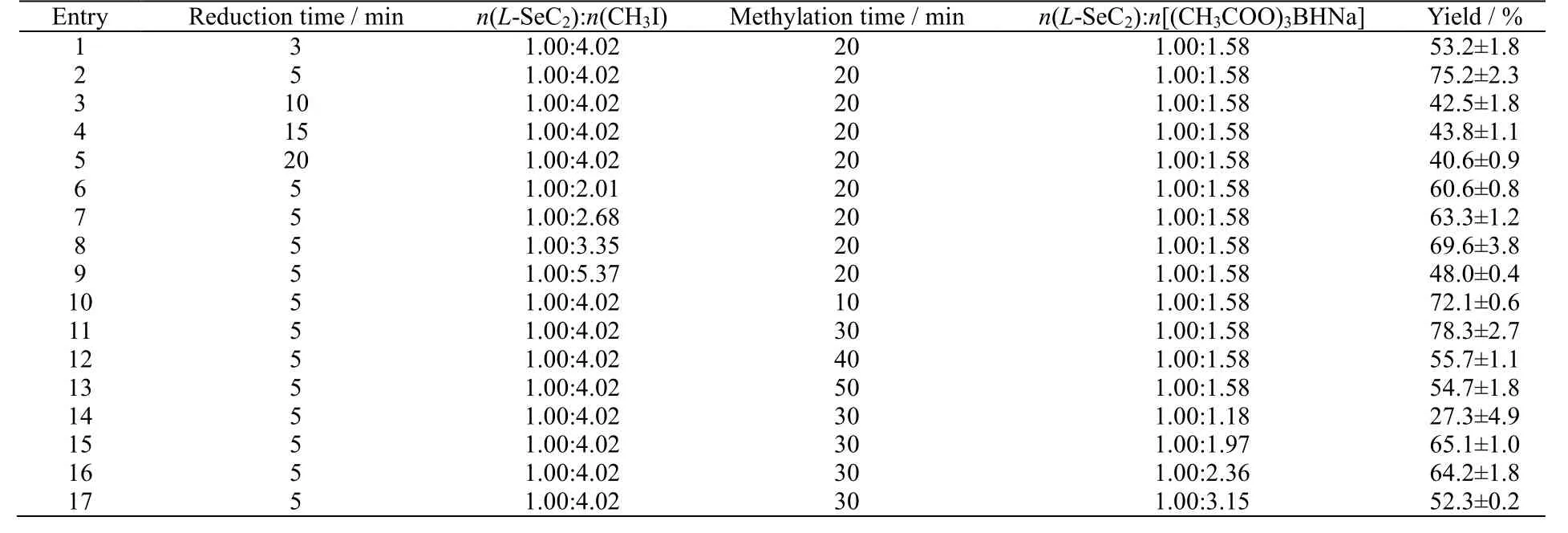
表2 工艺条件对L-SeMC 制备的影响Table 2 Effects of processing conditions on the yield of L-SeMC
3.4 中试实验
为验证合成工艺的合理性,根据最佳合成条件进行3 次平行实验,并于合成设备中放大100 倍物料用量进行中试实验验证。验证实验和中试实验L-SeC2产率如表3 所示。验证实验和中试实验中各产物产率与优化结果几乎一致。
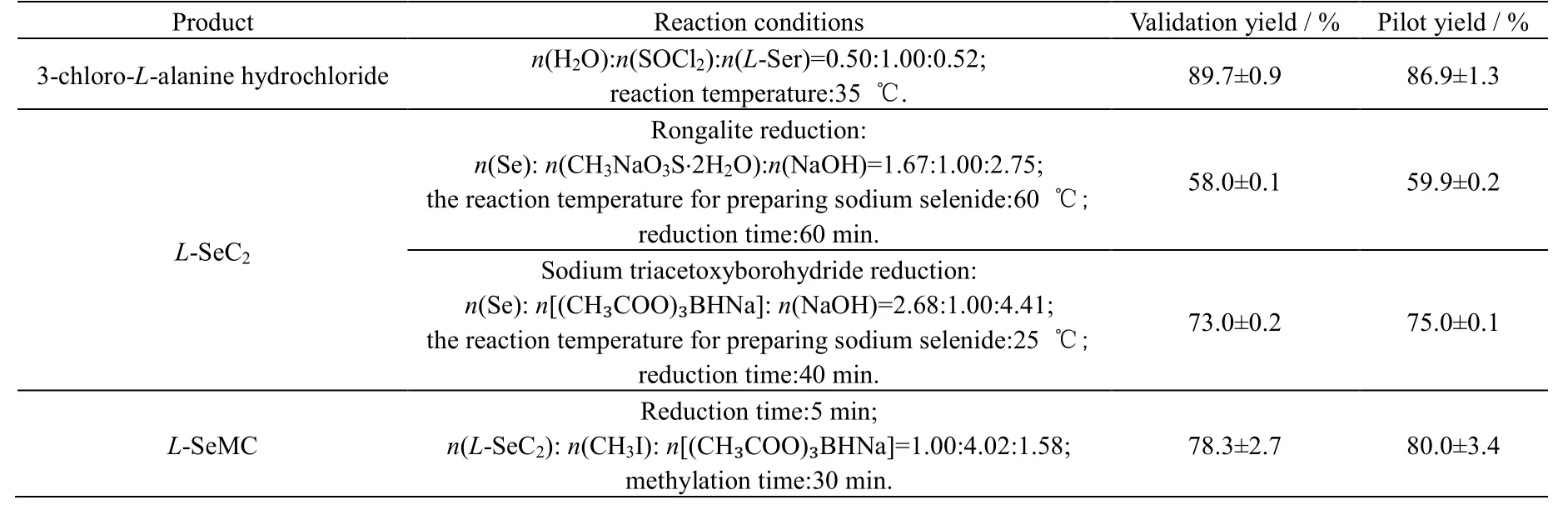
表3 验证实验和中试实验Table 3 Yield results of validation and pilot tests
4 结 论
(1) 通过向氯化亚砜/二氧六环反应体系中添加微量的水,选择性氯化原料L-丝氨酸分子中的羟基,获得产物3-氯-L-丙氨酸盐酸盐。经过优化,小试条件下可以达到89.7% 的产率,中试条件下则为86.9%。该过程一步合成,操作方便,产物收率高。
(2) 采用次硫酸氢钠甲醛/三乙酰氧基硼氢化钠2 种还原方法制取二硒化二钠溶液,与3-L-氯-丙氨酸盐酸盐反应获得到L-SeC2,经优化后,小试条件下可以获得最高产率分别为58.0%和73.0%,中试条件下则分别上升至59.9%、75.0%。2 种方法反应过程均比较温和,后处理简便。
(3) 筛选出L-SeC2还原制备L-SeMC 的最佳还原剂为三乙酰氧基硼氢化钠,取代文献所用易燃易爆试剂,使反应条件更加温和,小试条件下可以获得最高产率78.3%,中试条件下上升至80.0%。建立lgρ和t之间的关系,L-SeC2与三乙酰氧基硼氢化钠的反应为动力学一级反应。
总之,该文开发的L-SeMC 合成工艺稳定安全、产率高、步骤少。经过中试初步评估,该工艺适合L-SeMC 的工业化生产。

