基于CRISPR/Cas9的PALM基因敲除约氏疟原单克隆虫株的构建
曹玉洁,张玲红,苗昱辰,卢 里,李春草,张 璐,胡 瑞,李江艳,夏 惠,陶志勇,方 强,
疟疾是危害严重的寄生虫病。据2021年世界卫生组织数据[1]显示,2020年全球疟疾病例2.41亿,较2019年增加1 400万。尽管我国自2017年起已无本土疟疾病例报告,且WHO于2021年6月正式宣布中国消除疟疾[2],但输入性疟疾及疟疾再传播形势依然严峻[3]。传染病最理想的控制手段是有效的疫苗。尽管疟疾疫苗近年来已取得重大进展,首个疟疾疫苗获批上市,在撒哈拉以南非洲地区和中度至高度恶性疟原虫传播风险地区的儿童中使用[4],但其保护率仍不理想,约30%[5]。疟疾疫苗研发仍亟需加强。疟原虫的致病仅由红内期疟原虫引起,红外期疟原虫并不致病,因而红外期是预防性疫苗研制的理想阶段。疟原虫减毒子孢子可诱发高效的保护性免疫[6],但通过物理化学方法制备减毒子孢子不易进行质量控制。因此,遗传减毒子孢子疫苗是较为理想的疟疾预防性疫苗策略[7-8],即针对疟原虫红外期特异性关键发育基因进行敲除,制备遗传性状稳定的减毒子孢子,子孢子感染宿主后,疟原虫发育停滞于红外期,可诱发机体保护性免疫。疟原虫红外期特异性关键发育基因敲除是制备遗传减毒子孢子疫苗的关键。由于疟原虫基因敲除较困难,故遗传减毒子孢子疫苗发展较为缓慢。随着CRISPR/Cas9技术在疟原虫领域的应用[9-10],遗传减毒子孢子疫苗迎来新的发展机遇。近年来,部分仅在红外期疟原虫表达的发育关键基因如UIS[11-13]、P36[14]、P52[15]、SAP1[16-17]、Plasmei2[18]、Lisp2[19]等陆续被鉴定,并被应用于疟疾减毒子孢子疫苗研究。
有研究[20]发现疟原虫特异的顶质体蛋白(plasmodium-specific apicoplast protein plays an important role for liver merozoite formation,PALM)在伯氏疟原虫红外期裂殖子形成中起重要作用,其他疟原虫是否具备此特征,尚不清楚。约氏疟原虫是一种疟疾研究中常用鼠疟原虫,目前认为利用其建立的鼠疟模型的免疫特征与人类更加接近,是研究疟疾疫苗的更加理想的实验动物模型。构建PALM基因敲除约氏疟原虫虫株是了解PALM在约氏疟原虫红外期裂殖子形成中是否也具有重要作用,进而利用约氏疟原虫小鼠模型深入研究疟原虫减毒子孢子疫苗的必要前提。因此,本研究拟采用CRISPR/Cas9技术,构建PALM基因敲除的约氏疟原虫株,以期为进一步研究PALM基因功能及基于PALM的遗传减毒子孢子疫苗提供基础。
1 材料与方法
1.1 实验材料
1.1.1 疟原虫株、实验动物 非致死型约氏疟原虫(Plasmodiumyoelii17XNL)虫株由中国医科大学曹雅明教授馈赠,经本实验室小鼠传代保种。雌性昆明小鼠(5~6周龄),SPF级,购自湖南斯莱克景达实验动物有限公司[许可证编号:SCXK(湘)2019-0004]。
1.1.2 主要试剂 T4连接酶,Golden Gate Enzyme Mix,限制性内切酶BsaI、BsmBI购自NEB公司,高保真PCR酶Gflex购自日本Takara公司;电转试剂盒P3购自瑞士Lonza公司,无内毒素质粒大提试剂盒、琼脂糖凝胶DNA回收试剂盒及血液基因组DNA提取试剂盒均购自天根生化科技有限公司;乙胺嘧啶购自上海阿拉丁生化科技股份有限公司。
1.1.3 质粒和感受态细胞 DH5a感受态细胞购自天根生化科技有限公司,质粒 pYCm 为厦门大学袁晶教授惠赠,质粒上含乙胺嘧啶和5-氟胞嘧啶抗性基因。本实验室在此基础上进行改造,改建为带有Golden Gate克隆功能和蓝白斑筛选功能的pYCm-golden-blue质粒。
1.2 实验方法
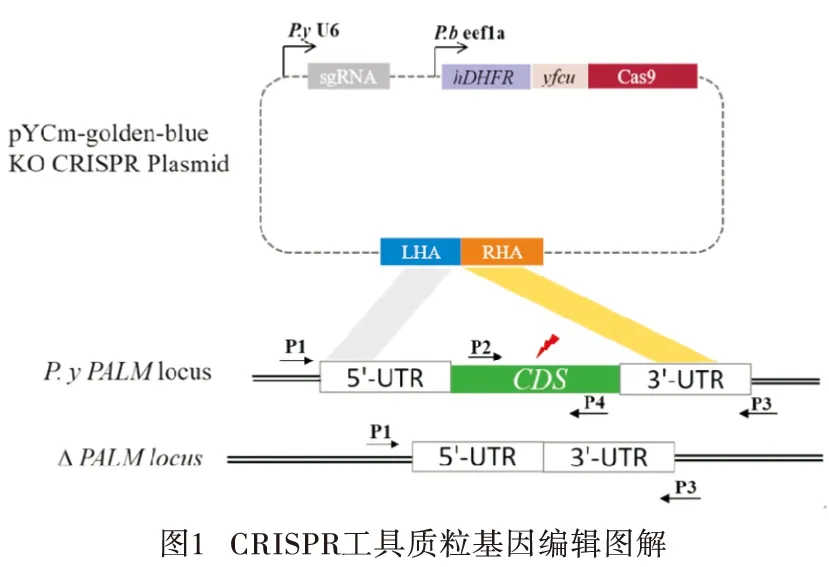
1.2.1 sgRNA与引物设计 从疟原虫Plasmo DB数据库中下载P.yoelii17XNL PALM基因序列,确定敲除区域以及进行同源重组修复的左、右同源臂长度。应用专用网站(http://crispr.tefor.net/)设计sgRNA, 用NEB Golden Gate 组装设计软件(https://goldengate.neb.com/)设计用于扩增左、右同源臂的上下游引物。
1.2.2 PALM 敲除CRISPR工具质粒的构建 从P.yoelii17XNL野生型(wild type,WT)基因组中扩增PALM左、右同源臂,PCR反应条件:94 ℃ 1 min;98 ℃ 10 s;55 ℃ 15 s;68 ℃ 20 s;共30个循环;68 ℃ 10 min。BsaI酶切pYCm-golden-blue质粒,切胶纯化PCR产物和载体酶切产物;根据NEB Golden Gate Assembly Kit (BsaI-HFv2)说明书,用推荐的摩尔比来计算连接反应所需要的DNA量,配置连接反应体系。接下来将连接后产物转化DH5a感受态细胞,筛选阳性重组质粒。将根据P.yoeliiPALM基因区域设计的sgRNA 退火形成双链。BsmBI酶切pYCm-golden-blue-PALM-LHA-RHA质粒,切胶纯化载体酶切产物,T4连接酶将退火成双链后的sgRNA与切胶纯化产物连接,转化DH5a感受态细胞,蓝白斑筛选阳性菌落,菌液PCR初步验证,测序确定,最终确保CRISPR工具质粒构建完成。CRISPR 工具质粒基因编辑图解及引物设计见图1。所需PCR引物见表1(下划线部分为BsaI酶识别点),以上引物均由上海生工生物公司合成。
1.2.3 浓集疟原虫和电击转染 注射1×107个感染P.yoelii17XNL的红细胞至昆明小鼠体内,裂殖体密度达50%时将小鼠取血到肝素抗凝管中,加入3 mL RPMI1640培养基(HyClone公司),混匀,室温2 500 r/min离心5 min,弃上清,用1640重悬沉淀;室温3 100 r/min离心20 min,小心吸取中间层(为浓集后含裂殖子的红细胞)加到提前备好的3 mL 50%percoll上;弃上清,沉淀同样用1640培养基混匀;室温2 500 r/min离心5 min,弃除上清,沉淀即为浓集后的疟原虫所得。将工具质粒、裂殖体与电转液混合加入电转杯,使用Lonza Nucleofector电转仪进行电击转染,电转后尾静脉注射昆明小鼠体内。次日查血,待镜检出现有疟原虫出现后每天给予小鼠6 mg/mL乙胺嘧啶喂水,隔天鼠尾采血镜检查疟原虫,至给药后第8天取鼠血进行PCR及测序鉴定。
1.2.4 有限稀释法获得单克隆虫株 取PCR鉴定基因敲除成功的含虫鼠血接种至新一只昆明小鼠,待原虫血症达0.2%~1.0%,用0.9%氯化钠溶液稀释感染疟原虫的红细胞至0.7个 iRBC/200 μL,然后尾静脉注射至12只小鼠体内,每只200 μL,进行克隆化。鼠尾静脉注射后第8天,血涂片镜检小鼠感染情况,待原虫生长至0.2%~1.0%可提基因组DNA采用PALM基因外侧基因组特异性引物P1/P3进行PCR鉴定是否获得阳性克隆虫株。
1.2.5 PALM基因敲除单克隆株生长分析 将PALM基因敲除的疟原单克隆株和P.yoelii17XNL,按1×105个iRBC/200 μL 0.9%氯化钠溶液的接种量,分别尾静脉注射小鼠各6只。每2天鼠尾采血,记录并统计原虫血症。
1.3 伦理学声明 本研究经蚌埠医学院伦理委员会审查批准通过(批准号:伦动科批字[2022]第196号)。
1.4 统计学方法 采用t检验。
2 结果
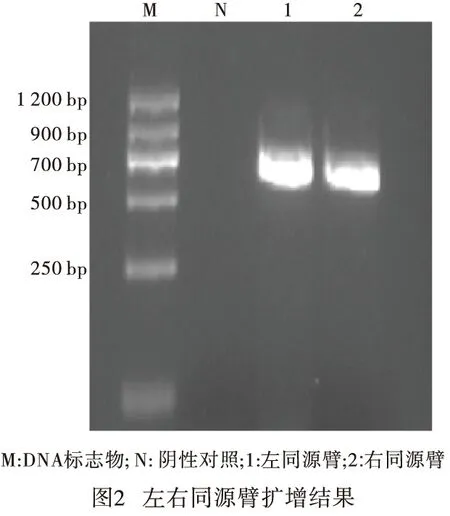
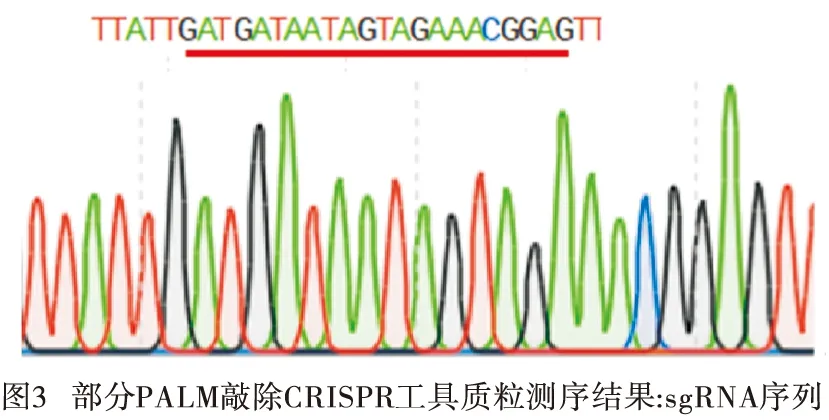
2.1 PALM敲除CRISPR工具质粒的构建 PCR扩增PALM 左、右游同源臂各约600 bp,片段长度均符合预期(见图2),将左右游同源臂、sgRNA分步与pYCm-golden-blue质粒连接构建PALM 敲除CRISPR工具质粒。对PALM 敲除CRISPR工具质粒的sgRNA部分测序(见图3),其序列与设计序列一致,PALM敲除CRISPR工具质粒构建成功。
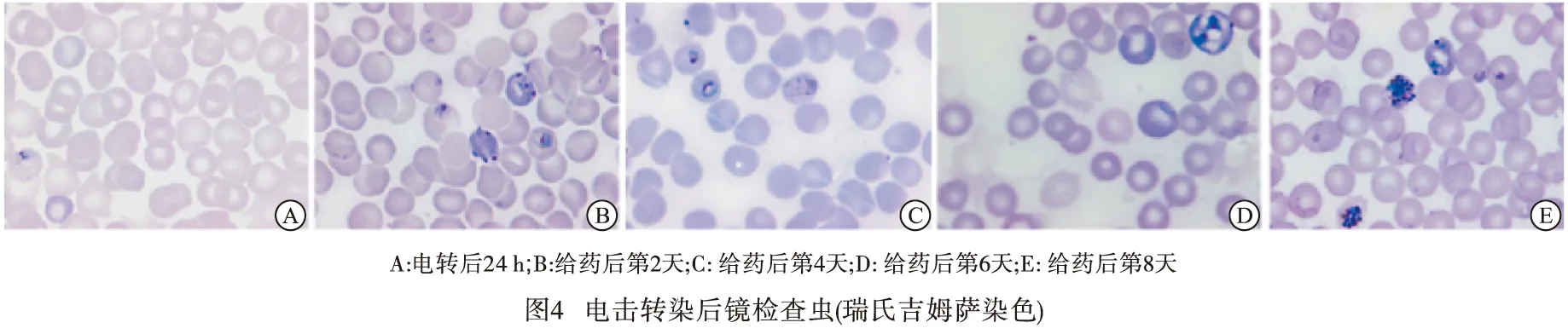
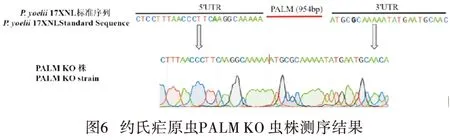
2.2 电击转染结果与基因敲除疟原虫的鉴定 PALM敲除CRISPR工具质粒电击转染后感染疟原虫的红细胞接种7只小鼠,24 h后镜检均见疟原虫。喂药筛选后,镜检见给药后2 d原虫密度最高,后逐渐降低,至6 d降至最低,且仅5只小鼠镜检疟原虫阳性。给药后第8天,仅2只小鼠镜检见疟原虫,但原虫密度显著回升,7.5%~9.0%(见图4);取镜检疟原虫阳性小鼠血,以PALM基因外侧基因组特异性引物P1/P3进行 PCR扩增后,在1 246 bp处可见条带(见图5A),用PALM基因内部引物P2/P4 PCR扩增未见条带(见图5B),而野生株则分别扩增出于预期相符的约2 200 bp和720 bp条带,提示成功获得P.yoelii17XNL PALM 敲除疟原虫。经测序发现,相较于P.yoelii17XNL 标准序列(PY17X_0102700)送测序列的PALM(954 bp) 完全缺失,进一步证实P.yoelii17XNL PALM基因成功敲除(见图6)。
2.3 PALM基因敲除疟原虫的单克隆鉴定 将含有PALM基因成功敲除疟原虫的鼠血采用有限稀释法接种小鼠进行单克隆筛选后第8天,采血镜检见12只小鼠中7只疟原虫阳性。用P1/P3引物对全部12只小鼠进行PCR鉴定,自7只小鼠血液中扩增出疟原虫阳性条带, 其中2只扩增出单一的大小为1 246 bp的PALM基因缺失条带(见图7), PALM基因敲除单克隆约氏疟原虫筛选成功。
2.4 PALM基因敲除单克隆株的生长分析P.yoelii17XNL PALM基因敲除单克隆株和P.yoelii17XNL野生株分别经尾静脉注射感染小鼠后,每2天鼠尾取血染色镜检,结果发现2组小鼠原虫率均随时间延长而增长,至观察终点(感染后第10天),P.yoelii17XNL野生株组的疟原虫血症为(17.00±1.08)%;P.yoelii17XNL PALM基因敲除单克隆株组的疟原虫血症为(17.42±1.39)%,2组小鼠疟原虫血症差异无统计学意义(P>0.05)。
3 讨论
遗传减毒子孢子疫苗由于其遗传性状的稳定性,在制备过程中无毒力回复的风险,是较为理想的减毒子孢子疟疾疫苗策略。而红外期特异性表达的发育关键基因的鉴定与敲除是研发遗传减毒子孢子疫苗关键。PALM是近年来在伯氏疟原虫中鉴定出的一种定位于疟原虫顶生质体,于疟原虫红外期特异性表达的发育关键基因。尽管理论上其他疟原虫中PALM基因也具备此特征,但尚未有研究证实。鉴于不同疟原虫之间基因表达调控尽管大部分类似,但也存在着一些差异,故明晰PALM基因在其他疟原虫中的表达特征与功能是必要的。约氏疟原虫是一种实验室常用的鼠疟原虫。约氏疟原虫建立小鼠模型仅需10个甚至更少的子孢子,远低于伯氏疟原虫,这在生物学上更接近于恶性疟原虫的特点[21];而且,约氏疟原虫的红外期免疫的建立的特点也更接近于人类疟原虫的特征[18]。因而,相对于伯氏疟原虫鼠疟模型,约氏疟原虫鼠疟模型被认为是研究红外期疟疾免疫及减毒子孢子疟疾疫苗更加理想的模型[22-23]。因此,为了利用约氏疟原虫鼠疟模型探讨基于PALM基因构建遗传减毒子孢子疫苗的可能性,有必要构建约氏疟原虫PALM基因敲除株,以进一步探讨在约氏疟原虫红外期裂殖子发育中PALM的功能,基因敲除技术近年来发展迅速,特别是CRISPR/Cas9技术的出现,将包括基因敲除在内的基因编辑技术提升至一个新的高度。与传统的基因编辑方式相比,CRISPR/Cas9技术具有更高的遗传操作效率和可靠性[9]。2014年,CRISPR/Cas9技术被成功用于疟原虫编辑,包括本团队在内的国内外研究者也已经利用CRISPR/Cas9技术开展了部分工作[24-26]。由于鼠疟原虫尚无法体外培养,利用CRISPR/Cas9技术进行鼠疟原虫基因编辑必须在小鼠模型体内进行筛选,难度远高于可体外连续培养的恶性疟原虫基因编辑,故采用CRISPR/Cas9技术对鼠疟原虫进行基因编辑的研究尚不多见。国内袁晶教授团队构建了含乙胺嘧啶和5-氟胞嘧啶抗性基因的单质粒系统质粒 pYCm,使利用CRISPR/Cas9技术对鼠疟原虫进行基因编辑和筛选更加可行。我们团队在袁晶教授馈赠的质粒 pYCm基础上改建获得了pYCm-golden-blue质粒[27],增添了重组阳性克隆的蓝白斑筛选功能,提高了阳性克隆的筛选效率。


本研究中,我们利用改造的 pYCm-golden-blue 质粒基于CRISPR/Cas9技术进行了约氏疟原虫P.yoelii17XNL PALM基因敲除,经乙胺嘧啶小鼠体内筛选后获得了阳性疟原虫,经PCR和测序验证表明PALM基因被成功敲除;而且,通过有限稀释法我们获得了单克隆化的P.yoelii17XNL PALM基因敲除虫株。我们比较了PALM基因敲除虫株和野生株约氏疟原虫感染后的小鼠疟原虫血症水平,发现二者无显著差异,表明PALM基因敲除对约氏疟原虫红内期生长发育无重要影响,是红内期发育的非必须基因,这与PALM在伯氏疟原虫红内期发育中作用一致,也进一步提示PALM基因在约氏疟原虫红外期发育的作用非常可能也与其在伯氏疟原虫红外期的作用一致,是红外期发育的关键基因。这些为后续深入研究基于PALM基因的遗传减毒子孢子疫苗提供了基础。

