不同来源葡萄种质资源果实叶酸含量及ISSR比较分析
梁 雎,刘国宏,王保民,何 桥,阿布来克·尼亚孜,郭红梅,李兴婷,,任红松
(1.新疆农业科学院吐鲁番农业科学研究所,新疆吐鲁番 838000;2.中国农业大学,北京 100083;3.西南大学,重庆 400700)
0 引 言
【研究意义】叶酸是人体生命活动必需的水溶性B族维生素,其分子由蝶啶、对氨基苯甲酸和谷氨酸残基三部分组成[1-2]。根据取代基的不同,叶酸分为不同的种类,目前在动植物中已发现的叶酸种类有50多种[3-4]。叶酸缺乏会引发巨幼红细胞贫血等疾病[5-7]。与水稻、谷子等作物相比,蔬菜、水果中叶酸含量较高[8-14]。由于蔬菜等在烹饪加热过程会导致叶酸降解[15-17],而葡萄以鲜食为主,能使其含有的叶酸最大限度地保留,且与其他水果比较葡萄还含有天然葡萄糖,可促进叶酸在人体的吸收[18]。葡萄是我国重要的大宗水果,面积约为72.51×104hm2,产量达到1 419.54×104t,其中新疆葡萄面积约为14.393×104hm2,产量达到270.57×104t[19-20]。利用ELISA检测和ISSR分子标记技术,研究并提出一种从分子水平评价和筛选高叶酸葡萄种质资源的方法,对高叶酸葡萄种质资源的充分利用有实际意义。【前人研究进展】较早的叶酸检测方法为比色法,该方法灵敏度高,但实验周期长,批次间检测结果重复性差,检测结果受样品中所含抗叶酸药物或抗生素成分的影响较大。随后采用高效液相色谱检测成为叶酸检测的主流技术,仪器分析方法重复性好,检测限低,可进行多种物质的同时检测,但是仪器检测对样品前处理要求严格,仪器昂贵,需要专业的操作分析人员。不论是比色法、微生物分析或是仪器分析,都难以进行大量样品的高通量检测。而对于葡萄种质资源筛选,大量材料的选择是关键步骤,实现大量材料的快速筛选,有利于品种筛选的推进,否则,将会影响品种筛选的效率[21-28]。目前,免疫检测(酶联免疫吸附检测ELISA)是特异、快速、高通量检测植物活性物质的常用方法之一。该方法已经应用于植物激素、营养物质、生长因子等的检测。Yue等制备单克隆抗体,建立ELISA方法进行玉米中5-甲酰四氢叶酸含量的检测。对不同玉米品种中的叶酸含量进行检测,可以对大批量品种进行有效的叶酸含量初筛[29];对山西谷子资源叶酸含量分析与评价的研究结果,解释了叶酸含量的变异与地理分布的关系,通过检查分析筛选出24份高含量叶酸谷子品种[28]。韩娟英等[10]报道了富含叶酸水稻研究进展,收集了塞拉利昂、圭亚那等的水稻种质资源。通过转基因技术培育出高叶酸含量的番茄,对蔬菜中番茄资源叶酸含量进行了检测和评价,对高含量番茄品种已经进入了实际利用阶段[30];绿叶蔬菜等天然叶酸在人的肠道中被吸收,而合成叶酸是在肝脏内被吸收的。肝脏吸收合成叶酸的量有限,未被吸收的过量合成叶酸会进入血液[31],葡萄本身就含有一定含量叶酸,且葡萄还含有大量天然葡萄糖[8-24],葡萄是天然叶酸筛选的优势果树。利用现代先进的酶联免疫检测技术检测、评价和筛选出高含量天然叶酸葡萄种质资源加以开发利用;目前用于葡萄种质资源鉴定的分子标记主要有:RFLP、RAPD、AFLP、SSR等,ISSR(Inter-simple sequence repeat polymor-phic DNA) 分子标记是一种基于微卫星序列发展起来的新的分子标记[31], 来源于植物基因组中丰富的简单序列重复 (SSRs),基本原理是用锚定的微卫星 DNA 为引物,即在 SSR 序列的 3′端或57′端加上2~4个随机核苷酸,由此组成的单引物进行重复序列间DNA的PCR 扩增 。ISSR分子标记具有简单迅速、稳定高效、DNA 多态性高的特点,克服了SSR的强特异性,可以在不同物种间通用,同时又克服了RFLP 技术的局限性和RAPD的假阳性等优点。 【本研究切入点】高含量天然叶酸葡萄种质资源评价、筛选和利用基础研究尚未见报道,需应用ELISA和ISSR标记技术,比较分析22份葡萄种质资源果实进行大通量叶酸检测、遗传多样性与亲缘关系。【拟解决的关键问题】建立检测葡萄种质资源果实的ELISA技术体系,建立葡萄种质资源ISSR 分子标记技术体系,在大量葡萄种质资源中评价和筛选出高含量叶酸葡萄材料。
1 材料与方法
1.1 材 料
1.1.1 ELISA材料
1.1.1.1 葡萄果实
材料来源于新疆农业科学院吐鲁番农业科学研究所葡萄种质资源圃(新疆吐鲁番市高昌区原种场内,N 42° 53′24.007 2″,E 89°18′29.084 4″),于2018年8月采集22份葡萄种质资源果实,用保鲜袋编号封存后置于冰盒送至中国农业大学实验室,样品至实验室后液氮速冻后置于-80℃冰箱中保存,以备检测叶酸含量。其中包括 6份欧美杂种品种,16份欧亚种品种[32-52]。 试验在中国农业大学实验室进行。表1
1.1.1.2 主要仪器
洗板机(普朗集团);酶标仪(Thermo Multiskan);紫外可见分光光度计(Angilent);涡旋揽拌器(北京鼎国);微量移液器(大龙兴创实验仪器公司);磁力揽拌器(大地自动化仪器厂);微量髙速离心机(Eppendorf);分析天平(Sartourius);pH仪(Mettler toledo)。
1.1.2 ISSR材料
1.1.2.1 葡萄叶片
于上述地点2019年5月采集22份葡萄种质资源幼嫩叶片,用保鲜袋编号封存后置于冰盒快递送至重庆西南大学实验室,样品至实验室后液氮速冻后置于-80℃冰箱中保存,以备提取DNA。其中包括 6份欧美杂种品种,16份欧亚种品种。试验在重庆西南大学实验室进行。表1
1.1.2.2 ISSR主要试剂
(1)DNA 提取:PVP(聚乙烯吡咯烷酮),去糖缓冲液(成分终浓度:1 mol/L NaCl,0.4 mol/L 葡萄糖,2%PVP,0.1 mol/L(pH=8)Tris-HCl),蛋白酶(10 mg/mL),β-巯基乙醇,CTAB(成分终浓度:1.4 mol/L NaCl,2%PVP,0.02 mol/L EDTA,0.1 mol/L Tris-HCl,2% CTAB),醋酸钾,氯仿∶异戊醇(24∶1),无水乙醇,RNA 酶,无菌水,10×loading buffer。

表1 基于 ISSR 分析的22份葡萄种质资源
(2)PCR 扩增:2.5 mM dNTPs,5U/μL rTaq,15 mM 10×buffer(Mg2+),ddH2O。
(3)样本检测:30%丙烯酰胺(29 g Acr,1 gBis 溶于 100 mL 去离子 H2O 中),5×TBE(27.5 g 硼酸,54 g Tris,10 mL 0.5 mol/L EDTA 定容至 1 L),TEMEDA,10%APS(1 g 过硫酸铵溶于 10 mL 去离子水),固定液(1 g AgNO3,100 mL 无水乙醇,5 mL冰醋酸,定容至 1 000 mL),显色液(14 g NaOH,2.5 mL 甲醛,定容至 1 000 mL),琼脂糖,溴化乙锭。
1.1.2.3 主要仪器
研钵,微量移液器(Eppendorf),制冰机(SANYO),台式离心机(Eppendorf),恒温水浴锅(Shellab),恒温仪,真空离心干燥仪(Eppendorf),核酸蛋白检测仪 NANODROP2000(Thermo),凝胶成像系统 GelDocTmXR+imagingsystem(BIO-RAD),Veriti PCR 仪(ABI),C1000 Touch PCR 仪(BIO-RAD),垂直板电泳槽(北京六一仪器厂 DYCZ-30C),水平板电泳槽(北京六一仪器厂DYCP-31E),普通电泳系统(BIO-RAD)。
1.2 方 法
1.2.1 ELISA方法
1.2.1.1 ELISA主要试剂
包被抗原叶酸-BSA、叶酸单克隆抗体和HRP-羊抗鼠IgG由中国农业大学作物化学控制中心提供,5-甲酰四氢叶酸标准样品购自美国Sigma公司,其他化学试剂均购自北京化学试剂公司。
1.2.1.2 最适工作条件
采用棋盘格法确定包被抗原以及抗体最佳稀释倍数,以获得最佳抑制曲线。(1)用包被缓冲液(Na2CO3-NaHCO3缓冲液,0.01 M,pH 9.6)将包被抗原叶酸-BSA(1 mg/mL)稀释1∶500、1∶1 000、1∶2 000、1∶4 000、1∶8 000五个浓度,分别向酶标板上每孔加入100 μL,37℃温育3 h,弃包被液,用洗液(0.01 M 的Na2HPO4- KH2PO4缓冲液,pH 7.5,含0.1% 吐温-20)洗板3次,甩干。(2)叶酸单抗(1 mg/mL)用样品稀释液(0.01 M 的Na2HPO4- KH2PO4缓冲液,pH 7.5,含0.1% 吐温-20及1 g/L明胶)稀释成1∶1 000、1∶2 000、1∶4 000、1∶8 000 四个浓度,分别向上述不同浓度抗原孔中加入50 μL/孔,形成棋盘格。同时,每个抗原-抗体浓度组合分别加入50 μL的叶酸标准液2 000和0 ng/mL两个浓度。37℃温育30 min,洗液洗板4次。(4)加入0.1 μg/mL 的HRP-羊抗鼠IgG,每孔100 μL,37℃温育30 min,洗板3次。(5)加OPD底物溶液,每孔100 μL,避光显色10 min。加2 M H2SO4,每孔50 μL终止显色反应。用酶联免疫检测仪在492 nm测定各孔光密度(OD)值。
1.2.1.3 标准曲线的建立
包被抗原用包被缓冲液稀释至工作浓度,加入酶标板100 μL/孔,37℃温育3 h,弃包被液,洗液洗板3次。将50 μL不同浓度(0、3.125、6.25、12.5、25、50、100、200 ng/mL) 的叶酸标准液加入酶标板,每个浓度重复3次,再加入50 μL稀释至工作浓度的叶酸单抗溶液,37℃温育30 min,洗板3次。每孔加入100 μL 0.1 μg/mL的HRP-羊抗鼠IgG,37℃温育30 min,弃液后洗板3次。每孔加入100 μL OPD底物溶液,避光显色10 min,每孔加50 μL 2 M H2SO4后于492 nm波长下测各孔OD值。将含0 ng/mL 叶酸标准品孔的OD值设为B0,其余孔OD值为B。标准品浓度的自然对数为横坐标,B/B0值为纵坐标,绘制标准曲线。
1.2.1.4 样品叶酸提取
采用乙酸乙酯对样品进行提取,称取0.5 g新鲜植物材料,加2 mL饱和食盐水,研磨成匀浆,转入10 mL离心管,涡旋30s,再加入5 mL乙酸乙酯提取,充分震荡后静置10 min,吸取3 mL上层有机相,转入新的10 mL离心管中,用氮气吹干,用2.5 mL样品稀释液定容,再稀释至合适浓度即为待测液。
1.2.2 ISSR方法
1.2.2.1 基因组 DNA 提取
基因组DNA提取参照改良 CTAB 法, 从葡萄幼叶中提取基因组DNA ,0.8% 琼脂糖凝胶电泳检测,使用核酸检测仪检测DNA 浓度和纯度,并将浓度稀释至20 ng/mL。
1.2.2.2 DNA 扩增和电泳
采用 20 μL 反应体系 ,其中包括 2 μL模板DNA ,2.0 μL Buffer, 0.7 μL引物,0.4 μLTap酶,1.6 μL dNTPs , 13.3 μLDDH2O。
用于ISSR-PCR反应的dNTP、Taq 酶、标准分子量(Marker) DI2000 购自北京全式金生物技术有限公司,引物来自加拿大哥伦比亚大学(UBC)提供的ISSR引物序列[3],由杭州生工公司合成。
PCR 反应程序为:94℃ 预变性1.5 min ,94℃ 变 性 40 s,53℃ 退火1 min , 72℃ 延伸 1.5 min , 进行 40个循环 , 最后 72℃ 延伸 5 min, 4℃保存。PCR 反应在德国Biometra公司生产的Tl型PCR循环仪上进行。扩增产物经0.8%琼脂糖凝胶电泳分离,将电泳产物在凝胶成像系统(BIO-RAD molecalar imager cel doc xr +)的紫外灯下观察、照相并保存图片。
1.3 数据处理
1.3.1 ELISA
依据叶酸标准曲线将所测OD值带入计算所测样品叶酸含量。
1.3.2 ISSR
根据各分子标记在相同电泳迁移率(相同分子量片段)的有无统计得到所有位点的二元数据,有DNA 扩增带记为1,无带记为0。利用NT-SYSpc2.10e软件进行Jaccard相似性系数分析,并通过非加权配对算术平均法(UPGMA) 进行聚类分析,建立亲缘关系图。
2 结果与分析
2.1 22份葡萄种质资源果实叶酸含量方差变化
研究表明,叶酸含量均值黑奇无核最高,为46.953 4 ng/g;其与红巴拉多、炎兴无核无显著差异;其与红宝石、夏黑、达米拉、本纳格、蜜红、无核紫、瑞都翠霞、宇选1号、京密、里扎马特、洛浦早生、粉红亚都蜜、杂1、美人指、无核白、红标无核、1124、京翠有显著差异;该批检测的葡萄种质资源中叶酸含量最低的是京翠,为5.039 4 ng/g;欧亚种的叶酸含量平均为17.234 9 ng/g,欧美杂种的为13.236 2 ng/g,欧亚种的叶酸含量较欧美杂种高3.998 7 ng/g。表2,图1
2.2 ISSR多态性
研究表明,9 条引物共扩增出78条带,其中多态性条带70 条,多态性百分率 89.7%。单条引物扩增的条带为4~13条,平均 8条。扩增产物长度介于250~3 000 bp,以500~2 000 bp的扩增片段居多。扩增条带数最多的引物为BC881,达13条,多态性百分率为100%,引物 BC856,BC811扩增条带数最少,均为4条。其中多态性百分率最高的还有BC815和 BC834,达100%,最低的为BC811,为25%。 表3,图1

表2 22份葡萄种质资源果实叶酸含量的方差变化
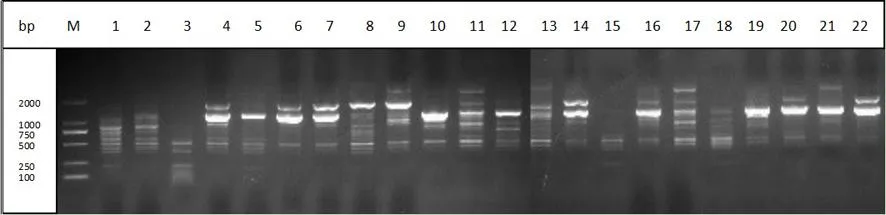
图1 ISSR 引物 881 对葡萄种质资源的扩增结果 Fig.1 Amplification profile of ISSR prime881 with part of samples

表3 不同引物的碱基序列及扩增结果
2.3 22 份葡萄种质资源亲缘关系
研究表明, 22 份葡萄材料的遗传相似系数为 0.474 4~0.846 2 ,平均遗传相似系数为0.654 5,其中无核紫与宇选1号、木纳格与力扎马特的遗传相似系数最大,均为 0.846 2 。宇选 l号与木纳格的遗传相似系数最小,为 0.474 4 。
在遗传相似系数为 0.621处,22份葡萄材料明显分为 2 大类群。第 1 大类包含1个欧亚种(红巴拉多),其余为第 2大类。在遗传相似系数为 0.622处 ,21份葡萄材料又明显分为 2 大类群。 第 1 大类包含11个欧亚种(炎兴无核、灰比诺、瑞都翠霞、京蜜、黑奇无核、无核白、1124、京翠、红宝石、无核紫、达米娜),6个欧美杂种 (杂1、夏黑、蜜红、红标无核、洛浦早生、宇选1号);第2大类包含4个欧亚种(美人指、粉红亚都蜜、木纳格、里扎马特)。 图2

图2 22 份葡萄种质资源亲缘关系树状图Fig.2 UPGMA dendrogram of 22 vitis varieties determined
2.4 22份葡萄种质资源聚类后叶酸含量
研究表明,在遗传相似系数为 0.621处,22份葡萄材料明显分为 2 大类群。第 1 大类叶酸含量平均为35.79 ng/g;,其余为第 2大类,叶酸含量平均为15.71 ng/g。在遗传相似系数为 0.622处 ,21份葡萄材料又明显分为 2 大类群。 第 1 大类叶酸含量平均为16.53 ng/g;第2大类叶酸含量平均为12.24 ng/g。 群体1的叶酸含量比群体2的叶酸含量高。图3
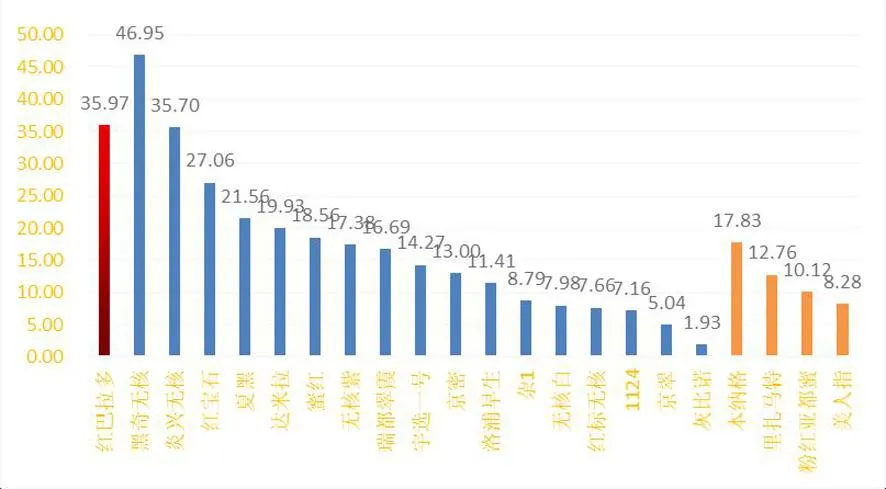
图3 22份葡萄种质资源聚类后叶酸含量Fig.3 Analysis of folic acid content of 22 grape germplasm resources after clustering
3 讨 论
3.1目前,建立叶酸酶联免疫吸附检测(ELISA)已有较多报道,杨霈瑶[21]报道了叶酸竞争抑制ELISA检测方法的建立,通过碳二亚胺法,将叶酸和牛血清白蛋白、鸡卵清白蛋白分别偶联合成了叶酸免疫原(FA-BSA、FA.BSA.ACA)和包被原(FA-OVA),利用FA-BSA免疫家兔制备多克隆抗体,在纯化抗体的基础上建立叶酸间接ELISA检测方法并制作标准曲线;刘小军[53]利用酶联免疫技术研制一种快速检测食品中的叶酸试剂盒,经过测试,该试剂盒对牛奶样本的检测限为 10.0 μg/L。建立ELISA方法进行玉米中5-甲酰四氢叶酸含量的检测。Yue等[29]制备单克隆抗体,对不同玉米品种中的叶酸含量进行检测,可以对大批量品种进行的有效的叶酸含量初筛。李贞[54]建立了牛奶中叶酸检测的酶联免疫反应方法,并对其叶酸本底含量测定。用竞争性酶联免疫,棋盘法确定最佳抗体包被条件、封闭条件、酶标抗原浓度等,并进行性能评价测定,检测 80 例牛奶样品中的叶酸本底含量。牛奶样本叶酸本底含量范围为12.55~68.72 μg/mL,均值37.93 μg/mL;解鑫[55]用酶联免疫法的试剂盒对代表性乳粉样品进行3d3平行检测,对检测数据做正态分布分析及不确定度计算,结果表明,酶联免疫方法不确定度范围为 9.6%~31.3%。此方法的最低检测限为2.22 μg/mL;李江[56]建立一种检测奶粉中叶酸质量分数的酶联免疫分析方法,结果表明,当加标质量分数为20,40和80 μg/kg时,空白基质奶粉中叶酸的提取回收率为93.5%~118.0%;非空白基质样品中叶酸的加标回收率为88%~92%;方法检出限为4 μg/kg。
3.2王发明等[57]对广西桂林的 17 份野生毛葡萄种质和 41 份栽培葡萄种质,使用12条ISSR引物进行了遗传多样性和亲缘关系检测。聚类分析表明41份葡萄资源中,京亚、香玉、藤稔等 11 个品种聚为一类,克伦森、夏黑、红玫瑰等6个品种聚为一类,群体遗传分析表明,ISSR分子标记可以产生丰富的遗传多态性位点,可以有效地应用于葡萄种质遗传多样性研究上。张富民等[58]利用ISSR分子标记技术对福建省各葡萄种植区收集到的196份葡萄资源进行亲缘关系鉴定。聚类分析表明,196份葡萄资源可以分为3大类,即东亚种群、欧美杂种和欧亚种;群体遗传分析表明,葡萄资源种内存在丰富的遗传多样性。吴子龙等[59]利用ISSR标记对l5份葡萄材料进行了基因组多态性分析,结果表明山葡萄与欧亚种 、美洲杂种葡萄的亲缘关系较远,欧亚种与美洲杂种之间亲缘关系较近。张永福等[60]利用 ISSR 分子标记技术对弥勒市8个主栽葡萄品种进行基因组多态性检测,聚类分析表明,8 份试材中玫瑰蜜、水晶、红玫瑰等分为第 1 大类,红地球、竞秀、青提等为第2大类。 唐宇宏等[61]采用ISSR技术对黑龙江省西部地区葡萄的9个品种进行亲缘关系的研究,聚类分析结果可分出欧亚种和美洲种 。 张永辉等[62]利用ISSR 标记对81份葡萄资源进行分类研究,将供试材料毛葡萄 1 099 确定为桑叶葡萄,对葡萄进行重新分类。崔鹏等[63]用ISSR 标记研究南方45个葡萄主要栽培品种的遗传多样性和亲缘关系。聚类分析将 45 个供试品种分为两个类群,欧亚种群和欧美杂种群。吴代东等[64]用 ISSR 标记研究36份抗病性不同的葡萄种质,聚类分析将 36 个供试品种分为两个类群,第一类包含9个品种分别为:雷司令、刺水 14、黑珍珠4号等; 第二类包含27个品种,包括水源12号、水源4号、金 1等。 陈小宇等[65]用 ISSR 标记研究蛇龙珠8个新株系的亲缘关系和遗传多样性,聚类分析表明,蛇龙珠E06与其他7个株系有差异,另外7个株系聚为一类。赖呈纯等[66]利用 ISSR 分子标记技术对 95 份葡萄品种(系) 资源进行遗传多样性和亲缘关系分析; 聚类分析结果表明,95 份葡萄资源划分为3大类,分别为欧亚种、欧美杂种和东亚种群,这与葡萄传统分类结果一致。李琳等[31]利用 ISSR 标记对 24 份葡萄材料进行了基因组多态性分析,聚类分析结果表明,24 份葡萄材料明显分为2 大类群,第 1 类包含10个欧美杂种、7个欧亚种、1个华欧杂种,第2 类包含3个美洲杂交种、1个河岸葡萄 、1个冬葡萄、1个东亚葡萄。 美洲杂交种与欧美杂种 、 欧亚种葡萄的亲缘关系较远,欧美杂种与欧亚种葡萄之间亲缘关系较近。
4 结 论
在遗传相似系数为 0.621处,22份葡萄材料明显分为 2 大类群。第 1 大类叶酸含量平均为35.79 μg/g;其余为第 2大类,叶酸含量平均为15.71 μg/g。在遗传相似系数为 0.622处 ,21份葡萄材料又明显分为 2 大类群。第1大类叶酸含量平均为16.53 μg/g;第2大类叶酸含量平均为12.24 μg/g。欧亚种的folic acid含量较欧美杂种稍高3.998 7 μg/g;群体1的叶酸含量比群体2的叶酸含量高。欧亚种的叶酸含量较欧美杂种稍高;在遗传相似系数为0.621处,22份葡萄材料明显分为2大类群。第1大类包含1个欧亚种(红巴拉多),其余为第2大类。在遗传相似系数为 0.622处 ,21份葡萄材料又明显分为2大类群。第1大类包含11个欧亚种(炎兴无核、灰比诺、瑞都翠霞、京蜜、黑奇无核、无核白、1124、京翠、红宝石、无核紫、达米娜),6个欧美杂种 (杂1、夏黑、蜜红、红标无核、洛浦早生、宇选1号)。第2大类包含4个欧亚种(美人指、粉红亚都蜜、木纳格、里扎马特);ISSR标记在葡萄种质资源鉴定方面有较高的分辨能力。

