白刺NtBES1转录因子家族的鉴定及分析
王丽蓉,杜 萌,易 丹,王 博,杨鑫光,李 毅*
(1 青海民族大学 青海省特色经济植物高值化利用重点实验室,西宁 810007;2 甘肃农业大学 林学院,兰州 730070;3 青海民族大学 青藏高原生态环境研究所,西宁 810007;4 青海民族大学 青藏高原资源化学与生态环境保护国家民委重点实验室,西宁 810007;5 青海民族大学 土地资源勘测与规划实验室,西宁 810007;6 青海民族大学 青藏高原种质资源研究与利用实验室,西宁 810007)
油菜素内脂(brassolidin,BR)是植物特有的类固醇激素[1],它在调节植物的细胞伸长与分裂、发育、感光、衰老以及抗逆性等方面起着重要作用[2-6]。BR信号的转导始于BR与细胞质膜上受体蛋白的结合,通过磷酸化反应将信号传至细胞内,继而细胞内BR通路上的负调控蛋白被抑制,同时正调控转录因子BRI1-EMS-suppressor 1(BES1)被激活并进入细胞核中与其他转录因子以及辅酶因子结合,作用于靶基因的启动子区域进行转录调控[6]。研究表明能被BES1调控的基因有5 000~8 000种[6-9],其中大部分被诱导,少部分被抑制,被诱导基因的启动子区包含一个E-Box (CANNTG)结构域,而被抑制基因的包含一个BR响应元件BRRE [CGTG(T/C)G][6-7]。BES1除参与BR通路的调控活动外,还参与多种应激活动,并在不同植物中呈现出多样化的功能[6-7,10-15]。随着研究的不断拓展,BES1及其家族已从越来越多的物种中被鉴定出来。目前从拟南芥、玉米、小麦、番茄、大白菜、甘蓝型油菜、马铃薯和棉花中分别鉴定出8、11、15、9、15、29、9和22个BES1家族成员[16-23]。这些BES1与BZR1、BEH1~BEH4同源,均具有一个高度保守的非典型碱性螺旋-环-螺旋结构(bHLH),是典型的bHLH转录因子。然而无论是直系还是旁系同源成员在结构、亚细胞定位、作用机制以及胁迫下的表达模式上均存在差异[6,12,16-23]。
干旱和盐胁迫是植物在生长发育中最常遇到的非生物胁迫。一些学者对BES1与耐旱或耐盐性的关系展开了研究:在棉花幼苗中发现干旱胁迫下BES1能响应外源喷施的油菜素内酯,并能提高棉花的抗旱能力[24];在马铃薯的研究中发现过表达马铃薯的SlBZR1D基因能够增强拟南芥转基因株对BR的响应并能提高转基因株的耐盐性,还发现SlBZR1D对马铃薯植株的耐盐性具有正向调控作用[19]。另外,研究者们还对BES1在干旱或盐胁迫下的作用机制展开了研究,其中包括BES1可调控独脚金内酯主导的拟南芥对干旱的转录记忆[25];一些学者还对BES1协调BR诱导的生长发育与抗逆的平衡机制展开了研究,发现BES1与WRKY协作可抑制干旱胁迫响应基因的表达;TINY联合TINY2/3可通过与BES1发生拮抗作用来协调生长与胁迫响应[6];BES1在干旱中可通过DSK2调控的选择性自噬作用被降解,从而抑制BR调控的生长[6];RD26可通过抑制BES1的活性来提高对干旱的响应[6]。此外,目前对BES1在干旱或盐胁迫下表达模式的报道较多,并且不同植物、不同成员对胁迫的响应存在差异:在干旱处理下,茶树的CsBES1-2~CsBES1-9的表达量显著提高[16];小麦的3个成员BES1d1、2、3在PEG或者干旱胁迫下表达上调,而剩余成员无响应[18];在棉花中,BR诱导的GhBES1在干旱胁迫下能够快速表达[22];在杨树中,PeBZR1在干旱胁迫下被抑制,但在盐胁迫下表达相对稳定[22];马铃薯的9个BES1成员中,StBES1-2、6、8均能受到干旱诱导而上调,8个StBES1成员能受到盐胁迫的诱导,而StBES1-4、StBES1-7和StBES1-9分别在干旱和盐胁迫下表达下调[22];辣椒的BES1基因则对盐胁迫诱导不敏感[26]。BES1在不同植物中对干旱和盐胁迫不同的响应模式证明BES1成员在耐旱和耐盐过程中发挥多种不同的作用。
白刺,又名唐古特白刺(Nitrariatangutorum),为蒺藜科(Zygophyllaceae)白刺属(Nitraria)第三纪孑遗灌木,在中国主要分布于西北干旱半干旱地区以及东部沿海盐渍化地区[27]。白刺被誉为沙漠樱桃,具有很高的营养价值、药用价值和饲用价值,还可为中药锁阳提供寄居环境,因此它具有很高的经济开发潜力[28-30]。除此之外白刺还具有很强的耐干旱、盐碱以及防风固沙的能力,是中国荒漠半荒漠地区群落的建群种[31]。目前,对白刺的抗逆机理从表型和分子层面展开了一系列研究[31-41],其中,抗逆分子机理研究主要是对一些抗逆基因如14-3-3、NtCBL1等在干旱或盐胁迫下表达特征的分析[36-37],或者对一些抗逆基因如NHX、CIPK11等的生理功能验证的研究[38-39];另外还有一些研究是基于大数据组学对白刺群体基因或代谢物在干旱或盐胁迫下的变化规律展开的研究[40-41],本实验室已测的白刺在干旱胁迫和盐胁迫下混合样品的三代转录组数据(原始数据已上传至NCBI GenBank数据库,登录号:SAMN16709478)中就发现了一批BES1的转录本,说明白刺的BES1在干旱或盐胁迫下会表达,它们可能在白刺耐干旱或耐盐过程中发挥作用。如上文所述,BES1转录子家族在植物耐干旱和耐盐中发挥重要作用并且功能多样[1,3,7,16,22],白刺作为耐干旱和盐碱的代表性植物对其BES1基因的研究十分必要。以单分子实时测序技术(SMRT)为代表的三代全长转录组测序技术,在测序深度和精度上均优于二代技术,它能提供更为准确和丰富的物种基因组背景信息[42]。本研究以白刺全长转录组数据为基础,首先鉴定出BES1转录因子家族成员,利用生物信息学方法预测它们的理化性质及功能,分析它们的系统进化关系;利用荧光定量PCR分析家族基因在不同胁迫下的表达模式,以期为后续深入研究白刺BES1家族成员的功能以及白刺耐干旱或耐盐等抗逆分子机理奠定基础。
1 材料和方法
1.1 材料培养与处理
白刺果实于2019年8月采自青海省格尔木市诺木洪农场,经揉搓清洗后获得实验所需种子,之后将种子冷藏于4 ℃备用。当年10月,种子用75%酒精浸泡30 s后用无菌水清洗3遍,种于装有河沙(清洗并高温消毒)的小花盆中。播种后,将花盆置于培养间培养,培养条件为:光照18 h,黑暗6 h,白天温度(26±1)℃,夜晚温度(22±1)℃,相对湿度60%~70%。每3 d向花盆底部托盘中灌入蒸馏水至沙子完全浸湿。
2个月后选取生长良好且长势一致的白刺幼苗并移至1/2霍格兰(Hoagland)营养液中,培养条件同上,水中全天充氧。适应培养3 d后,将材料移至用营养液配制的处理液中进行胁迫处理。干旱胁迫用不同浓度(10%和30%)PEG营养液模拟,处理2、12、24 h后取样;盐胁迫用2个浓度(200和450 mmol/L)NaCl营养液,处理2、12、24和48 h后取样,每3株苗为1个生物学重复,收集全部叶片后迅速放入液氮中,之后放入-80 ℃冰箱保存待用。以营养液培养的植株为对照(即处理 0 h)。
1.2 数据分析方法
1.2.1 家族成员鉴定利用本实验室已获取的白刺三代转录组的注释信息初筛得到了24条BES1家族转录本序列,除去重复序列后,用DNAMAN V6.0 将转录本序列翻译成氨基酸序列并放入Pfam(http://pfam.xfam.org/)在线软件和NCBI的CDD(https://www.ncbi.nlm.nih.gov/cdd)数据库中进行保守结构域分析[16],通过与2个数据库的比对,去除不含有BES1_N保守结构域的序列,之后利用本地的CDS(Coding Sequence)数据库和ORF Finder(https://www.ncbi.nlm.nih.gov/orffinder/)在线软件共同预测白刺BES1蛋白序列CDS的完整性,去除不完整的序列,最终序列鉴定为白刺NtBES1蛋白序列[43]。
1.2.2 蛋白理化性质预测分析利用ExPASy在线程序ProtParam(https://web.expasy.org/protparam/)分析白刺NtBES1序列的氨基酸数目、分子量、等电点、不稳定指数和亲疏水性[16];利用在线软件PSORT(http://www.psort.org/)预测蛋白的亚细胞定位;利用在线软件SOPMA(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)预测蛋白的二级结构;通过在线工具NetPhos3.1Servert(/www.cbs.dud/servicesNetPhos/)对蛋白的磷酸化位点苏氨酸(T)、丝氨酸(S)和酪氨酸(Y)进行预测,并进行统计分析[43]。
1.2.3 保守基序及保守结构域的分析利用DNAMAN V6.0对白刺的NtBES1氨基酸序列进行多序列比对,获得BES1_1保守序列。利用在线软件MEME(https://meme-suite.org/meme/)分析蛋白序列的保守基序motif[44],经验证基序最多值设置为10,其余为默认值,利用TBtools工具对导出的MEME文本结果进行分析并绘制保守基序图[3]。
1.2.4 进化树的构建基于上述多序列比对后的氨基酸序列,利用MEGA 7.0软件[44],采用邻接法(bootstrap 1 000)建立系统进化树;用相同方法建立白刺与拟南芥(8条)、水稻(6)、玉米(11条)等物种BES1氨基酸序列系统进化树。
1.2.5 荧光定量PCR总RNA按RNAprep Pure Plant Kit RNAprep Pure植物总RNA提取试剂盒(北京天根生化科技有限公司,北京)的说明在低温无菌条件下提取。cDNA利用PrimeScriptTMRT reagent Kit with gDNA Eraser(Perfect Real Time)反转录试剂盒(TaKaRa北京宝生物公司,北京)合成,反转录过程按照说明进行操作,反转录程序:反转录反应(37 ℃,15 min);反转录酶失活反应(85 ℃,5 s);4 ℃保存。利用TB Green Premix Ex TaqTMⅡ(Tli RNaseH Plus)试剂盒(TaKaRa北京宝生物公司,北京)进行qRT-PCR实验。使用ABI Stepone Plus荧光定量PCR仪(Thermo Fisher Scientific 公司,新加坡)检测样品的CT值。首先将cDNA稀释至1/10原浓度备用,qRT-PCR反应体系(20 μL):TB Green Premix Ex TaqⅡ(Tli RNaseH Plus)(2×conc.) 10 μL,cDNA模板2.5 μL,正反向引物各0.8 μL(10 μmol/L),ddH2O 5.5 μL,ROX 0.4 μL。反应程序:95 ℃预变性2 min,95 ℃变性10 s,60 ℃复性30 s,72 ℃延伸20 s,40个循环,设置3个技术重复。特异性引物由Primer在线软件(http://www.primer3plus.com/cgi-bin/dev/primer3plus.cgi)设计,特异性引物序列如表1所示。内参基因为EF1α基因。预实验以CK、30% PEG-2 h和450 mmol/L NaCl-24 h的RNA为模板,分析各个基因引物的溶解曲线及CT值,选取表达量相对较高的成员进行后续分析。利用2-ΔΔCT方法计算基因在不同处理中的相对表达量[16]。
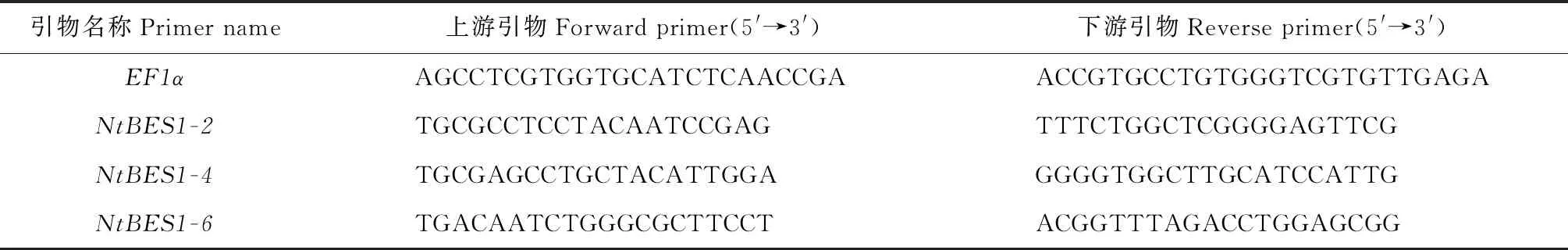
表1 荧光定量PCR引物序列Table 1 The primers used in qRT-PCR
1.3 数据分析
利用Excel 2010和SPSS 21.0软件对数据进行统计和分析。One-way ANOVA单因素方差分析方法用于分析不同处理间的差异显著性[36]。
2 结果与分析
2.1 家族成员及其理化性质
通过筛选、鉴定,从白刺转录组数据中共获得7条均具有完整CDS的BES1序列,命名为NtBES1-1~NtBES1-7。理化性质分析结果显示(表2):白刺的7条NtBES1蛋白序列的氨基酸数目在86 aa(NtBES1-4)~422 aa(NtBES1-6)之间,分子量在9.75 kD(NtBES1-4)~47.53 kD(NtBES1-6)之间,理论等电点在5.29(NtBES1-5)~10.22(NtBES1-4)之间,不稳定指数范围在34.88(NtBES1-1)~75.02(NtBES1-7)之间。平均亲水系数均为负值,表明这些蛋白均为亲水性蛋白。亚细胞定位预测结果显示NtBES1-6定位在细胞质中,其余的成员均被定位在细胞核中。
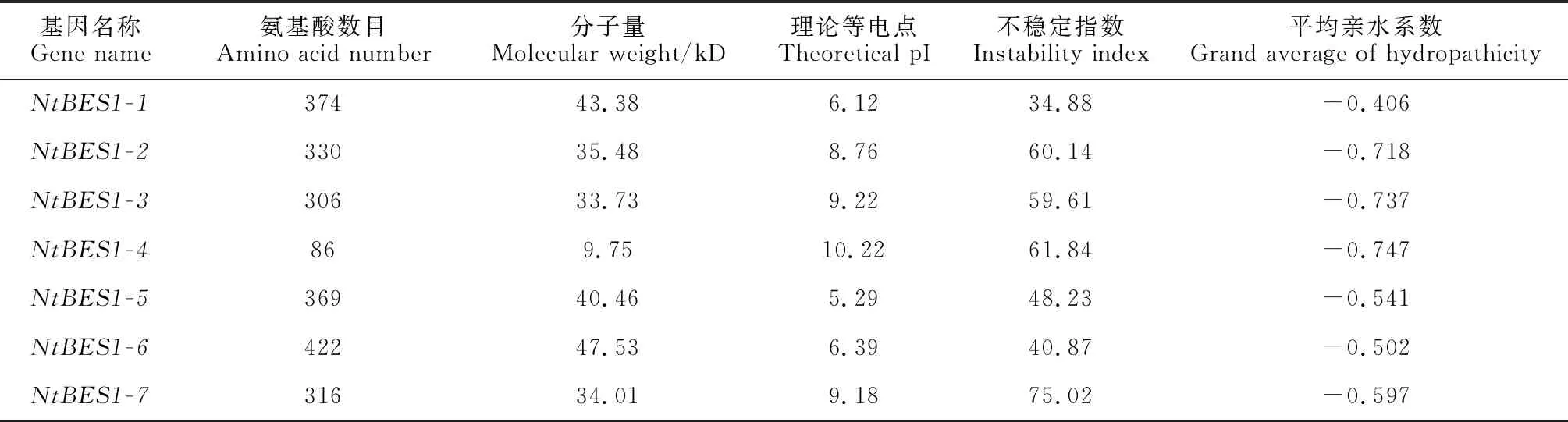
表2 白刺NtBES1基因家族成员理化性质Table 2 The physic-chemical characters of NtBES1 family members in N. tangutorum
对7个NtBES1蛋白的磷酸化修饰位点进行预测,发现所有蛋白中丝氨酸的数目最多,酪氨酸数目最少。NtBES1-4中的每类氨基酸磷酸化位点数目均是最少的,总共有9个磷酸化位点,NtBES1-2中的最多,有45个,且最多的是丝氨酸,NtBES1-6中具有最多的酪氨酸(表3)。

表3 白刺NtBES1蛋白磷酸化位点预测Table 3 Prediction of NtBES1 protein phosphorylation sites in N. tangutorum
2.2 保守结构
对氨基酸序列进行多序列比对,发现所有的序列均具有完整bHLH结构的BES1_N保守结构域(图1)[3]。保守基序分析结果显示,NtBES1家族成员共包含10种基序,每个成员所含基序的数量和种类存在一定的差异但是至少包含一个Motif1(BES1_N结构域)。结合系统发育树分析,发现GroupI、GroupⅡ和GroupⅢ中的蛋白在保守基序组成上存在明显差异,而同一组成员的基序组成十分相似(图2,B):GroupI的3个蛋白(NtBES1-2、NtBES1-3、NtBES1-7)均含有Motif6、Motif8、Motif9、Motif7和Motif10;GroupⅢ的3个蛋白(NtBES1-1、NtBES1-5、NtBES1-6)均含有Motif5且至少包含一个糖基水解酶保守结构域(Glyco_hydro_14,Motif2或Motif3)。

图1 白刺NtBES1家族蛋白的BES1_N 结构域Fig.1 The BES1_N domain of NtBES1 family proteins in N. tangutorum
2.3 系统发育关系
基于白刺和拟南芥等8种植物的BES1蛋白序列构建的系统进化树(图 3)分为三组,分组结果与它们单独分组(图2,A)的基本一致:Group A对应GroupⅠ;GroupⅠ和NtBES1-4被聚在另外一大组Group B中,在组内NtBES1-4又单独成一支。物种间相似度高的成员组合包括:NtBES1-2与AtBES1-4,NtBES1-3与AtBES1-1、AtBES1-7,NtBES1-7与MtBES1-8,NtBES1-5与AtBES1-8,NtBES1-1、NtBES1-6与CaBES1-2和SIBES1-1。被聚类的三组中仅有Group C中没有分布NtBES1的任何成员,分布的物种均为单子叶植物的成员:ZmBES1-6、OsBES1-6、CaBES1-8以及SIBES1-8,这些家族成员可能是单子叶植物和双子叶植物分化后在单子叶植物中进化出的。

图2 白刺NtBES1蛋白系统进化关系(A)及保守基序分析(B)Fig.2 Phylogenetic relationship of NtBES1 proteins in N. tangutorum (A) and conserved motif analysis(B)

Nt.白刺;At.拟南芥;SI.番茄;Cs.黄瓜;Ca.辣椒;Mt.蒺藜苜蓿;Os.水稻;Zm.玉米;Si.谷子图3 白刺与其他物种BES1蛋白的系统进化关系Nt.Nitraria tangutorum;At.Arabidopsis thaliana;SI.Solanum lycopersicum;Cs.Cucumis sativus;Ca.Capsicum annuum;Mt.Medicago truncatula;Os.Oryza sativa;Zm.Zea mays;Si.Setaria italicaFig.3 Phylogenetic relationship in BES1 proteins between N. tangutorum and other species
2.4 功能注释及解析
对7个 NtBES1成员在公共数据库(COG、KEGG、GO)中的注释结果进行分析,发现NtBES1在COG中被注释到2个功能类中;KEGG注释显示NtBES1参与2条通路活动;NtBES1在GO中被注释到3个功能类中,其中“生物学过程”(Biological Process)共有13个亚类,“细胞成分”(Cellular Component)有3个亚类,“分子功能”(Molecular Function)有3个亚类。对各数据库中的所有注释进行归纳分析,NtBES1的功能可被分为16种(表4)。除了NtBES1-1、NtBES1-5外,其余成员均参与转录调控;NtBES1-3和NtBES1-4的功能与其他基因的功能差异最大且NtBES1-3注释到最多的功能;NtBES1-1、NtBES1-3、NtBES1-6均参与植物生长发育过程;NtBES1-3参与生物胁迫防御活动;NtBES1-1、NtBES1-5、NtBES1-6参与糖类代谢,其中NtBES1-5是“淀粉和蔗糖代谢”KEGG通路中的基因;另外还有3个成员参与“植物激素信号”KEGG通路中油菜素内酯素介导的信号通路。
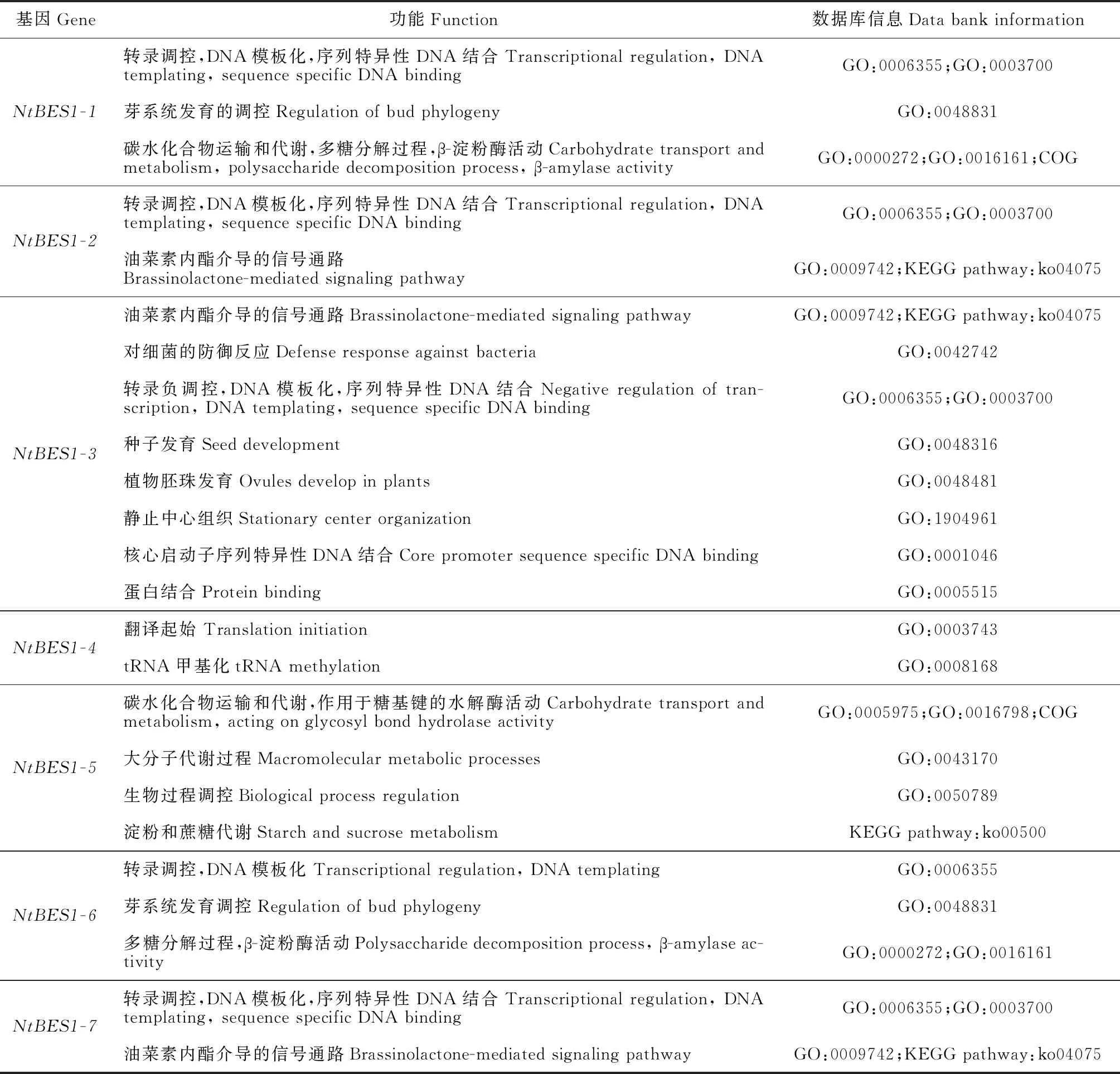
表4 白刺NtBES1家族基因功能注释汇总Table 4 Summary of functional annotation of NtBES1 family genes of N. tangutorum
2.5 胁迫下的表达分析
白刺的自然生境特征以干旱和盐碱为主,为探索NtBES1家族基因在白刺应对干旱和盐碱胁迫中的作用,利用荧光定量PCR对NtBES1基因家族成员在干旱和盐碱胁迫下的表达特征进行分析。根据预实验结果,选取表达水平相对较高的基因NtBES1-2、NtBES1-4和NtBES1-6用于表达模式分析。
如图4所示,在不同浓度PEG处理下,NtBES1-2、NtBES1-4、NtBES1-6在各时间段均有表达。其中,NtBES1-2和NtBES1-6有相似的表达模式:在低浓度处理下表达均下调;高浓度处理早期(2 h)表达显著上调至最高,之后随时间延长表达量降低且低于对照(0 h)。NtBES1-4有不同的表达模式:不论是高浓度还是低浓度处理,在干旱刺激之初均显著上调;之后在低浓度处理下,12 h时出现显著下调且低于对照,随着胁迫时间的延长,在24 h时又显著增加至最高;而在整个高浓度胁迫过程中随时间推移表达量呈现先增加后减少的模式,2 h时表达量最高。
如图5所示,在不同浓度NaCl处理下,3个基因的表达量总体均上调,其中,低浓度处理的表达量在胁迫初期(2 h)开始显著增加;高浓度处理的在胁迫中、后期(12 h、24 h)才开始显著增加,且在胁迫后期(24 h)增加至最高,但是每个基因的表达特征又存在一定差别。NtBES1-2在低浓度处理下,表达量整体呈现先增加后减少的模式,2 h的表达量最高,是对照组(0 h)的8.4倍;在高浓度处理下呈现逐渐增加的趋势,48 h的表达量上调至最高,是对照组(CK)的4.5倍。NtBES1-4在低浓度处理下表达模式与NtBES1-2类似,高浓度处理下在24 h时的表达量显著增加为对照组的13.9倍,其余处理下较对照无显著变化。NtBES1-6在低浓度处理下2 h后表达量显著上调且之后相对平稳;在高浓度处理下总体呈现先增加后减少的模式,24 h表达量最高,是对照组的8.6倍。
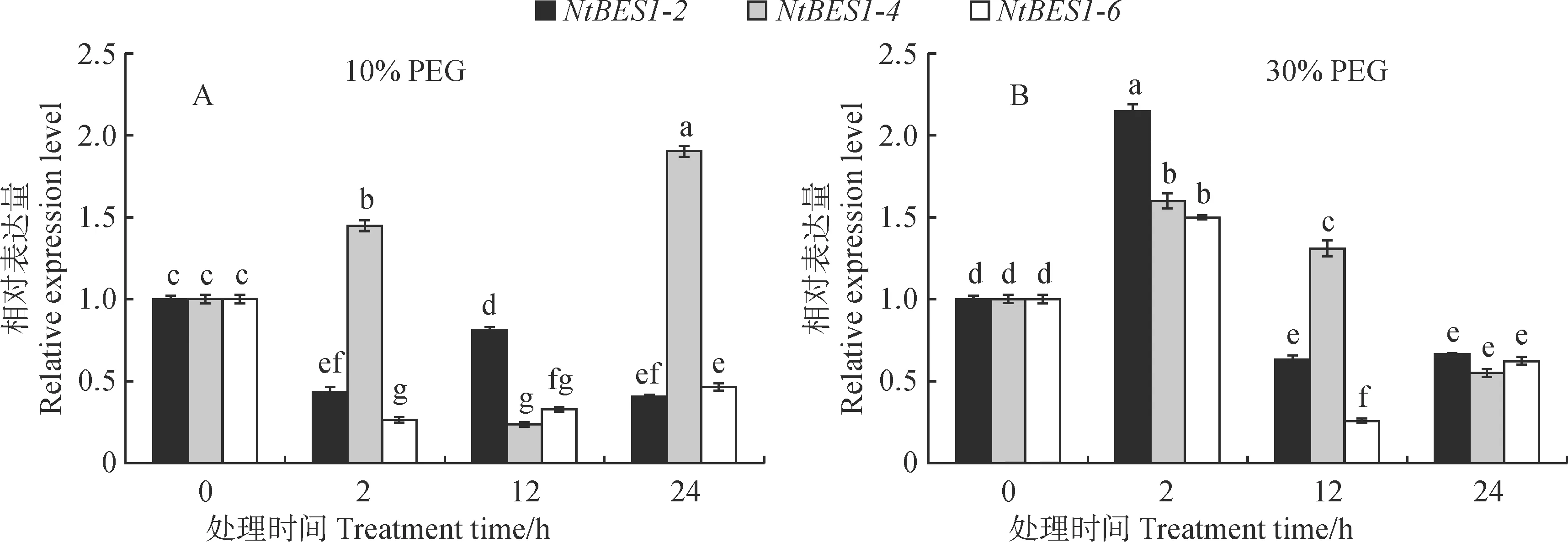
不同小写字母表示不同处理时间差异显著(P<0.05),下同。图4 不同浓度PEG处理下白刺NtBES1转录因子家族基因的相对表达水平Bars marked with different normal letters showed significant difference at the 0.05 level;the same as belowFig.4 Relative expression levels of three representative genes of N. tangutorum NtBES1 transcription factor family under different concentrations of PEG
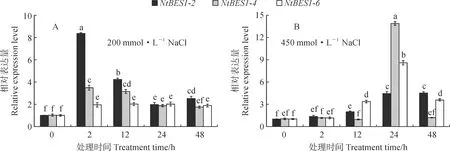
图5 不同浓度NaCl处理下白刺NtBES1转录因子家族代表基因的相对表达水平Fig.5 Relative expression levels of three representative genes of N. tangutorum NtBES1 transcription factor family under different concentrations of NaCl
3 讨 论
生物在进化中不断淘汰不适应环境的基因,进而得以适应环境,这种适应最终依赖于蛋白质结构与功能的统一[45],本研究对NtBES1家族蛋白的分析结果亦发现NtBES1蛋白结构与功能的统一。BES1转录因子的bHLH结构域包含两段高度保守且功能不同的序列:N端序列的主要功能是与目标DNA的E-box或BRRE序列相结合,C端序列的主要功能是与其他蛋白结合,并启动调控过程,进而调控多种生理活动[6]。保守结构分析显示所有的NtBES1均包含bHLH完整的两端结构,这是NtBES1调控功能发挥的基础。另外,GroupⅢ 中的3个蛋白中均发现了糖基水解酶保守基序,结合功能注释结果发现,所有的成员中,仅这3个成员被注释到多糖分解或β-淀粉酶活动的功能。无规则卷曲往往是蛋白质分子特殊构象和功能实施的重要区域[46],因此这些结构的高占比必定会使基因功能更多样化,数据库注释信息也证实了这点,无规则卷曲占比较高的NtBES1-3被注释到最多的功能且功能与其他基因差别很大,除涉及其他蛋白有的功能外,还涉及静止中心组织等特殊的功能。这些结果均能反映NtBES1蛋白结构与功能的统一。
BR信号的细胞转导过程涉及多个空间和反应,首先BR信号从细胞外进入细胞质中,再传导至细胞核中才可与目标基因结合并起到调控作用,其中BES1是将信号从细胞质传递至细胞核内的关键基因[6]。在亚细胞定位预测中,大部分基因仅被定位于细胞核中,推测它们在细胞核内的转录调控中起着重要的作用,而仅有NtBES1-6被定位于细胞质中,推测它在BR信号从细胞质转至细胞核的过程中起着重要作用,磷酸化位点预测结果也可证明该推测。蛋白磷酸化是生物体内细胞信号传导最重要的机制[36],磷酸化底物蛋白的氨基酸残基主要有两种,一种是丝氨酸(含苏氨酸),另一种是酪氨酸,丝氨酸磷酸化的主要作用是变构蛋白质以激活蛋白质或酶的活力,而酪氨酸磷酸化除了激活功能外,更重要的功能是进行信号的多次传递。在磷酸位点预测中,我们发现NtBES1-6的酪氨酸磷酸化位点最多,这成为NtBES1-6将信号从胞质传至胞内的结构基础。
基因表达模式分析可在一定程度上预测基因参与的生理活动和基因功能。在PEG模拟干旱的实验中,低浓度的PEG胁迫下,只有NtBES1-4表达上调,对于高浓度的PEG的诱导,3个基因均出现了上调,且均在早期(2 h)表达量最高,然而只有NtBES1-4在12 h时仍然较CK处于上调状态,另外2个基因的表达均受到抑制,由此可以说明NtBES1-4在白刺响应PEG胁迫的过程中起着重要作用,可能是白刺耐干旱过程中的重要基因。NtBES1-2、NtBES1-6在PEG胁迫下受到了一定程度的抑制,这与杉木(Cunninghamialanceolata)和马铃薯中的研究结果相似[3],ClBES1在干旱胁迫下也出现了表达抑制的情况,这可能与它们除Motif1(BES1_N)外的其他的结构有关。盐胁迫实验中,低浓度盐处理下NtBES1-2和NtBES1-4在胁迫早期(2 h)和中期(12 h)显著上调,且NtBES1-2表达量更高;高浓度盐胁迫下,3个基因从中期(12 h)开始陆续上调,且在24 h后表达量最高,虽在此过程中NtBES1-4贡献了最高的表达量,但它仅在24 h上调,而NtBES1-6从中期(12 h)到晚期(48 h)表达均上调,所以就整个过程来看,NtBES1-6的贡献更突出。综上,NtBES1-2和NtBES1-6分别在低浓度和高浓度NaCl胁迫的耐盐过程中起到更重要的作用。另外,3个基因在高浓度盐胁迫24 h时均受到强烈诱导,说明该高浓度处理下24 h是白刺的一个生理转折点,此时白刺可能通过调整更多的生理活动去适应更长时间的高盐胁迫。
综上所述,白刺NtBES1成员不同的结构特征以及在干旱和盐胁迫下的不同表达模式表明这些成员具有不同的功能,本研究不仅丰富了植物BES1转录因子的信息,还补充了白刺抗逆分子机理的内容,可为白刺及其他作物、林木和牧草的人工栽培、遗传改良以及综合开发利用提供理论参考。

