基于肠道菌群和代谢组学研究化滞柔肝颗粒治疗非酒精性脂肪肝的作用机制
朱春胜,施亚敏,付智慧,于东升,边 猛,聂安政,李晓萍
基于肠道菌群和代谢组学研究化滞柔肝颗粒治疗非酒精性脂肪肝的作用机制
朱春胜,施亚敏,付智慧,于东升,边 猛,聂安政,李晓萍*
郑州大学第一附属医院,河南 郑州 450052
探讨化滞柔肝颗粒治疗非酒精性脂肪肝(nonalcoholic fatty liver disease,NAFLD)的作用机制。高脂饮食饲养8周构建大鼠NAFLD模型,化滞柔肝颗粒ig给药4周。半自动生化分析仪测定大鼠血脂相关指标;油红O染色观察肝脏组织病理变化;Illumina Miseq测序平台对V3~V4可变区进行扩增和测序,超高效液相色谱串联质谱(UPLC-MS/MS)开展血浆代谢组学研究,并结合Spearman进行肠道菌群与代谢组学之间的关联分析。与模型组相比,化滞柔肝颗粒中、高剂量组可显著降低大鼠体质量(<0.05、0.01)和血清总胆固醇(total cholesterol,TC)、三酰甘油(triacylglycerol,TG)水平(<0.01),升高高密度脂蛋白(high-density lipoprotein cholesterol,HDL-C)水平(<0.05、0.01)。此外,化滞柔肝颗粒高剂量组还可显著降低大鼠低密度脂蛋白(low-density lipoprotein cholesterol,LDL-C)水平(<0.05)。油红O染色显示各给药组脂滴分布较模型组减少。16S rDNA测序显示化滞柔肝颗粒可提高NAFLD模型大鼠杜氏乳杆菌属、脱硫弧菌属、Ruminococcaceae-UCG-010等菌群的相对丰度。代谢组学共筛选出18个差异代谢物,通路分析显示化滞柔肝颗粒抗NAFLD主要通过调控氨酰-tRNA生物合成、胆汁分泌、胆固醇代谢等通路。化滞柔肝颗粒改善NAFLD的作用机制可能与调控肠道菌群组成和胆汁分泌、胆固醇代谢等相关代谢通路有关。
化滞柔肝颗粒;非酒精性脂肪肝;肠道菌群;代谢组学;胆固醇代谢
非酒精性脂肪性肝病(nonalcoholic fatty liver disease,NAFLD)是世界范围内较常见的慢性肝病,尤其是在西方国家,其正成为肝移植最常见的适应证[1]。NAFLD包含一系列的组织学特征,临床以肝细胞内脂质过度堆积为特征的单纯性脂肪变性,到炎症或纤维化相关的非酒精性脂肪性肝炎,最终发展为肝硬化和肝脏恶性肿瘤[2]。流行病学调查显示NAFLD的全球患病率已高达25%,其中NAFLD影响了大约27%亚洲人口,30%美国人口,30%南美人口,24%欧洲人口,以及13%非洲人口[3-5]。值得注意的是,目前NAFLD已成我国第一大慢性肝病,NAFLD在成人中的患病率已高达29.2%,且逐渐呈现出年轻化趋势[6-7]。此外,大量临床研究显示NAFLD不仅与2型糖尿病、慢性肾脏疾病及心血管疾病有着密切联系,而且还是肝脏恶性肿瘤的主要危险因素[8-9]。可见,NAFLD危害严重,需引起进一步的重视。
目前,NAFLD的一些治疗方法已在临床试验中被证实具有较好的疗效,如临床中常采用的吡格列酮、维生素E、多烯磷脂酰胆碱等药物治疗[10-11]。然而,上述药物在临床使用过程中存在部分不良反应,如服用吡格列酮可使患者体质量增加3~5 kg,此外还有增加患膀胱癌的风险[12-13];维生素E可增加患前列腺癌和出血性脑卒中的风险[14-15];多烯磷脂酰胆碱使用过程中常出现呕吐、皮疹、腹泻等不良反应,严重限制了上述药物在临床中的推广[16]。因此,寻找更加安全有效的治疗NAFLD药物势在必行。化滞柔肝颗粒具有清热利湿、化浊解毒、祛瘀柔肝之功,临床用于治疗非酒精性单纯性脂肪肝湿热中阻证[17]。然而,有关化滞柔肝颗粒治疗NAFLD的作用机制研究较薄弱,目前多停留在临床观察中。近年来,肠-肝轴的研究模式已在NAFLD的研究中逐步获得国内外学者的认可,肠道菌群亦成为探讨NAFLD的研究热点。而代谢组学利用现代分析技术定量测定生物体液内源性代谢产物变化,结合生物信息学阐明内源性小分子代谢物变化规律,为揭示中药发挥药效的可能作用机制提供了可能[18]。因此,本研究联合肠道菌群和代谢组学探讨化滞柔肝颗粒治疗NAFLD的作用机制,为化滞柔肝颗粒向临床推广提供依据。
1 材料
1.1 药品与试剂
化滞柔肝颗粒(批号0051904010)购自山东新时代药业有限公司;多烯磷脂酰胆碱胶囊(批号TC10004)购自赛诺菲(北京)制药有限公司;高脂饲料(批号D12451,配方为78.8%普通饲料、1%胆固醇、0.2%牛胆盐、10%蛋黄粉、10%猪油)购自协同生物科技有限公司。
三酰甘油(triacylglycerol,TG)试剂盒(批号A110-1-1)、总胆固醇(total cholesterol,TC)试剂盒(批号F002-1-1)、高密度脂蛋白(high-density lipoprotein cholesterol,HDL-C)试剂盒(批号A112-1-1)、低密度脂蛋白(low-density lipoprotein cholesterol,LDL-C)试剂盒(批号A113-1-1)均购自南京建成生物工程研究所。乙腈(批号1499230-935)购自Merck公司,乙酸铵(批号70221)购自Sigma公司,均为高效液相色谱纯。
1.2 主要仪器
SAF-680T半自动生化分析仪(上海巴玖实业有限公司);石蜡组织切片机(美国AO公司);Nikon Eclipse E100型正置光学显微镜(日本Nikon公司);AB Triple TOF 6600质谱仪(AB SCIEX公司);Agilent 1290 Infinity LC超高压液相色谱仪(Agilent公司);5430R低温高速离心机(德国Eppendorf公司);恒温水浴锅(北京医疗设备厂)。
1.3 动物
36只雄性清洁级SD大鼠,5周龄,体质量(180±10)g,购自北京维通利华实验动物中心,动物合格证号SCXK(京)2014-0001。本实验获得郑州大学第一附属医院生命科学伦理委员会批准,批号K2020-0004。
2 方法
2.1 动物分组及给药
SD大鼠饲养于温度(26±2)℃、相对湿度(50±5)%的环境中。适应环境3 d后,按体质量随机分为6组,分别为正常组、模型组、多烯磷脂酰胆碱胶囊阳性药组(PPC)、化滞柔肝颗粒高剂量组(HZRG-H)、化滞柔肝颗粒中剂量组(HZRG-M)、化滞柔肝颗粒低剂量组(HZRG-L),每组6只。正常组给予普通饲料,其余各组均给予高脂饲料8周复制大鼠NAFLD模型。各组均自由饮食、饮水,饲料和水每天更换1次。于实验第9周开始,PPC组大鼠ig多烯磷脂酰胆碱胶囊0.144 g/kg,HZRG-H、HZRG-M、HZRG-L组大鼠分别ig化滞柔肝颗粒5.000、2.500、1.250 g/kg,正常组和模型组大鼠ig同体积生理盐水,连续给药4周。
2.2 样本收集
末次给药后,各组大鼠ip水合氯醛麻醉,腹主动脉采血,部分全血置于涂有肝素钠的EP管中,其余全血放于普通试管中,离心(转速3000×,10 min),分离上清液,其中血清用于测定TG、TC、HDL-C、LDL-C水平,血浆用于代谢组学研究;取部分肝脏组织,置于4%多聚甲醛固定用于病理学观察;收集各组大鼠足量的盲肠内容物于1.5 mL无菌EP管中,液氮速冻后置于超低温冰箱−80 ℃保存,进行16S rDNA测序。
2.3 体质量和血脂相关指标测定
于实验第8周和12周测量大鼠体质量。使用检测试剂盒检测给药4周后各组大鼠血清中的TG、TC、HDL-C、LDL-C水平。
2.4 油红O染色观察肝脏组织病理变化
取部分新鲜肝脏置于冰冻切片机上切取冰冻组织,甲醛-钙固定10 min,蒸馏水洗涤,60%异丙醇浸洗30 s,油红O染液染色15 min,60%异丙醇洗去多余染液,苏木素复染5 min,蒸馏水洗涤3次,甘油明胶封片,光镜下观察病理改变。
2.5 16S rDNA测序
采用试剂盒说明书对各组大鼠样本的盲肠内容物DNA进行提取,根据测序区域的选择,使用NEB Next®Ultra™DNA Library Prep Kit建库试剂盒进行文库构建,构建好的文库通过Agilent Bioanalyzer 2100和Qubit进行质检,采用Illumina Miseq测序平台对V3~V4可变区进行扩增和测序,并利用线性判别分析效应大小(linear discriminant analysis effect size,LEfSe)和R软件进行表达和分析。
2.6 代谢组学分析
2.6.1 血浆样本处理 将各组血浆缓慢解冻,取200 μL样本加入预冷甲醇-乙腈-水溶液(2∶2∶1)600 μL,涡旋混合,低温超声30 min,−20 ℃静置10 min,14 000 r/min、4 ℃离心20 min,取上清真空干燥;质谱分析时加入100 μL乙腈水溶液(乙腈-水1∶1)复溶,涡旋,14 000 r/min、4 ℃离心15 min,取上清液进样分析。
2.6.2 色谱条件 Waters ACQUITY UPLC BEH Amide色谱柱(100 mm×2.1 mm,1.7 μm);流动相为水-25 mmol/L乙酸铵-25mmol/L氨水(A)-乙腈(B);梯度洗脱:0~0.5 min,95% B;0.5~7 min,95%~65% B;7~8 min,65%~40% B;8~9 min,40% B;9~9.1 min,40%~95% B;9.1~12 min,95% B;柱温25 ℃;体积流量0.5 mL/min;进样量2 μL。
2.6.3 质谱条件 电喷雾离子源温度600 ℃,质谱电压5500 V(正离子模式),−5500 V(负离子模式),离子源气体I 4.1×105Pa,气体II 4.1×105Pa,气帘(curtain gas)2.0×105Pa,碰撞能量(35±15)eV。
2.6.4 数据分析 将质谱采集的数据信息导入R软件,进行多元数据处理,包括主成分分析(principal component analysis,PCA)和正交偏最小二乘判别分析(orthogonal partial least squares-discriminant analysis,OPLS-DA)。多元OPLS-DA模型的变量重要性投影(variable importance in projection,VIP)初步筛选出各组代谢物,选取VIP>1.0且<0.05的变量进行进一步数据分析,最后将筛选出的差异代谢物导入京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes, KEGG)进行代谢途径的富集分析。
2.7 统计方法
3 结果
3.1 各组大鼠体质量变化
饲养8周后,与正常组相比,所有喂食高脂饲料大鼠体质量均显著升高(<0.01),但各组之间无显著差异(>0.05),见图1。给药4周后,各组大鼠体质量均有增长,与模型组相比,PPC、HZRG-M、HZRG-H组大鼠体质量增长显著降低(<0.05、0.01),说明化滞柔肝颗粒具有减缓NAFLD大鼠体质量增长作用。
3.2 各组大鼠血清TG、TC、HDL-C、LDL-C的变化
给药4周后,与正常组相比,模型组大鼠血清TC、TG、LDL-C显著升高(<0.01),HDL-C显著降低(<0.05);与模型组相比,各给药组大鼠血清TC、TG均显著降低(<0.01),PPC组、HZRG-H组大鼠血清LDL-C显著降低(<0.05),PPC、HZRG-M、HZRG-H组大鼠血清HDL-C显著升高(<0.05、0.01),其余各组无显著差异,见表1。
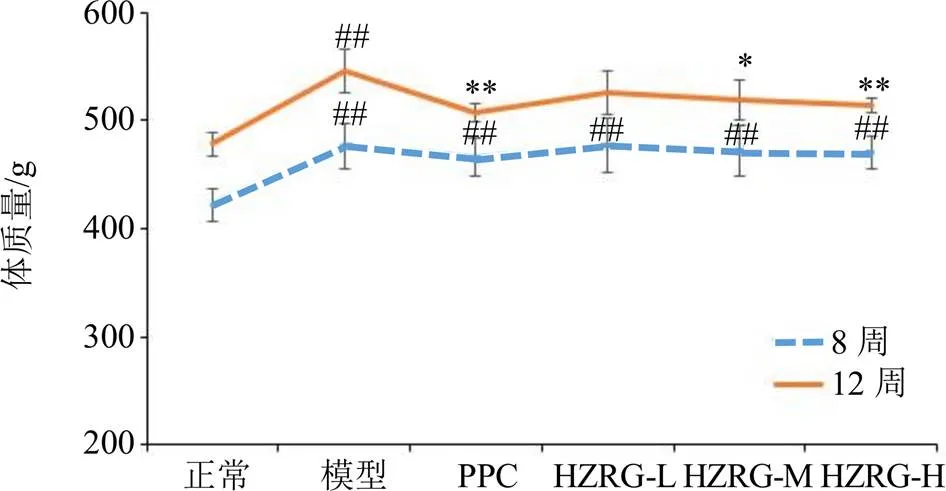
与正常组比较:#P<0.05 ##P<0.01;与模型组比较:*P<0.05 **P<0.01
3.3 各组大鼠肝脏组织病理变化
油红O染色显示,正常组大鼠肝细胞形态正常,胞质内几乎无红色脂滴;模型组大鼠肝细胞形态不规则,胞质内散在大小不等的脂滴空泡;PPC、HZRG-L、HZRG-M、HZRG-H组大鼠肝细胞间界限较模型组清晰,胞质内的脂滴均呈现不同程度的减轻,其中化滞柔肝颗粒3个剂量组脂滴数量与给药剂量成反比(图2)。
表1 各组大鼠血清TC、TG、LDL-C、HDL-C水平()
与正常组比较:#<0.05##<0.01;与模型组比较:*<0.05**<0.01
#< 0.05##< 0.01normal group;*< 0.05**< 0.01model group
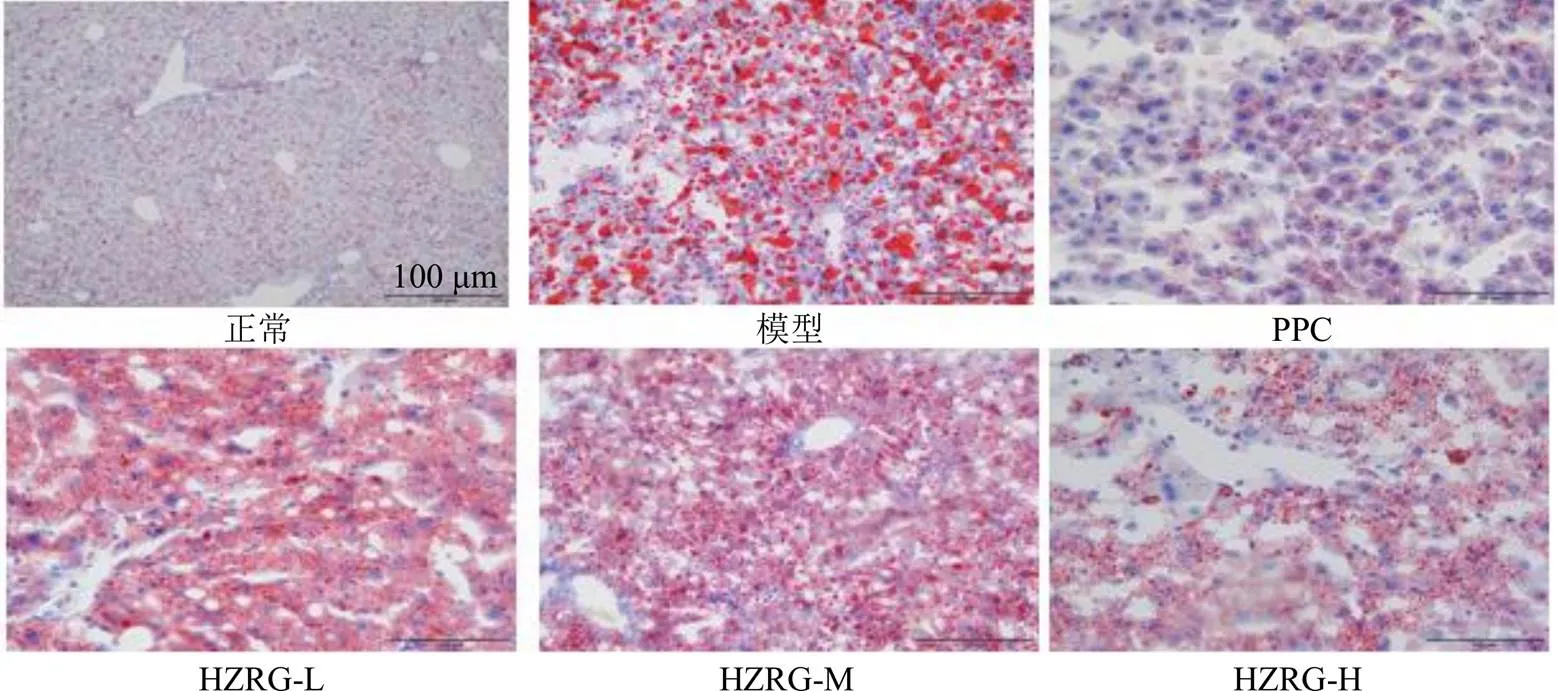
图2 各组大鼠肝脏组织病理变化(×200)
3.4 各组大鼠肠道菌群变化
鉴于HZRG-H组具有较好的药效和改善NAFLD大鼠病理形态的作用,后续实验选择HZRG-H组大鼠开展肠道菌群和代谢组学研究。
3.4.1 多样性分析
(1)α多样性指数分析:采用α多样性对各组大鼠肠道物种多样性进行评价,包括Shannon、Simpson、Ace、Chao指数,结果显示3组之间虽无显著性差异,但值得注意的是,与正常组相比,模型组Ace、Chao指数降低,与模型组相比,HZRG-H组可升高Ace、Chao指数,说明高剂量的化滞柔肝颗粒可改善高脂饮食引起的NAFLD大鼠肠道菌群物种多样性,结果见表2。
(2)β多样性分析:采用Weighted Unifrac距离的β多样性比较不同样本间的肠道菌群组成差异,结果显示HZRG-H组大鼠肠道菌群物种组成与模型相比差异明显,与正常组大鼠肠道菌群物种β多样性较接近,说明高剂量化滞柔肝颗粒能够纠偏高脂饲料引起的NAFLD大鼠肠道菌群群落组成差异,结果见图3。
表2 各组大鼠肠道菌群α多样性分析()
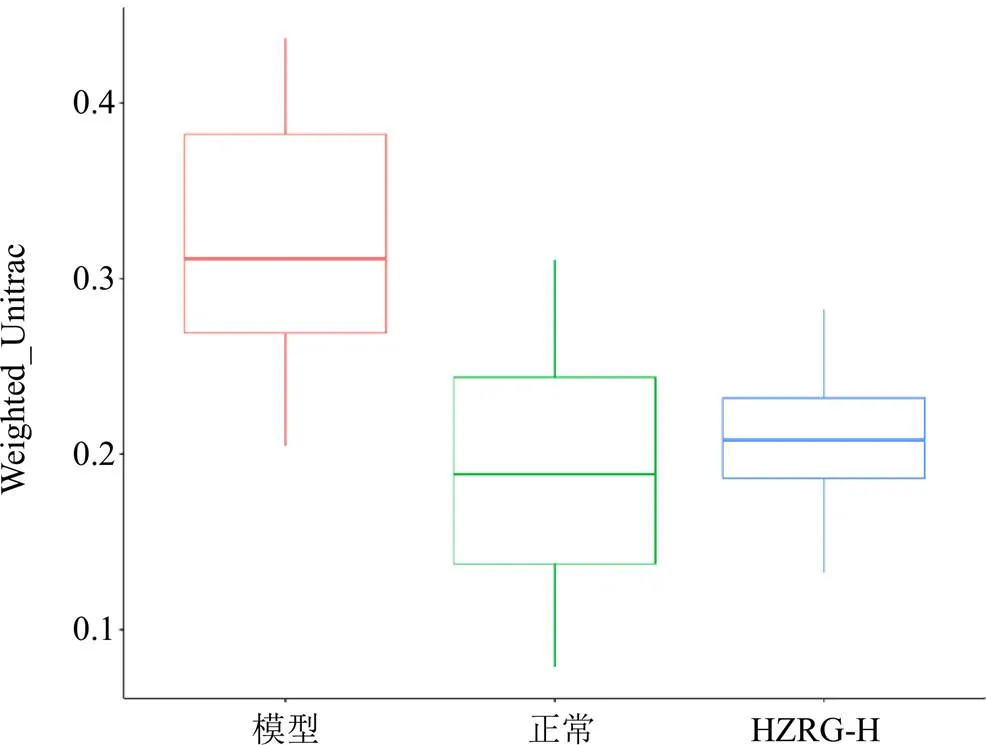
图3 基于Weighted Unifrac距离的各组大鼠肠道菌群β多样性分析
3.4.2 群落结构分析 在门水平上,厚壁菌门、变形菌门、拟杆菌门是3组大鼠肠道菌群主要的门,但在各组中组成不同。与模型组相比,HZRG-H组大鼠肠道菌群厚壁菌门与拟杆菌门比值降低。在属水平上,与正常组相比,模型组大鼠肠道菌群中属相对丰度显著升高(<0.05);与模型组相比,HZRG-H组大鼠肠道菌群中属相对丰度显著降低(<0.05),结果见图4-A~C。
3.5 各组大鼠肠道菌群LEfSe分析
LEfSe多级物种层级树图显示了从门到属水平各组肠道菌群变化,如图5所示,HZRG-H组从纲水平调控放线菌纲、螺旋体纲、柔膜菌纲等优势菌,从属水平调控杜氏乳杆菌属、脱硫弧菌属、Ruminococcaceae-UCG-010等优势菌。
3.6 各组大鼠代谢组学分析
3.6.1 代谢轮廓分析 PCA是一种可快速表征样本差异信息的化学计量学方法。因此,采用PCA对正、负离子模式下各组样本间差异进行分析,结果表明正常组与模型组明显区分,HZRG-H组在正离子模式下部分样本有向正常组转化趋势,见图6。
3.6.2 差异代谢物筛选 基于OPLS-DA对正、负离子模式下检测到的所有代谢物进行差异分析,绘制正、负离子模式下代谢物火山图(图7),观察差异代谢的分布。以同时满足VIP>1、<0.05作为条件筛选差异代谢物,并结合HMDB、KEGG等数据库,最终共筛选18个差异代谢物,其中负离子模式下12个,正离子模式下6个,见表3。
3.6.3 差异代谢物的相关通路分析 基于Metabo Analyst 5.0 KEGG进行生物途径分析,筛选潜在的关键代谢通路,结果显示化滞柔肝颗粒主要通过调节氨酰-tRNA生物合成、胆汁分泌、胆固醇代谢等通路来发挥清热利湿、化浊解毒、祛瘀柔肝的功效,见图8。
3.7 肠道菌群与代谢组学关联分析
为进一步探讨肠道菌群与代谢组学是否有相关关系,本实验结合Spearman数据分析方法对模型组和HZRG-H组肠道菌群与代谢组学进行关联分析,结果见图9,HZRG-H组调控肠道菌群的关键菌属为、-6、杜氏乳杆菌属、脱硫弧菌属、,其中、-6属与-哌啶酸、-组氨酸代谢物呈负相关,与牛磺胆酸、神经酸、2()-二十碳烯酸代谢物呈正相关,而杜氏乳杆菌属、脱硫弧菌属、与之相反。

mod-模型组 con-正常组 HZRG-化滞柔肝颗粒高剂量组(图6同) A-门水平上各组物种丰度聚类热图 B-属水平上正常组与模型组样本菌群差异 C-属水平上模型组与HZRG-H组样本菌群差异

图5 各组大鼠肠道菌群LEfSe进化分支图
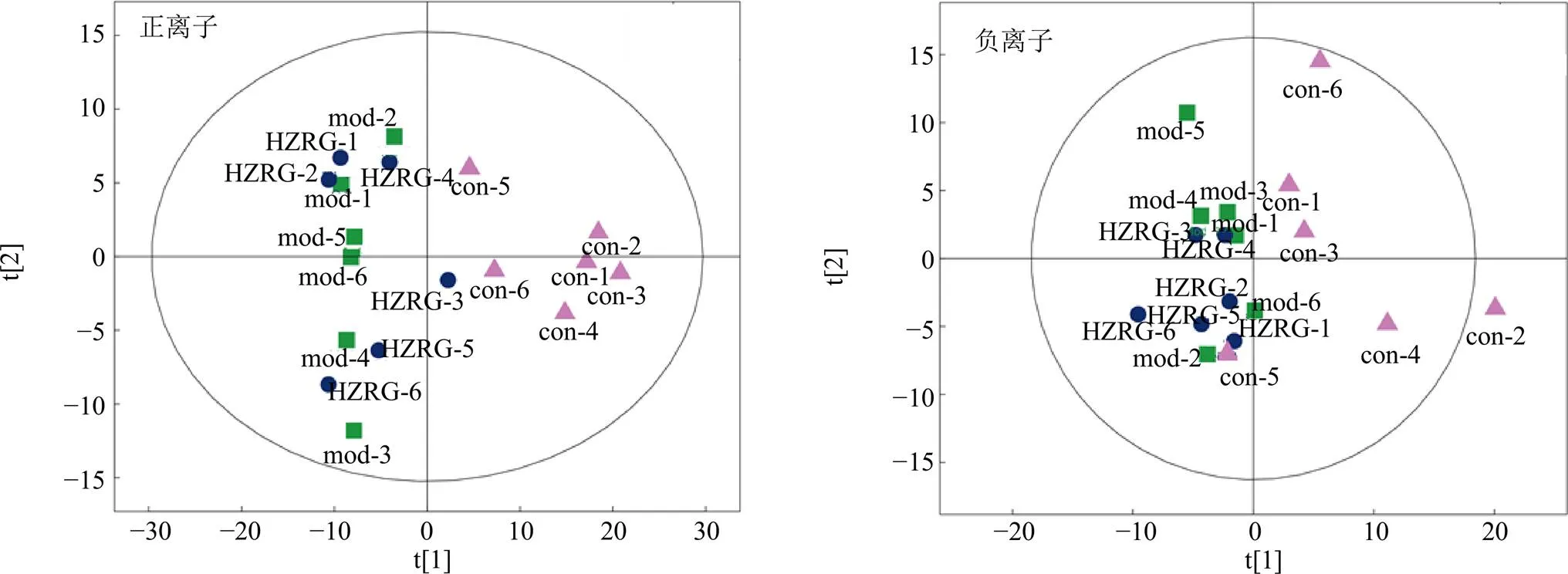
图6 不同离子模式下各组大鼠血浆代谢物的PCA分析
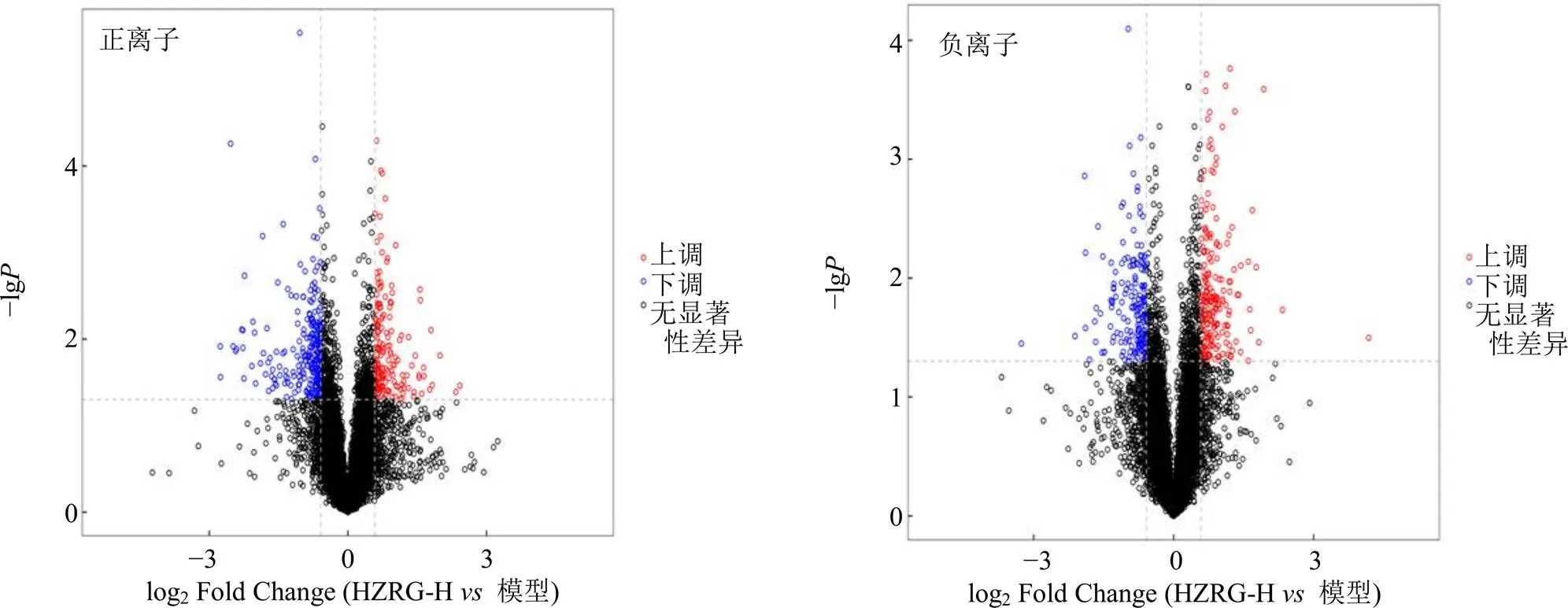
图7 不同离子模式下模型组和HZRG-H组代谢物火山图
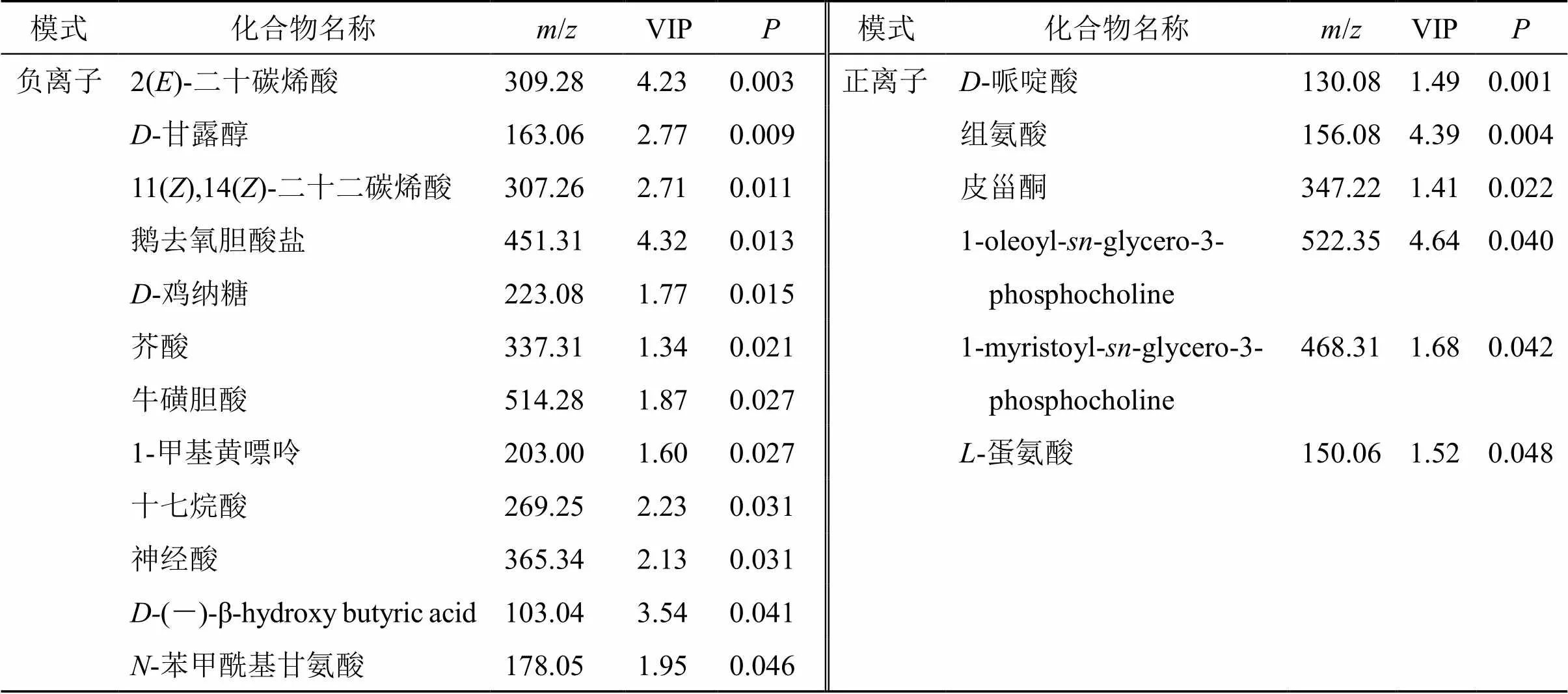
表3 正、负离子模式显著性差异代谢物
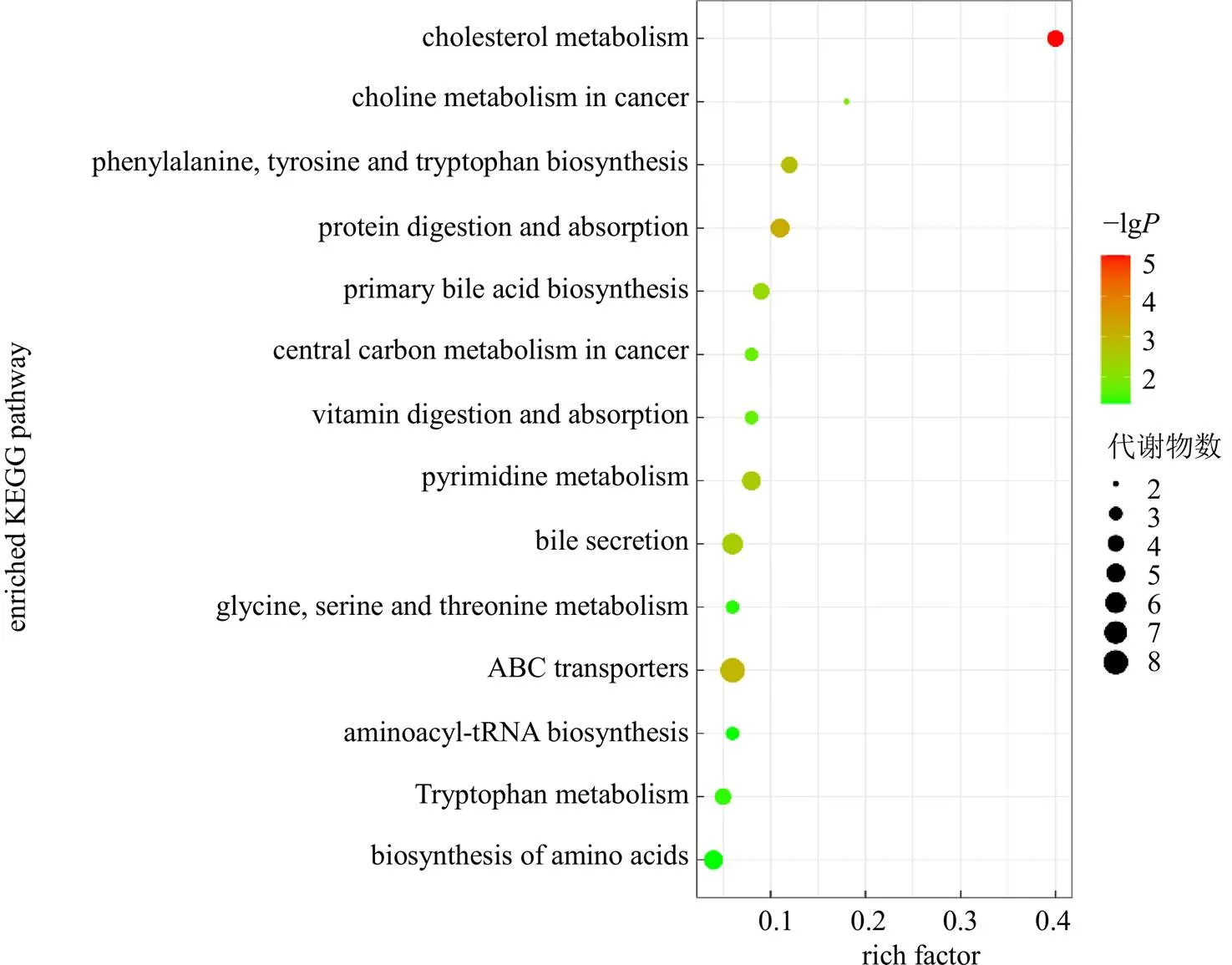
图8 KEGG富集通路图

图9 模型组和HZRG-H组肠道菌群与差异代谢物的相关性热图
4 讨论
中医古书籍中并无NAFLD病名记载,近代医家根据其临床症状将其归属于“肝癖”“肝积”“协痛”“积聚”等范畴[19]。如《圣济总录·癖气》[20]记载:“癖气者、聚于两胁间。有时而痛是也。以其僻在肋下,故名癖气”;《灵枢·百病始生篇》[21]记载:“留而不去,持舍于肠胃之外,募原之间,留著于脉,稽留而不去,息而成积”;《丹溪心法·胁痛》[22]记载:“胁痛,肝火盛,木气实,有死血,有痰流注”。现代医家结合古书籍记载及自身的临床经验,认为NAFLD主要病因与个体体质、饮食不节、劳逸失度、情志失调等有关,且普遍认为NAFLD早期多以肝郁脾虚为主,后期可演变为痰湿内阻、湿热蕴结,进而发展为痰湿阻滞气血循行,最终导致气滞血瘀[23-24]。可见,NAFLD临床多以本虚标实为主要表现,本虚以肝、脾虚为主,标实可见痰湿、气滞、瘀血等因素,最终痰湿瘀互结,瘀阻肝络。
化滞柔肝颗粒由决明子、茵陈、大黄、泽泻、猪苓、山楂、炒苍术、白术、陈皮、瓜蒌、女贞子、墨旱莲、枸杞子、小蓟、柴胡、甘草组成,2017年NAFLD中医诊疗专家共识意见推荐化滞柔肝颗粒用于NAFLD的治疗[25]。研究发现,决明子可通过调控属、双歧杆菌属、黏液真杆菌属相对丰度,改善肠屏障损伤,减少脂质在肝脏的积累及NAFLD引起的肝损伤[26];由大黄、泽泻、白术组成的大黄泽泻汤可提高NAFLD大鼠拟杆菌属、颤螺旋菌属和属的相对丰度,抑制肠道Toll样受体4信号通路,增加肠道紧密连接蛋白表达发挥治疗NAFLD药效[27];枸杞中的枸杞多糖能增加脱铁杆菌门,降低疣微菌门的相对丰度,上调短链脂肪酸水平,从而修复肠道屏障,发挥治疗NAFLD作用[28];茵陈可通过激活p38丝裂原活化蛋白激酶通路,促进自噬进而减少NAFLD小鼠肝脏TG沉积,保护肝细胞,延缓NAFLD的发展[29];山楂中的山楂酸可通过抗炎及抑制氧化应激反应,有效改善高脂饮食诱导的NAFLD小鼠肝脏病变程度[30];女贞子中有效成分女贞子总苷可通过抑制固醇调节元件结合蛋白-1c、肝脏X受体-α和白细胞介素-6蛋白表达,抑制炎性反应,进而调节血脂改善NAFLD[31]。可见,化滞柔肝颗粒可能是通过多组分、多通路发挥治疗NAFLD的药效。值得注意的是,目前化滞柔肝颗粒治疗NAFLD的基础研究较少,有学者[32]采用网络药理学和分子对接技术发现化滞柔肝颗粒通过活性成分槲皮素、山柰酚、木犀草素和汉黄芩素激活核心靶点白细胞介素-6、肿瘤坏死因子、表皮生长因子等蛋白,进而调控糖基化终产物/糖基化终末产物受体信号通路、人巨细胞病毒感染等信号通路来发挥抗NAFLD药效,但未得到进一步验证。因此,本研究联合肠道菌群和代谢组学,明晰化滞柔肝颗粒治疗NAFLD的作用机制。
首先,考察了化滞柔肝颗粒治疗NAFLD的药效。结果显示,给药4周后,与模型组相比,HZRG-H、HZRG-M组可显著降低NAFLD大鼠体质量(<0.05、0.01)。HZRG-H、HZRG-M、HZRG-L组可显著降低NAFLD大鼠TC、TG水平(<0.01),HZRG-H、HZRG-M组可升高HDL-C水平(<0.05、0.01),HZRG-H组还可显著降低LDL-C水平(<0.05),表明化滞柔肝颗粒具有较好的抗NAFLD药效,且呈一定的量效关系。宋立艳等[33]选取88例湿热蕴结型NAFLD患者,分为2组,对照组口服硫普罗宁肠溶片,观察组在此基础上加服化滞柔肝颗粒,给药2月后,发现观察组有效率达93.18%,且TG、TC、HDL-C、LDL-C水平较治疗前及对照组改善更明显,该发现与本研究结果一致。此外,油红O染色显示不同剂量化滞柔肝可有效改善NAFLD大鼠肝脏病理状态,提示化滞柔肝颗粒可有效减少脂滴在大鼠肝脏内聚集。
其次,为了探讨化滞柔肝颗粒治疗NAFLD的作用机制,本研究采用16S rDNA观察化滞柔肝颗粒对NAFLD大鼠肠道菌群的影响。结果显示,与模型组相比,高剂量化滞柔肝颗粒可降低肠道菌群厚壁菌门与拟杆菌门比值,厚壁菌门与拟杆菌门比值是反映肠道菌群紊乱的重要指标[34-35],提示化滞柔肝颗粒可缓解NAFLD引起的肠道菌群紊乱。Liu等[36]发现化滞柔肝颗粒可改变高脂饮食小鼠肠道菌群的组成,降低厚壁菌门与拟杆菌门的比例,这与本研究结果一致。此外,与模型组相比,高剂量化滞柔肝颗粒可显著降低属相对丰度,有学者发现丰度与肝纤维化指标α-平滑肌肌动蛋白和转化生长因子-β呈正相关[37],表明化滞柔肝颗粒可能通过降低的丰度来减少NAFLD相关致病因子水平。值得注意的是,LEfSe分析显示高剂量化滞柔肝颗粒可显著提高大鼠肠道瘤胃球菌属-UCG-010相对丰度。有学者发现瘤胃球菌属与NAFLD相关指标如肝脏质量、血清转氨酶水平、肝脏脂肪变性和炎症程度呈负相关[38],上述研究结果提示化滞柔肝颗粒可能通过改善部分菌群丰度来发挥治疗NAFLD的作用。
再者,本研究结合代谢组学进一步观察化滞柔肝颗粒对NAFLD大鼠体内代谢物的影响。代谢组学结果显示,高剂量化滞柔肝颗粒可上调鹅去氧胆酸盐、牛磺胆酸、神经酸含量,下调-哌啶酸等差异代谢物含量。有研究发现鹅去氧胆酸盐是形成羟甲基戊二酰辅酶A、抑制胆固醇合成的关键物质[39]。牛黄胆酸可缓解高脂饮食诱导的小鼠肝脏脂肪变性、炎症反应、肥胖和胰岛素抵抗[40]。NAFLD的形成与神经酸浓度呈负相关[41]。肠道菌群对膳食-赖氨酸的分解代谢会引起血浆中-哌啶酸水平的升高,进而加重慢性肝病的进展[42]。以上报道结合本研究筛选的差异代谢产物结果,提示化滞柔肝颗粒发挥抗NAFLD药效可能是通过调控多个代谢物共同发挥作用。同时,对上述差异代谢物进行KEGG通路分析,发现化滞柔肝颗粒通过调控胆汁分泌、胆固醇代谢等途径发挥抗NAFLD药效,这为后期深入开展化滞柔肝颗粒治疗NAFLD作用机制提供了研究基础。
最后,为了探讨肠道菌群与代谢产物是否有依存关系,本研究对肠道菌群与代谢组学进行了关联分析。结果表明,给予化滞柔肝颗粒后差异菌杜氏乳杆菌属、脱硫弧菌属与血浆中的代谢物-组氨酸、甘露醇呈显著正相关,与甲基丙二酸呈显著负相关。有研究发现杜氏乳杆菌属的丰度提高可减轻NAFLD大鼠肝脏和脂肪代谢紊乱、减少肝损伤和抑制肝脏炎症细胞因子的释放[43]。脱硫弧菌属可提高硫化氢水平进而触发蛋白激酶B(protein kinase B,Akt)信号通路改善NAFLD[44]。与此同时,关联分析还显示a属与牛磺胆酸呈显著正相关,而属被认为与肠道免疫稳态有关,且属下的与脂肪代谢直接相关[45]。
综上,本研究通过肠道菌群及代谢组学联合分析证实,化滞柔肝颗粒可通过调控NAFLD大鼠肠道菌群脱硫弧菌属、杜氏乳杆菌属、等菌属丰度,进而调控胆固醇代谢、胆汁酸等代谢相关通路来调节肝脏脂质堆积,发挥改善NAFLD作用。总之,本研究不仅为深入研究化滞柔肝颗粒干预NAFLD的作用机制提供依据,同时也为化滞柔肝颗粒的进一步临床应用提供参考。
利益冲突 所有作者均声明不存在利益冲突
[1] Cotter T G, Rinella M. Nonalcoholic fatty liver disease 2020: The state of the disease [J]., 2020, 158(7): 1851-1864.
[2] Pierantonelli I, Svegliati-Baroni G. Nonalcoholic fatty liver disease: Basic pathogenetic mechanisms in the progression from NAFLD to NASH [J]., 2019, 103(1): e1-e13.
[3] Younossi Z M, Koenig A B, Abdelatif D,. Global epidemiology of nonalcoholic fatty liver disease-Meta-analytic assessment of prevalence, incidence, and outcomes [J]., 2016, 64(1): 73-84.
[4] Vernon G, Baranova A, Younossi Z M. Systematic review: The epidemiology and natural history of non-alcoholic fatty liver disease and non-alcoholic steatohepatitis in adults [J]., 2011, 34(3): 274-285.
[5] Petersen K F, Dufour S, Feng J,. Increased prevalence of insulin resistance and nonalcoholic fatty liver disease in Asian-Indian men [J]., 2006, 103(48): 18273-18277.
[6] 闫冰冰, 晁旭, 冯雪松, 等. 非酒精性脂肪性肝病发病机制的研究进展 [J]. 海南医学院学报, 2021, 27(12): 956-960.
[7] Zhou F, Zhou J H, Wang W X,. Unexpected rapid increase in the burden of NAFLD in China from 2008 to 2018: A systematic review and meta-analysis [J]., 2019, 70(4): 1119-1133.
[8] Rafiq N, Bai C H, Fang Y,. Long-term follow-up of patients with nonalcoholic fatty liver [J]., 2009, 7(2): 234-238.
[9] Li X, Ge J D, Li Y J,. Integrative lipidomic and transcriptomic study unravels the therapeutic effects of saikosaponins A and D on non-alcoholic fatty liver disease [J]., 2021, 11(11): 3527-3541.
[10] 徐京杭. 多烯磷脂酰胆碱在肝病临床应用的专家共识 [J]. 中华实验和临床感染病杂志: 电子版, 2017, 11(4): 313-319.
[11] Carr R M, Oranu A, Khungar V. Nonalcoholic fatty liver disease: Pathophysiology and management [J]., 2016, 45(4): 639-652.
[12] Musso G, Gambino R, Cassader M,. A Meta-analysis of randomized trials for the treatment of nonalcoholic fatty liver disease [J]., 2010, 52(1): 79-104.
[13] Lewis J D, Ferrara A, Peng T,. Risk of bladder cancer among diabetic patients treated with pioglitazone: Interim report of a longitudinal cohort study [J]., 2011, 34(4): 916-922.
[14] Schürks M, Glynn R J, Rist P M,. Effects of vitamin E on stroke subtypes: Meta-analysis of randomised controlled trials [J]., 2010, 341: c5702.
[15] Klein E A, Thompson I M Jr, Tangen C M,. Vitamin E and the risk of prostate cancer: The selenium and vitamin E cancer prevention trial (SELECT) [J]., 2011, 306(14): 1549-1556.
[16] 文晓玲, 张海浪. 多烯磷脂酰胆碱不良反应文献分析 [J]. 中国药物警戒, 2020, 17(8): 526-530.
[17] 于洋, 钱丽旗, 侯鹏, 等. 化滞柔肝颗粒治疗非酒精性脂肪性肝病疗效观察 [J]. 现代中西医结合杂志, 2014, 23(21): 2302-2304.
[18] 王杰, 隗鑫, 陈威, 等. 代谢组学技术在中药复方配伍规律研究中的应用 [J]. 中草药, 2022, 53(5): 1528-1539.
[19] 朱振红, 郭朋, 唐旭东, 等. 脂肪肝从毒论治 [J]. 辽宁中医杂志, 2014, 41(12): 2568-2570.
[20] 钟郁萱. 基于数据挖掘的刘汶教授治疗非酒精性脂肪性肝病回顾性研究[J]. 北京中医药大学, 2021.
[21] 王洪图, 贺娟. 黄帝内经灵枢白话解 [M]. 第2版. 北京: 人民卫生出版社, 2014: 244.
[22] 元·朱震亨. 丹溪心法 [M]. 北京: 人民卫生出版社, 2005: 231.
[23] 王乾皓. 中药代茶饮干预非酒精性脂肪性肝病(湿热蕴结证)的临床疗效观察 [D]. 北京: 北京中医药大学, 2021.
[24] 张春花. 非酒精性单纯性脂肪肝患者体质与出生时期五运六气的规律探究 [D]. 北京: 北京中医药大学, 2021.
[25] 张声生, 李军祥. 非酒精性脂肪性肝病中医诊疗专家共识意见(2017) [J]. 临床肝胆病杂志, 2017, 33(12): 2270-2274.
[26] Luo H Y, Wu H W, Wang L X,. Hepatoprotective effects ofon mice with non-alcoholic fatty liver disease based on gut microbiota [J]., 2021, 4(1): 1357.
[27] Fang J, Sun X Q, Xue B Y,. Dahuang Zexie Decoction protects against high-fat diet-induced NAFLD by modulating gut microbiota-mediated toll-like receptor 4 signaling activation and loss of intestinal barrier [J]., 2017, 2017: 2945803.
[28] Gao L L, Ma J M, Fan Y N,.polysaccharide combined with aerobic exercise ameliorated nonalcoholic fatty liver disease through restoring gut microbiota, intestinal barrier and inhibiting hepatic inflammation [J]., 2021, 183: 1379-1392.
[29] 贾宁, 邵珊珊, 陈文斌, 等. 茵陈对非酒精性脂肪肝小鼠肝脏脂质沉积及p38 MAPK、p62/LC3表达的影响 [J]. 现代中西医结合杂志, 2021, 30(3): 229-235, 277.
[30] 何峰, 张雪莲, 温祥臣. 山楂酸对高脂饮食诱导的非酒精性脂肪肝模型小鼠炎症反应及氧化应激的影响 [J]. 中国药房, 2019, 30(7): 901-905.
[31] Yang N Y, Zhang Y W, Guo J M. Preventive effect of total glycosides fromagainst nonalcoholic fatty liver in mice [J]., 2015, 70(9/10): 237-241.
[32] 刘莹莹, 张景媛, 谭影影, 等. 基于网络药理学和分子对接技术的化滞柔肝颗粒治疗非酒精性脂肪性肝病的作用机制研究 [J]. 中国医院用药评价与分析, 2022, 22(4): 395-400, 406.
[33] 宋立艳, 袁庆丰. 化滞柔肝颗粒治疗湿热蕴结型非酒精性脂肪肝44例 [J]. 浙江中医杂志, 2022, 57(4): 253-254.
[34] Vaiserman A, Romanenko M, Piven L,. Differences in the gut Firmicutes to Bacteroidetes ratio across age groups in healthy Ukrainian population [J]., 2020, 20(1): 221.
[35] Nicholson J K, Holmes E, Kinross J,. Host-gut microbiota metabolic interactions [J]., 2012, 336(6086): 1262-1267.
[36] Liu Y Y, Tan Y Y, Huang J Q,. Revealing the mechanism of Huazhi Rougan Granule in the treatment of nonalcoholic fatty liver through intestinal flora based on 16S rRNA, metagenomic sequencing and network pharmacology [J]., 2022, 13: 875700.
[37] Yamamoto K, Honda T, Yokoyama S,. Microbiome, fibrosis and tumor networks in a non-alcoholic steatohepatitis model of a choline-deficient high-fat diet using diethylnitrosamine [J]., 2021, 53(11): 1443-1450.
[38] Milton-Laskibar I, Cuevas-Sierra A, Portillo M P,. Effects of resveratrol administration in liver injury prevention as induced by an obesogenic diet: Role of Ruminococcaceae [J]., 2022, 10(8): 1797.
[39] Broughton G 2nd. Chenodeoxycholate: the bile acid. The drug. A review [J]., 1994, 307(1): 54-63.
[40] Wang W J, Zhao J F, Gui W F,. Tauroursodeoxycholic acid inhibits intestinal inflammation and barrier disruption in mice with non-alcoholic fatty liver disease [J]., 2018, 175(3): 469-484.
[41] Konstantynowicz-Nowicka K, Berk K, Chabowski A,. High-fat feeding in time-dependent manner affects metabolic routes leading to nervonic acid synthesis in NAFLD [J]., 2019, 20(15): 3829.
[42] Fujita T, Amuro Y, Hada T,. Plasma levels of pipecolic acid, both L- and D-enantiomers, in patients with chronic liver diseases, especially hepatic encephalopathy [J]., 1999, 287(1/2): 99-109.
[43] Hu M Y, Zhang L, Ruan Z,. The regulatory effects ofpeel powder on liver metabolites and gut flora in mice with non-alcoholic fatty liver disease (NAFLD) [J]., 2021, 10(12): 3022.
[44] Chen L, Gao Y S, Zhao Y J,. Chondroitin sulfate stimulates the secretion of H2S byto improve insulin sensitivity in NAFLD mice [J]., 2022, 213: 631-638.
[45] Depommier C , Hul MV , Everard A ,. Pasteurizedincreases whole-body energy expenditure and fecal energy excretion in diet-induced obese mice[J]., 2020, 11(5):1231-1245.
Mechanism of Huazhi Rougan Granule in treatment of non-alcoholic fatty liver disease based on intestinal flora and metabolomics
ZHU Chun-sheng, SHI Ya-min, FU Zhi-hui, YU Dong-sheng, BIAN Meng, NIE An-zheng, LI Xiao-ping
The First Affiliated Hospital of Zhengzhou University, Zhengzhou 450052, China
To investigate the mechanism of Huazhi Rougan Granule (化滞柔肝颗粒) in treatment of non-alcoholic fatty liver disease (NAFLD).Rats were fed a high-fat diet for eight weeks to establish a NAFLD model, and Huazhi Rougan Granules were administered intragastrically for four weeks. The semi-automatic biochemical analyzer was used to determine the blood lipid-related indicators in rats; Oil red O was used to observe the pathological changes of liver tissue; The Illumina Miseq sequencing platform was used to amplify and sequence the V3—V4 variable region, and UPLC-MS/MS was used to research plasma metabolomics. The correlation between intestinal flora and metabolomics was analyzed by Spearman.Compared with model group, the body weight (< 0.05, 0.01) and serum level of total cholesterol (TC) and triacylglycerol (TG) (< 0.01) of rats were significantly decreased and high density lipoprotein cholesterol (HDL-C) of rats was significantly increased (< 0.05, 0.01) in Huazhi Rougan Granule medium and high dose groups. In addition, low density lipoprotein cholesterol (LDL-C) of rats was also significantly decreased in Huazhi Rougan Granule high dose group (< 0.05). Oil red O staining showed that the fat distribution in each administration group was lower than that of the model group. 16S rDNA sequencing showed that Huazhi Rougan Granule could increase the relative abundance of,, Ruminococcaceae-UCG-010 bacteria in NAFLD model rats. A total of 18 differential metabolites were identified by metabolomics, pathway analysis showed that the anti-NAFLD effects of Huazhi Rougan Granules was mainly through the regulation of aminoacyl-tRNA biosynthesis, bile secretion, cholesterol metabolism and other pathways.The mechanism of Huazhi Rougan Granules improving NAFLD may be related to the regulation of intestinal flora composition, cholesterol metabolism and other related metabolic pathways.
Huazhi Rougan Granule; non-alcoholic fatty liver disease; intestinal flora; metabolomics; cholesterol metabolism
R285
A
0253 - 2670(2023)04 - 1190 - 11
10.7501/j.issn.0253-2670.2023.04.019
2022-11-12
河南省医学科技攻关计划联合共建项目(LHGJ20190273);郑州大学第一附属医院横向课题(K2020-0004)
朱春胜,男,硕士,主管药师,研究方向为中药防治代谢性疾病。E-mail: zhuchunsheng6@163.com
李晓萍,女,主任药师,从事医院药学管理和中药临床药学研究。Tel: (0371)66278520 E-mail: lixiaoping630209@163.com
[责任编辑 潘明佳]

