阿卡宁下调Trx/Akt通路诱导急性髓系白血病细胞凋亡的作用研究
徐宏宏,昌 潇,罗 琼,张 波, 2*
阿卡宁下调Trx/Akt通路诱导急性髓系白血病细胞凋亡的作用研究
徐宏宏1,昌 潇1,罗 琼1,张 波1, 2*
1. 石河子大学药学院,新疆植物药资源利用教育部重点实验室,新疆 石河子 832002 2. 成都大学药学院,四川抗菌素工业研究所,四川 成都 610106
探讨新疆紫草代表成分阿卡宁对急性髓系白血病细胞HL-60的抑制作用及机制。取对数生长期HL-60细胞,采用台盼蓝法检测阿卡宁、紫草素处理后的细胞增殖抑制率;Hoechst 33258染色观察细胞形态;流式细胞仪检测细胞凋亡率;通过系统药理学方法筛选出阿卡宁以及急性髓系白血病(acute myeloid leukemia,AML)的共同靶点并分析得到关键靶点。通过邻苯二甲醛(o-phthalaldehyde,OPA)荧光探针法、差示扫描荧光分析实验在体外分子水平验证化合物与靶点的结合能力。通过Western blotting检测凋亡通路标志分子半胱氨酸天冬氨酸蛋白酶-3(cystein-asparate protease-3,Caspase-3)、cleaved Caspase-3、B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)、Bcl-2相关X蛋白(Bcl-2 associated X protein,Bax)蛋白表达。阿卡宁呈剂量相关性抑制HL-60细胞增殖。Hoechst染色后荧光显微镜下可见阿卡宁处理后的HL-60细胞呈现细胞缩小、染色质颜色加深、染色质逐渐碎片化等的凋亡形态;与对照组比较,阿卡宁诱导的细胞凋亡率显著升高(<0.001),Bcl-2蛋白表达水平显著下调(<0.01),Bax、cleaved Caspase-3蛋白表达水平均显著上调(<0.01、0.001);通过系统药理学筛选得到阿卡宁和AML共有靶点96个,对共有靶点分析得到蛋白质-蛋白质相互作用网络(protein-protein interaction,PPI)中度值较高的靶点是蛋白激酶B(protein kinase B,Akt)、半胱氨酸天冬氨酸蛋白酶-3(cystein-asparate protease-3,CASP3)、细胞色素C(cytochrome C,CYCS)、硫氧还蛋白还原酶(thioredoxin reductase,TXNRD)等。基因本体(gene ontology,GO)功能和京都基因与基因百科全书(Kyoto encyclopedia of genes and genomes,KEGG)通路分析表明阿卡宁治疗AML主要涉及RNA聚合酶II启动子转录的正调控、细胞凋亡过程的正调控及信号转导等生物学过程,涉及的分子功能有蛋白结合、氧化还原酶活性,信号通路主要包括癌症相关信号通路。共价对接结果表明,阿卡宁与硫氧还蛋白(thioredoxin,Trx)活性位点半胱氨酸形成共价键。体外分子水平结果显示阿卡宁可以与谷胱甘肽(glutathione,GSH)、Trx结合。Western blotting结果显示阿卡宁可显著下调Trx、Akt、p-Akt的表达(<0.05、0.001)。阿卡宁诱导HL-60细胞凋亡,其机制与下调Trx/Akt通路有关。
紫草;阿卡宁;凋亡;Trx/Akt通路;巯醇;急性髓系白血病细胞
白血病作为血液肿瘤,是恶性程度最高、治疗方法最棘手、愈后易复发的血液疾病[1]。最新国家儿童肿瘤监测报告显示白血病仍是儿童患病人群最多的重大恶性疾病,占比57.1%。而白血病中急性髓系白血病(acute myelocytic leukemia,AML)成人发病率最高,儿童位居第2,占儿童白血病死亡率50%以上。目前AML的临床治疗手段有造血干细胞移植、化疗、放疗、免疫治疗、靶向药物治疗等[2]。化疗是首选方法,但AML患者在初次诱导治疗后难以治愈且易复发[3]。因此,寻找新的治疗方法和治疗靶点,以提高患者的顺应性和生活质量至关重要。
阿卡宁是从紫草Sieb. et Zucc.的根部提取而来的天然产物,是紫草的主要的活性成分之一。阿卡宁具有多种生物活性,其中抗癌活性引起广泛关注。据报道,阿卡宁对乳腺癌MCF-7细胞、白血病K562细胞、前列腺癌DU145细胞等多种肿瘤细胞均有抑制作用[4]。研究表明,紫草中的另一个主要活性成分紫草素对慢性髓系白血病K562、CLL细胞以及B细胞前淋巴白血病JVM-13细胞、急性髓系早幼粒白血病NB4细胞等白血病细胞、人急性髓系白血病细胞HL-60均有抑制作用[5-9]。根据美国国立癌症研究(National cancer institut 60,NCI60)数据库显示紫草素对HL60细胞最为敏感,紫草素的这一特点为本研究提供了抗AML药物的结构基础。作为紫草素的异构体,阿卡宁对AML的作用鲜有报道。因此本研究以HL-60细胞为模型探究阿卡宁的药效及相关机制。
1 材料
1.1 细胞株
HL-60细胞购自中国科学院典型培养物保藏委员会细胞库/中国科学院上海生命科学研究院细胞资源中心。
1.2 药品与试剂
阿卡宁(质量分数≥98%,批号T31290)购自上海源叶生物科技有限公司;紫草素(质量分数≥98%,批号3275584)购自EMD Millipore公司;胎牛血清(批号2033119)购自以色列BI公司;1%青霉素链霉素混合液(批号10378016)、IMDM培养基(批号12200069)购自美国Gibco公司;AnnexinⅤ-FITC/碘化丙啶(PI)试剂盒(批号A10642)购自杭州联科生物技术股份有限公司;蛋白激酶B(protein kinase B,Akt)抗体(批号9272S)、p-Akt抗体(批号4060T)、半胱氨酸天冬氨酸蛋白酶-3(cystein-asparate protease-3,Caspase-3)抗体(批号9665S)、cleaved Caspase-3抗体(批号9664S)购自美国CST公司;硫氧还蛋白(thioredoxin,Trx)抗体(批号ab109385)购自英国Abcam公司;B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)抗体(批号ZP76488P48)、Bcl-2相关X蛋白(Bcl-2 associated X protein,Bax)抗体(批号13CM400B)购自武汉博士德生物工程有限公司;β-actin抗体(批号211050331)购自北京全式金生物公司;羊抗兔IgG二抗(批号133499)、羊抗鼠IgG二抗(批号219760401)购自中杉金桥生物技术有限公司。
1.3 仪器
313型CO2细胞培养箱(美国Thermo公司);ZHJH 1112B型超净工作台(上海智诚分析仪器有限公司);BDS200-PH型倒置生物显微镜(重庆奥特光学仪器有限公司);Imager.M2型正置荧光显微镜(德国ZEISS公司);5424型低温离心机(德国Eppendorf公司);FACS-Calibur型流式细胞仪(美国BD公司);Q5000型超微量核酸蛋白测定仪(美国Quawell公司)。
2 方法
2.1 体外细胞水平药效
2.1.1 细胞培养及细胞抑制率的测定 细胞培养于含20%胎牛血清、1%青霉素链霉素混合液的IMDM培养液中,在37 ℃、5% CO2饱和湿度的培养箱中培养。取生长状态良好的细胞以5×105个/孔接种于6孔板中,培养液总体积为2 mL。分别加入不同浓度的阿卡宁、紫草素,药物终浓度分别为0、0.25、0.5、1、2、4 μmol/L,每组设3个复孔,37 ℃培养。紫草素作用24 h后终止培养,阿卡宁分别培养24、48、72 h后终止培养。每孔细胞吹匀后,取20 µL细胞液与20 µL 0.4%台盼蓝混合,使用计数板进行计数,计算细胞抑制率[10]。
细胞抑制率=1-给药组活细胞数/对照组活细胞数
2.1.2 Hoechst 33258染色 细胞培养结束后,收集细胞,离心去培养液,加入4%多聚甲醛固定液固定10 min,离心去固定液,用PBS洗3遍,最后吸去大部分液体保留约50 μL液体,缓缓悬起细胞,滴加至载玻片上,尽量使细胞分布均匀。稍晾干,使细胞贴在载玻片上不易随液体流动均匀滴加Hoechst 33258染液,染色5 min。用吸水纸吸去边缘液体,微晾干,用PBS洗2遍,盖上盖玻片于荧光显微镜下观察。
2.1.3 流式细胞术检测细胞凋亡率 取对数生长期的HL-60细胞,调整细胞密度为5×105个,分别加入终浓度为0、0.5、1、2 μmol/L的阿卡宁及1 μmol/L的紫草素,孵育24 h后收集细胞。细胞收集后用冷PBS洗2次,加入500 μL Binding Buffer悬浮细胞,分别加入5 μL Annexin V混匀,室温避光反应5~15 min。上机前加入5 μL PI,1 h内采用流式细胞仪检测,利用Flow Jo软件分析数据。
2.1.4 Western blotting法检测蛋白表达 HL-60细胞经0、0.5、1、2 μmol/L阿卡宁处理24 h后,用4 ℃预冷的PBS洗2遍,加入250 μL RIPA细胞裂解液,冰上裂解30 min,4 ℃、12 000 r/min离心10 min,取上清。蛋白测定仪测定蛋白浓度,蛋白经煮沸处理后,蛋白样品经10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至PVDF膜,脱脂奶粉封闭1h后,分别加入Caspase-3、cleaved Caspase-3、Bcl-2、Bax、Trx、Akt、p-Akt抗体,4 ℃孵育过夜;次日以TBST洗膜4次,每次5 min洗去一抗,加入二抗,室温孵育1 h;以TBST洗膜4次,每次5 min洗去二抗,加入ECL显色液,经免疫印迹成像系统显影检测目的蛋白[11],利用Image J软件进行蛋白条带灰度分析。
2.2 体外分子水平药物-靶点互作
2.2.1 邻苯二甲醛荧光(o-phthalaldehyde,OPA)法[12]测定谷胱甘肽(glutathione,GSH)结合特征 向96孔板中加入终浓度分别为0.1、1、10、100、1000 μmol/L的阿卡宁,随后加入等体积终浓度为1000 μmol/L的GSH溶液,震荡混匀后,室温孵育4 h。随后每孔加入10 µL OPA溶液,震荡混匀,室温避光孵育40 min。采用酶标仪于340 nm激发波长、420 nm发射波长测定荧光强度,计算GSH结合率。
GSH结合率=给药组荧光值/对照组荧光值
2.2.2 差示扫描荧光法[13]测定蛋白巯醇结合特征 将在PBS中的蛋白样品(2 mg/mL)在Rotor-Gene中以20 μL的反应体积孵育。终浓度为1.5、3、6 μmol/L的阿卡宁分别与硫氧还蛋白在37 ℃孵育0、4、6 h。Sypro Orange稀释25倍。将样品从35 ℃加热到60 ℃,以1 ℃为增量进行荧光采集。使用Rotor-Gene上的高分辨率熔解(HRM)通道获取荧光测量结果。
2.3 系统药理学[14]分析
2.3.1 阿卡宁及AML相关靶点的收集 利用Batman-TCM(http://bionet.ncpsb.org.cn/batman-tcm/index.php)数据库获取阿卡宁的相关靶点,删除重复靶点信息,选取score值大于2.394的靶点。利用GeneCards(https://www.genecards.org/)、OMIM(https://omim.org/)、Disgenet(https://www.disgenet. org/)数据库,以AML为词条获得AML相关靶点,删除重复靶点后选择score值大于2.37的靶点进行后续分析[15-16]。
2.3.2 阿卡宁及AML相关靶点蛋白质-蛋白质相互作用(protein-protein interaction,PPI)网络构建及分析 将阿卡宁及AML的靶点输入Venn(http://www.bioinformatics.com.cn/static/others/jvenn/ example.html)数据库得到化合物-疾病共同靶点,将共同靶点导入String数据库以获得PPI,设置条件物种为人源、置信分数为高置信度。将筛选得到的PPI信息导出,输入到Cytoscape以实现可视化。以不同的节点表示靶点,用节点的度值进行评估。度值是指以靶点为节点,与其他节点相连的线数量。线数量越多,节点度值越高,节点越大节点颜色越深,该节点越重要。
2.3.3 基因本体(gene ontology,GO)功能和京都基因与基因百科全书(Kyoto encyclopedia of genes and genomes,KEGG)通路富集分析 将共同靶点导入DAVID 6.8(https://david.ncifcrf.gov/tools.jsp)数据库中的基因列表,选择基因名称“OFFICIAL GENE SYMBOL”形式,设置物种为“Homo sapiens”,进行GO功能和KEGG通路分析,将信息导出,上传至Bioinformatics(http://www. bioinformatics.com.cn/)在线数据分析可视化平台进行绘图。
2.3.4 阿卡宁活性位点预测 通过PubChem获得阿卡宁结构,将结构上传至QSAR(OECD QSAR Tool Box-DPRA Cystine Peptide,3.2.0,2013),选择DPRA Cysteine peptide模块以预测阿卡宁消耗巯基的活性部位。DPRA Cysteine peptide的原理为从已被实验验证过具有消耗半胱氨酸的112个化合物中提取32个具有消耗巯基的特征结构构建训练集,与待测化合物比对,若一致则认定具有消耗巯基的性质。
2.3.5 共价对接 人Trx的晶体结构获取自蛋白质数据库(PDB ID:4PUF),使用Schrödinger 2022-1套装软件中的蛋白质制备工具(ProPrep)制备蛋白质结构。通过具有优化氢键网络的Maestro中的PROPKA工具在pH 7.0添加氢原子。赋予OPLS-2005力场并对蛋白结构进行能量优化,将晶体结构中的所有配体都提取出来。配体阿卡宁的结构在PubChem中获得并经过LigPrep进行准备,使用OPLS-2005在pH 7.0下生成低能构象。使用Glide Docking模块进行共价对接。以Cys32和Cys35作为共价对接的反应残基,选择对接反应为迈克尔加成,使用PyMOL对对接结果进行可视化。
2.4 统计学分析

3 结果
3.1 阿卡宁、紫草素对HL-60细胞增殖的影响
台盼蓝拒染法检测阿卡宁及紫草素对HL-60细胞增殖的影响,结果如图1所示,阿卡宁及紫草素均能明显抑制HL-60细胞增殖,随着浓度的增加,阿卡宁、紫草素对细胞增殖的抑制率逐渐升高,呈剂量相关性。分析得出阿卡宁对HL-60细胞24、48、72 h的半数抑制浓度(median inhibition concentration,IC50)分别为(1.68±0.16)、(1.25±0.02)、(1.24±0.02)μmol/L,紫草素作用HL-60细胞24 h的IC50为(0.74±0.01)μmol/L,阿卡宁作用HL-60细胞24 h的IC50高于紫草素,说明二者的抑制作用有差异。48 h和72 h时抑制结果接近,且在2 μmol/L时阿卡宁的抑制率急剧上升,说明阿卡宁作用时间延长时作用窗口变窄。2 μmol/L阿卡宁作用HL-60细胞24 h后对其增殖的抑制率就已达到50%以上,因此选择0.5、1、2 μmol/L阿卡宁进行后续实验,1 μmol/L紫草素作用HL-60细胞24 h的抑制率达到68.22%,因此选择1 μmol/L紫草素作为阳性对照。
3.2 阿卡宁对HL-60细胞形态及核形态的影响
如图2所示,对照组细胞核呈均匀的淡蓝色荧光且细胞呈饱满的类圆形形态,经0.5 μmol/L的阿卡宁处理后部分细胞核呈亮蓝色,说明细胞核浓缩。1 μmol/L的阿卡宁处理后细胞体积变小,染色质高度浓集成亮蓝色,2 μmol/L时可见细胞染色质更多的呈现分叶状、碎片状等细胞凋亡下的核形态。
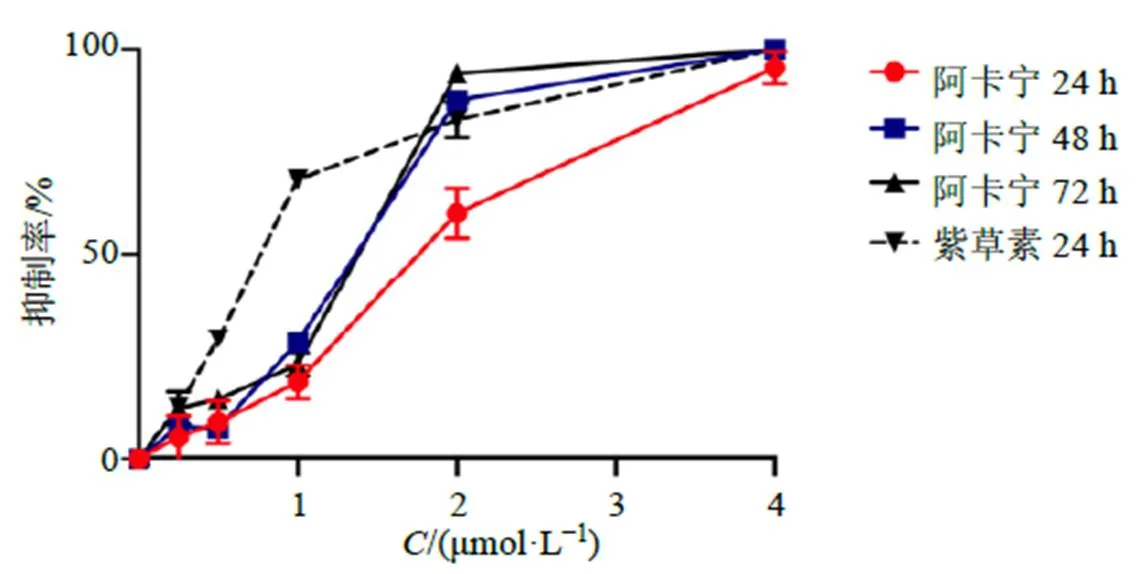
图1 阿卡宁及紫草素对HL-60细胞增殖的影响(, n = 3)

图2 阿卡宁对HL-60细胞核形态的影响
3.3 阿卡宁、紫草素诱导HL-60细胞凋亡
如图3所示,阿卡宁处理HL-60细胞24 h后,细胞凋亡率随着给药浓度的增加而增加,呈剂量相关性。0、0.5、1、2 μmol/L的阿卡宁处理后的细胞凋亡率以及1 μmol/L紫草素处理后的凋亡率分别为(0.12±0.04)%、(13.50±2.87)%、(25.32±4.84)%、(29.68±1.48)%、(57.77±11.03)%。与对照组比较,1、2 μmol/L阿卡宁处理后的细胞凋亡率均显著升高(<0.001),2 μmol/L阿卡宁组细胞坏死明显增多,紫草素诱导的细胞凋亡率明显高于阿卡宁。

与对照组比较:*P<0.05 **P<0.01 ***P<0.001,图4、12同
3.4 阿卡宁对HL-60细胞凋亡相关蛋白表达的影响
如图4所示,与对照组比较,0.5、1、2 μmol/L 阿卡宁处理24 h后,细胞cleaved Caspase-3蛋白表达显著上调(<0.001);1、2 μmol/L阿卡宁处理24 h后,Bax蛋白表达水平显著上调(<0.01、0.001),Bcl-2表达显著下调(<0.01)。表明阿卡宁可以通过影响凋亡蛋白的表达而诱导HL-60细胞凋亡。
3.5 阿卡宁抗AML靶点的PPI网络构建及分析
将获取的阿卡宁和AML的相关靶点取交集,得到96个阿卡宁作用AML的潜在靶点见图5。将交集靶点上传至String数据库得到靶点相互作用关系,通过Cytoscape可视化及分析后发现关键节点主要有Akt、细胞色素C(cytochrome c,CYCS)、半胱氨酸天冬氨酸蛋白酶-3(cystein-asparate protease-3,CASP3)、硫氧还蛋白还原酶(thioredoxin reductase,TXNRD)等(图6)。

图4 阿卡宁对HL-60细胞凋亡相关蛋白表达的影响(, n = 3)

图5 阿卡宁和AML靶点Venn图

图6 阿卡宁和AML共同靶点的PPI网络
3.6 阿卡宁作用AML的潜在靶点GO功能和KEGG通路富集分析
GO功能分析共得生物过程(biological process,BP)285个条目(<0.05)、细胞组分(cellular component,CC)55个条目(<0.05)、分子功能(molecular function,MF)87个条目(<0.05),按值排序,选取排名前20的条目可视化,结果如图7所示,阿卡宁治疗AML主要涉及RNA聚合酶II启动子转录的正调控、细胞凋亡过程的正调控及信号转导等BP,涉及的MF有蛋白结合、氧化还原酶活性。KEGG通路富集分析共得79条信号通路按值排序,选取排名前20的条目可视化,结果如图8所示,气泡的大小表示包含的基因数的多少,颜色由蓝到绿表示该通路值由小到大。分析富集的通路发现,主要有癌症相关信号通路等。
3.7 阿卡宁可与巯基肽及蛋白结合
经QSAR巯基消耗活性预测,阿卡宁具有巯基消耗特性,活性部位为图9-A所示的红色区域,进一步对阿卡宁与巯基蛋白Trx进行共价对接,结果显示阿卡宁可以与Trx的第32位半胱氨酸残基形成共价键(图9-B、C所示)。随后在分子水平验证阿卡宁与巯基的结合能力,结果如图10所示,阿卡宁可以与巯基GSH结合且呈现浓度相关性。通过差示扫描荧光分析实验可知,3、6 μmol/L阿卡宁与Trx及荧光染料分别共孵育4、6 h后蛋白质被打开所需的温度(melting temperature,m)均上升0.5 ℃,说明阿卡宁可以与Trx结合(图11)。
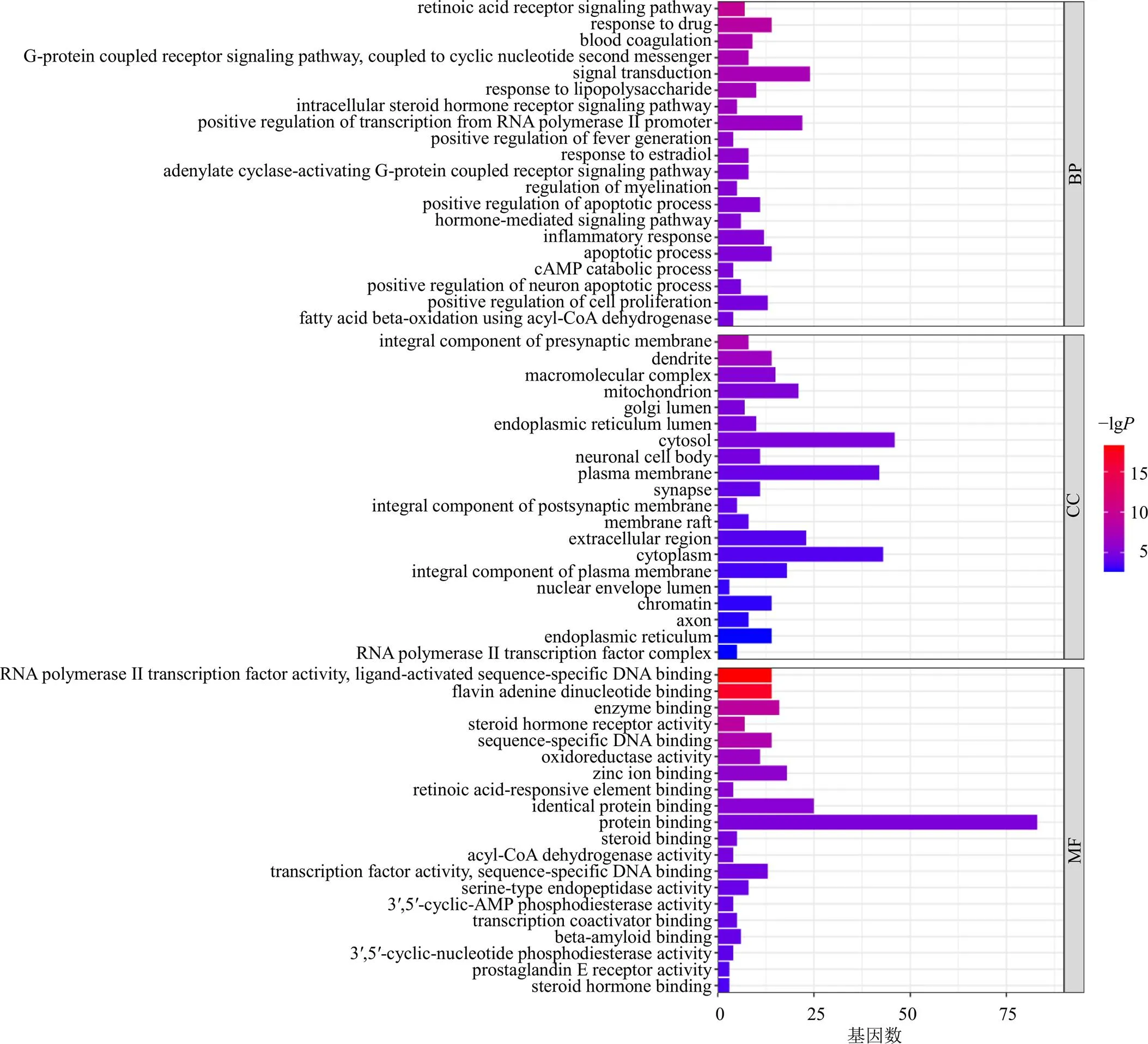
图7 GO功能富集分析

图8 KEGG通路富集分析

图9 QSAR预测阿卡宁巯基消耗结构 (红色部分,A)、阿卡宁与Trx结合的3D图(B) 和3D surface图(C)

图10 阿卡宁与GSH的结合率
3.8 阿卡宁对HL-60细胞Trx/Akt信号通路相关蛋白表达的影响
如图12所示,阿卡宁处理HL-60细胞24 h后,细胞内Trx、Akt、p-Akt蛋白表达逐渐减少,呈现剂量相关性。与对照组比较,阿卡宁(0.5、1、2 μmol/L)组Trx蛋白表达水平显著降低(<0.05、0.001),阿卡宁(0.5 μmol/L)组p-Akt蛋白表达水平显著降低(<0.001),阿卡宁(1 μmol/L)组Akt蛋白表达水平显著降低(<0.05),表明阿卡宁可能通过抑制Trx而影响Akt的表达及磷酸化。

图11 1.5、3、6 μmol·L−1阿卡宁与Trx和Sypro-Orange反应0、4、6 h后熔解温度变化

图12 阿卡宁对HL-60细胞Trx/Akt通路相关蛋白表达的影响(, n = 3)
4 讨论
AML是由造血干细胞异常克隆导致的具有生物学特性高度异质性的恶性血液疾病。用于AML的标准强化化疗(结合蒽环类和阿糖胞苷)已经使用了很多年。尽管近年来已经发现许多新的治疗AML的分子靶点及化合物,为许多患者提供了个性化的治疗选择[17],但AML患者高复发率和预后差这些问题依然存在[18]。因此寻找新的抗AML的化合物可以为全面治疗AML提供更多选择。
天然产物是治疗药物的重要来源,在癌症治疗中受到越来越多的关注。新疆紫草清热凉血的功效认识由来已久,近年来研究人员发现紫草质量标志物的萘醌化合物中紫草素具有优良的抗白血病活性[19],作为紫草素的立体异构体阿卡宁在白血病中的作用鲜有报道,根据结构相似作用可能相似原理,本研究着重研究了阿卡宁作用白血病细胞的药效,并初步探索其潜在的分子机制。
药效学相关实验结果显示阿卡宁、紫草素均可以抑制HL-60细胞增殖,而阿卡宁的抑制作用稍弱,同时流式结果显示在相同浓度1 μmol/L下,紫草素诱导的细胞凋亡率更高,阿卡宁在2 μmol/L时细胞坏死增多,诱导的凋亡与坏死的结果总和接近于1 μmol/L紫草素的抑制结果。紫草素与阿卡宁互为立体异构体,文献报道紫草素对多种癌细胞具有活性,但还未能进入临床原因之一在于其有较强的毒性,紫草素对正常人肝细胞L-02的IC50为3.41 μmol/L,而阿卡宁对L-02的IC50在55.04 μmol/L毒性远远小于紫草素[20-21]。因此展开对阿卡宁诱导HL-60细胞凋亡的机制研究。
为了明晰这一机制,通过系统药理学收集了阿卡宁及AML的相关靶点,并对二者的共同靶点进行分析。经过Cytoscape软件可视化PPI网络后可知Akt、CASP3、TXNRD等具有较高的度值,其中CASP3与药效学实验结果一致,实验证明阿卡宁可影响Caspase-3及cleaved Caspase-3的表达。Akt在这其中度值最高,说明它可能发挥关键作用。KEGG通路富集分析显示阿卡宁及AML的共同靶点更多的集中在癌症通路中,GO功能分析显示阿卡宁治疗AML的靶点主要涉及对细胞凋亡过程的调控及信号转导等生物学过程,以上结果进一步证明Akt信号通路可能参与HL-60细胞的凋亡过程。阿卡宁与AML共同靶点涉及的分子功能有蛋白结合,氧化还原酶活性等这与PPI网络可视化中得到的TXNRD可能相关。TXNRD为硫氧还蛋白还原酶,主要作用是还原氧化的Trx,还原状态的Trx可以还原氧化的蛋白而调节蛋白活性,是细胞内非常重要的氧化还原蛋白[22]。进一步文献调研发现Trx可能与Akt有关。
Akt是一种丝氨酸/苏氨酸激酶,Akt被激活后会调节许多参与细胞存活、增殖、迁移、代谢和血管生成的下游蛋白质的功能[23]。在许多类型的人类癌症中经常失调,包括卵巢癌、肺癌、胰腺癌、白血病[24]。研究报道60%~80% AML患者中PI3K/Akt通路是上调的[25],Akt通过PI3K激活后可以通过抑制凋亡相关蛋白如Bcl-2细胞死亡拮抗剂BAD和Caspase-9来阻断细胞凋亡,它还可以磷酸化MDM2,降解p53以抑制细胞凋亡[26-27]。磷酸酶和张力蛋白同系物(phosphatase and tensin homolog,PTEN)是一种肿瘤抑制因子,是PI3K的主要拮抗剂,因此也是PI3K/Akt途径的负调节因子[28]。功能性PTEN的缺失导致激活Akt的PIP3水平升高,从而激活Akt及下游信号通路[29],因此PTEN可通过抑制Akt磷酸化来诱导凋亡。而PTEN的活性由Trx调节,生理状态下Trx由TrxR还原,在白血病细胞内高表达的Trx可导致PTEN减少,抑制其磷酸酶活性,使细胞中Akt的活化增加[30]。这与本研究网络药理学分析所得结果一致,因此推测抑制Trx可能会抑制Akt的活化。
通过巯基消耗结构预测及共价对接预测阿卡宁与巯基蛋白Trx的结合能力,结果显示阿卡宁可以与巯基结合并且可以与Trx的32位半胱氨酸形成共价键,于是在分子水平验证了阿卡宁与巯基肽和蛋白的结合能力,结果显示阿卡宁可以与小分子肽及Trx结合。进一步采用Western blotting检测Trx、Akt、p-Akt的表达,结果显示阿卡宁可以抑制Trx、Akt、p-Akt蛋白表达。研究表明阿卡宁的立体异构体紫草素可同时抑制Akt及p-Akt蛋白的表达从而抑制MCF-7细胞增殖[31],紫草素还可调控PTEN/Akt通路抑制宫颈癌细胞增殖[32]。本研究在阿卡宁处理的HL-60细胞中也观察到了相似的结果,结果表明阿卡宁处理过后细胞内的凋亡相关蛋白Caspase-3减少、cleaved Caspase-3升高,Bcl-2降低,Bax升高并且Akt及磷酸化Akt均被显著抑制。根据结果推测阿卡宁可能通过降低Trx蛋白的表达来使PTEN增加,抑制Akt及Akt的进一步磷酸化,影响凋亡相关蛋白的表达,从而抑制HL-60细胞增殖、诱导细胞凋亡。
因此本研究发现阿卡宁具有良好的抗白血病的活性,有助于阐明阿卡宁抗白血病的分子机制,可为其治疗白血病的临床应用提供实验依据,也可为紫草萘醌化合物的现代开发应用提供结构基础。
利益冲突 所有作者均声明不存在利益冲突
[1] 张静, 何欢, 曾雪倩, 等. 急性髓系白血病耐药相关信号通路的研究进展 [J]. 河北医学, 2021, 27(1): 167-170.
[2] Short N, Rytting M, Cortes J. Acute myeloid leukaemia [J]., 2018, 392: 593-606.
[3] 高小凤, 张坤, 张丽君, 等. 高三尖杉酯碱联合用药对急性髓系白血病细胞的增殖抑制 [J]. 华西药学杂志, 2021, 36(1): 35-38.
[4] Sun B Z, Zhang J Z, Liu M H,. RETRACTED: Alkannin inhibits proliferation, migration and invasion of hepatocellular carcinoma cells via regulation of miR-92a [J]., 2019, 114: 108782.
[5] Han W D, Xie J S, Fang Y,. Nec-1 enhances shikonin-induced apoptosis in leukemia cells by inhibition of RIP-1 and ERK1/2 [J]., 2012, 13(6): 7212-7225.
[6] Huang X B, Chen Z Z, Ni F,. Shikonin overcomes drug resistance and induces necroptosis by regulating the miR-92a-1-5p/MLKL axis in chronic myeloid leukemia [J]., 2020, 12(17): 17662-17680.
[7] Todorovic Z, Milovanovic J, Arsenijevic D,. Shikonin derivatives fromdecrease expression of phosphorylated STAT3 in leukemia cells and exert antitumor activity [J]., 2021, 13(4): 1147.
[8] Sweeney S R, Collins M, Pandey R,. Identification of a synergistic combination of dimethylaminoparthenolide and shikonin alters metabolism and inhibits proliferation of pediatric precursor-B cell acute lymphoblastic leukemia [J]., 2020, 59(4): 399-411.
[9] Shan Z L, Zhong L, Xiao C L,. Shikonin suppresses proliferation and induces apoptosis in human leukemia NB4 cells through modulation of MAPKs and c‑Myc [J]., 2017, 16(3): 3055-3060.
[10] 柴冰阳, 陈泽慧, 张闪闪, 等. 4种细胞毒活性方法评价紫草素体外肿瘤细胞抑制作用效果 [J]. 中草药, 2019, 50(1): 172-177.
[11] 张闪闪, 李天一, 王晓琴, 等. 内质网应激在三氧化二砷抑制HL-60增殖过程中的效应机制 [J]. 中国药理学通报, 2017, 33(11): 1589-1595.
[12] Tsiasioti A, Tzanavaras P D. Determination of glutathione and glutathione disulfide using zone fluidics and fluorimetric detection [J]., 2021, 222: 121559.
[13] Niesen F H, Berglund H, Vedadi M. The use of differential scanning fluorimetry to detect ligand interactions that promote protein stability [J]., 2007, 2(9): 2212-2221.
[14] 牛明, 张斯琴, 张博, 等.《网络药理学评价方法指南》解读 [J]. 中草药, 2021, 52(14): 4119-4129.
[15] Li X, Wei S Z, Niu S Q,. Network pharmacology prediction and molecular docking-based strategy to explore the potential mechanism of Huanglian Jiedu Decoction against sepsis [J]., 2022, 144: 105389.
[16] He S, Wang T Q, Shi C W,. Network pharmacology-based approach to understand the effect and mechanism of Danshen against anemia [J]., 2022, 282: 114615.
[17] Newell L F, Cook R J. Advances in acute myeloid leukemia [J]., 2021, 375: n2026.
[18] Chen Y, Cai J Y, Murphy T J,. Overexpressed human mitochondrial thioredoxin confers resistance to oxidant-induced apoptosis in human osteosarcoma cells [J]., 2002, 277(36): 33242-33248.
[19] Zhang B, Chen N, Chen H M,. The critical role of redox homeostasis in shikonin-induced HL-60 cell differentiation via unique modulation of the Nrf2/ARE pathway [J]., 2012, 2012: 781516.
[20] Zheng Q W, Li Q, Zhao G,. Alkannin induces cytotoxic autophagy and apoptosis by promoting ROS-mediated mitochondrial dysfunction and activation of JNK pathway [J]., 2020, 180: 114167.
[21] Lin H Y, Han H W, Sun W X,. Design and characterization of α-lipoic acyl shikonin ester twin drugs as tubulin and PDK1 dual inhibitors [J]., 2018, 144: 137-150.
[22] Ghareeb H, Metanis N. The thioredoxin system: A promising target for cancer drug development [J]., 2020, 26(45): 10175-10184.
[23] Revathidevi S. Akt in cancer: Mediator and more [J]., 2019, 59: 80-91.
[24] Song M, Bode A M, Dong Z,. AKT as a therapeutic target for cancer [J]., 2019, 79(6): 1019-1031.
[25] Herschbein L, Liesveld J L. Dueling for dual inhibition: Means to enhance effectiveness of PI3K/Akt/mTOR inhibitors in AML [J]., 2018, 32(3): 235-248.
[26] Shariati M, Meric-Bernstam F. Targeting AKT for cancer therapy [J]., 2019, 28(11): 977-988.
[27] Fruman D A,Chiu H Y, Hopkins B D,. The PI3K pathway in human disease [J]., 2017, 170(4): 605-635.
[28] Haddadi N, Lin Y G, Travis G,. PTEN/PTENP1: “Regulating the regulator of RTK-dependent PI3K/Akt signalling”, new targets for cancer therapy [J]., 2018, 17(1): 37.
[29] Parsons R. Discovery of the PTEN tumor suppressor and its connection to the PI3K and AKT oncogenes [J]., 2020, 10(8): a036129.
[30] Meuillet E J, Mahadevan D, Berggren M,. Thioredoxin-1 binds to the C2 domain of PTEN inhibiting PTEN’s lipid phosphatase activity and membrane binding: A mechanism for the functional loss of PTEN’s tumor suppressor activity [J]., 2004, 429(2): 123-133.
[31] 陈菊英, 刘朝纯, 曾智, 等. 紫草素通过PI3K/Akt通路促进人乳腺癌MCF-7细胞自噬 [J]. 中国药理学通报, 2013, 29(2): 194-198.
[32] 蒋汉霞, 刘志杰. 紫草素调控PTEN/AKT通路抑制宫颈癌细胞增殖、侵袭研究 [J]. 热带医学杂志, 2019, 19(7): 822-826.
Effect of alkannin on apoptosis of acute myeloid leukemia cells by down-regulating Trx/Akt pathway
XU Hong-hong1, CHANG Xiao1, LUO Qiong1, ZHANG Bo1, 2
1. Xinjiang Key Laboratory of Plant Medicine Resource Utilization, Ministry of Education, School of Pharmacy, Shihezi University, Shihezi 832002, China 2. Sichuan Antimicrobial Industry Research Institute, School of Pharmacy, Chengdu University, Chengdu 610106, China
To investigate the inhibitory effect and mechanism of alkannin (ALK), a representative component of, on HL-60 cells of acute myeloid leukemia.HL-60 cells in logarithmic proliferation phase were selected, and inhibitory rate of cell proliferation after treatment with ALK and shikonin (SK) was detected by trypan blue method; Hoechst 33258 staining was used to observe the cell morphology; Apoptosis rate was detected by flow cytometry; Systematic pharmacological methods was used to screen the common targets of ALK and acute myeloid leukemia (AML) and the key targets were analyzed. The binding ability of compound with target was verified at the molecular level by an o-phthalaldehyde (OPA) fluorescence probe and differential scanning fluorescence analysis. The protein expressions of apoptosis pathway marker cystein-asparate protease-3 (Caspase-3), cleaved Caspase-3, B-cell lymphoma-2 (Bcl-2) and Bcl-2 associated X protein (Bax) were detected by Western blotting.ALK inhibited the proliferation of HL-60 cells in a dose-dependent manner. Under fluorescence microscope after Hoechst staining, HL-60 cells treated with ALK showed apoptosis morphology, such as cell shrinkage, chromatin color deepening, chromatin fragmentation, etc; Compared with control group, apoptosis rate induced by ALK was significantly increased (< 0.001), Bcl-2 protein expression was significantly decreased (< 0.01), Bax and cleared Caspase-3 protein expressions were significantly increased (< 0.01, 0.001); A total of 96 common targets of ALK and AML were obtained through systematic pharmacological screening, and the higher degree targets in protein-protein interaction (PPI) network were protein kinase B (Akt), cystein-asparate protease-3 (CASP3), cytochrome C (CYCS), thioredoxin reductase (TXNRD), etc. Gene ontology (GO) function and Kyoto encyclopedia of genes and genomes (KEGG) pathway analysis showed that the treatment of AML with ALK was mainly related to the positive regulation of RNA polymerase II promoter transcription, apoptosis, and signal transduction regulation, involved molecular functions include protein binding and oxidoreductase activity, signal pathways mainly including cancer-related signal pathways. The results of covalent docking showed that ALK formed a covalent bond with cysteine at the active site of thioredoxin (Trx). Molecular results showed that ALK could bind to glutathione (GSH) and Trx. Western blotting results showed that ALK could significantly down-regulate the expressions of Trx, Akt, and p-Akt (< 0.05, 0.001).ALK induced apoptosis of HL-60 cells, which is related to the inhibition of the Trx/Akt pathway.
Sieb. et Zucc.; alkannin; apoptosis; Trx/Akt pathway; thoils; acute myeloid leukemia
R285.5
A
0253 - 2670(2023)04 - 1138 - 11
10.7501/j.issn.0253-2670.2023.04.013
2022-11-03
国家自然科学基金资助项目(U1603122);新疆兵团科技创新领域中青年领军人才项目(2018CB019);新疆兵团英才计划项目(CZ000601)
徐宏宏(1995—),女,硕士生,研究方向为中药药理学与系统药理学。Tel: 13239932721 E-mail: xuhh2018@163.com
张 波(1978—),男,研究生导师,教授,从事系统药理学与中药药理学研究。E-mail: bozhang_lzu@126.com
[责任编辑 李亚楠]

