脑-骨交互视阈下应对抑郁症与骨质疏松症的运动调节机制研究进展
徐 帅 ,沈 飞
抑郁症(depression)和骨质疏松症(osteoporosis)是本属2个不同体系的疾患形式,亦是重要的合并症(Bellanti et al., 2020)。现代医学研究策略中的生物-心理-社会结构融合,为抑郁症和骨质疏松症共发病机制提供了新的研究思路。基于整合医学领域,下丘脑-骨骼信号传导和骨骼-下丘脑信号传导的交互机制,为骨-脑信号交互提供了更为深远的研究(徐帅 等,2021),尤其是在脑和骨骼之间的传递机制中,脑-骨交互为抑郁症和骨质疏松症的密切相关搭建出脑-骨网络学说,是抑郁症和骨质疏松症相关性研究在现代医学发展前沿领域的最新理论。运动为二者共同干预的手段,通过运动调节探索脑-骨交互视阈下中抑郁症与骨质疏松症之间的联系,进一步挖掘新视角下应对脑-骨之间双向信息交流和功能整合的研究机制。
现有抑郁症和骨质疏松症的研究基础存在以下研究认知:其一,抑郁形成的机体内部变化导致骨质疏松的发生,骨质疏松是抑郁症引发的后果;抑郁诱导的异常行为,导致不良行为习惯,间接引发骨质疏松形成。其二,骨质疏松症诱导抑郁机制,骨质疏松症患者多存在悲伤、沮丧和抑郁情绪,其抑郁情绪来源于骨质疏松中机体的功能性退化;骨质疏松引起骨骼内分泌能力减弱,诱发抑郁症的发展。运动作为非药物治疗手段,对抑郁症和骨质疏松症均具有功能改善作用(徐帅 等,2019;薛香莉等,2019)。本研究通过分析抑郁症的生理功能变化对骨骼质量的影响,以及骨质疏松症的生理功能变化对抑郁患病机制的影响,探讨抑郁症和骨质疏松症之间的脑-骨交互机制(Aloumanis et al.,2013)。
1 抑郁症诱发骨质疏松的生理学基础及运动干预
抑郁症导致骨质减少/骨质疏松发生的潜在机制中,可通过刺激促肾上腺皮质激素释放激素(corticotropin-releas‑ing hormone, CRH),诱导促肾上腺皮质激素(adrenocortico‑tropic hormone,ACTH)、蓝斑(locus coeruleus)、促性腺激素释放激素(gonadotropin-releasing hormone, GnRH)、生长激素抑制素(somatostatin)和生长激素释放激素(growth hor‑mone releasing hormone, GHRH)等异常性分泌,导致骨代谢恶化,骨形成减少和骨吸收增加,引起骨质疏松症(图1)。运动作为非药物治疗抑郁症方法,可减轻抑郁症患者症状,改善抑郁症诱导的分子水平变化(Schuch et al., 2019),提高骨形成过程,缓解骨丢失水平,改善骨微结构。
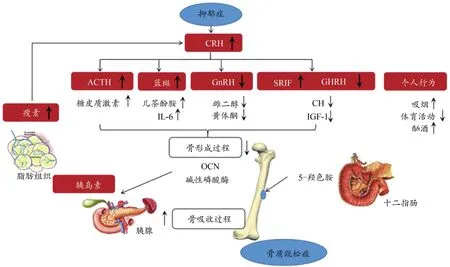
图1 抑郁症诱发骨质疏松的潜在机制(Cizza et al., 2009)Figure 1. Underlying Mechanism of Depression-Induced Osteoporosis (Cizza et al., 2009)
1.1 下丘脑-垂体-肾上腺轴传导对骨质的影响
下丘脑-垂体-肾上腺轴(hypothalamic-pituitary-adrenal axis, HPA)从中枢神经系统(central nervous system, CNS)向周围介导抑郁情绪信号途径(Bab et al., 2010)。HPA轴受下丘脑分泌的CRH和加压素(vasopressin, AVP)调控。在应激作用刺激下,CRH从下丘脑释放,刺激下游应激反应中ACTH异常分泌,刺激肾上腺皮质分泌皮质激素,包括糖皮质激素(glucocorticoids, GCs)(主要是皮质醇)和盐皮质激素,GCs调节神经元存活,神经发生、记忆获取以及情感评价(Pariante et al., 2008),过量GCs对成骨细胞分化起抑制作用,引起骨质流失,被称为GCs诱发的骨质疏松症(glucocorticoid-induced osteoporosis, GIOP)(Jiang et al.,2020)。对60岁以上抑郁症患者CRH、ACTH、皮质醇进行荟萃分析,患抑郁症人群表现出高度HPA轴活动失调,抑郁对皮质醇水平有显著影响(Murri et al.,2014)。而对14名参加6周有氧运动训练的重度抑郁症患者研究中,皮质醇反应性从基线到干预后均未改变(Gerber et al.,2020)。妊娠期大鼠按每天0.1 mg/kg接受地塞米松(dexamethasone, DXMS)摄入可诱发抑郁样行为,当采用60 min/天、5天/周、共4周游泳运动后,可缓解胚胎期接触GCs前暴露于DXMS大鼠的HPA活性并改善其抑郁样行为(Liu et al.,2012),长期服用DXMS,还会导致松质骨骨量增加,形成GCs诱导鼠类动物骨质疏松症模型(Liu et al.,2020)。CRH影响HPA轴抑制下丘脑释放GnRH和GHRH(图1),生长激素(growth hormone, GH)、胰岛素样生长因子 1(insulin-like growth factor 1, IGF-1)以及性类固醇分泌减少,导致骨形成减少和骨吸收增加(Cizza et al.,2001; Cizza,2009)。
HPA功能障碍与儿童期抑郁症密切相关,伴随年龄增长,社交能力增强,抑郁情绪得以缓解,除年龄外,运动对HPA轴的影响亦是重要因素(Budde et al., 2018)。运动可增加HPA轴对应激刺激的适应性,急性运动可刺激ACTH、皮质醇和乳酸分泌,长期运动后机体内激素变化更缓和、恢复更快。运动和振动可预防悬尾大鼠骨骼退化,其中悬尾大鼠的皮质醇血清水平显著升高,ACTH血清水平没有显著升高,经运动干预发现,局部振动对大鼠骨质流失的调节有积极作用,而被动运动影响较弱(Luan et al.,2018)。运动减缓抑郁过程中,外周给予IGF-1与抑郁症相关行为时,对游泳运动大鼠施加IGF-1,IGF-1在前额叶皮质和海马部位产生作用,运动抗抑郁效果显著增强(Duman et al.,2009),IGF-1水平升高,进一步改善骨骼质量,抑制骨质疏松的生理变化。通过2 068名骨质疏松症患者和2 071名健康对照者的荟萃分析发现,IGF-1基因多态性与骨质疏松症易感性之间存在显著相关性(Gao et al.,2018),积极改善骨质减少/骨质疏松的运动效果中,IGF-1分泌水平升高后促进成骨细胞存活,提高成骨作用,通过PI3K/AKT/mTOR信号传导通路增强成骨细胞前体(osteoblast precursor cells, OBPC)增殖(Bakker et al.,2015),延缓或改善骨质疏松的发生态势。
1.2 交感神经系统传输对骨质的影响
抑郁症是骨密度(bone mineral density, BMD)减弱的危险因素,可通过刺激交感神经系统(sympathetic nervous system, SNS)影响骨吸收和骨重建过程,导致骨质流失,诱发骨质疏松症(Bab et al., 2010)。慢性轻度应激(chronic mild stress, CMS)小鼠的实验研究中,抑郁症导致的骨质流失与骨骼中去甲肾上腺素(noradrenaline)增加有关,β受体阻滞剂可预防CMS小鼠骨质流失(Bab et al., 2010)。CMS诱导骨质流失伴随成骨细胞数量减少导致骨形成受阻,抗抑郁疗法可抑制对CMS行为反应,完全抑制骨形成减少(Yirmiya et al.,2006),运动干预作为抗抑郁手段,可缓解CMS行为,进一步刺激成骨细胞,提高骨形成过程。此外,5-羟色胺(5-hydroxytryptamine, 5-HT)作为单胺类神经递质,可在神经元突触中释放,对维持骨骼稳态具有重要的调节作用,同时5-HT可改善机体心理和行为功能,如情绪焦虑症状。缝核产生5-HT的神经元投射到下丘脑腹膜内侧,抑制SNS活性,对成骨细胞表面负性肾上腺作用进行正向调节(Aloumanis et al., 2013)。久坐不动会引发SNS环节中适应机制缺陷,形成情绪衰落、机体运动意向降低等症状(Sanches et al.,2016)。运动在刺激SNS过程中,16天跑轮运动可改善永久性大脑中动脉阻塞(permanent middle cerebral artery occlusion, pMCAO)大鼠神经功能,增强神经元可塑性,并上调5-HT、5-HT受体和脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)分泌水平(Lan et al.,2014)。5-HT神经元信号降低SNS活性后,抑制骨量增长,运动可引起血清5-HT水平升高,缓解骨抑制症状(Piotrowicz et al.,2019)。
除此以外,SNS进一步介导的儿茶酚胺(catechol‑amine)作为应激激素,包括去甲肾上腺素、肾上腺素和多巴胺。心理压力通过儿茶酚胺诱导的成骨细胞和破骨细胞上的β-肾上腺素受体(β adrenergic receptor)活化,β肾上腺素受体活化可增加NF-κβ受体活化因子配体(recep‑tor for activation of nuclear factor kappa β ligand, RANKL)表达,导致破骨细胞分化,β-肾上腺素信号传导还通过产生活性氧(reactive oxygen species, ROS)促进破骨细胞生成,加剧骨质流失(Kelly et al.,2019)。同时递增负荷运动中,儿茶酚胺的分泌水平与反应时间和运动时间密切相关(Mcmorris et al.,2003)。
1.3 瘦素调节对骨质的影响
瘦素是脂肪组织中的重要细胞因子,与抑郁症和骨重塑调节有关,在体质量、食物摄入和能量代谢中起调节作用。研究发现,瘦素在情绪和认知水平有潜在的调节机制,该作用是通过改善大脑突触变化来进行抗抑郁调节。其中,抑郁症患者的高瘦素血症状比瘦素敏感性受损的肥胖和代谢异常引起的中心瘦素抵抗症状更强(Ge et al.,2018)。瘦素与抑郁症和骨重塑的调节有关,通过直接或间接参与骨骼重塑,抑制破骨细胞生成以控制骨代谢。骨质疏松症循环瘦素与BMD之间存在显著相关性,瘦素通过SNS起作用,通过刺激下丘脑可卡因和苯丙胺调节的转录表达来抑制骨吸收(Mclarnon,2012)。瘦素通过SNS调节骨代谢,与其下丘脑瘦素受体(leptin receptor,Ob-Rb)结合,对下丘脑腹腔(ventromedial hypothalamus,VMH)中金硫葡萄糖(gold thioglucose, GTG)敏感性神经元调节,诱导交感活动,并通过β2肾上腺素受体(β2adren‑ergic receptor, Adrβ2)向骨细胞发出信号。其一,Adrβ2可使转录因子cAMP反应元件结合蛋白(cAMP-response ele‑ment binding protein, CREB)来调节基因表达,通过CREB抑制c-Myc表达,从而增加细胞周期蛋白D1(cyclin D1)水平,抑制成骨细胞增殖;其二,Adrβ2激活蛋白激酶A(protein kinase A, PKA),引起转录激活因子4(activating transcription factor 4, ATF4)磷酸化,上调RANKL表达,促进破骨细胞的吸收作用(Chen et al., 2015)。
瘦素可发挥抗抑郁作用,进而减轻大鼠的抑郁样行为,刺激GSK3β/β-catenin信号,并通过Ser9磷酸化抑制糖原合酶激酶 3β(glycogen synthase kinase-3β, GSK-3β)活性,表明GSK3β/β-catenin信号通路依赖的神经发生与瘦素的抗抑郁作用有关(Ge et al.,2018; Liu et al.,2017)。瘦素通过抑制破骨细胞形成对去卵巢(ovariectomized,OVX)大鼠起骨保护作用,促进骨髓间充质干细胞(bone marrow mesenchymal stem cells, BMSCs)成骨分化,通过调节RANKL/OPG比率抑制破骨细胞生成(Said et al.,2020),而在RANK/RANKL/OPG路径与运动关系中,常规性运动锻炼对RANK/RANKL/OPG途径具有积极影响,极度剧烈运动(马拉松运动)会产生负面调节(Keramaris et al.,2013)。运动刺激机体内瘦素水平提高,瘦素敏感性得以缓解,进一步调节抑郁性功能,同时瘦素的调节改善骨骼质量,形成抗骨质疏松作用。
1.4 炎症细胞因子分泌对骨质的影响
蓝斑位于第四脑室底,脑桥前背部。蓝斑是脑中合成去甲肾上腺素的主要部位,与应激反应有关,应激时蓝斑-交感-肾上腺髓质系统可引起脑桥蓝斑的中枢效用,引发兴奋、警觉及紧张、焦虑和抑郁等情绪。蓝斑去甲肾上腺素神经元中GCs受体缺失可减弱雌性小鼠社交互动能力(Jacobson,2019)。炎症反应不仅是机体受伤或感染的主要来源,亦是诱导机体患抑郁症的重要因素,慢性应激会干扰免疫反应,抑郁症存在促炎性细胞因子的释放和过量的皮质醇症状(Sanches et al.,2016)。Liu等(2017)证实,游泳运动可以改善抑郁症大鼠代谢和炎症反应。运动改善细胞功能,缓解炎症反应。抑郁情绪下,神经内分泌激素会影响骨形成和/或骨吸收,外周(血清)和中央(脑脊液)中白介素 1(interleukin-1,IL-1)、白介素 6(inter‑leukin-6,IL-6)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、干扰素 γ(interferon-γ, IFN-γ)等促炎细胞因子水平升高,诱导全身炎症性反应导致抑郁样行为(Mezuk et al., 2008),引发骨骼质量下降,增加破骨细胞活性,增强骨吸收,降低BMD水平(Rosenblat et al.,2016)。
对OVX小鼠进行糖水实验、旷场实验和悬尾实验发现,小鼠抑郁样行为发生改变,包括兴趣缺失、探究性行为减少、绝望情绪增加,产生抑郁样行为,小鼠体内促炎细胞因子IL-1β、IL-6含量升高,抑炎细胞因子白介素4(interleukin-4,IL-4)、白介素 10(interleukin-10,IL-10)含量降低,进行为期5周、5天/周、40 min/天、15 m/min的运动干预后,可逆转IL-1β和IL-4表达改变(鲍青悦 等,2015)。OVX是构建骨质疏松的经典模型,可导致大鼠体内IL-1β mRNA和蛋白水平以及胫骨中IL-6和环氧合酶-2(cyclo‑oxygenase-2, Cox-2)蛋白水平显著增加,对OVX大鼠进行 251.2 m/天、6天/周、3个月的跑轮运动,OVX 大鼠IL-1 mRNA和蛋白、IL-6 mRNA、Cox-2 mRNA和蛋白水平下降(Li et al.,2014)。OVX干预可造成抑郁行为和骨质疏松一体化模型,经运动干预后,既可以缓解抑郁和骨质疏松中促炎因子和抑郁情绪,同时抑制骨吸收,增加骨形成和骨质疏松的骨量水平。
1.5 抗抑郁药摄入对骨质的影响
抗抑郁药摄入会调节骨骼健康,对1年内有过髋部骨折史的477名受试者(50岁以上)进行队列分析发现,髋部骨折发生与抗抑郁药物使用存在显著相关性(Leavy et al.,2016)。美国国立卫生研究院(National Institute of Health, NIH)将选择性5-羟色胺再摄取抑制剂(selective serotonin reuptake inhibitor, SSRI)作为抗抑郁的一线治疗药物(Guo et al.,2019)。SSRI能抑制突触前神经元对5-HT的再摄取,维持突触间隙更高水平的5-HT并增加突触后神经传递。对60岁以上老年人研究发现,SSRI与跌倒、骨质流失和骨折有关,SSRIs在老年人安全性中存在忧虑,可增加骨质疏松,引起跌倒和骨折风险(Gebara et al.,2014)。其中,SSRI和5-羟色胺去甲肾上腺素再摄取抑制剂(serotonin and norepinephrine reuptake inhibitor, SNRI)使用情况与BMD降低、骨折风险增加等存在相关性。SSRI使用与骨折风险的关联可能会因剂量、用药时间、年龄或性别而异,停用SSRI后,骨折风险会迅速降低(Bruyère et al., 2015; Wu et al.,2015)。在抗抑郁药治疗中增加有氧运动会形成明显的优势效果(Murri et al.,2018),对15名年轻(20~39岁)和年老(60~79岁)抑郁症患者进行>20 min/天、>3天/周、12周运动干预,发现运动增强和药物疗法对不同年龄段抑郁人群均可行,并且对与抑郁有关的核心大脑区域具有神经益处(Gujral et al.,2019),尤其是运动形成对骨骼刺激,可形成良性调节骨骼质量手段。在对24月龄老年大鼠有氧运动干预(共6周、5天/周、2次/天 、15 min /次、5~8 m/min)、SSRI摄入干预(10 mg/kg)、SSRI+运动双重介导干预的3种干预方式研究中,发现SSRI+运动老年大鼠的杏仁核和海马组织中5-HT水平显著升高,同时干预会增加海马、前额叶皮层和杏仁核中细胞数量,减少老年焦虑和抑郁情况,且运动刺激会缓解骨质流失过程(Gokdemir et al., 2020;Stanghelle et al.,2020)。
2 骨质疏松症诱发抑郁的生理学基础及运动干预
抑郁对BMD产生不利影响并增加抑郁症患者骨折风险,且患有骨质疏松症患者罹患抑郁症的可能性亦明显升高(表1),已有研究证实了骨质疏松症可加剧抑郁症状(Carlone et al.,2015)。根据老年抑郁量表(geriatric de‑pression scale, GDS)评估报道,患有椎骨骨折绝经女性比无骨折女性存在更多的抑郁症状,其中骨折女性抑郁可能性(GDS≥6)会增加至 2.5%(Silverman et al.,2007)。流行病学研究中心抑郁量表(center for epidemiologic stud‑ies depression scale, CES-D)在评估与骨质减少/骨质疏松的相关研究中,经过校正协变量(体质量指数、年龄、雌激素、种族、吸烟和饮酒)后,抑郁症状中白人女性髋部BMD变量的占比约为2%(Lyles,2001)。研究认为,骨骼质量的下降,带来生活能力不便必然引发机体情绪波动,诱导抑郁症发生;有别于传统医学对骨骼的认知,骨骼上升为内分泌系统已经得到了广泛共识,骨骼作为内分泌器官可分泌骨骼因子作用于下丘脑,进而诱导抑郁症状。运动对骨质疏松有效改善效果分析认为:运动可缓解骨质疏松症和脊椎骨折老年女性行走的恐惧心理(Stang‑helle et al.,2020),缓解因骨骼质量减弱导致的精神压力,减轻抑郁症进一步恶化;运动调节骨骼质量的改善,进一步引起骨骼分泌因子的释放,通过下丘脑组织,缓解抑郁症状的发生。

表1 抑郁症与骨质疏松症的关联性研究Table 1 Correlation Study between Depression and Osteoporosis
2.1 骨质降低诱导的抑郁情绪
成年人进入30岁后骨骼质量将缓慢衰减,患骨质疏松或存在骨折史的患者多存在忧患意识,尤其是面临再次跌倒风险,长期处于高压情绪状态可形成忧郁意识。对患有骨质疏松症并存在椎骨骨折女性进行12周的抗阻和平衡运动,可以改善肌肉强度和平衡能力,提高骨骼质量,并减少跌倒的恐惧感(Stanghelle et al.,2020)。伴随增龄性疾病的发生,中老年人机体能力显著下降,易引发其情绪意识的失调,表现出焦虑不安、抑郁等症状。当骨骼质量下降后,会直接诱导跌倒性骨质损伤的发生,在跌倒与抑郁的双向性调节中,跌倒对抑郁的影响与跌倒后期恐惧心理之间存在必然联系(Rosenblat et al.,2016),对患有骨质疏松症的老年人健康教育中,保持良好精神状态、乐观情绪进而提高神经反应,同样可以缓解应激压力。
高强度渐进式阻力和冲击训练(high-intensity progres‑sive resistance and impact training, HiRIT)可提高骨骼强度,改善跌倒和骨折风险相关功能,缓解负面心理作用,形成良好的心理机能状态(Harding et al.,2020)。对日本百岁老人的流行病调查研究发现,定期运动、95岁以后没有严重跌倒、保持基本的日常生活活动,能够有效维持老年人幸福感和个人机体能力,形成成功的个体衰老机制(Strandberg et al., 2007),使老年人维持在健康的身心健康状态中。采用运动干预时,针对老年人的活动能力,快步走和阶梯行走有助于减轻与年龄有关的自然骨骼质量下降问题,并且可以轻松地融入老年人日常活动中(Mar‑telli et al.,2020),采取顺其自然的方式进行有效调控,尤其是对骨质疏松患者的运动干预,在认知行为疗法中适当采用正念接受时亦可缓解疼痛和负面情绪(Kober et al.,2019),由此形成的健康心理状态能够有效预防骨质减少/骨质疏松引起的抑郁情绪。
2.2 骨骼内分泌功能调节抑郁情绪
在骨内分泌系统(bone endocrine system)的视角下,骨钙素(osteocalcin, OCN)、成纤维细胞生长因子23(Fibro‑blast Growth Factor, FGF23)和 脂 质 蛋 白 2(lipocalin-2,LCN2)构成了新型骨内分泌源激素,3种因子可通过血液循环体系进行全身性机能改善,其中OCN和LCN2可对下丘脑进行进一步的调节(徐帅 等,2021)。OCN由成骨细胞分泌,通过羧化后形成有活性的羧化不全骨钙素(un‑carboxylated osteocalcin, ucOCN),ucOCN与机体能量代谢密切相关,可调节脂肪和葡萄糖代谢,在抗阻训练和有氧间歇训练中ucOCN循环水平显著增加(Rahimi et al.,2020)。ucOCN可作用于BDNF和神经生长因子(nerve growth factor, NGF),共同改善下丘脑对神经功能的影响。在“抑郁症的神经营养蛋白假说”的研究中,压力或抗抑郁药治疗与BDNF下调或上调相关(Martinowich et al., 2007),BDNF在神经可塑性、神经发生和神经保护中起调节作用,骨骼中的ucOCN能够作用于BDNF,BDNF的水平与抑郁症状的严重程度呈负相关(Ge et al.,2018)。运动后血清BDNF、GDNF水平升高(Piotrowicz et al.,2019)。ucOCN经血液循环可增加脑内GH合成,并通过与GPR158受体结合,在记忆增加和减少焦虑/抑郁中起重要作用。另外,参与空间学习和记忆处理的大脑区域OCN水平显著性升高。值得注意的是,OCN水平低的小鼠大脑体积始终小于OCN水平正常的小鼠大脑体积,OCN缺陷小鼠表现出较高的焦虑样行为和认知能力下降,OCN注入后,OCN缺陷小鼠症状得以纠正(Diaz-Franco,2019)。OCN 穿越血脑屏障(blood brain barrier,BBB)可恢复小鼠记忆力和认知能力,高脂膳食饲养C57BL/6雄性和雌性小鼠8周后,再进行8周的OCN注射或跑步运动干预,后2周完成抑郁样行为、焦虑样行为、小鼠解决问题能力和记忆行为测试,在性别差异、饮食结构与运动关系中,高脂饮食仅增加雌性的焦虑样行为,OCN注射和运动有效降低小鼠抑郁样行为,OCN注射和运动干预对抑郁样行为的影响虽然相似但机制效果不同,并且OCN和运动效果存在明显的重叠作用(Winberg et al.,2020)。
LCN2属于先天免疫的铁相关蛋白,由成骨细胞分泌,可参与情绪行为变化和认知功能改善过程。研究发现,10周龄雄性LCN2缺失小鼠表现出焦虑样行为、抑郁样行为以及空间学习任务认知障碍,该行为改变与HPA轴过度激活有关,并反映在LCN2缺失小鼠中皮质类固醇水平升高过程中;LCN2缺失小鼠海马神经元形态分析显示,海马脑细胞结构改变,腹侧海马颗粒状和锥体神经元肥大,该区域与情绪行为有关(Ferreira et al.,2013)。在慢性应激反应抑郁模型(unpredictable chronic mild stress,UCMS)的研究中,LCN2与慢性应激反应诱导的抑郁症发病有密切关系,其机制与中枢系统小胶质细胞活性有关。对小鼠颅骨成骨细胞进行模拟微重力分析时发现,与单位重力条件相比,LCN2水平显著上调(Rucci et al.,2015)。运动刺激LCN2分泌水平,通过血液循环进入脑内,改善抑郁症状。除此以外,LCN2与肥胖症、Ⅱ型糖尿病和代谢综合征的相关调节密切相关(Moghadasi et al.,2014)。总之,运动通过改善抑郁症,提高骨骼质量,抑制或缓解骨质疏松的恶化。通过改善骨质疏松,提高行动能力,缓解抑郁情绪;同时骨骼分泌OCN和LCN2作用于脑内组织,缓解抑郁症的发生(图2)。
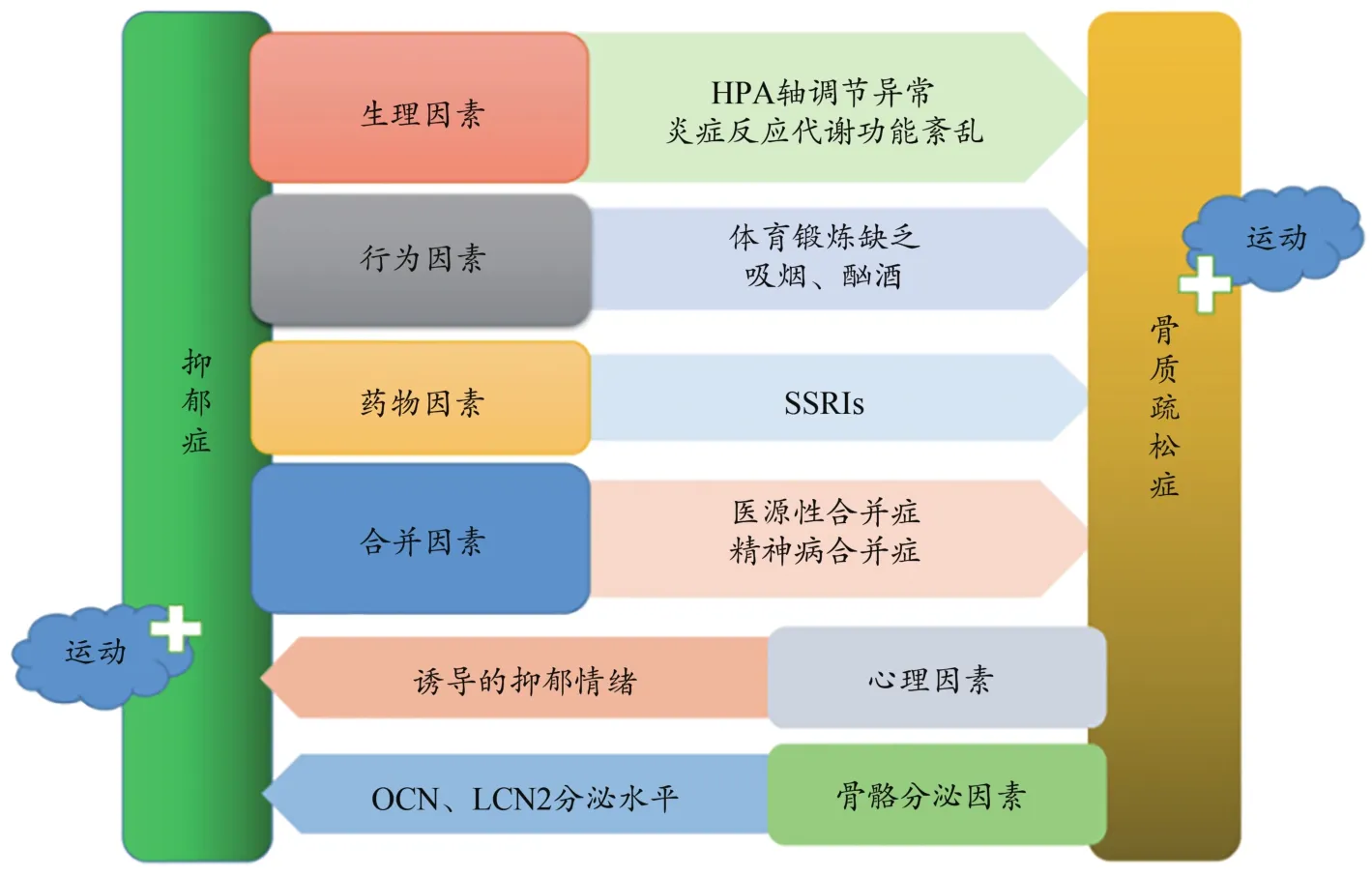
图2 运动贯穿抑郁症和骨质疏松症路径分析示意图(Rosenblat et al., 2016)Figure 2. Schematic Diagram of Path Analysis of Exercise Running through Depression and Osteoporosis (Rosenblat et al., 2016)
3 小结与展望
脑-骨交互是应对抑郁症和骨质疏松症共病的新机制,在罹患抑郁症或骨质疏松症的独立研究中,抑郁症是机体罹患骨质疏松和骨折的危险因素,及时对患有抑郁症的患者进行骨骼质量检测,有助于骨质流失或骨质疏松的早期筛查。骨质疏松症中出现BMD降低和骨骼分泌能力下降后,一方面由于骨骼质量的下降,生活质量受到干扰,可引发患者情绪化;另一方面骨骼内分泌因子OCN和LCN2水平下降,亦可诱导抑郁症的发生发展,及时对患有骨质疏松症的患者进行抑郁情绪检测,有助于及时解决患者情绪化问题。
本研究旨在将脑-骨交互进一步延伸到整合生物学的整体角度提供新靶向,更深入的研究方向在于:1)中青年抑郁症患者的骨量是否会完全达到峰值;抑郁症中骨质减少/骨质疏松的发生几率需要进一步确定,对抑郁症诱发骨折进行及时有效的前瞻性评估;2)绝经女性特有的身体变化,雌激素水平下降可诱导骨质下降,同时伴有情绪变化可能引发抑郁风险,在总体研究中需考虑性别差异性;3)运动干预抑郁症和/或骨质疏松症中具有显著效果,而采用的运动方式却存在差别,抑郁症多采用有氧运动干预,骨质疏松症多采用直接应力刺激,如何进一步选取有效的运动模式来缓解共发病的过程,尤为重要。

