郭家沟富油煤细菌降解产腐殖酸研究
尚煜超,刘向荣,2,石 晨,杨再文,2,赵顺省,2
(1.西安科技大学化学与化工学院,陕西省西安市,710054;2.自然资源部煤炭资源勘查与综合利用重点实验室,陕西省西安市,710021)
0 引言
腐殖酸(Humic acid,HA)是一种天然高分子有机物,广泛分布于土壤、水体及低阶煤中[1]。腐殖酸含有大量活性官能团,如羧基、酚羟基、羰基、磺酸基和甲氧基,这些活性官团使其具有促进植物生长、与重金属络合固定重金属离子减少重金属富集和毒害作用以及抗病毒和抗炎活性的能力。因此,腐殖酸广泛应用于农业、医药、卫生、废水处理等方面[2-5]。
我国煤中腐殖酸资源较为丰富,原生腐殖酸含量为10%~80%[6-7],目前从煤中提取腐殖酸方法较多,主要有酸抽提法[8]、碱抽提法[9]及微生物溶解法[10]3种。酸抽提法具有操作简单的优点,但也存在使用大量化学试剂、成本高、污染环境等缺点,同时也受到其提取杂质较高而有所限制;碱抽提法因操作简单、提取率较高最为常用,但是碱抽提法也存在使用大量化学试剂、成本高、污染环境等缺点;微生物溶解法是20世纪初开始研究的一种煤炭转化新方法,通过微生物溶解法提取腐殖酸具有反应条件温和、清洁无污染、产品生物活性高等优点,但也存在腐殖酸提取率相对较低的缺点[6,11-12]。
Huculak-Mączka M等人[13]的研究表明,煤中腐殖酸提取程度及其结构的决定因素主要是提取剂的类型,使用NaOH溶液可以获得较大的腐殖酸提取率,使用Na4P2O7溶液腐殖酸提取率较低,在结构上与NaOH溶液提取的腐殖酸相比有着分子量小、羧基含量较高的特点;DONG L等人[10,14]的研究表明,微生物处理煤产生的腐殖酸与碱抽提法相比提取率较低,但其所得的腐殖酸水溶性腐殖物质大大增加,生物活性更好。我国煤炭资源丰富,富油煤在我国西部储量丰富,是一种中低成熟度的油气资源,焦油产率大于7%,目前的利用方式主要是作为动力煤燃烧,其在使用过程中污染严重,极易造成大气污染[15]。通过微生物转化技术以清洁无污染的方式用于燃料和非燃料化学品的生产,可为富油煤的利用开辟更具效益的前景,也有利于早日实现“双碳”的目标。
本文利用单因素实验及正交实验确定了荧光假单胞菌和蜡样芽孢杆菌降解郭家沟富油煤提取生物腐殖酸的(bHA)的最佳工艺条件,并通过元素分析、UV-vis、FTIR、XRD及有机质元素分析的表征方法对生物提取的腐殖酸和碱抽提法所得的腐殖酸进行了对比分析,为生物腐殖酸在农业方面的应用奠定了基础。
1 实验部分
1.1 煤样制备
实验所用煤样为陕西省榆林市郭家沟富油煤,焦油含量为7.25%,利用球磨机将其破碎并进行筛分,获得粒径为0.25~0.50 mm的样品,用10 mol/L的硝酸对原煤氧化48 h,并用去离子水洗涤至中性,烘干、灭菌后备用。根据《煤的工业分析方法》(GB/T212-2008)和《煤的元素分析》(GB/T31391-2015)的方法利用Perkin Elmer 2400分析仪和5E-S3200库仑硫分析仪对硝酸氧化前后的煤样进行工业分析和元素分析,氧化前后煤样的工业分析和元素分析见表1。
由表1可以看出,原煤经硝酸氧化后C、H、S含量降低,O、N含量增加,灰分变化不大,挥发分降低,这是由于硝酸与煤样反应,芳香环羧基化,侧链烷基氧化和硝化的原因[12]。

表1 氧化前后煤样的工业分析和元素分析 %
1.2 菌种的培养
由于富油煤油气含量较高的属性,选取了降解原油效果较好的棒状杆菌属[16]的2种细菌,即荧光假单胞菌(Pseudomonasfluorescens)和蜡样芽胞杆菌(Bacilluscereus),均购买于中国微生物菌种保藏中心(CICC),编号分别为CICC 20066和CICC 21290。培养基均采用CICC所提供的牛肉膏培养基配方,即牛肉膏3 g、蛋白胨5 g、氯化钠5 g、去离子水1 L。将菌种接种于装有50 mL牛肉膏培养基的锥形瓶内,并置于恒温30 ℃且160 r/min的摇床内振动培养。
1.3 煤样腐殖酸的提取
1.3.1 单因素实验设计
在含0.3 g灭菌煤样的150 mL锥形瓶中加入50 mL灭菌的牛肉膏培养基和10 mL菌液,置于恒温30 ℃、160 r/min的振动培养箱振动培养。在相同培养条件下分别改变煤浆浓度(0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1.0 g/50 mL)、提取时间(2、4、6、8、10、12、14、16 d)、菌液用量(2、4、6、8、10、12、14、16、18 mL/50 mL)研究各因素对煤样腐殖酸提取率的影响,实验结束离心操作(10 000 r/min,20 min)后分离固相产物和液相产物备用。
1.3.2 正交实验设计
在单因素实验的基础上,设计三因素三水平正交实验得出荧光假单胞菌和蜡样芽孢杆菌降解郭家沟富油煤提取腐殖酸的最佳工艺条件,正交实验因素及水平见表2。

表2 2种细菌降解氧化煤提取腐殖酸的正交实验设计
1.3.3 腐殖酸提取率的计算
腐殖酸提取率的计算见式(1)[3]:
(1)
式中:ε——腐殖酸提取率,%;
m1——起始煤样的质量,g;
Mad——氧化煤中的含水量,%;
m2——残煤的质量,g。
将离心后所得固相产物用蒸馏水洗涤至无菌体残留,干燥称重,通过式(1)计算腐殖酸提取率。
1.3.4 生物腐殖酸和化学腐殖酸的提取方法
生物腐殖酸提取:将离心后的液相产物用0.22 μm微膜过滤器进行过滤后获得滤液,用6 mol/L的HCl酸化至pH<2的沉淀腐殖酸,并通过离心(4 000 r/min,20 min)仪器进一步分离腐殖酸,然后再利用Spectrapore膜(MWCO 3500)纯化和透析腐殖酸,直到游离氯离子被洗掉,最后冷冻干燥,获得2种生物腐殖酸(bHA)。
化学腐殖酸提取:用0.1 mol/L的NaOH和0.1 mol/L的焦磷酸盐溶液从氧化煤中抽提,比例为1∶10(煤样∶萃取剂),然后再通过上述步骤提取获得化学腐殖酸(cHA)[17]。
1.4 腐殖酸表征方法
采用Perkin Elmer 2400分析仪和5E-S3200库仑硫分析仪对提取腐殖酸样品进行S元素分析;使用TU1950 型紫外可见分光光度计(UV-Vis)测定腐殖酸样品E4/E6(465 nm/665 nm)比率;通过Nicolet iN 10 &iZ10型傅里叶红外光谱仪定量溴化钾压片法(固相产物∶KBr为1 mg∶200 mg),在4 000~400 cm-1范围内,分辨率4 cm-1对腐殖酸样品进行红外光谱扫描;利用Mini Flex 600 X-射线衍射仪对腐殖酸样品进行分析,扫描范围为5°~80°,扫描速度为2°/min;使用KDN-520型凯氏定氮仪和TITAN 10型微波消解仪通过凯士定氮法和火焰光度法对腐殖酸的N、P、K、Ca、Mg元素进行测定。
2 结果与分析
2.1 单因素实验结果
单因素对生物腐殖酸提取率的影响如图1所示。
由图1(a)中可以看出,随着煤浆浓度的增加,荧光假单胞菌和蜡样芽孢杆菌对煤样中腐殖酸的提取率均先增加后降低。在煤浆浓度分别为0.5 g/50 mL和0.6 g/50 mL时,达到的最优提取率分别为31.20%和33.22%。原因可能是当煤浆浓度过大时抑制了荧光假单胞菌和蜡样芽孢杆菌的生长。
由图1(b)中可以看出,随着降解天数的增加,荧光假单胞菌和蜡样芽孢杆菌对煤样中腐殖酸的提取率均呈现先增加后趋于稳定的现象,均在提取12 d时处于缓慢增长期,提取率分别为29.08%和33.55%。原因可能是在降解时间达到12 d时,培养基中的营养物质几乎被细菌消耗,部分细菌趋于死亡[18],使得12 d后的腐殖酸提取率变化不大。
由图1(c)中可以看出,随着菌液用量的增加,荧光假单胞菌和蜡样芽孢杆菌对煤样中腐殖酸的提取率均呈现出先增加后降低的趋势,分别在菌液用量为10 mL/50 mL和12 mL/50 mL时,对煤样中腐殖酸的提取率达到最大,分别为29.02%和34.51%。这是由于菌液接种量较低时,煤浆环境对细菌生长有抑制作用,随着菌液接种量的增加抑制作用减弱,当接种量超过一定数值后,有限的营养物质导致细菌之间的竞争和抑制,从而影响了对煤样腐殖酸的提取效果。
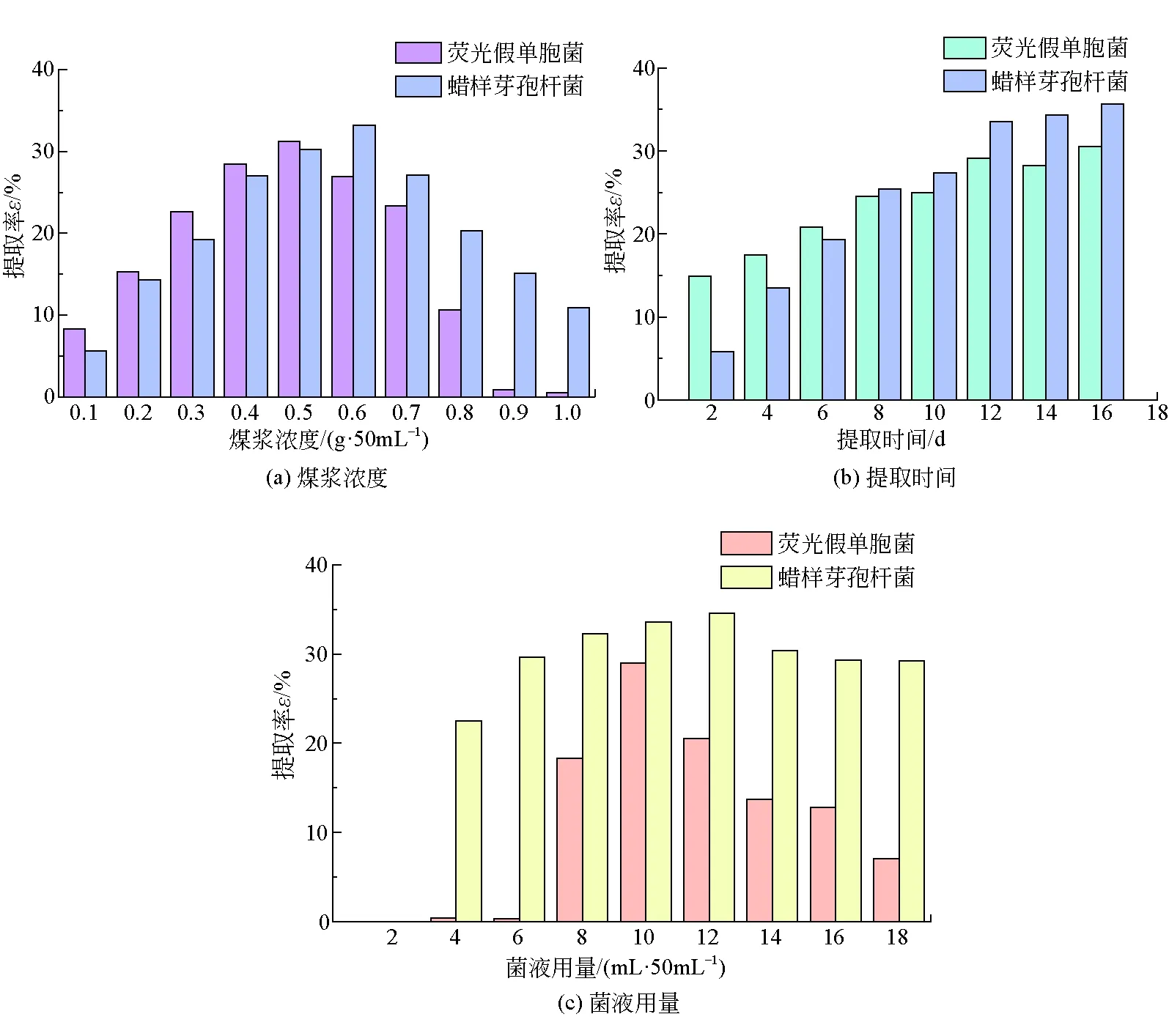
图1 单因素对生物腐殖酸提取率的影响
2.2 正交实验结果
荧光假单胞菌和蜡样芽孢杆菌提取郭家沟富油煤腐殖酸的正交实验见表3和表4。
对表3和表4中数据进行分析后得出,根据各因素的K1、K2和K3值的荧光假单胞菌在最优工艺组合为A2、B3、C3,即煤浆浓度0.5 g/50 mL、提取时间14 d、菌液用量12 mL/50 mL时煤样腐殖酸的提取率最高,为32.87%;蜡样芽孢杆菌在最优工艺组合为A1、B3、C1,即煤浆浓度0.5 g/50 mL、提取时间14 d、菌液用量8 mL/50 mL时对煤样腐殖酸提取率最高,为38.23%。根据正交实验的极差R可以看出3个因素对荧光假单胞菌和蜡样芽孢杆菌提取腐殖酸的影响由大到小分别为:降解时间>煤浆浓度>菌液用量和菌液用量>降解时间>煤浆浓度。
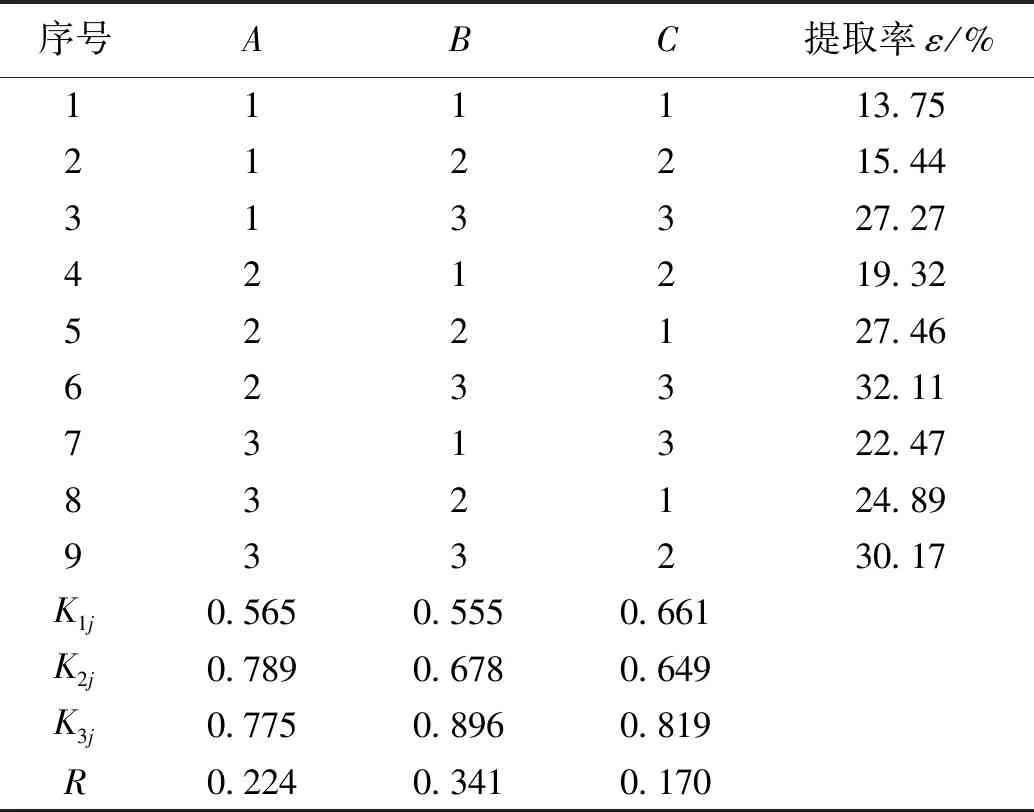
表3 荧光假单胞菌降解氧化煤提取腐殖酸正交实验
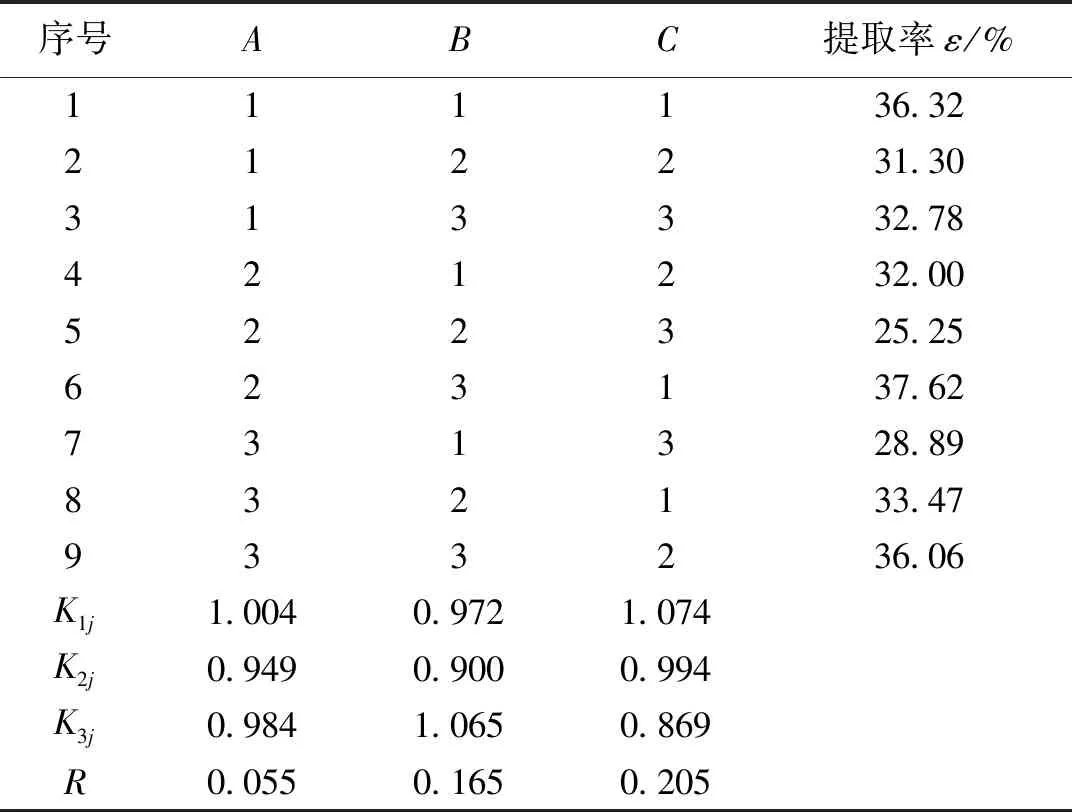
表4 蜡样芽孢杆菌降解氧化煤提取腐殖酸正交实验结果
2.3 腐殖酸的表征结果
2.3.1 元素分析
按照1.4中方法提取的腐殖酸元素,bHA(1)和bHA(2)分别为荧光假单胞菌和蜡样芽孢杆菌降解产生的腐殖酸,cHA为碱抽提法提取的腐殖酸。腐殖酸样品的元素分析结果见表5。
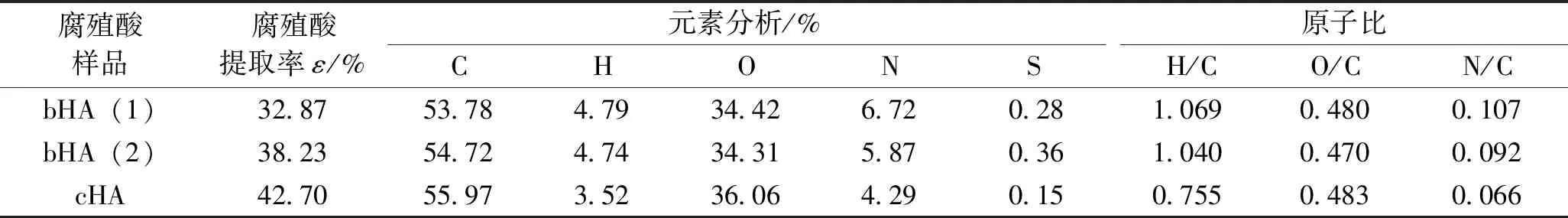
表5 腐殖酸样品的元素分析结果
由表5可以看出,2种细菌降解生成的腐殖酸元素组成差别不大,与化学方法提取的腐殖酸相比,H、N及S含量较高,O、C含量较低;H/C原子比代表芳香度,H/C越低则意味着芳香度和分子量越高,2种细菌降解产生的腐殖酸H/C原子比几乎相同并大幅高于化学方法提取的腐殖酸,这说明细菌降解生成的腐殖酸含有更多的脂肪族化合物,芳香度和分子量较低;O/C原子比反映腐殖酸中的氧含量,2种细菌降解产生的腐殖酸与化学腐殖酸相比O/C原子比较低,表明2种生物腐殖酸比化学腐殖酸的含氧官能团少[2,14];N/C原子比反映了腐殖酸中的氮含量,通常煤衍生腐殖酸的N/C值通常在0.05左右,2种生物腐殖酸的N/C比较高可能是其均具有脱氨基能力[17]。
2.3.2 紫外分析
不同波长下的UV-Vis比值被用作腐殖酸的重要表征指标,E4/E6(465 nm/665 nm)是最常用的吸光度比,E4/E6比率主要与腐殖酸的分子量及芳香度相关,通常E4/E6值随分子量和芳香度的增加而降低,同时,该比值还会随着氧含量的增加而增加。3种腐殖酸样品的紫外E4/E6比率见表6。

表6 腐殖酸样品E4/E6比率
由表6可以看出,E4/E6比率表明2种生物腐殖酸拥有比化学腐殖酸高的分子量和芳香度,这与元素分析结果相矛盾,这可能是由于化学腐殖酸中含氧量较高引起其E4/E6比值升高[14,19]。
2.3.3 红外光谱分析
为进一步了解腐殖酸的结构和官能团排列,并对比生物腐殖酸和化学腐殖酸的芳香度及含氧结构参数,对3种腐殖酸的FTIR分析如图2所示。

图2 3种腐殖酸的FTIR分析
由图2中可以看出,3种腐殖酸样品的红外光谱特征峰及主要特征峰的出现位置基本相同。3 425 cm-1处的吸收峰是N-H或羟基(OH)伸缩振动的标志,吸收峰位于2 930 cm-1和2 804 cm-1归因于脂肪族CH3和CH2的C-H伸缩振动,吸收峰位于1 635 cm-1是羧酸的O=C伸缩振动,2 625 cm-1的吸收峰是由羧酸中OH伸缩振动引起的,在1 533 cm-1处的吸收峰为硝基伸缩振动引起的[18],吸收峰在1 385 cm-1是由酚羟基的OH变形和C-O拉伸振动引起的,同时,吸收峰位于762 cm-1表示芳香族C-H的拉伸振动[2]。FTIR光谱的吸收峰主要分为4个区域:3 600~3 000 cm-1波段羟基(-OH)的吸收区,3 000~2 800 cm-1波段脂肪族结构的吸收区,1 800~1 000 cm-1波段含氧结构的吸收区,900~700 cm-1波段的芳环结构的吸收区[20],对这4个吸收峰分别进行拟合,得到高斯峰,并确定其面积、半峰宽等参数,从而确定fa(芳香度)、C'(含氧结构参数)[21]。3种腐殖酸样品的红外分峰拟合如图3~图5所示。

图3 bHA(1) FTIR分峰
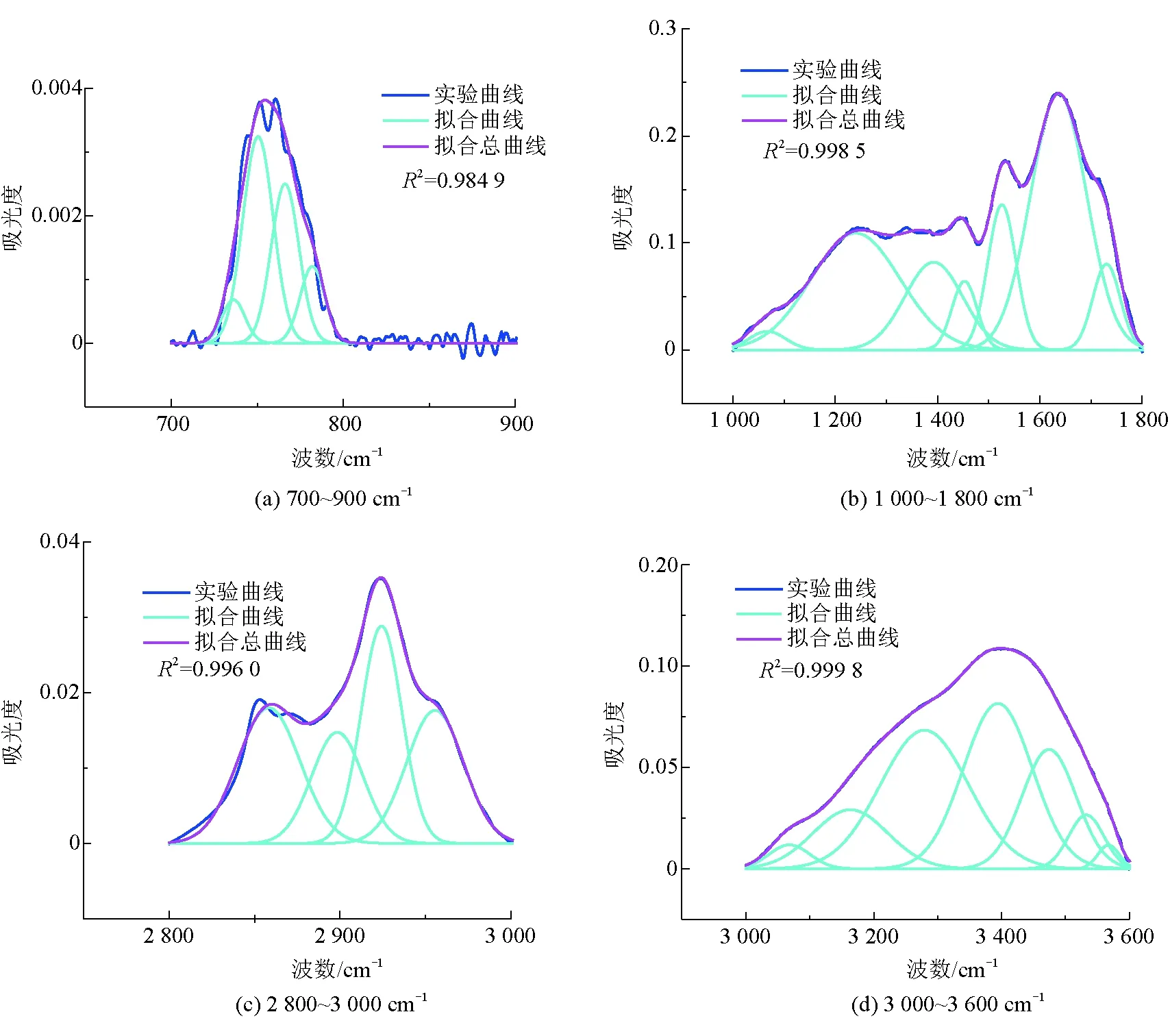
图4 bHA(2) FTIR分峰
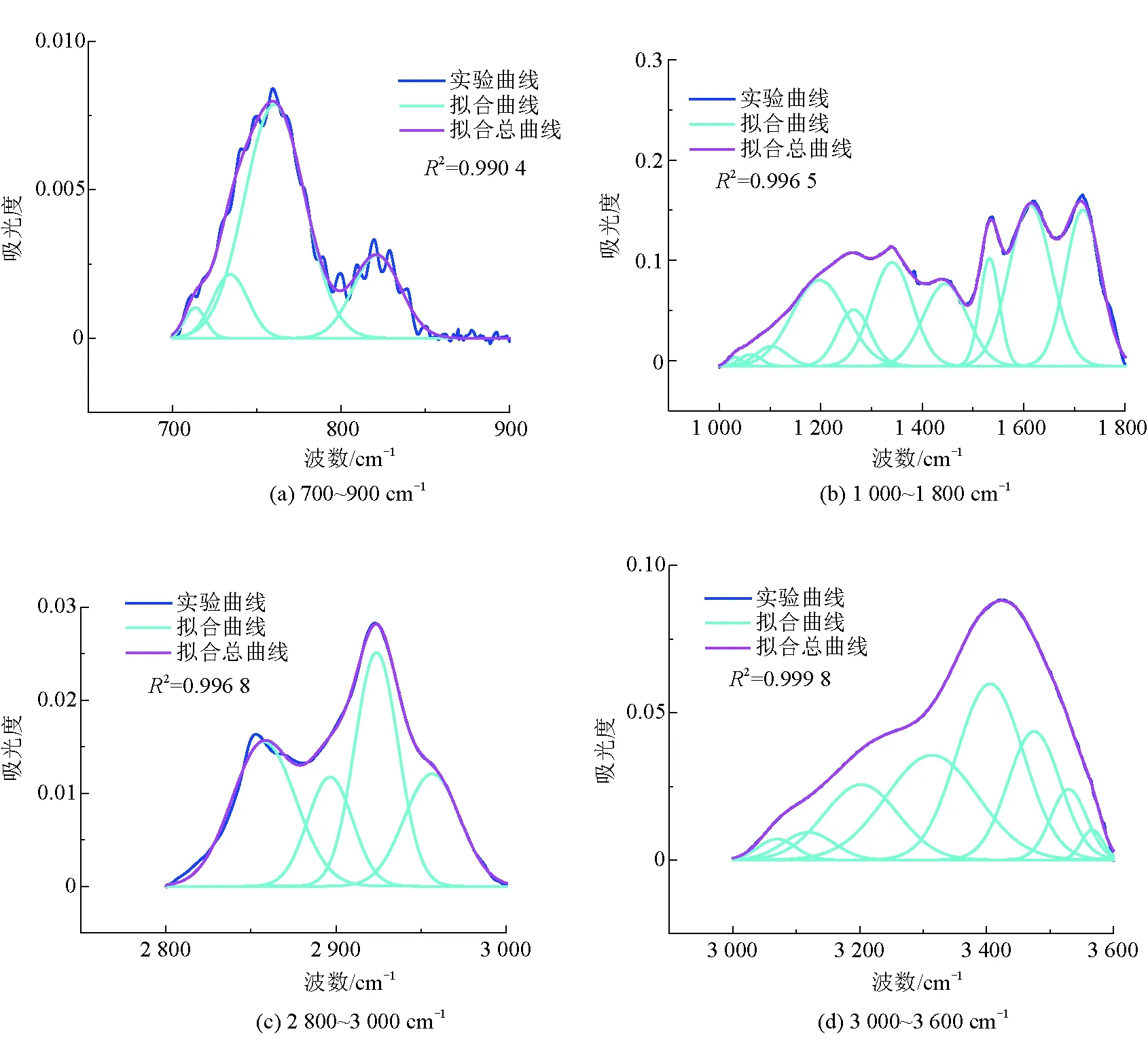
图5 cHAFTIR分峰
腐殖酸FTIR拟合结构参数fa和C′见表7。

表7 腐殖酸FTIR拟合结构参数
由表7可以看出,2种生物腐殖酸的芳香度相差不大,与化学腐殖酸相比芳香度较低,说明这2种生物腐殖酸含有脂肪族链较多,低分子化合物较多;从C'可以看出,这2种生物腐殖酸含氧官能团含量相差不大,都小于化学腐殖酸含氧官能团数量,这与元素分析的结果一致,这也解释了紫外分析中化学腐殖酸E4/E6比值大于生物腐殖酸,是由于化学腐殖酸含氧官能团含量较高引起的。
2.3.4 XRD分析
为了解生物腐殖酸和化学腐殖酸在微晶结构方面的差异,通过X-射线衍射对3种腐殖酸样品的XRD分析如图6所示。

图6 3种腐殖酸样品的XRD分析
由图6可以看出,3种腐殖酸样品均显示出高背景强度,在26°附近出现清晰的002峰,40°附近出现100峰,002峰和100峰分别表示煤中芳香结构单元的平行取向度和平面延伸度,002峰具有对称性,而图6中未表现出不对称性,表明此处呈现的峰由γ和002拟合峰的叠加组成[22]。
使用Origin Pro绘图软件对10°~45°范围内的光谱进行峰值拟合,首先对实验数据进行基线校正和平滑处理,然后对平滑后的曲线进行拟合,曲线拟合过程中获得的参数,如峰位、强度、全宽半最大值(FWHM)、面积,用于计算腐殖酸样品的层间距(d002)、微晶平均直径(La)、微晶平均高度(Lc)和碳层数(N)[23-24]。XRD分峰拟合如图7所示,分峰拟合数据见表8。

图7 3种腐殖酸XRD分峰
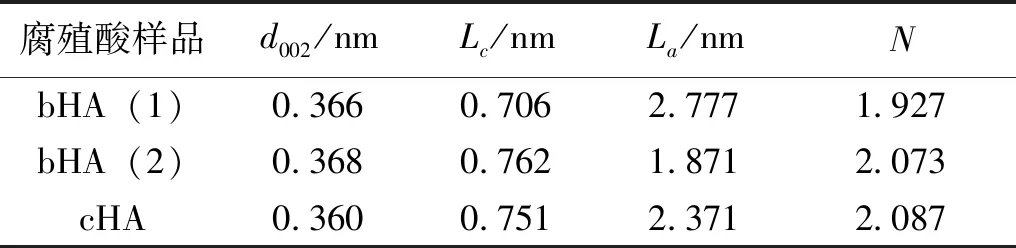
表8 3种腐殖酸XRD拟合结构参数
由表8可以看出,2种生物腐殖酸及化学腐殖酸的La和Lc差别较大,La和Lc共同反映了煤中的微晶尺寸,3种腐殖酸的微晶尺寸差别较大,可能是由于2种细菌及碱抽提法提取腐殖酸的作用部位有差异引起的;对比3种腐殖酸的d002和N,2种生物腐殖酸的d002与化学腐殖酸相比较大,N较小,表明2种生物腐殖酸有比化学腐殖酸大的芳香层片间距和少的碳层数。
2.3.5 腐殖酸营养元素测定
3种腐殖酸营养元素含量见表9。

表9 3种腐殖酸营养元素含量
由表9可以看出,2种生物腐殖酸的N、P、K、Ca、Mg含量远远大于化学腐殖酸,N、P、K为土壤的大量元素,是作物生长所必须的营养元素,Ca、Mg等虽为微量元素,但也是作物生长过程中不可或缺的元素[25-26]。同时这些营养元素也分为全量元素和有效态元素,有效态元素才是可以被植物所吸收的元素,腐殖酸有助于提高营养元素的有效性,使其更容易被作物吸收[27]。生物腐殖酸含有远高于化学腐殖酸的营养元素,配合腐殖酸提高营养元素的有效性,使得生物腐殖酸比化学腐殖酸作为农作物营养源更具优势。
3 结论
(1)通过单因素实验和正交实验得到了荧光假单胞菌在煤浆浓度0.5 g/50 mL、提取时间14 d、菌液用量12 mL/50 mL时对煤样腐殖酸的提取率最高,为32.87%;蜡样芽孢杆菌在煤浆浓度0.5 g/50 mL、提取时间14 d、菌液用量8 mL/50 mL时对煤样腐殖酸提取率最高,为38.23%。
(2)元素分析、UV-vis和FTIR分析表明,2种生物腐殖酸与化学腐殖酸相比拥有有较小的分子量、低的芳香度和较少的含氧官能团;XRD分析表明,2种生物腐殖酸相较于化学腐殖酸有较大的芳香层片间距和较少的碳层数。
(3) 3种腐殖酸的营养元素含量测定表明2种生物腐殖酸的N、P、K、Ca、Mg的含量远远高于化学腐殖酸,这种差异会使生物腐殖酸在作为农作物营养源时更具优势。另外,微生物提取反应条件温和,清洁无污染。
(4)利用微生物降解富油煤提取腐殖酸的最高产率相对碱提取法降低了4.47%,但是微生物降解的工艺条件温和、清洁无污染,而且生物腐殖酸具有远高于化学腐殖酸的营养元素,作为农作物营养源更具优势。因此,本研究为富油煤的清洁和高价值转化提供新途径。

