参芩凝胶中小檗碱、黄芩苷经皮微量渗析取样方法的建立及促渗工艺评价
张建军,李洁环,王利胜,苏安宇
[1.广东省第二中医院(广东省中医药工程技术研究院),广东省中医药研究开发重点实验室,广东广州 510095;2.广州中医药大学中药学院,广东广州510006]
参芩方由苦参、黄芩、黄柏等药味组成,原为搽剂,是广东省第二中医院的院内制剂,多年来一直用于治疗由湿疹引起的皮肤瘙痒或炎症感染、糜烂、结痂,疗效确切,年使用量达1 万瓶。但是参芩搽剂的生物利用度较低,其所含有效成分因水溶性低极易结晶析出,难以分散均匀,临床使用过程中易干燥,药物作用时间短,且载药量小,皮损广泛者用药也受到限制,因而制约了其推广应用。为提高该方有效成分的溶解度和分散度,增加药物透皮吸收,提高其生物利用度,课题组在前期的研究中,已将其开发制成了凝胶制剂,完成参芩凝胶处方的筛选及制备工艺优化,现拟进一步研究其体内皮肤局部药动学。
微量渗析取样技术是基于膜渗析原理,将渗析探针埋植于活体组织中,在基本不干扰正常体内生命过程的情况下,实现活体的连续、动态采样,具有多部位、多组分同时取样,取样量少,避免活体处于失血状态等优点;且取出样品杂质含量少,可直接进入分析系统,分析条件更接近体内条件[1-2]。小檗碱和黄芩苷是参芩凝胶中的重要活性成分,其中,小檗碱具有抗病原微生物、抗肿瘤、抗炎等活性[3],其通过降低T 细胞与外基质的黏附能力,阻断炎性细胞mRNA 的复制与转录发挥抗炎作用[4];黄芩苷具有抗炎、抗病毒、抗菌等生物活性[5],可通过Toll样受体(TLR)、脂多糖(LPS)等影响效应分子的表达和分泌,并影响肿瘤坏死因子-α(TNF-α)和白细胞介素(IL)等炎症因子的水平,干扰相关信号通路,从而达到改善炎症的作用[6]。本研究旨在建立小檗碱、黄芩苷皮肤在体微量渗析取样方法,考察回收率的稳定性等,以明确所建立的微渗析方法的可行性,并初步考察冰片对参芩凝胶的促渗透作用。
1 仪器与材料
1.1 仪器
高效液相色谱仪(悟空K2025);AUW120D 十万分之一电子分析天平(日本SHIMADZU 公司);90-1 型恒温磁力搅拌器(上海沪西分析仪器公司);微量渗析取样系统:MD-0100 灌注器、MD-1001 灌注器推进泵、MD-1000B 流速控制器(美国BAS);CMA30 线性探针(直径0.24 mm,分子截留量6 kDa,瑞典CMA);KQ5200DE 超声波清洗器(昆山市超声仪器有限公司)。
1.2 试药
苦参、黄芩、黄柏等饮片购自广州金芝中药饮片有限公司,经广东省中医药工程技术研究院刘法锦研究员鉴定,苦参(产地:黑龙江)为豆科植物苦参Sophora flavescensAit.的干燥根的加工炮制品,黄芩(产地:山西)为唇形科植物黄芩Scutellaria baicalensisGeorgi 的干燥根的加工炮制品,黄柏(产地:四川)为芸香科植物黄皮树Phellodendron chinenseSchneid.的干燥树皮的加工炮制品,冰片(合成龙脑)购自福建青松股份有限公司,上述饮片经鉴定均为正品,质量均符合《中国药典》2020 年版一部各饮片项下的有关规定。
黄芩苷对照品(批号110715-201318,纯度93.3%)、盐酸小檗碱对照品(批号110713-200911,纯度86.8%)(中国食品药品检定研究院);乙腈(色谱纯,美国MREDA 公司);磷酸(色谱纯,天津市科密欧化学试剂有限公司);无水乙醇(分析纯,天津津东天正精细化学试剂厂);氯化钠(天津市大茂化学试剂厂);乌来糖(上海源叶生物科技有限公司);肝素钠(150 u/mg,兰杰柯科技有限公司);肉豆蔻酸异丙酯、聚氧乙烯蓖麻油(上海阿拉丁生化科技股份有限公司);丙三醇(湖南尔康制药股份有限公司);参芩凝胶(实验室自制)。
1.3 实验动物
SPF 级雄性Wistar 大鼠,体质量200~240 g,动物许可证号:SCXK(粤)2019-0202,广州中医药大学实验动物中心提供。
2 方法与结果
2.1 小檗碱、黄芩苷含量测定方法的建立[7]
2.1.1 色谱条件与系统适应性 色谱柱:Agilent C18柱(4.6 mm×250 mm,5 μm),流动相:乙腈-0.2%磷酸溶液(30∶70);检测波长:230 nm;流速:1 mL/min;柱温:30 ℃;进样量:10 μL;理论塔板数按黄芩苷峰计算应不低于3 000。
2.1.2 对照品溶液的配制 精密称取黄芩苷对照品8.00 mg、盐酸小檗碱对照品3.00 mg 于100 mL 量瓶中,用30%乙醇生理盐水溶解并定容至刻度,配成黄芩苷浓度为80.0 μg/mL、盐酸小檗碱浓度为30.0 μg/mL的混合对照品溶液。
2.1.3 供试品溶液的配制 分别以黄芩苷和盐酸小檗碱混合对照品溶液、30%乙醇生理盐水为灌注液[8-10],分别通过微量渗析探针灌注,收集渗析液,分别作为体外渗析液样品和空白渗析液样品。
2.1.4 专属性试验 取上述混合对照品溶液、体外渗析液和空白渗析液样品,按“2.1.1”项下色谱条件进样测定。结果表明,黄芩苷、小檗碱峰形良好,渗析液中其他成分对本测定无干扰。见图1。
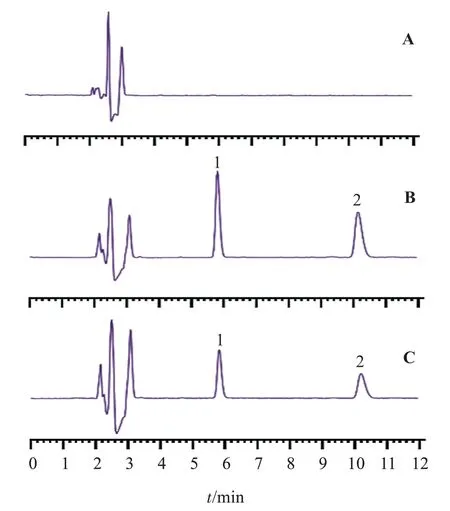
图1 黄芩苷和小檗碱的HPLC图Figure 1 HPLC diagrams of baicalin and berberine
2.1.5 线性关系考察 精密量取上述混合对照品溶液0.001、0.01、0.02、0.04、0.1、0.2 mL,分别置于1 mL 量瓶中,加30%乙醇生理盐水稀释至刻度,配制成浓度分别为0.08、0.8、1.6、3.2、8.0、16.0 μg/mL的黄芩苷对照品溶液和浓度为0.03、0.3、0.6、1.2、3.0、6.0 μg/mL 的盐酸小檗碱对照品溶液。按上述色谱条件进样10 μL 测定,以浓度为横坐标(X)、峰面积为纵坐标(Y)作图,得黄芩苷线性回归方程为Y=12.104X-0.291 2,r2=0.999 9;盐酸小檗碱线性回归方程为Y=28.934X-0.854 8,r2=0.999 7。表明黄芩苷在0.08~16.0 μg/mL、小檗碱在0.03~6.0 μg/mL范围内与峰面积呈良好线性关系。
2.1.6 精密度试验 取黄芩苷、盐酸小檗碱浓度分别为8.0、3.0 μg/mL 的混合对照品溶液,进样10 μL测定,重复进样6 次,计算得黄芩苷、小檗碱峰面积RSD分别为0.32%、0.38%,表明仪器的精密度良好。
2.1.7 稳定性试验 取微量渗析液样品,于第0、2、4、6、8、12、24 h 分别进样10 μL 测定,计算黄芩苷、小檗碱峰面积RSD 值分别为2.88%、0.40%,表明黄芩苷和小檗碱在24 h内稳定。
2.2 微量渗析探针回收率和空白耗损率的测定
增量法:探针外药物经膜渗入探针内,使空白灌注液中药物浓度升高,这个过程叫药物的回收。回收率(R)=C渗析/C组织×100%,其中C渗析代表渗析液中药物的浓度,C组织代表探针植入组织中药物的浓度。
减量法:探针内药物经膜流出探针外,使含药灌注液药物浓度降低,这个过程叫药物的损失或耗损。损失率(L)=(C灌注-C渗析)/C灌注×100%,其中C渗析代表渗析液中药物的浓度,C灌注代表灌注液中药物的浓度。
2.3 灌注速度与取样间隔的确定
取黄芩苷、盐酸小檗碱浓度分别为8.0、3.0 μg/mL的混合对照品溶液适量,置于烧瓶中,将线性探针浸入其中,保鲜膜封住。以30%乙醇生理盐水为灌注液,温度控制在37 ℃左右,在0.5、1、2、3、4 μL/min的流速下进行灌注,灌注1 h 后开始收集不同流速下的渗析液,平行收集3 个样品,每个样品30 μL。按上述色谱条件进样测定,并计算探针体外回收率。
同法将探针浸于30%乙醇生理盐水中,以黄芩苷、盐酸小檗碱混合对照品溶液(黄芩苷浓度为8.0 μg/mL、盐酸小檗碱浓度为3.0 μg/mL)为灌注液,同法在不同流速下灌注并进样测定,计算探针体外空白耗损率。结果见图2。
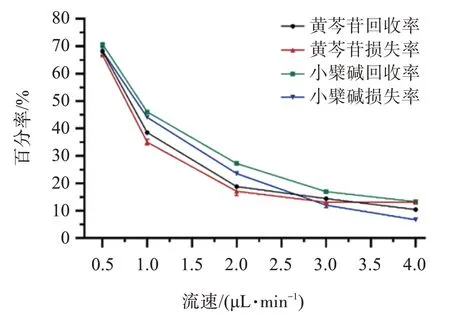
图2 灌注速度对体外回收率和空白耗损率的影响Figure 2 The effects of perfusion speeds on the in vitro R and L of the probe(,n=3)
由结果可知,黄芩苷、小檗碱探针体外回收率均与灌注速度呈负相关,以0.5 μL/min 的灌注速度下体外回收率最高,但低灌注速度下取样时间延长,样品间误差增大,不利于数据获取,而且实验效率低下。综合考虑,确定灌注速度为1 μL/min,取样间隔为30 min,此条件下黄芩苷和小檗碱的探针体外回收率分别为(38.01±0.42)%和(44.74±0.33)%。由实验结果可知,同一灌注速度下两个成分的体外回收率与空白耗损率基本一致,表明反渗析法适用于计算体内回收率。
2.4 药物浓度对体外回收率的影响
取黄芩苷、盐酸小檗碱浓度分别为16.0、6.0 μg/mL,8.0、3.0 μg/mL,3.2、1.2 μg/mL、0.8、0.3 μg/mL 的4 组混合对照品溶液,置于烧瓶中,将探针依次浸入其中,保鲜膜封住。以30%乙醇生理盐水为灌注液,温度控制在37 ℃左右,控制灌注液流速为1 μL/min,开泵运行1 h 后开始收集渗析液,每次收集30 μL,每个浓度收集3个样品,按上述色谱条件进样测定,并计算探针体外回收率。
同法将探针浸于30%乙醇生理盐水中,以上述4组不同浓度的混合对照品溶液为灌注液,同法操作并进样测定,计算探针体外空白耗损率。结果见图3。

图3 药物浓度对体外回收率和空白耗损率的影响Figure 3 The effects of drug concentrations on the in vitro R and L of the probe(,n=3)
由试验结果可知,在试验设计的药物浓度下,黄芩苷、小檗碱的体外回收率基本一致;相同浓度下,黄芩苷、小檗碱各自的探针体外回收率与空白耗损率也大致相等;表明药物浓度对探针体外回收率影响不显著,实验结果也进一步表明反渗析法适用于计算体内回收率。
2.5 微量渗析探针体内回收率稳定性考察
2.5.1 动物处理与探针植入 取25%乌来糖(5 mL/kg)对SD 大鼠进行腹腔注射麻醉后,剃除大鼠腹部皮毛。大鼠仰卧位固定在加热垫上,标记探针植入点。按探针植入操作说明,撕裂管植入大鼠皮下,再将探针插入撕裂管内(探针事先进行饱和:浸泡于1 000 u/mL 的肝素钠溶液中,并以含1 000 u/mL肝素钠的30%乙醇生理盐水作为灌注液进行灌流),随后把撕裂管撕开使探针膜管留在皮下。最后用组织胶将探针固定在植入点。整个过程需保持探针膜湿润,可用30%乙醇生理盐水进行灌流。
2.5.2 探针在体回收率的稳定性考察 以30%乙醇生理盐水为灌注液,以1 μL/min 的流速灌流1 h使平衡后,换成混合对照品溶液(黄芩苷、盐酸小檗碱的浓度分别为8.0、3.0 μg/mL),以1 μL/min 流速继续灌流探针,平衡1 h 后开始收集样品,取样间隔为30 min,按上述方法进样测定并计算各个时间点的探针体内空白耗损率,结合回收率与空白耗损率的关系,考察探针在12 h 内体内回收率的稳定性。结果见图4。

图4 黄芩苷、小檗碱探针体内回收率的稳定性Figure 4 Stability of recovery rates for baicalin and berberine probes in vivo(,n=3)
结果表明,黄芩苷、小檗碱的探针体内回收率分别为(21.91±1.90)%、(40.08±1.87)%,且12 h 内保持稳定,表明经皮微量渗析取样试验过程中,各时间点的探针体内回收率基本一致。因此,对测试所得的渗析液中的药效成分浓度,采用回收率进行校正,即可得到探针外组织液中大致的药效成分浓度,表明该方法可用于黄芩苷、小檗碱的经皮微量渗析取样的研究。
2.6 参芩凝胶促渗工艺的初步研究及评价
本实验选用冰片作为透皮促渗剂,考察冰片加入对参芩凝胶中黄芩苷、小檗碱透皮性能的影响。
2.6.1 参芩凝胶的制备 按前期实验优选的处方和方法制备参芩凝胶。称取7%肉豆蔻酸异丙酯、30%聚氧乙烯蓖麻油、30%丙三醇,将三者混匀,加入黄柏提取物、黄芩提取物(黄柏提取物、黄芩提取物均为实验室自制,各提取物的加入量按原处方生药量及提取物干浸膏得率折算),搅拌均匀,加入不同剂量的冰片(0%、3%,冰片事先用适量乙醇溶解),搅拌均匀后逐滴加水至100 g,同时匀速同向搅拌,加入已充分溶胀的卡波姆至凝胶基质含量为1%,搅匀,滴加三乙醇胺至pH值达6.5~7.5,即得。
2.6.2 冰片对参芩凝胶的促渗作用考察 按“2.5.2”项下方法处理动物并植入探针,以1 μL/min 的流速灌流30%乙醇生理盐水平衡1 h 后,于探针上方大鼠腹部表皮标记2 cm×2 cm 的给药区域,仔细涂抹参芩凝胶1 g,开始收集样品,灌注液为30%乙醇生理盐水,流速为1 μL/min,采样间隔为30 min,按“2.1.1”项下色谱条件进行测定,并利用“2.5.2”项下所得的黄芩苷与小檗碱的在体耗损率,结合回收率与耗损率的关系,考察无冰片凝胶组和3%冰片凝胶组中小檗碱与黄芩苷的透皮释放情况,绘制冰片加入后参芩凝胶皮下黄芩苷、小檗碱药-时变化曲线。结果见图5。
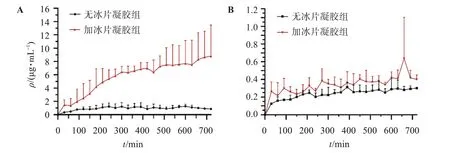
图5 冰片加入后的参芩凝胶皮下黄芩苷、小檗碱药-时变化曲线Figure 5 Drug-time curves of baicalin and berberine in Shenqin gel after borneol addition(,n=3)
结果表明,3%冰片加入后能显著提升参芩凝胶中黄芩苷的透过量,同时对小檗碱的透过量也有一定的提升作用,这对后续参芩凝胶促渗工艺、透皮性能的进一步研究提供了一定的参考。
3 讨论
微量渗析取样技术因其创伤小、可连续动态取样、采集液可直接进样分析等优势,已成为经皮药动学研究的主流[11-12],具有广阔的应用和发展前景。本实验首次建立了参芩凝胶中黄芩苷、小檗碱经皮微量渗析取样的方法,经过对灌注速度、药物浓度的考察,发现探针体外回收率与灌注速度呈负相关,从试验效率和数据稳定性出发,确定灌注速度为1 μL/min,取样间隔为30 min。在此条件下,黄芩苷、小檗碱体外回收率分别为(38.01±0.42)%、(44.74±0.33)%;同时,在试验设计的药物浓度下,黄芩苷、小檗碱的体外回收率基本一致;相同浓度下,两成分各自的探针体外回收率与空白耗损率也无显著差异,证明了反渗析法可用于两成分在体微量渗析取样实验中回收率的测定,从而确定了黄芩苷、小檗碱皮肤在体微量渗析取样的方法。
参芩凝胶由苦参、黄芩、黄柏等药味组成,其中苦参、黄芩为方中君药,黄柏为方中臣药,均具有清热燥湿、解毒之功效。实验前期对渗析液中苦参碱、氧化苦参碱的含量测定方法进行了考察,发现样品不经过中性氧化铝柱处理时色谱峰分离度较差,无法满足定量分析的需求,且凝胶样品经过透皮吸收,渗析液中苦参碱、氧化苦参碱含量偏低,再经过过柱处理,几乎测不到渗析液中苦参碱、氧化苦参碱成分,因此,选择君药黄芩中黄芩苷和臣药黄柏中小檗碱作为本研究的含测指标。
由于灌注液的选择要考虑与组织中细胞外液的相关因素尽可能相近,以减少灌注液对动物体内环境的影响,提高实验结果的准确性[8]。为减少实验误差,提高系统适应性,实验拟采用微渗析介质来配制对照品溶液。因此,在前期实验中,试用过林格氏液和生理盐水作为灌注液,但由于黄芩苷几乎不溶于水,在这两种灌注液中溶解不充分。经查阅文献后,采用30%乙醇生理盐水作为灌注液时,黄芩苷可溶,且未见30%乙醇生理盐水有不良效果的报道,因此,本研究采用30%乙醇生理盐水作为灌注液。在后续研究中,将继续对灌注液的种类进行优选,以期筛选出更加优良的微渗析介质。
冰片是一种常用的化学促渗剂,能改变皮肤角质层结构从而促进药物经皮渗透,本身也具有抗菌、消炎、止痒的外用功效。本研究拟在参芩凝胶中加入适量冰片以促进方中有效成分透皮吸收,提高疗效。为考察冰片在微渗析中对参芩凝胶的促渗效果,对加入冰片与未加冰片的样品开展了比较实验研究。在前期研究中,通过Franz 扩散池法初步考察了冰片对参芩凝胶的体外透皮促进作用,发现质量浓度为3%的冰片具有较好的促进透皮效果。因此,本研究采用加入3%冰片与未加冰片的样品进行比较。后续将继续开展不同质量浓度冰片促渗效果的研究,优选最佳剂量,并考察不同冰片种类(天然冰片、合成冰片)及其他促渗剂对参芩凝胶的影响。
在参芩凝胶的初步促渗工艺研究中,发现3%冰片对黄芩苷的促渗效果比对小檗碱的促渗效果显著。分析原因可能是对于促渗小檗碱来说,冰片的加入量还不够多,或冰片不是小檗碱的最优促渗剂[13-15]。在一些研究中也出现相同的研究结果,郭淑娟[16]、欧阳丽影[17]的研究中,冰片对黄芩苷的促渗作用显著,杨丹[14]的研究显示3%冰片对小檗碱有促渗透作用,但与冰片对黄芩苷的促渗相比,其对小檗碱的增渗比明显小很多,促渗作用较弱。但这一研究结果尚缺乏充分的讨论与系统性研究。笔者认为冰片的促渗原理是改变表皮角质层的微结构[18],具有广泛的促渗作用,黄芩苷因其水、醇溶性差的特性[19-20],本身难以透过表皮角质层,当加入冰片后可以得到显著的透皮效果;而小檗碱本身分子量小、脂溶性与水溶性良好,本身就有较好的透过性能,故加入冰片对小檗碱的表皮角质层透过量影响相对较小。相关研究有待进一步实验验证。

