煤、污泥和生物质三类典型燃料的热解气生成特性研究
陈发林,熊小鹤,吕钊敏,谭厚章
(西安交通大学热流科学与工程教育部重点实验室,陕西 西安 710049)
0 引言
在“碳中和、碳达峰”的背景下,固体燃料的利用呈现多元化局面,具体表现在,以煤作为传统燃料正被逐渐弱化,而被认为是“零碳排放”的生物质燃料则逐渐受到重视[1],另一方面,国家也重视和鼓励开展固体废弃物的资源化利用,以往被视为废弃物的市政污泥,由于其具有一定热值且待处理量大(已超过9 000 万t[2]),也被赋予了“燃料”属性。热解作为燃料热转化过程重要的前驱步骤,对燃料后续燃烧、气化或液化都有重要影响,因此,开展这些不同类型的固体燃料热解特性研究有重要意义。
近几十年来,煤和污泥的热解气生成特性受到国内外学者广泛关注。ZHANG等[3]采用热重-质谱(Thermogravimetry-Mass Spectrometry,TG-MS)联用技术研究了三种煤的热解特性和产气规律,结果表明,三种煤在热解过程中的产气规律相似,H2和CH4是两种主要的热解气体产物。LI等[4]采用落管式热解炉研究了平庄煤的热解特性,发现随着热解温度升高,H2和CO 明显增多,而CO2、CH4和C2-C3烃类产率逐渐减少。LIU等[5]采用TG-FTIR-GC/MS 技术研究了胜利褐煤热解挥发产物,得出小分子热解气体主要是煤中羧基、羰基、脂肪族链和芳香族结构断裂和缩聚释放的CO2、CO、CH4以及轻芳烃,另外还得出CO 初始析出温度为300 ℃,高于CO2,低于CH4,最高含量析出温度为540 ℃。ZHU等[6]采用热重分析仪-傅里叶变换红外分析(Thermogravimetric-Fourier Transform Infrared Spectroscopy,TG-FTIR)研究了预干燥脱水污泥的热解特性,热解气成分分析结果表明,热解过程中主要气体成分为CH4、CO2、CO。ZAKER等[7]综述了污泥热解过程中热解气析出特性,热解气大量析出主要发生在热裂解阶段,低于600 ℃时,C-H 键和C=O 键断裂产生CH4、CO 和CO2,随着温度的升高,气相产量增加,高温有利于CH4、CO 等合成气的生产。生物质因其可再生、“零碳”排放和污染物排放较低引起广泛关注[8]。我国农村地区每年都会种植大量的辣椒,产生的废弃秸秆可以作为一种可依赖的能源资源,因此,研究其热解产气特性十分重要。牛艳青[9]等探究了低热解温度下辣椒秆热解过程,发现辣椒秆的热解率最高可达79%,且气相物质产量可观。另外,无论是煤、污泥还是生物质燃料,其燃烧过程中的NOx排放一直是关注热点,根据相关报道[10-12],燃料在热解过程中部分燃料氮会以N2的形式释放,这为减少燃烧过程NOx排放提供了一种思路,即通过调控热解条件来提高N2析出量,进而降低燃烧过程中燃料氮向氮氧化物的转化率。
通过梳理文献,发现同时比较煤、污泥和生物质三类燃料的热解气析出特性的研究不多,基于此,选取三种煤(石炭煤、神混煤和韩城煤)、污泥和辣椒秆作为研究对象,采用固定床热解装置,探究不同温度下各固体燃料的热解气(CO、CO2、H2、C2H2、C2H4和N2)生成特性,了解和比较不同类型燃料的热解特性,拓展其工业应用。
1 实验方法与设备
1.1 实验试样
实验选取石炭煤(ST)、神混煤(SH)、韩城煤(HC)、污泥(WN)和辣椒秆(LJG)等五种燃料作为研究对象,粒径38~61 μm,具体参数见表1,表中Mad为空气干燥基水分,Aar为收到基灰分,Vdaf为干燥无灰基挥发分,FCad为空气干燥基固定碳,可见挥发分含量辣椒秆最高、韩城煤最低;N 含量污泥最高、神混煤最低。

表1 实验试样工业分析与元素分析结果 单位:%
1.2 固定床热解系统
图1 为固定床热解实验系统,主要包括载气钢瓶(He 和N2)、浮子流量计、质量流量计、GSL-1700X管式炉、热解气收集器(气球)和热解气体成分分析装置(气相色谱仪GC-2014 和计算机)。实验在五种不同温度(600 ℃、800 ℃、1 000 ℃、1 200 ℃和1 300 ℃)下进行。实验初始,待管式炉温度升至热解终温,打开浮子流量计吹扫2 min,流量为5 L/min,同时抽气三次,待排尽装置中的空气后,将试样(2 g)平铺放入石英舟中,然后置于管式炉入口处,继续He吹扫1 min。吹扫完毕后关闭浮子流量计,打开质量流量计(流量为500 mL/min),将试样迅速推入管式炉恒温段并热解1 min,热解气体使用气球收集,测过体积后进行成分分析。每一组实验均有空白样作为对照,即推入空坩埚重复上述步骤,热解气产率为两者之差;测量H2采用N2作为热解载气,其余组分含量测样均以He 为载气。使用气相色谱仪(GC-2014)分析热解气体成分,可检测物质最低体积浓度为1~100 μL/L,准确度为0.1%。
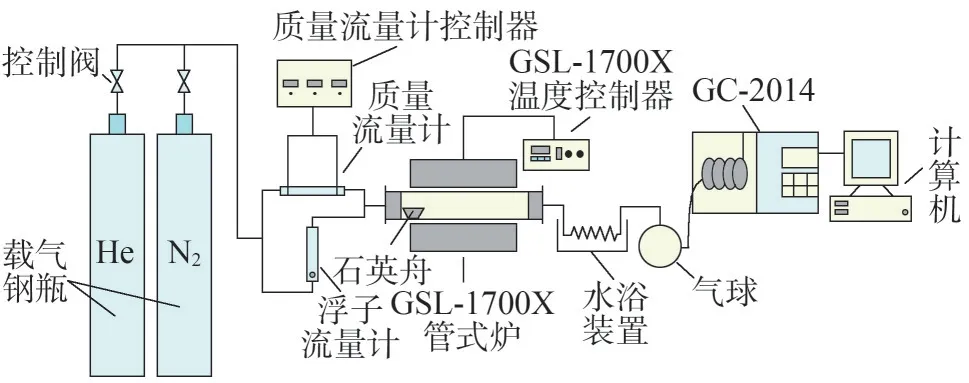
图1 固定床热解实验系统
1.3 N2转化率定义
关注燃料热解过程中N2产率对于后续燃烧过程中NOx减排具有重要意义,将热解过程中燃料氮向N2的转化量定义为N2转化率[12]

式中:φN2为燃料氮的N2转化率,%;V为收集的烟气体积,L;CN2为烟气中N2平均体积浓度,μL/L;m为试样质量,g;wN为试样干燥基氮元素质量分数,%。
2 实验结果与分析
图2 显示了不同温度下各燃料热解气生成量的变化趋势,可以看出,温度是影响热解气生成的重要因素,各燃料热解气产率随温度升高而增大。对于煤:SH 热解气产率大于ST 和HC;在700~1 100 ℃之间,HC 热解气产率大于ST,高温下(>1 100 ℃)则是ST大于HC,表明部分煤种的热解气产量与煤化程度无关[13];SH和ST热解气生成量随温度升高呈现先增强后减弱的增加趋势,HC 则是增强—减弱—增强的增加趋势,SH 和HC 热解产气速率最快温度区间相同,均为800~1 000 ℃,ST 主要为1 000~1 200 ℃。WN 热解气生成量大于三种煤,这是WN 水分和有机成分高、结构稳定性较煤差所致,其热解气产率随温度升高呈现逐渐减弱的增加趋势,最快产气速率区间为600~1 000 ℃。LJG 热解气产率远高于同温度下其他燃料,这主要得益于其挥发分含量高,在800~1 000 ℃间,LJG 热解产气速率最快,析出增量为224.9 mL/g,主要是热解过程中产生的生物油二次裂解成气相产物,此时LJG热解率接近最大。

图2 温度对不同燃料热解气产率的影响
图3 给出了不同温度下各燃料热解N2转化率,结果表明,燃料氮向N2的转化率受温度影响大,除LJG 外,其余燃料的N2转化率随温度升高而增大。三种煤的N2析出规律基本一致,最高N2转化率对应热解温度均为1 300 ℃,ST 和HC 最高N2转化率约为42.5%,SH 约为30%;温度较低时(<1 000 ℃),SH 的N2转化率高于ST 和HC,而较高温度下(>1 200 ℃)则是SH 显著低于ST 和HC,表明低温下挥发分含量越高的煤的N2释放越容易,而高温下N2释放主要受制于各燃料的燃料氮含量及固相反应。WN 在800~1 000 ℃间N2的析出速率较快,1 000~1 300 ℃间析出速率逐渐减缓,最高N2转化率同样为1 300 ℃,最高接近60%,远高于煤和LJG,这是因为WN 含氮量高且物质结构较煤稳定性低,N2更容易释放。LJG 的N2转化率呈单峰,峰值温度为800 ℃,这与其他燃料明显不同,LJG 的结构稳定性较煤和WN 差,在600~800 ℃,N2就已随挥发分大量析出,高温下(>800 ℃),N2产率明显降低则是因为气相产物二次反应,部分N2转变成其他含氮中间体。热解温度较低时(<800 ℃),高挥发分燃料的N2转化率较高,这是快速热解过程中产生的大量自由基粒子(H•、•OH 和N•)与HCN 和部分键能较低的含氮杂环综合作用的结果[12],其主要过程是HCN 与H 和OH 自由基结合生成N 自由基,进而生成N2;部分热稳定性差的含氮杂环受到自由基粒子攻击发生热分解产生N2。随着热解温度升高,低挥发分燃料的N2转化率逐渐增大,含氮杂环中的N-5、季氮向N-6 转化以及N-5、N-6 向N-Q 转化过程均会释放大量N2,另外,挥发分氮对N2产率也有一定贡献,主要是900 ℃下NH3的分解以及焦油氮和HCN 与活性矿物质的二次反应[12]。随着热解终温持续升高至1 300 ℃,五种燃料的N2转化率由大到小顺序为:WN、ST、HC、SH、LJG,与各燃料N 元素含量呈正相关关系,说明在高热解温度下,燃料氮含量是N2转化的关键因素。
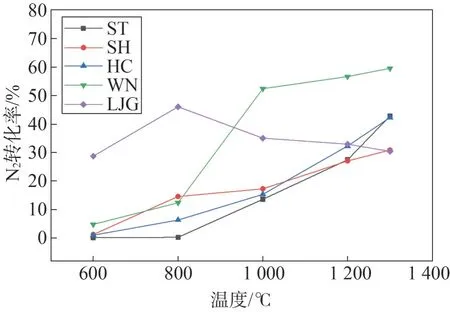
图3 不同温度下各燃料热解N2转化率
图4 为H2析出特性曲线,可以看出,热解过程中H2的释放受温度影响较大[13],各燃料的H2产率随温度升高而增大,其中LJG 和WN 的H2产量随温度变化幅度显著大于煤,同温度下,H2产率由大到小顺序为:LJG、WN、SH、ST、HC。就煤而言,SH 的H2析出量最大,ST次之,HC最小,明显与煤干燥基挥发分含量呈正相关关系,煤中H含量对H2产量影响较小,ST 和HC 的H2析出规律相似,H2产量相差较小。H2主要来源于燃料的脱氢反应,主要包括脂肪链的脱氢缩合、脱氢环化、环烷烃的芳构化以及芳烃的缩聚脱氢[14-15]。430~600 ℃是热解过程中H2较早析出阶段,主要由大分子结构破裂生成的自由基缩聚以及氢化芳香结构的脱氢反应,产生少量H2,因此600 ℃下H2产量较少。另外,在600~800 ℃,LJG 和WN 的H2产率显著大于煤,这是因为LJG 和WN 物质结构稳定性较煤差。随着热解终温升高,燃料中大分子C-H 键断裂速度加快,长直链烷烃断裂缩合环化,芳香核缩聚成煤焦,产生的大量H 自由基相互结合生成H2[15]。由于WN 和LJG 的结构稳定性较煤差,上述脱氢反应更加剧烈,从而产生更多H2,另外,在600~800 ℃时,反应C+H2O→CO+H2和CO+H2O→CO2+H2也是主要原因之一。
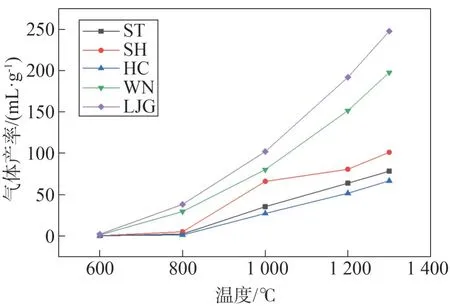
图4 不同温度下各燃料H2释放特性
图5 是CH4析出特性曲线,可以看出,各燃料的CH4析出曲线呈宽单峰,析出规律基本一致,最高CH4产率温度在1 000 ℃左右。LJG的CH4产量最大,SH次之,WN、ST和HC相近。与其他燃料不同的是,ST 的CH4产量在1 000~1 200 ℃温度区间略微增大,这是因为在该温度区间是ST 热解产气速率最快,CH4随挥发分一起析出,从而CH4产率略微增大。CH4主要来源于热解过程中各种官能团的脱落,热解过程中直接产生CH4主要有α 位或β 位甲基官能团的裂解以及甲氧基团的脱甲基反应等方式[14,16]。在600~800 ℃之间,各燃料均有少量的CH4产生,这主要是较短脂肪烃侧链上的甲基官能团键能较低,受热裂解产生的甲基自由基进一步与氢结合生成CH4,另外,与杂原子(O 或S)相连的脂肪链断裂所需温度也较低,对CH4的生成也有贡献。随着温度进一步升高,脂肪烃类官能团断裂、芳环脂肪侧链受热裂解、芳环杂环结构断裂以及芳香结构缩聚等反应相互重叠,释放大量CH4。
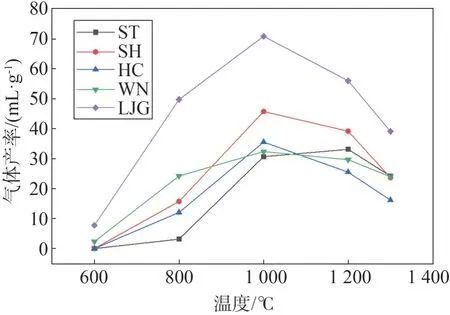
图5 不同温度下各燃料CH4释放特性
图6(a)、图6(b)分别是CO 和CO2析出特性曲线,结果表明,WN 与LJG 的CO 和CO2产量远大于煤,这与燃料物质组成和结构特征有关。煤的CO 和CO2释放规律相似,且深受煤化程度影响,煤化程度越高,产气量越少,更多的C 被固定在煤焦中。各燃料的CO 析出量随温度升高呈现逐渐增强的增加趋势;LJG 的CO2析出量随温度升高呈现逐渐减弱的增加趋势,其余则为先增大后减小,即存在明显的CO2析出峰值温度。CO 主要来源于羰基、醚键等含氧杂环以及酚羟基的热解[17-18]。温度低于800 ℃时,羰基、短链脂肪酸以及部分键能较低的含氧杂环断裂产生少量CO,因此在低温度下,CO 产量较低;温度高于800 ℃时,酚羟基、醚键以及键能较高的含氧杂环开始发生缩合和断裂,释放出大量的CO。另外,高温下半焦与CO2的二次反应也是CO 析出速率增加的原因之一。CO2来自燃料中羧基、酯类等含氧官能团的裂解,其产率主要取决于燃料中羧基官能团的数量[19]。羧基在200 ℃以上会发生分解产生CO2,因此较低温度下,CO2生成量即可达到最大,但从图6(b)得出CO2析出温度区间较广,且在600~1 000 ℃仍呈上升趋势,这与含羧基结构热稳定的多样性有关,即热稳定性较差的含羧基结构在低温下就会发生分解产生CO2,而热稳定性较强的含羧基结构则需要更高温度才能发生脱羧反应生成CO2。另外,高温条件下CO2产气量降低是因为与半焦发生二次反应产生CO,LJG 热解率在1 000 ℃时已接近最大,因此CO2产量不受该反应限制。
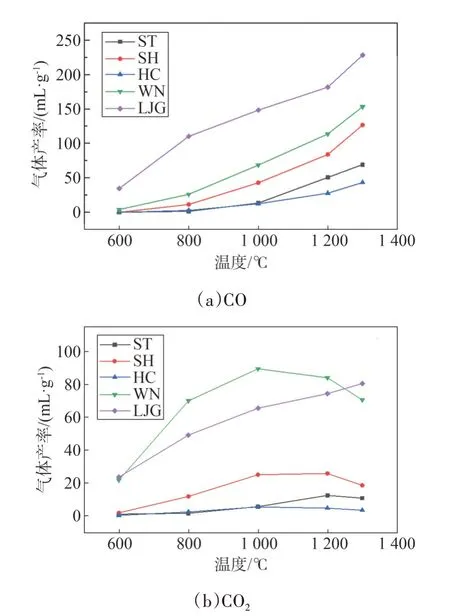
图6 不同温度下各燃料CO和CO2释放特性
图7(a)、图7(b)是C2烃(主要是C2H2、C2H4)的析出特性曲线,可见各燃料的C2烃产量较低,均低 于20 mL/g,且析出量C2H4大于C2H2。LJG 和WN的C2烃析出量普遍大于煤,两者C2烃析出量呈单峰状,C2H2析出峰温较C2H4大。煤的C2H2和C2H4的析出特性规律不同,其中C2H2随温度升高产量逐渐增大,C2H4则是先增大后减小。C2烃的来源主要有两种方式[14,20]:1)芳环脂肪侧链发生热分解断裂,且芳环数越多、脂肪链越长,其侧链越不稳定;2)游离相中的脂肪烃发生自由基裂解也会产生C2烃。
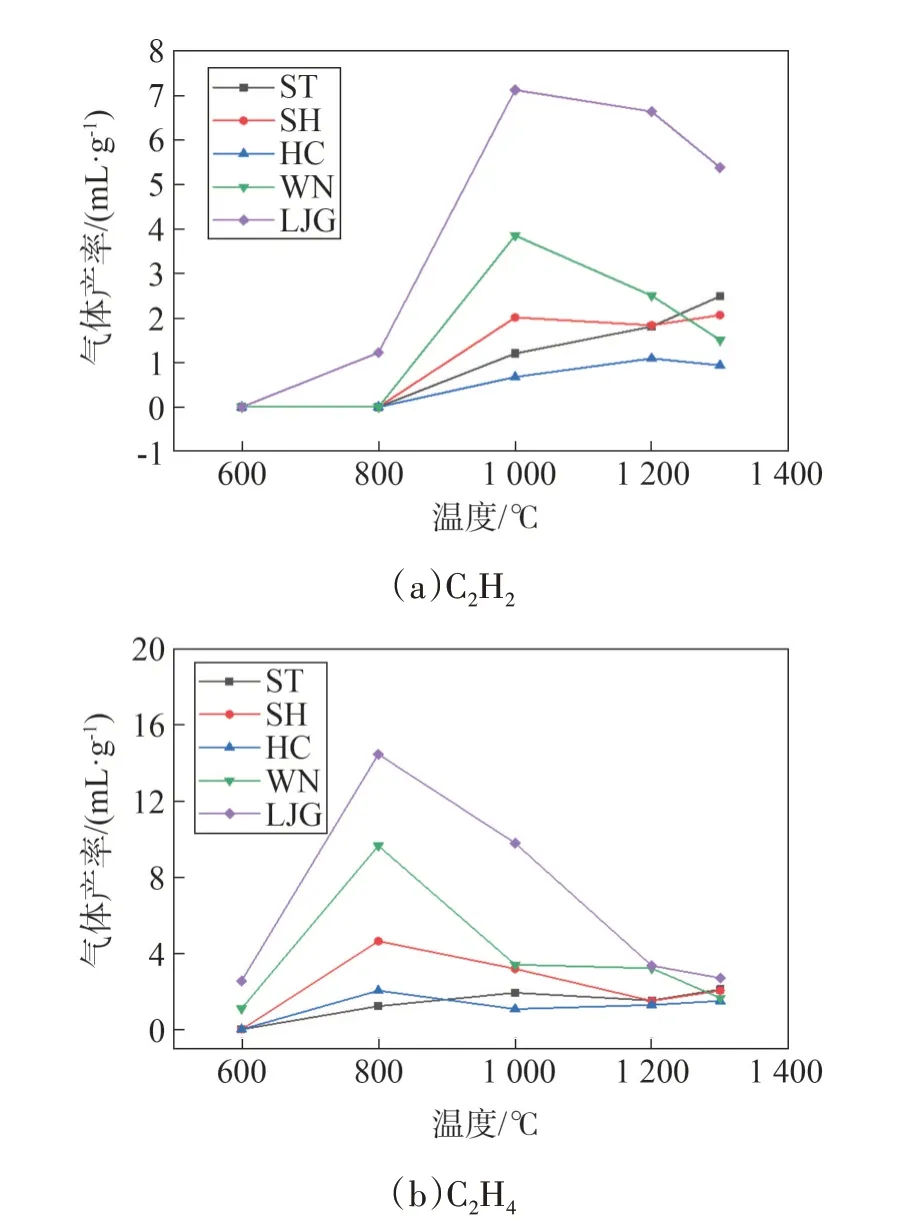
图7 不同温度下各燃料C2烃释放特性
3 结语
选择了三种煤、WN 和LJG 等燃料制备热解气,比较了不同温度下这些不同类型燃料的热解气生成特性。
温度是影响热解气析出的重要因素,各燃料热解气产率均随温度升高而增大。各燃料热解产气速率最快温度区间为:ST(1 000~1 200 ℃)、SH(800~1 000 ℃)、HC(800~1 000 ℃)、WN(600~1 000 ℃)和LJG(800~1 000 ℃)。
提升热解温度有利于煤和WN 中燃料氮向N2转化,两者最高N2转化率均在1 300 ℃,煤最高约为42.5%,WN 则接近60%。与煤和WN 明显不同的是,LJG 的N2析出曲线呈单峰,峰值温度为800 ℃,温度越高越不利于LJG 中燃料氮向N2转化。在1 300 ℃时,五种燃料的N2转化率由大到小顺序为:WN、ST、HC、SH、LJG,与各燃料N元素含量呈正相关关系。
各燃料热解气中,H2、CH4和CO 组分含量较高,CO2和N2次之,C2H2和C2H4最低;WN 和煤的热解气各组分的析出特性相似,其中CH4、CO2、C2H2和C2H4存在峰值温度,N2、H2和CO则是随温度升高而增大。
各热解温度下五种燃料的H2和CO 产率大小顺序相同,均为LJG、WN、SH、ST、HC,对于LJG 和WN 而言,通过热解制取高热值燃气(H2和CO)是一种有效利用途径。

