康复训练通过DCC/APPL-1/AKT通路对缺血性脑卒中大鼠功能恢复和神经细胞凋亡影响
郭娜,张勃
1 天津中医药大学第一附属医院脑病康复科,天津300193;2 国家中医针灸临床医学研究中心;3 天津中医药大学体育健康学院
缺血性脑卒中是由于多种原因限制脑部血液供应,导致局部脑组织缺氧和缺血性坏死以及相应神经功能缺失的一类临床综合征。该病具有高病死率、高复发率和高致残率的特点[1]。幸存者中约有一半以上的患者伴有不同程度的后遗症,包括吞咽障碍、半身不遂、言语不清等[2]。缺血性脑卒中神经损伤的机制较多,病因不同,发病机制、发病时间和临床类型等不同,主要实施个体化治疗[3]。随着神经可塑性理论的发展和“治疗时间窗”的提出,缺血性脑卒中的早期治疗备受关注[4]。目前,溶栓治疗是缺血性脑卒中最有效的治疗措施,但溶栓时间窗只有3~4 h,很多患者无法满足此条件,所以,尽可能减少后遗症成为缺血性脑卒中治疗的首要任务[5]。康复医学主要治疗因疾病或者外伤遗留的功能障碍、生活和工作能力暂时性减弱或丧失,使其功能尽可能地最大限度恢复[6-7]。研究表明,脑卒中的康复治疗可有效帮助患者恢复大脑和肢体功能,重返社会[8]。2021 年8 月—2022 年 3 月,我们探讨了康复训练对脑卒中大鼠功能恢复和神经细胞凋亡的影响及机制。现报告如下。
1 材料与方法
1.1 动物和试剂 健康成年Sprague-Dawley (SD)大鼠100 只,体质量250~280 g,购于北京维通利华实验动物有限公司,清洁级,标准的饲料与纯净水喂养,温度在21~25 ℃,湿度为40%~60%,实验动物许可证号:SYXK(京)2021-0019。MK2206 试剂(AKT抑制剂)购自美国Sigma-Aldrich 公司;LY294002 购自英国Abcam 公司;DCC、APPL-1、P-AKT 和AKT 一抗购自碧云天生物技术有限公司。
1.2 动物建模 随机抽取80 只大鼠建立大脑中动脉闭塞(MCAO)模型,10%水合氯醛将大鼠麻醉,左心室局部注射LY294002 5 μL,30 min后采用缝合法进行MCAO 建模,用2%戊巴比妥钠腹腔麻醉大鼠。颈部皮肤乙醇消毒后行正中切开,然后钝性剥离皮下组织,分离右侧锁骨与胸骨舌肌之间的右侧颈总动脉(CCA)、颈外动脉(ECA)和颈内动脉(ICA)。在颈内外动脉分叉处结扎颈外动脉,并结扎近心端的颈总动脉。在近端ECA 结扎区切一个0.25 mm 的孔,距ICA 和ECA 分叉约5 mm 处缝合,从ECA 和分叉18~20 mm 处进入ICA,阻止大脑中动脉(MCA)的进入并结扎ECA 近端部分。2 h 后从ECA 中抽出缝线再灌注。将未行造模的20只大鼠作为假手术组,假手术组大鼠进行类似手术,但线栓不入颅,不阻断MCA 的血流。在全手术过程,采用加热垫将大鼠体温保持在37 ℃左右,待大鼠清醒后放回笼中,同时自由进食和饮水。
1.3 分组和康复训练 80 只造模大鼠随机分为自然恢复组、自然恢复+MK2206 组、康复训练组、康复训练+MK2206 组,每组20 只。造模48 h,康复训练组和康复训练+MK2206 组开始进行康复训练。自然恢复+MK2206 组和康复训练+MK2206 组中的大鼠侧脑室注射MK2206 试剂。康复训练步骤:①平衡木训练:将大鼠置于长1.7 m、宽2 cm 的方棒上爬行,方棒水平放置在支架上,距地面7 cm,该训练主要评估大鼠的协调性、行走能力和平衡能力。②旋转棒训练:将大鼠置于长1.5 m、直径4.5 cm 的圆棒上爬行,圆棒以3 r/min(半径2.25 cm),顺时针和逆时针方向交替旋转,该训练主要评价大鼠模型的动态平衡能力;③滚筒训练:将大鼠置于长65 cm、直径60 cm 的训练模拟器中,中间可分为4 个正方形。训练装置两侧固定,一侧装有手摇曲柄,转速为5 r/min(半径30 cm),该训练主要评价大鼠模型的抓握、旋转等运动能力。该训练方案7 d/周,2次/d,每次10 min,训练的前3 d可控制训练强度。自然恢复组、自然恢复+MK2206 组的大鼠自由饮水和进食,自由活动,均在普通笼中饲养。造模过程中自然恢复+MK2206组死亡2只,剔除实验。
1.4 大鼠神经功能和运动功能评分 分别于术后2、7、14、21 d进行神经功能和运动功能评分,神经功能评分参照Bederson 评分标准,无神经功能障碍大鼠为0分;左侧前肢屈曲,提起时左前肢不能上抬为1分;行走时左侧旋转为2分;行走时向左侧倾倒为3分;不能独立行走或者昏迷为4 分。运动功能评分依据平衡木实验,将大鼠置于30 cm×1.3 cm 的棒上,保持平衡。大鼠站在平衡木上保持平衡为1分;一侧爪子握住木条或者在木条上摇晃为2 分;一或者两个肢体滑下木条为3 分;三个肢体均滑下木条为4分;在平衡木上力争保持平衡,但滑下为5分;在平衡木平衡失败,然后跌落为6分;从平衡木上直接跌落为7分。
1.5 大鼠海马组织DCC、APPL-1、AKT、P-AKT蛋白表达检测 采用Western blotting法。术后14 d,每组取5只大鼠进行海马组织提取,采用3%戊巴比妥麻醉大鼠,直接断头取脑,并分离海马组织。采用生理盐水冲洗海马组织,液氮研磨,转移到离心管中,加入RIPA裂解缓冲液进行完全裂解,BCA蛋白检测试剂盒蛋白浓度。用10%聚丙烯酰胺凝胶电泳分离,转膜。采用5%胎牛血清封闭1 h,加入DCC(1∶1 000稀释)、APPL-1(1∶1 000 稀释)、AKT(1∶5 000 稀释)、P-AKT(1∶5 000稀释)一抗,4 ℃过夜。然后添加相应的山羊抗兔二抗,室温下孵育1 h,清洗3次,以β-actin为内参,采用ECL发光,暗室内显影、曝光,凝胶成像仪拍照,采用Image J软件进行灰度值分析。
1.6 大鼠海马组织中DCC、APPL-1、AKT 阳性表达检测 采用免疫组化法。石蜡切片,烘烤,采用二甲苯脱蜡,依次用100%、95%、75%、50%乙醇依次水化,采用PBS 洗涤。同时加入1 滴过氧化氢,室温孵育10 min,PBS 洗涤,加入柠檬酸盐,烘干后,PBS 再次冲洗,加入山羊血清,室温孵育5 min,脱去血清,加入1∶75稀释的DCC,1∶100稀释的APPL-1、1∶100稀释的AKT一抗,室温过夜,PBS冲洗3次。取石蜡切片加入生物素标记的山羊抗兔二抗,室温孵育15 min,PBS冲洗3次,再将石蜡切片加入过氧化物酶标记的卵白蛋白溶液中,室温孵育15 min,加入新鲜二氨基联苯胺,普通显微镜下观察,苏木精重新染色,二甲苯脱水,用中性树脂胶固定,在光学显微镜下拍照。随机选取5个视野,计算阳性细胞数量,取平均值。
1.7 大鼠海马神经细胞凋亡检测 将各组海马组织剪成1 mm3左右的碎块,加入0.25%胰蛋白酶,在37 ℃、5%CO2培养箱中消化,用20%胎牛血清的DMEM/F12 终止消化,悬浮、离心、过滤,收集细胞。选择各组神经细胞,以每孔2×104个细胞接种在24孔板中。隔夜孵育后,按照制造商说明书,用Annexin V-FITC-PI 凋亡试剂盒染色,在流式细胞仪上进行分析,所有实验重复3次。
1.8 大鼠海马神经细胞周期检测 取出各组细胞培养液,用PBS 冲洗,0.25%胰蛋白酶溶液消化,始收缩变圆时,取出消化液后与血清混合,停止消化。离心处理,1 000 r/min 离心5 min,去上清液,PBS 清洗,用70%乙醇固定细胞30 min,离心后收集,再次用PBS 洗涤,用1% PI 染色。PBS 洗涤,采用PBS 缓冲液将细胞体积调整至1 mL,上流式细胞仪中检测细胞周期情况,每组3个细胞样本,实验重复3次。
1.9 统计学方法 采用GraphPad Prism9统计软件。计量资料符合正态分布以± s 表示,不同时点均数比较采用重复测量方差分析,多组间比较采用单因素方差分析,进一步两两比较采用Dunnett-t 检验。P<0.05为差异有统计学意义。
2 结果
2.1 康复训练对缺血性脑卒中大鼠神经功能和运动功能的影响 术后第2 天,其他各组的神经功能评分和运动功能评分高于假手术组(P 均<0.05);术后7、14 和21 d,神经功能和运动功能评分较术后第2 天均出现不同程度的改善,与康复训练组相比,自然恢复组、自然恢复+MK2206 组和康复训练+MK2206组的神经功能和运动功能评分较高(P均<0.05),自然恢复+MK2206 组的神经功能和运动功能评分高于自然恢复组(P 均<0.05),康复训练+MK2206 组神经功能和运动功能评分高于康复训练组(P均<0.05),康复训练+MK2206组神经功能和运动功能评分低于自然恢复+MK2206 组(P 均<0.05)。见表1、2。
表1 各组大鼠神经功能情况比较(分 ± s)
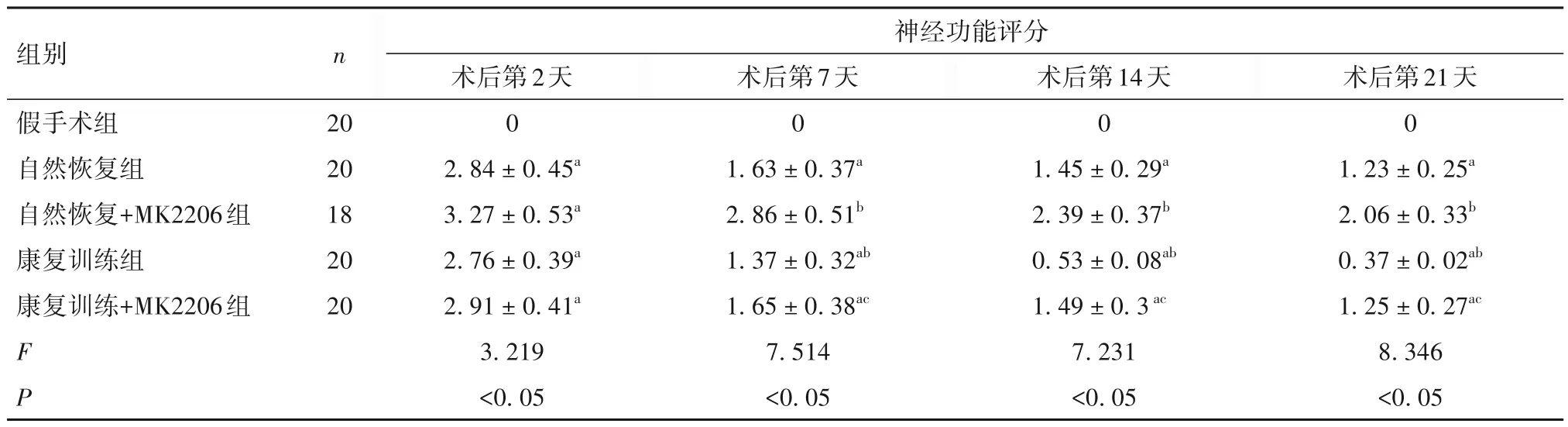
表1 各组大鼠神经功能情况比较(分 ± s)
注:与假手术组相比,aP<0.05;与自然恢复组相比,bP<0.05;与康复训练组相比,cP<0.05。
images/BZ_49_235_402_2243_520.png
2.2 康复训练对大鼠海马组织中DCC/APPL-1/AKT通路的影响 与康复训练组相比,自然恢复组、自然恢复+MK2206 组和康复训练+MK2206 组的海马组织中DCC、APPL-1、AKT蛋白较低(P均<0.05),自然恢复+MK2206组中的DCC、APPL-1和P-AKT蛋白表达低于自然恢复组(P 均<0.05),康复训练+MK2206 组中的DCC、APPL-1 和P-AKT蛋白表达低于康复训练组(P 均<0.05),康复训练+MK2206组中的DCC、APPL-1 和P-AKT 蛋白表达高于自然恢复+MK2206组(P均<0.05);各组AKT对比差异无统计学意义(F=1.312,P>0.05)。见表3。
表3 各组大鼠海马组织中DCC、APPL-1、AKT蛋白表达比较± s)
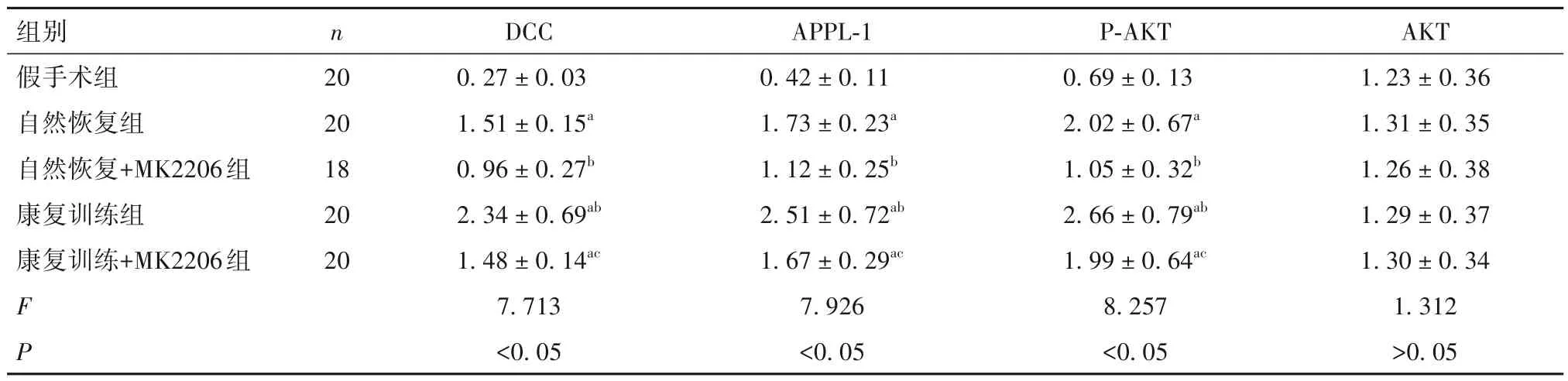
表3 各组大鼠海马组织中DCC、APPL-1、AKT蛋白表达比较± s)
注:与假手术组相比,aP<0.05;与自然恢复组相比,bP<0.05;与康复训练组相比,cP<0.05。
images/BZ_49_235_1738_2243_1797.png
2.3 康复训练对大鼠海马组织中DCC、APPL-1、AKT 阳性表达的影响 与康复训练组相比,自然恢复组、自然恢复+MK2206 组和康复训练+MK2206 组海马组织中DCC、APPL-1、AKT 蛋白阳性表达率较高(P均<0.05),自然恢复+MK2206组中的DCC、APPL-1 和P-AKT 蛋白阳性表达率低于自然恢复组(P均<0.05),康复训练+MK2206 组中的DCC、APPL-1 和P-AKT 蛋白阳性表达率低于康复训练组(P均<0.05),康复训练+MK2206 组中的DCC、APPL-1 和P-AKT 蛋白阳性表达率高于自然恢复+MK2206 组(P均<0.05)。见表4。
表2 各组大鼠运动功能情况比较(分, ± s)

表2 各组大鼠运动功能情况比较(分, ± s)
注:与假手术组相比,aP<0.05;与自然恢复组相比,bP<0.05;与康复训练组相比,cP<0.05。
images/BZ_49_235_1071_2243_1189.png
表4 各组大鼠海马组织中DCC、APPL-1、AKT阳性率比较(%± s)
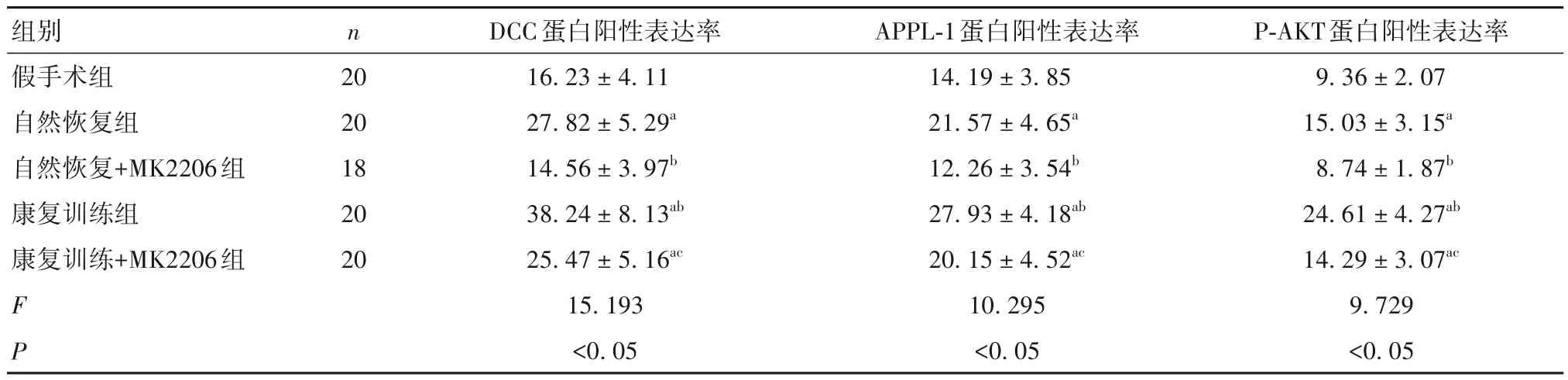
表4 各组大鼠海马组织中DCC、APPL-1、AKT阳性率比较(%± s)
注:与假手术组相比,aP<0.05;与自然恢复组相比,bP<0.05;与康复训练组相比,cP<0.05。
images/BZ_49_235_2616_2243_2675.png
2.4 康复训练对大鼠海马神经细胞凋亡的影响 假手术组、自然恢复组、自然恢复+MK2206 组、康复训练组、康复训练+MK2206 组神经细胞凋亡率分别为(6.13 ± 1.32)% 、(20.57 ± 4.26)% 、(32.41 ± 6.17)%、(16.83 ± 3.56)%、(21.34 ± 4.31)%,与康复训练组相比,自然恢复组、自然恢复+MK2206 组和康复训练+MK2206 组的神经细胞凋亡率较高(P均<0.05),自然恢复+MK2206 组的神经细胞凋亡率高于自然恢复组(P<0.05),康复训练+MK2206 组的神经细胞凋亡率高于康复训练组(P<0.05),康复训练+MK2206 组的细胞凋亡率低于自然恢复+MK2206组(P<0.05)。
2.5 康复训练对大鼠海马神经细胞周期的影响 与康复训练组相比,自然恢复组、自然恢复+MK2206组和康复训练+MK2206 组的G0~G1期细胞比例较高(P均<0.05),自然恢复+MK2206组的G0~G1期细胞比例高于自然恢复组(P<0.05),康复训练+MK2206组的G0~G1期高于康复训练组(P<0.05),康复训练+MK2206 组的G0~G1期细胞比例低于自然恢复+MK2206 组(P<0.05);与康复训练组相比,自然恢复组、自然恢复+MK2206 组和康复训练+MK2206 组的S 期 细 胞 比 例 较 低(P均<0.05),自 然 恢 复+MK2206 组的S 期细胞比例低于自然恢复组(P<0.05),康复训练+MK2206组的S期细胞比例低于康复训练组(P<0.001),康复训练+MK2206 组的S 期细胞比例高于自然恢复+MK2206 组(P<0.05);各组G2~M 期细胞比例对比差异无统计学意义(P均>0.05)。见表5。
表5 各组大鼠海马神经细胞周期变化情况比较(% ± s)

表5 各组大鼠海马神经细胞周期变化情况比较(% ± s)
注:与假手术组相比,aP<0.05;与自然恢复组相比,bP<0.05;与康复训练组相比,cP<0.05。
3 讨论
脑卒中是一种由脑血管局灶性破裂或堵塞所引起的中枢神经系统功能缺陷,是导致患者术后残疾的主要原因之一。据统计,70%以上缺血性脑卒中患者会遗留不同程度和类型的功能障碍,包括认知、运动和感觉等功能障碍,严重影响患者的生活质量、日常生活能力和社会回归能力[9]。在卒中后期,神经可塑性和再生尤为重要[10]。相关研究证实,脑卒中患者进行一段时间的康复训练后,脑梗死区域的相关蛋白表达明显增加,此可刺激神经细胞的分化、增殖和轴索的再生等,进而促进神经功能的恢复[11]。康复训练能刺激梗死灶周围结构的重组和功能改变,使脑组织恢复应有的适应性和敏感性。经常进行康复训练可帮助患者恢复肢体运动能力,从而逐渐参与日常活动[12]。既往研究表明,康复训练对卒中后患者的运动功能影响较大,尤其是能力失衡患者[13]。本研究旨在探讨康复训练是否通过激活DCC/APPL-1/AKT 信号通路抑制缺血性卒中大鼠神经细胞凋亡,促进其神经和运动功能的恢复。
本研究结果显示,康复训练组的神经功能和运动功能评分较自然恢复组、自然恢复+MK2206 组和康复训练+MK2206 组较低,说明康复训练有助于神经功能和运动功能恢复。基础研究表明,脑组织损伤后,脑细胞可通过康复训练增加感觉运动输入而激活,康复训练能促使脑细胞分泌多种营养因子,起到保护神经和促进神经损伤修复的作用[14]。定期康复训练已被证明可减少全身炎症反应,保护健康细胞免于凋亡,诱发大脑神经重塑。研究显示,早期康复训练可有效改善急性脑卒中患者的日常活动和肢体运动功能,提高生活质量,降低残疾的发生风险[15]。
APPL-1 是一种多功能内体结合蛋白,通过与结直肠癌缺失基因(DCC)、表皮生长因子(EGF)、脂联素等跨膜受体结合。APPL-1作为关键调节因子,已被证明可以调节AKT 的活性[16]。本研究检测DCC、APPL-1、AKT 蛋白表达目的是证实康复训练可激活DCC/APPL-1/AKT 信号通路。本研究结果表明,与康复训练组相比,自然恢复组、自然恢复+MK2206组和康复训练+MK2206 组海马组织中DCC、APPL-1、AKT 蛋白表达较低,且康复训练+MK2206 组中的DCC、APPL-1 和P-AKT 蛋白表达明显低于康复训练组。与康复训练组相比,自然恢复组、自然恢复+MK2206 组和康复训练+MK2206 组海马组织中DCC、APPL-1、AKT 蛋白阳性表达率较低,且康复训练+MK2206组中的DCC、APPL-1和P-AKT蛋白表达阳性率低于康复训练组。本研究发现,抑制DCC/APPL-1/AKT 信号通路,可以促进海马神经细胞凋亡和阻滞细胞周期变化,说明DCC/APPL-1/AKT 信号通路在脑缺血后大鼠神经功能和运动功能恢复中发挥重要作用,同时在神经细胞凋亡和细胞周期中有一定调控作用。
综上所述,缺血性脑卒中大鼠康复训练可通过DCC/APPL-1/AKT 信号通路,抑制神经细胞凋亡,有助于神经和运动功能恢复。

