LncRNA MEG3在胶质瘤组织中的表达变化及其相关功能
张珂珂,张振,郭庚寅,陈金言,何东
1 山东第一医科大学附属省立医院医务部,济南 250012;2 山东第一医科大学附属省立医院神经外科
胶质瘤是神经外胚层发育的胶质细胞来源的肿瘤,具有浸润性生长、易复发、致残率和病死率高等特点[1-2]。尽管显微外科技术的进步和切除精细化的提升已能够达到满意切除[3],但由于胶质瘤浸润生长的特性,其术后复发率仍近100%[4]。尽管替莫唑胺为代表的化疗方案对改善患者预后有效,但随之也带来了低级别胶质瘤向高级别胶质瘤转化的超突变问题[5]、耐药性问题[6]和假性进展问题[7]。寻找有效的治疗靶点和更加深入探讨胶质瘤的发病机制非常必要[8]。长链非编码RNA(LncRNA)最初被认为是转录组中的无用成分,后期研究发现由于其长链特性伴随着复杂的RNA 二级结构,可能参与更为多样的生物学活动,包括调节染色质动力学、基因表达、生长分化和发育过程[9-12]。LncRNA 母体表达基因3(MEG3)是一种位于染色体14q32上的新型肿瘤抑制基因。MEG3 通过多种信号通路抑制包括神经胶质瘤在内的肿瘤的发生发展[13]。然而,MEG3 在胶质瘤中的表达特征和可能涉及的通路仍未完全阐明。本研究基于生物信息学方法研究和探讨了MEG3 在胶质瘤中的表达模式、预后预测价值及可能涉及的功能等,现报告如下。
1 资料与方法
1.1 资料来源 人类蛋白质图谱(HPA)数据集(www. proteinatlas. org)中来自95 例人体标本的27个不同组织的RNA 测序(RNA-seq)数据;TCGA 数据库中高级别胶质瘤(GBM)、低级别胶质瘤(LGG)临床特征资料;LinkedOmics 数据库研究MEG3 所可能涉及的功能;TIMER 数据库(https://cistrome.shinyapps.io/timer/)研究癌症免疫治疗和宿主免疫系统之间的相互作用;TCGA-GBMLGG 数据集中的RNA测序(RNA-seq)信息。
1.2 分析方法 使用人类蛋白质图谱(HPA)数据集(www.proteinatlas.org)[14]中来自95例人体标本的27 个不同组织的RNA 测序(RNA-seq)数据用以分析MEG3 的组织特异性。使用TCGA 数据库中高级别胶质瘤(GBM)、低级别胶质瘤(LGG)数据集进行表达模式分析,根据其中的临床特征资料进行相关性分析,使用24种经典免疫细胞生物标志物作为参照[15]。使用单样本基因富集分析(ssGSEA)算法对GBM/LGG基因集的每个样本计算对对应的得分,推断每个样本的免疫细胞浸润情况。用LinkedOmics数据库[16]对MEG3 所可能涉及的功能进行分析,分别从基因本体论(GO)的三个层次进行分析。该数据库对单基因的GO 分析基于过表达分析(ORA)算法。使用其内建的GESA 算法富集通路用于解释相关基因参与的功能。用TIMER 数据库(https://cistrome. shinyapps. io/timer/)研究癌症免疫治疗和宿主免疫系统之间的相互作用,预先计算32 种TCGA癌症类型的10 897 个肿瘤的6 种肿瘤浸润性免疫亚群的水平,评价MEG3 与6 种免疫浸润亚群的关系,并可给出基于纯度矫正后的相关系数。
将TCGA-GBMLGG 数据集中的RNA 测序(RNA-seq)信息按照MEG3表达状态划分为两组,高表达组和低表达组,并将两组差异表达的情况获取与该分子有关的差异表达列表,并通过该列表进行GESA 分析。差异基因分析采用R 软件及其DESeq2软件包。
将存在差异的56 494 个基因的基因名和log2Foldchange 数值输入新数据表,使用MSigDB 数据 库(https://www. gsea-msigdb. org/gsea/msigdb/index.jsp)中的Hallmark 注释基因集进行分析,并计算富集得分(ES)和校正后归一化的富集得分(NES)。
1.3 统计学方法 统计学分析和绘图使用R软件,其余使用SPSS24.0 和GraphPad Prism 6.0 软件。数据来自于UCSC Xena 中预处理后的TCGA 数据,应用算法为R 软件包对应的处理算法,数据处理方式见https://cran.r-project.org/web/packages/。
2 结果
2.1 MEG3 在不同组织中的表达 MEG3 在肾上腺、大脑、胎盘组织中表达丰富,见图1。除胆管癌(CHOL)、睾丸生殖细胞肿瘤(TGCT)、胸腺瘤(THYM)、嗜铬细胞瘤和副神经节瘤(PCPG)、肉瘤(SARC)外,其他肿瘤组织中MEG3 表达均较正常组织低;除头颈鳞状细胞癌(HNSC)外,其他肿瘤组织中MEG3表达与正常组织比较差异有统计学意义(P均<0.05),见图2。在泛胶质瘤(GBMLGG)组织中MEG3 表达低于正常脑组织(P均<0.05),见图3。MEG3 的表达同泛胶质瘤的WHO 分级、IDH 的突变状态无关,与1p/19q共缺少关系密切,见图3。
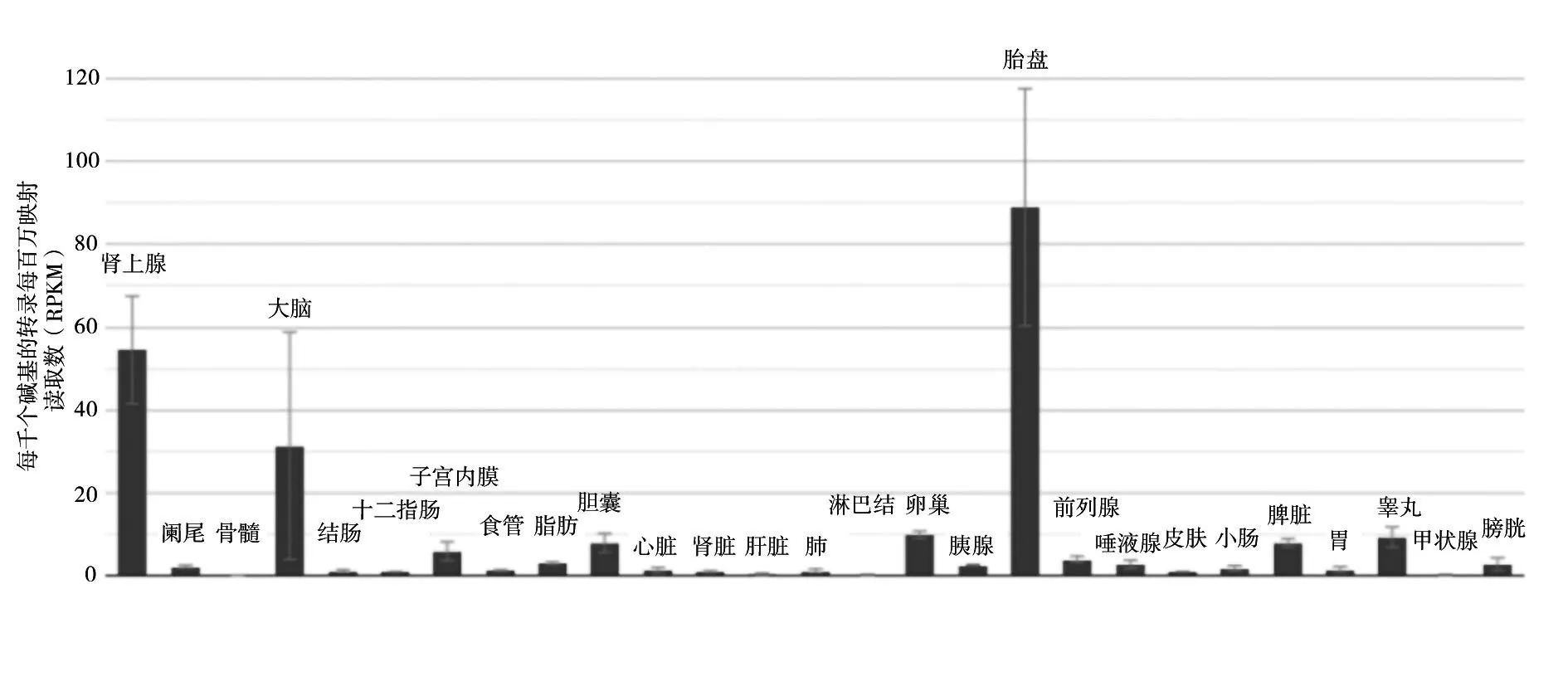
图1 MEG3在各正常组织中的表达
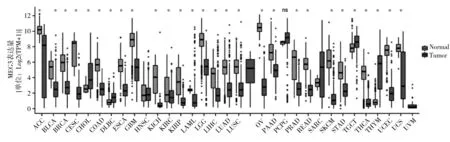
图2 MEG3在各肿瘤组织中的表达
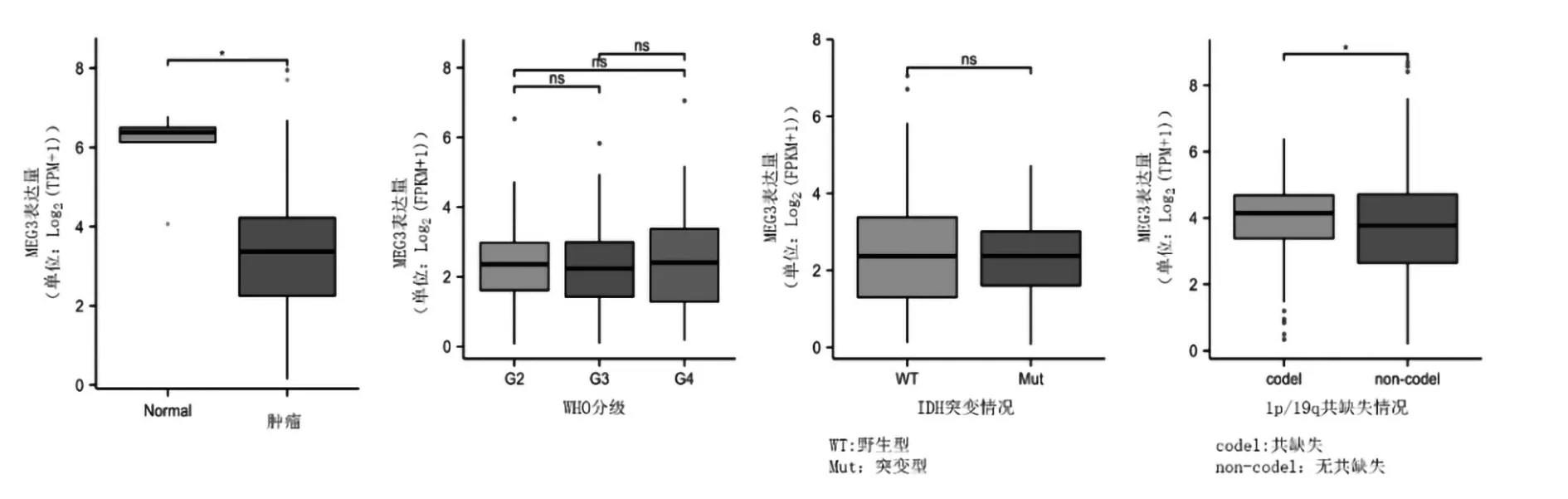
图3 MEG3在TCGA-GBMLGG中的表达及其与典型分子分型的关系
2.2 MEG3 对胶质瘤诊断及预后评估的价值 纳入GTEx 数据库中1 157 例正常脑组织以及鉴别GBMLGG 数据集中689例肿瘤组织。绘制受试者工作特征(ROC)曲线,MEG3 诊断肿瘤的曲线下面积为0.944,95% CI为0.934~0.954。其最佳截断值为7.24,灵敏度为0.926,特异度为0.860。
基 于TCGA-LGGGBM 中 临 床 数 据[17],按 照MEG3 表达截断值(截断值:50%)分组,将泛胶质瘤患者(LGGGBM)患者划分为高表达组(High)和低表达组(Low),标准化MEG3 表达量后绘制生存曲线,在GBMLGG 患者中高表达组有更好的预后(HR=0.84),单独比较GBM 患者中也得到同样结论(HR=0.73),而且高表达组拥有更好的无病生存预后(HR=0.79)。
2.3 MEG3 的功能 基因本体论(GO)分析结果:生物学过程(BP)部分MEG3主要与突触传导信号通路、细胞膜电位调节、神经递质转运和钾离子转运正相关,与免疫相关的通路如抗原呈递提呈、DNA 损伤反应、白细胞黏附等负相关;细胞组分(CC)部分主要与突触膜、转运复合体等正相关,与染色体、囊泡腔和细胞基质连接负相关;分子功能(MF)部分主要与主动转运、单价无机阳离子跨膜转运、鸟苷酸交换因子活动正相关,与蛋白酶体结合、电子转运、未折叠蛋白结合、核苷酸转移酶活动、细胞因子结合、核糖核蛋白复合体负相关。
通路富集分析结果:神经元系统、心脏传导和胺配体结合受体为正相关通路、白细胞介素10 信号、下游TCR信号转导、小RNA的转录调控、G2/M检查点、抗原加工-交叉呈递、中性粒细胞脱颗粒、干扰素刺激基因的抗病毒机制为负相关通路。
2.4 MEG3在免疫调节及免疫浸润过程中的作用 基于差异基因算法获取差异表达基因共56 494 个,其中符合log2Foldchange 绝对值>1.5 且P<0.05 的差异表达基因共256 个。MEG3 的差异表达基因主要富集居前三位的是免疫球蛋白生成、补体激活经典通路及长时程增强。该结果与Linkedomics 分析的结果近似,都反应出与神经系统相关的特征以及与免疫活动相关的重要特征。基于差异表达基因的GESA 分析结果,负相关前四位主要是γ 干扰素反应、α 干扰素反应、Myc 靶点氧化磷酸化;正相关前四位主要是Hedgehog 信号通路、Kras 信号通路、胰腺β细胞和精子生成。
用单样本基因富集分析(ssGSEA)算法对GBM/LGG 基因集的每一个样本计算对对应的得分,推断每个样本的免疫细胞浸润情况。结果显示GBMLGG 融合队列中与类浆细胞树突状细胞、CD56高表达自然杀伤细胞正相关,相关系数绝对值>0.2;与细胞毒性细胞、巨噬细胞负相关,相关系数绝对值>0.2。单独比较LGG 数据队列发现正相关情况同融合队列,负相关中巨噬细胞绝对值>0.2,且接近0.4,中性粒细胞、未成熟树突状细胞、树突状细胞、细胞毒性细胞、激活树突状细胞,Th17 细胞的相关系数绝对值均>0.2。而GBM 数据队列的结果中正相关系数绝对值>0.2 的细胞类型为Tcm、Tem细胞,负相关系数绝对值>0.2 的细胞为细胞毒性细胞、T 细胞。同时对富集得分和24 种免疫细胞类型按照MEG3 表达高低分组后进行比较,发现T 细胞、类浆细胞树突状细胞、CD56 高强度自然杀伤细胞、中性粒细胞、巨噬细胞、未成熟树突状细胞、嗜酸性细胞、树突状细胞、细胞毒细胞和激活树突状细胞的富集分数在高MEG3 组、低MEG3 组间差异有统计学意义(P 均<0.05)。其中T 细胞、中性粒细胞、巨噬细胞、未成熟树突状细胞、嗜酸性粒细胞、树突状细胞、细胞毒性细胞、激活树突状细胞中MEG3低表达组的富集分数更高,类浆细胞树突状细胞在MEG3高表达组中的富集分数更高。
用TIMER 数据库对基于纯度矫正的免疫浸润结果进行分析发现,在GBM 中,MEG3的表达与CD8阳性T细胞(纯度矫正相关系数0.206)、树突状细胞(纯度矫正相关系数-0.18)浸润相关性较强;在LGG中,MEG3的表达与B细胞(纯度矫正相关系数-0.309)、CD8 阳性T 细胞(纯度矫正相关系数-0.299)、CD4阳性T 细胞(纯度矫正相关系数-0.243)、巨噬细胞(纯度矫正相关系数-0.297)、中性粒细胞(纯度矫正相关系数-0.22)、树突状细胞(纯度矫正相关系数-0.326)浸润相关性较强。
3 讨论
LncRNA 被定义为转录本长度超过200 个核苷酸且不会被翻译成蛋白质的RNA[18]。随着研究的深入,这一概念尽管有不完备之处,但仍被广泛接受。在鉴定LncRNA 的一般定义中人们会以保守性和非编码性来验证其性质。LncRNA 曾被认为是RNA 聚合酶Ⅱ转录的副产品,没有生物学功能,但截至目前,已有大量LncRNA 已被证明可调节细胞过程,如染色体和基因组修饰、转录激活和干扰以及核转运等,这些LncRNA 的功能值得我们进一步深入鉴定与研究。现在认为LncRNA 在正常的大脑发育以及包括神经胶质瘤发生在内的多种疾病过程中发挥着重要作用。有趣的是,某些LncRNA 与胶质瘤的起始、分化、进展、复发和干细胞样特征密切相关,因此可用于亚分类、诊断和预后。LncRNA 还可以作为潜在的治疗靶点以及治疗胶质瘤的新型生物标志物[19]。
LncRNA MEG3是母系表达的印记基因,位于染色体14q32.3,是一类核定位的LncRNA。该基因在许多正常组织中表达,但在不同组织来源的多种癌细胞系中表达缺失。已有大量实验验证其在体外抑制肿瘤细胞增殖,并且其还与肿瘤抑制基因p53 相互作用,并调节p53 靶基因的表达[13]。多项研究表明该基因是一种肿瘤抑制基因,如:MEG3 通过调节miR-9-5p/QKI-5 轴 抑 制 前 列 腺 癌 的 进 展[20];MEG3 通过p53 信号通路抑制胃癌的增殖和转移[21]等。在胶质瘤中,MEG3 被证实在基因毒性应激诱导的细胞死亡过程中上调,同时与TUG1BC20 0MIR155HG 等LncRNA 有一定的协同现象[22],已有研究证实MEG3过表达时胶质瘤细胞的增殖受到抑制、细胞凋亡增加[23],这种抗增殖功能主要通过抑制MDM2 和激活p53 信号通路发挥作用[21,24]。MEG3敲除小鼠模型揭示了MEG3在调节大脑血管形成中的功能作用。在MEG3-null 胚胎的大脑中观察到微血管形成的增加,以及参与VEGF 血管生成途径的基因表达升高。此外,在大多数临床无功能的垂体腺瘤中观察到MEG3的表达缺失[25-26],以上研究结果表明MEG3作为神经胶质瘤的治疗靶点具有相当大的潜在意义。本研究首次系统总结了MEG3在胶质瘤中的表达情况以及首次阐明了其与胶质瘤免疫浸润等密切相关。
本研究基于生物信息学手段发现,MEG3 在胶质瘤中的表达显著降低,而且值得注意的是这种降低并没有明显的等级趋势,即WHO 2~4 级中的MEG3 表达含量均显著降低。而且MEG3 与1p/19q共缺失显著相关。在临床预后方面与其他相关研究所得出的结论一致,高表达MEG3 分组的患者整体临床预后更佳。诊断效能方面MEG3可以作为鉴别胶质瘤和正常脑组织的生物标志物,提示MEG3 有望作为诊断性靶点协助胶质瘤边缘标记或术中快速诊断使用。分别对MEG3相关表达基因集、MEG3分组数据集进行分析,两者的功能富集得到的结论近似,基于MEG3 相关表达基因集的功能富集显示神经元系统、心脏传导和胺配体结合受体为正相关通路,白细胞介素10信号、下游TCR信号转导、小RNA的转录调控、G2/M 检查点、抗原加工-交叉呈递、中性粒细胞脱颗粒、干扰素刺激基因的抗病毒机制为负相关通路,而使用MEG3 分组的差异基因富集功能显示免疫球蛋白生成、补体激活经典通路以及长时程增强为主要富集通路。以上两方面提示,MEG3 可能与神经系统的免疫功能密切相关。基于全部56 494 个基因的GESA 分析提示,干扰素可能参与了MEG3 相关的免疫功能调节。ssGESA 和TIMER 进一步分析了其与免疫功能的关系,MEG3低表达的肿瘤组织可能存在细胞毒性细胞与巨噬细胞浸润的差异,与既往研究中的胶质瘤诱导抑制性免疫微环境相关。另外,低级别胶质瘤数据显示了更为活跃的免疫浸润性。
综上所述,胶质瘤患者的LncRNA MEG3 表达显著降低,其表达降低有可能是导致胶质瘤免疫治疗效果不理想的重要原因,这种表达模式可能与胶质瘤独特的免疫微环境相关,基于MEG3 表达调控相关的胶质瘤研究有望成为免疫治疗的重要目标。

