胆囊肝样腺癌4例临床病理分析
李巧转,周志华,王 倩,赵海滨
肝样腺癌(hepatoid adenocarcinoma,HAC)是一种罕见的伴有肝样分化的肝外上皮细胞肿瘤,具有肝细胞肝癌组织学形态及免疫表型。临床上以胃部多见,这可能与胃和肝胚胎发育时同起源于前肠衍生物有关[1],也可发生于肺、胰腺、泌尿系统及女性生殖系统等[2,3],发生于胆囊者非常罕见。笔者收集4例原发胆囊肝样腺癌(hepatoid adenocarcinoma of the gallbladder,HAG),探讨其临床病理特征、鉴别诊断要点及预后。
1 临床资料
1.1 一般资料 回顾2010-01至2020-12我院原发胆囊癌手术切除标本共102例,收集其中4例HAG患者资料。病例1:女,73岁,因右上腹痛20年入院,术前血甲胎蛋白(AFP)90.28 μg/L,术后2.75 μg/L,术后8个月无病生存。病例2:男,77岁,因右上腹痛4年余入院,术前血AFP 15.25 μg/L,术后4.54 μg/L,术后26个月无病生存。病例3:男,56岁,因右上腹痛4个月入院,术前血AFP 4.23 μg/L,术后6.26 μg/L,术后19个月多发肝转移。病例4:男,59岁,因右上腹隐痛不适1个月入院,术前血AFP 3.56 μg/L,术后未复查,术后半年死亡,死因不详。
1.2 影像学特征 病例1超声示胆囊壁毛糙,胆汁透声性差,可见4.1 cm×2.7 cm的偏强回声,不伴声影不伴随体位而改变(图1A)。病例2 MRI示肝实质未见结节,胆囊颈部可见不规则短T2信号压迫临近胆总管,肝内胆管及胆总管扩张,最大径1.2 cm,下段呈渐进性狭窄(图1B)。病例3外院腹部CT示肝门部胆管占位。病例4 超声胆囊显示不清,可见4.4 cm×3.2 cm混合低回声,部分向肝内延伸3.2 cm×2.0 cm。

图1 胆囊肝样腺癌影像学
1.3 病理学特征
1.3.1 大体特征 病例1胆囊大小9 cm×6 cm×0.3 cm,底部可见肿块切面灰黄灰红色,肝脏切面未见肿块。病例2胆囊大小6 cm×4 cm,壁厚0.5~1 cm,胆囊壁粗糙,体部可见1.1 cm×1 cm×1 cm的凸起肿块,表面呈乳头状,肝组织切面未见肿块。病例3胆囊大小9 cm×7 cm×0.3 cm,胆囊近颈部黏膜灰白色,质硬范围约3 cm×1.7 cm×1 cm。病例4胆囊大小5.5 cm×3 cm,胆囊体部切面可见6 cm×6 cm×5 cm灰白色肿块,与周围肝组织融合粘连,侵犯胃壁。
1.3.2 HE染色 显示特征性肝样分化,呈小梁状、实性巢片状排列(图2A、B);癌细胞立方或多边形,胞浆丰富嗜酸,核空泡状,部分可见嗜酸核仁,核分裂易见(图2C);局灶表现为管状、乳头状腺癌。其中病例2、3局灶区域呈现肠母细胞分化,细胞胞浆透明空泡状,管状乳头状、囊腺样排列,腺腔内可见均质红染的圆形小体及腺腔内红染物(图2D)。所有混合腺癌或肠母细胞分化区域所占比例均<10%。
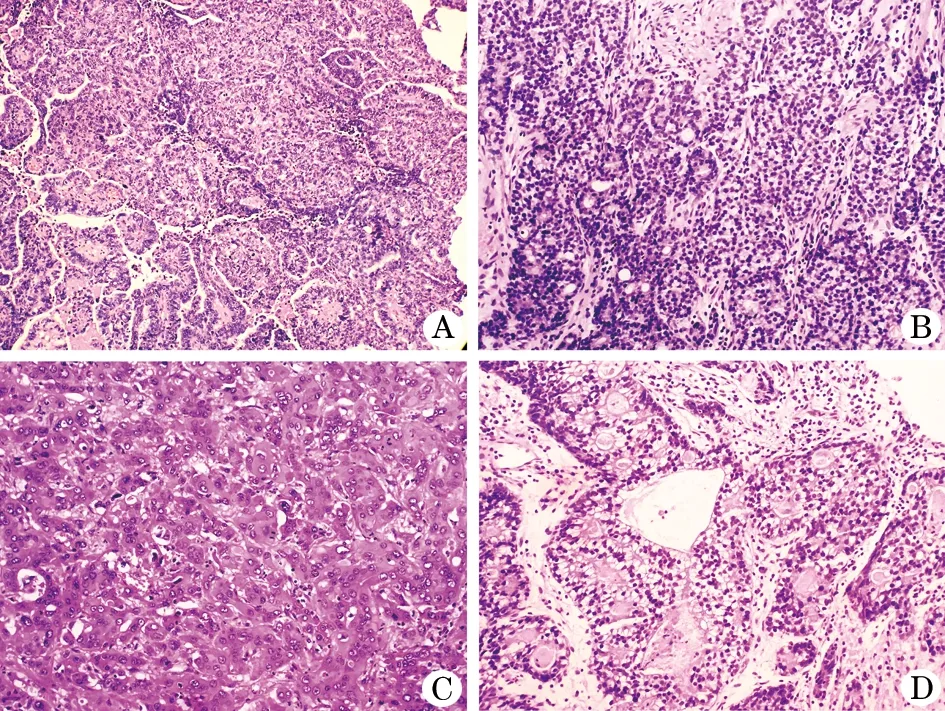
图2 胆囊肝样腺癌病理学特征
1.3.3 免疫组织化学 癌细胞弥漫表达CK19(4/4),阳性表达癌胚蛋白AFP(2/4;图3A)、GPC-3(2/4)、Heppar1(2/4)和胚胎干细胞标志SALL4(3/4;图3B),每一例至少表达上述4种标志物之二,CDX2(2/4),Her-2(3+,3/4)。Ki-67阳性指数20%~80%。

图3 胆囊肝样腺癌免疫组化
A,B.特征性肝样分化区呈小梁状、实性巢片状排列(HE,×200);C.癌细胞立方或多边形,胞浆丰富嗜酸,核空泡状,部分可见嗜酸核仁,核分裂易见(HE,×400);D.部分呈现肠母细胞分化,胞浆透明空泡状,管状乳头状、囊腺样排列,腺腔内可见均质红染的圆形小体及腺腔内红染物(HE,×400)。
2 讨 论
HAC是1985年由Ishikura等[4]作为胃部原发肿瘤首次提出,因组织学形态与肝细胞癌相似而命名,发病部位以胃部多见,位于胆囊者罕见,在HAC中仅占3.8%,1995年首次详细报道[5,6]。本文102例原发胆囊癌中,HAG 4例,占比3.92%,与以往报道一致。AFP是由胎儿胃肠道及卵黄囊所产生的一种血清蛋白。胃HAC患者中超过90%患者表达AFP[6],其伴随血清AFP升高机制不明,可能是胎儿胃肠道细胞或肿瘤细胞分化成肝细胞而产生[7]。起初HAC被认为是AFP分泌型肿瘤,然而越来越多的研究证实,部分HAC不伴有血清AFP升高或AFP表达,其染色阳性率为70.0%~83.3%,且AFP升高和免疫组织化学结果并不具有一致性[8]。本文4例HAG中仅有2例伴随AFP升高,术后显著下降至正常范围,降幅为70.2%~96.9%,提示术前AFP升高是由癌细胞所导致的。其中1例肝样分化区阳性表达AFP,同时另外1例不伴随AFP升高者阳性表达AFP,与以往文献报道相符。这也提示,HAG与产AFP胆囊癌相关又有不同,产AFP胆囊癌指血清AFP>20 μg/L或免疫组织化学阳性表达AFP[9],HAG则指具有肝样分化特征的原发胆囊癌,其诊断应依赖于肝样分化的形态学特征,而不论是否伴随AFP升高或表达[10,11]。
临床上中老年多发,无特异症状,多以右上腹部疼痛、腹部包块等就诊,本文4例均表现为右上腹部疼痛,首次诊断前病程1个月至20余年。病例4病程1个月,但发现时瘤体直径已达6 cm,侵犯邻近器官,6个月后死亡,提示HAG起病隐匿,不易早期发现,预后较差。
HAG术前通常难以确诊,影像学仅提示占位,最终需依赖组织形态及免疫组化。组织结构上,有管状、乳头状腺癌等腺样分化区域和特征性的肝样分化区域,部分病例可表现为肠母细胞分化。细胞学上,癌细胞立方或多边形,胞浆丰富可见嗜酸核仁;本文3例伴随典型管状腺癌,其中病例2、3,肿瘤细胞胞浆透明空泡状,管状乳头状、囊腺样排列,腺腔内可见均质红染的圆形小体及腺腔内红染物,免疫表型CDX2弥漫阳性,证实肠母细胞分化。有研究报道伴有肠母细胞分化腺癌与HAC关系密切,可能是其发展的前期阶段,最终转变为HAC[12,13]。与本文中病例2、3的病理特点一致。免疫表型上,肿瘤细胞弥漫表达CK19、CEA,肝样分化区域不同程度表达AFP、GPC-3、Heppar、SALL4等。
除了要与普通胆囊腺癌鉴别外,还需要与肝脏原发癌鉴别。当HAG合并肝脏侵犯或肝脏转移时,需要与肝细胞肝癌侵犯胆囊鉴别。本文中病例4,肿块主体位于胆囊,术后病理肝脏癌组织与周围正常肝组织突然转化,境界清,而胆囊上皮表现为正常柱状上皮-异型增生-腺癌的过渡转化,均支持胆囊原发;典型的管状乳头状或肠母分化腺癌区域,相互移行的特征性肝样分化区域,且肝样分化区域SALL4、HepPar-1阳性表达,更进一步证实HAG的诊断。HAG与肝原发胆管细胞癌的鉴别,除了临床病史与大体标本,主要依靠病理学检查,原发胆管细胞癌通常起源于胆管二级分支胆管上皮细胞,以腺癌结构为主,类似胆管的腺腔状,呈不规则浸润性生长,间质纤维增生明显,伴有周边肝内胆管不规则扩张和局部肝叶萎缩,HAG则表现为特征性肝样分化,易于鉴别。
目前,建议HAG主要以手术治疗为主,术后辅助放化疗。通常参照胃HAC治疗,可选用顺铂为基础的一线化疗方案或ramucirumab(抗VEGF-2药物)等[14,15]。靶向治疗亦具有一定可行性,我们发现3/4的HAG存在Her-2的高表达,比文献[16]报道胃HAC中Her-2表达率(25%)高,是否可以说明靶向治疗在HAG中具有更大的应用价值,尚需更多病例研究证实。当术前血清AFP≥500 μg/L时,胃HAC总体无病生存率显著降低,同时SALL4阳性更易发生远处转移,AFP、HepPar-1和SALL4联合应用可作为胃HAC预后的可靠指标[17,18]。HAG同其他部位HAC一样,整体预后差,易发生肝脏或淋巴结转移,本文1例术后19个月多发肝转移,1例在确诊时已伴随邻近器官侵犯,术后6个月死亡,另外2例分别无病生存8、26个月,目前我们仍在对存活的患者进行随访观察。
HAG少见,临床无特异表现,伴或不伴血清AFP升高,诊断依赖于形态学特征和免疫组化,预后较差,关于其治疗标准及辅助放化疗对预后的影响,仍需更多的病例及临床随访支持。临床工作中应充分认识,避免漏诊。

