电石渣湿法脱硫中结晶产物的影响因素研究
杨凤玲,翟 敏,任 磊,张圆圆,程芳琴,董宏育
(1.山西大学资源与环境工程研究所煤矸石资源高效利用技术国家环境保护重点实验室,山西太原030006;2.山西大学固废综合利用长治襄垣研发基地,山西长治 046000;3.襄垣县诚丰热力有限公司,山西长治 046000)
电石渣是电石法生产聚乙烯的副产物,其主要成分为氢氧化钙[Ca(OH)2],以电石渣为脱硫吸收剂,能够有效替代石灰石用于工业烟气脱硫[1-2]。目前,电石渣湿法脱硫技术因具有脱硫效率高、脱硫成本低等优点已在一些企业陆续投入使用。然而,在电石渣湿法脱硫工艺运行过程中,仍存在亚硫酸钙(CaSO3)氧化率低、脱硫石膏脱水难、品质差等问题,严重制约了企业的稳定运行和可持续发展[3-4]。电石渣湿法脱硫结晶产物的有效调控对电石渣湿法脱硫技术在相关行业的应用及后续脱硫石膏的资源化利用意义重大。
影响电石渣湿法脱硫中结晶产物二水合硫酸钙(CaSO4·2H2O)的因素有很多,如pH、氧化风量、电石渣粒径等[5-10]。目前,关于以上因素对CaSO4·2H2O结晶过程的影响已有很多报道。CaSO3氧化过程主要包括4个阶段:长期明显上升阶段、平稳阶段、短期上升阶段和再稳阶段[11]。马双忱等[11]研究发现初始阶段溶解的CaSO3与溶解氧的接触量逐渐降低,使得溶液由碱性逐渐呈中性。邓庆德、尤彩霞等[12-13]认为pH在4.5~5.5为最佳反应条件,此时亚硫酸盐氧化作用最强。崔鹏等[10]通过调节pH制备出不同晶体形貌和尺寸的CaSO4·2H2O晶体。童艳、赵建立、钟秦等[14-16]发现较小的电石渣粒径对电石渣的消溶特性有利。张鑫博、杨敦峰等[17-18]认为氧化风量是影响溶解氧的主导因素。汪黎东、赵立文等[19-20]发现适当的氧气流量对反应溶液有辅助搅拌的作用,使反应体系形成一个稳定的发泡区域;如果氧气流量过大,氧气不能完全溶解到溶液中,不利于气液传质,从而导致氧化结晶速率降低;如果氧气流量过小,则导致CaSO3的氧化速率降低,氧化不充分。目前,相关学者对结晶过程的研究多采用纯CaSO3体系。然而,在实际湿法脱硫过程中,SO2与电石渣的反应过程较为复杂,且针对实际过程的研究相对缺乏。因此,研究电石渣湿法脱硫中结晶产物的影响因素具有现实意义。
本工作以电石渣为原料,通过调节pH、氧化时间和电石渣粒径探讨各因素对CaSO4·2H2O结晶的影响,最终提出最佳操作条件,为电石渣湿法脱硫过程中脱硫石膏品质的控制提供指导。
1 实验原料与方法
1.1 实验原料
实验所用电石渣购自襄垣某热电厂。采用X射线荧光光谱仪(XRF)对电石渣进行化学组成分析,如表1所示。从表1可以看出,电石渣主要由CaO、SiO2和少量金属氧化物组成。
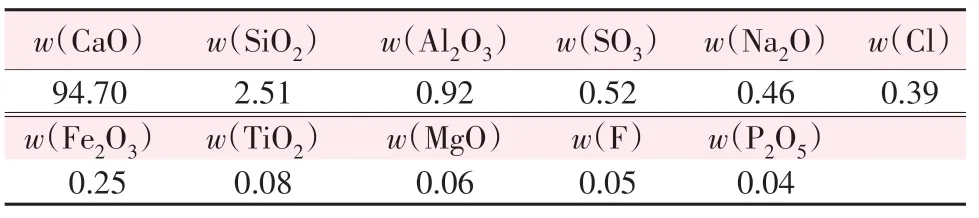
表1 电石渣的化学组成Table 1 Chemical compositions of carbide slag %
电石渣在105 ℃下干燥24 h后进行筛分,其粒径分布结果如图1所示。采用X射线衍射仪(XRD)对电石渣矿相组成进行分析,图2为不同粒径电石渣矿相组成结果。由图1和图2可知,电石渣主要成分为Ca(OH)2,且不同粒径的电石渣在成分上没有明显差异。
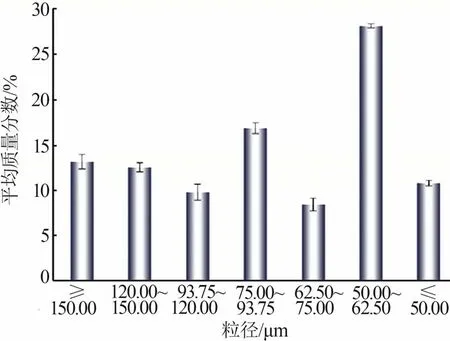
图1 电石渣粒径分布Fig.1 particle size distribution of carbide slag

图2 不同粒径电石渣和纯Ca(OH)2的矿相组成Fig.2 Mineral compositions of carbide slag and pure Ca(OH)2 with different particle sizes
1.2 实验装置及方法
结晶反应装置主要由数控恒温水浴锅、机械搅拌器、四口烧瓶、恒压滴液漏斗、冷凝管、尾气吸收装置、气体质量流量计和pH计等仪器组成,实验装置如图3所示。实验流程:采用不同粒径(≥150.00 μm、125.00~150.00 μm、75.00~93.75 μm、62.50~75.00 μm、≤50.00 μm)的电石渣配制质量分数为10%的浆液并置于(50±0.5) ℃的恒温结晶反应装置中,在机械搅拌速率为200 r/min的条件下,加入不同体积的H2SO3溶液[(1.5±0.5) mol/L]以控制反应体系达到不同pH(4.06、4.20、4.35、4.50、5.06、5.76),控制滴加速率为(5.5±0.1) mL/min以模拟湿法脱硫过程;待反应体系降为酸性时,向烧瓶内持续通入不同时间(3、4、6、12 h)的空气,控制流速为200 mL/min,氧化结束后继续恒温搅拌2 h;最后,对溶液进行恒压抽滤,得到的结晶产物在(45±3) ℃烘箱内烘干,并测定其含水率及用于后续表征分析。
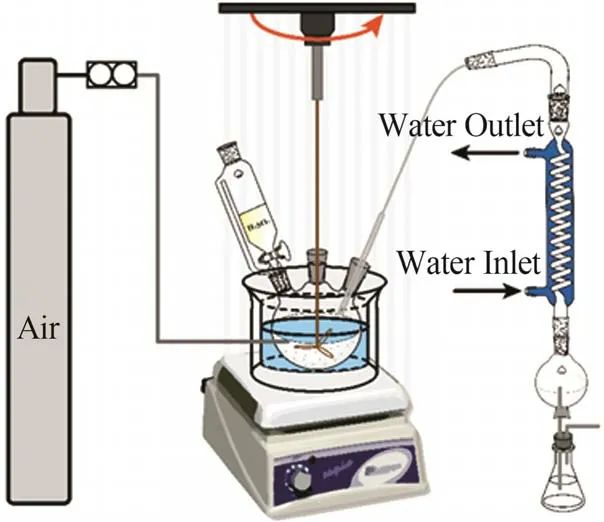
图3 实验装置Fig.3 Experimental facility
1.3 表征手段
1)微观形貌分析。采用扫描电镜-能谱联用仪(SEM-EDS,JMS-IT500HR)对结晶产物的微观结构进行分析。
2)晶体矿相组成分析。采用X射线衍射仪(XRD,D2 PHASER)对结晶产物的组成结构进行分析。扫描范围为10~80°,扫描速率为4 (°)/min,采用步进扫描法记录X射线晶体衍射数据,参考ICDD粉末衍射数据库并确定样品的矿物组成。
3)亚硫酸盐含量测定。采用碘量法对结晶产物中亚硫酸盐含量进行测定。具体步骤按照GB/T 5484—2012《石膏化学分析方法》操作。
2 结果与讨论
2.1 pH对二水硫酸钙结晶的影响
图4为不同pH下结晶产物的亚硫酸盐含量和含水率。由图4可以得出,随着pH的升高,结晶产物的含水率和亚硫酸盐含量均逐渐增大。与pH为4.0时相比,pH在4.5~5.76时,产物中亚硫酸盐含量和含水率明显升高,说明升高pH不利于CaSO3·1/2H2O的氧化。此时体系中存在大量CaSO3·1/2H2O与CaSO4的混合物,细小的CaSO3·1/2H2O晶体会对结晶产物的脱水性能产生不利影响,使得结晶产物含水率较高。

图4 不同pH下结晶产物的亚硫酸盐质量分数和含水率Fig.4 Sulfite mass fractions and water contents of crystalline products at different pH
图5为不同pH下结晶产物的矿相组成。由图5可以得出,pH越小,CaSO4·2H2O晶体的衍射峰强度越强,结晶效果较好,说明降低pH可以促进CaSO4·2H2O的生成。当pH大于4.5时,CaSO4·2H2O晶体的(020)晶面衍射峰消失,此时产物主要以CaSO3·1/2H2O为主。当pH继续升高时,CaSO4·2H2O晶体的特征峰强度降低,CaSO3·1/2H2O衍射峰强度逐渐升高,说明pH的升高会抑制CaSO3·1/2H2O的氧化。因此,为了更好地促进CaSO3·1/2H2O的氧化,需要降低浆液的pH。
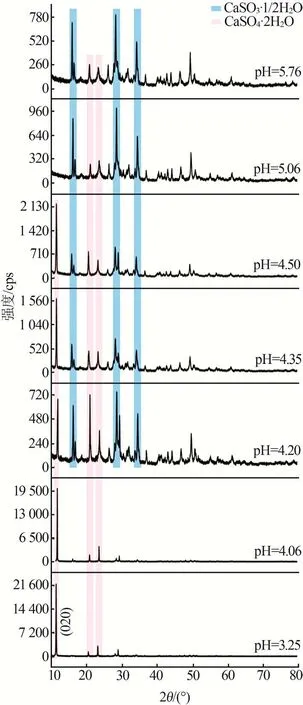
图5 不同pH下结晶产物的矿相组成Fig.5 Mineral compositions of crystallization products at different pH
图6为不同pH下结晶产物的微观形貌。由图6可知,当pH为3.25时,晶体粒径较大,呈棒状结构,随着pH增大,晶体粒径逐渐减小,产物多为絮状结构。絮状结构的增多说明pH的增大抑制了晶体的形成和晶面的生长。结合上述分析(图4~5),推测絮状物为CaSO3·1/2H2O,说明pH大于4.5时不利于CaSO3·1/2H2O的氧化,pH在4.06时CaSO4·2H2O结晶度最高。因为溶液pH不同,HSO3-、SO32-的含量有所不同,在氧化过程中由于HSO3-、SO32-与溶解氧结合,使得其含量逐渐降低,在氧化达到终点时溶液pH呈中性,同时随着反应进行反应物随之减少,导致相同时间内氧化效果有所差别。pH达到4.5时,相同时间内HSO3-、SO32-的氧化率变化不大,此时pH对HSO3-和SO32-氧化程度的影响有限,这可能是受溶液中CaSO3原始浓度的限制。

图6 不同pH下结晶产物的表面微观形貌Fig.6 Surface micromorphology of crystallization products at different pH
2.2 氧化时间对二水硫酸钙结晶的影响
图7为不同氧化时间下结晶产物的亚硫酸盐含量和含水率。由图7可以得出,氧化时间由3 h延长至12 h时,结晶产物中亚硫酸盐质量分数下降为原来的30.7%,含水率下降为原来的35.6%。氧化时间的延长,增加了溶解氧与CaSO3·1/2H2O的接触时间,促进了CaSO4·2H2O的生成,从而降低了产物的含水率。对比6 h和12 h的实验结果,发现产物的含水率与亚硫酸盐含量降幅较小,说明氧化6 h后,继续延长氧化时间对产物的亚硫酸盐含量和含水率基本没有影响。
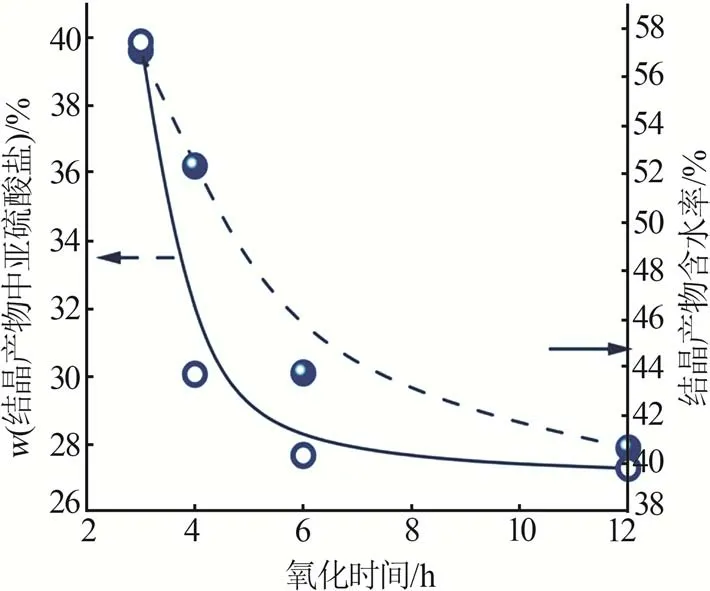
图7 不同氧化时间下结晶产物的亚硫酸盐质量分数和产物含水率Fig.7 Sulfite mass fractions and water contents of crystalline products under different oxidation times
图8为不同氧化时间下结晶产物的矿相组成。由图8看出,随着氧化时间的延长,CaSO4·2H2O晶体的衍射峰强度逐渐增强,达到6 h后CaSO3·1/2H2O的衍射峰消失,说明延长氧化时间能促进亚硫酸盐向正价硫酸盐转变、降低CaSO3·1/2H2O相对含量,利于CaSO4·2H2O晶体各个晶面的生长,进而提高CaS O4·2H2O的结晶度。因此,延长一定的氧化时间能促进亚硫酸盐的氧化和CaSO4·2H2O晶面的生长。
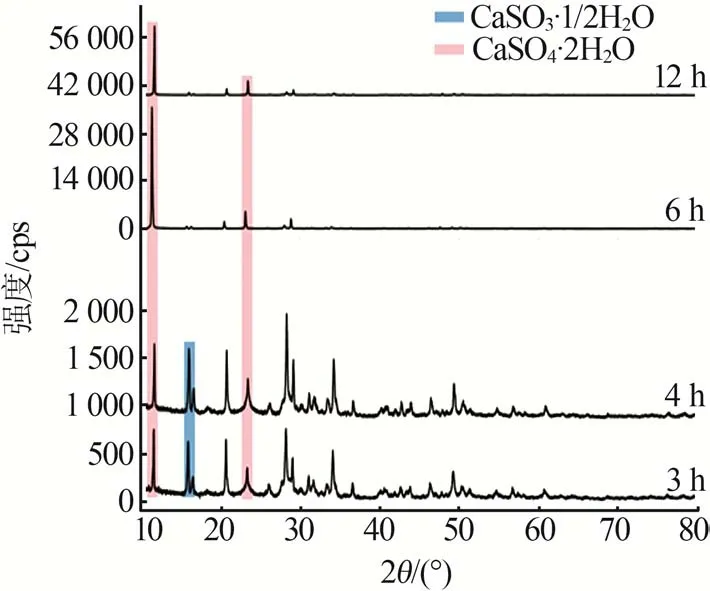
图8 不同氧化时间下结晶产物的矿相组成Fig.8 Mineral compositions of crystallization products at different oxidation times
图9为不同氧化时间下结晶产物的表面微观形貌。由图9可以得出,随着氧化时间的延长,絮状结构逐渐减少,棒状结构逐渐增多,晶体粒径逐渐变大;氧化时间达到6 h后,晶体微观形貌变化不大。这说明延长一定的氧化时间有利于亚硫酸盐的氧化,促进晶体各晶面的生长,达到6 h后变化不大,再次验证一味地延长氧化时间并不能很好地解决结晶问题。CaSO3·1/2H2O的氧化大致分为明显上升阶段和平稳阶段。CaSO3·1/2H2O在溶液中呈微溶状态,通入的空气溶于水受液膜控制。在初始阶段,HSO3-、SO32-与O2反应生成SO42-,氧化速率处于快速上升阶段,溶液pH由于HSO3-、SO32-与溶解氧结合而逐渐降低至中性;随着溶解的CaSO3·1/2H2O逐渐被氧化,氧化率处于平稳阶段,此时溶解氧不再是氧化率的主导因素,延长氧化时间并不会大幅度提高氧化效果。综上所述,氧化时间控制在6 h为宜。

图9 不同氧化时间下结晶产物的表面微观形貌Fig.9 Surface micromorphology of crystallization products at different oxidation times
2.3 电石渣粒径对二水硫酸钙结晶的影响
图10为不同粒径电石渣湿法脱硫结晶产物的亚硫酸盐含量和含水率。由图10可以得出,以不同粒径的电石渣作为原料时,结晶产物的含水率和亚硫酸盐含量有所不同,随着粒径的不断增大,两者均呈现先降低后上升的趋势。粒径在75.00~93.75 μm时,结晶产物的亚硫酸盐含量和含水率均最低,粒径≥150 μm时两者均最高。粒径越大,其表面积越小,使得溶液相对过饱和度低、晶体成核的推动力弱,因而反应越不充分,一定程度上减小了Ca2+与SO42-的碰撞概率,抑制了亚硫酸盐的氧化,导致产物中存在大量的CaSO3晶体而不易脱水。然而,当粒径≤50 μm时结晶产物的含水率和亚硫酸盐质量分数反而升高,说明进一步减小电石渣粒径并不能促进亚硫酸盐的氧化。因此,电石渣粒径在75.00~93.75 μm时CaSO3氧化效果最好。

图10 不同粒径的电石渣下结晶产物中亚硫酸盐质量分数和产物含水率Fig.10 Mass fractions of sulfite and water contents of products crystallized from calcium carbide slag with different particle sizes
图11为不同粒径电石渣湿法脱硫结晶产物的矿相组成。由图11得出,以不同粒径的电石渣作为原料时,结晶产物的矿物相主要组成均为CaSO4·2H2O,而衍射峰强度存在明显差异,粒径在75.00~93.75 μm时,CaSO4·2H2O晶体衍射峰强度最强,说明电石渣在该粒径范围内晶体形成和生长最佳,其余粒径的结晶产物衍射峰强度均有所降低。
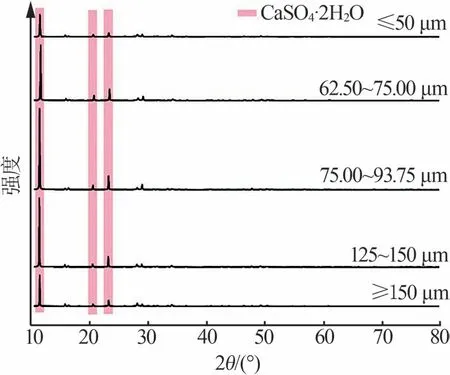
图11 不同粒径的电石渣下结晶产物的矿相组成Fig.11 Mineral compositions of crystallization products at different particle sizes of carbide slag
图12 为不同粒径电石渣湿法脱硫结晶产物的表面微观形貌。由图12可以得出,不同粒径下结晶产物的晶体形貌和尺寸存在明显差异,电石渣粒径在75.00~93.75 μm时晶体粒径最大且最多,其他粒径范围下均不利于晶体的形成和生长,因此电石渣粒径在75.00~93.75 μm时产物的晶体形貌最佳,与之前得出的结论(图10~11)一致。电石渣粒径越小,一方面增大了比表面积和溶解度,使得溶液中Ca2+浓度升高、溶液过饱和度增大,有效降低了液相阻力,更有利于CaSO4·2H2O晶体的成核过程,而短时间内消耗的大量Ca2+使得晶体无法充分生长;另一方面,瞬时生成的CaSO3·1/2H2O晶体间存在静电团聚现象,形成凝聚体,降低了其比表面积,从而抑制了CaSO3·1/2H2O的氧化,阻碍了后续脱水进行。

图12 不同粒径的电石渣下结晶产物的表面微观形貌Fig.12 Surface micromorphology of crystallization products at different particle sizes of carbide slag
3 结论
本文以电石渣为原料系统研究了pH、氧化时间、粒径对CaSO4·2H2O结晶过程的影响,探讨了操作条件对结晶产物含水率、亚硫酸盐含量、矿相组成及微观形貌的影响,得到的主要结论如下。
1)pH受溶液中HSO3-、SO32-含量的影响,因此可通过控制结晶器内通入亚硫酸溶液的体积调节pH。氧化过程中溶液pH由于离子含量降低使得pH逐渐呈中性,pH过高会限制CaSO3·1/2H2O与溶解氧的反应,pH较低对CaSO3的氧化更有利。
2)CaSO3的氧化过程大致分为2个阶段:快速上升期和平稳期。初始阶段氧化率主要受溶解氧因素影响,溶液中溶解的大量HSO3-、SO32-与通入的空气瞬时发生反应,氧化率快速上升;随着溶液中HSO3-、SO32-的氧化,HSO3-、SO32-的含量不断降低,持续通入的空气在溶液中会积累一定的溶解氧,而此时溶液中的CaSO3·1/2H2O大部分被氧化,氧化率表现为缓慢平稳,不再受氧化时间的影响。实验室条件下,当pH为4.06、氧化时间为6 h时,大部分CaSO3·1/2H2O被氧化,不断地延长氧化时间并不会增大氧化率。
3)电石渣粒径对CaSO4·2H2O的结晶有重要影响。电石渣粒径越大,比表面积越小,溶液相对过饱和度越低,使得晶体成核的推动力较弱,一定程度上减小了Ca2+与SO42-的碰撞概率;而电石渣粒径越小,比表面积越大,溶解度相对也大,使得溶液中Ca2+浓度升高,增大了溶液过饱和度,更有利于CaSO4·2H2O晶体的成核过程,而短时间内消耗的大量Ca2+使得晶体无法充分生长;同时瞬时生成的CaSO3·1/2H2O晶体间发生静电团聚,形成凝聚体,降低了比表面积,抑制了CaSO3·1/2H2O的氧化,对后续脱水极为不利。因此,电石渣粒径为75.00~93.75 μm时最佳。

