肝脏血管周上皮样细胞瘤38例临床诊治分析
苏文欣,肖亮,米星宇,莫蕾,方统迪,龙果,陈麒丰,周乐杜
(中南大学湘雅医院 1. 普通外科 2. 病理科,湖南 长沙 410008)
血管周上皮样细胞瘤(perivascular epithelial cell neoplasm,PEComa)是由特征性血管周围细胞组成的间叶源性肿瘤,可见于子宫、肾脏、膀胱、前列腺、肺、胰腺和肝脏等多种器官[1]。发生于肝脏的PEComa缺乏典临床症状和体征,大多数患者通常是在腹部影像学检查中偶然发现[2]。由于缺乏典型影像学特征,在术前影像诊断中很容易被误诊为其他肝脏肿瘤,如肝细胞癌、肝腺瘤、局灶性结节性增生(FNH)等。明确诊断仍需依赖术后组织病理学检查,免疫组化染色黑色素细胞标志物HMB45、melan-A及抗平滑肌抗体(SMA)阳性具有确诊价值[3]。部分肝脏PEComa具有侵袭、转移、复发等特征,但目前对于肝脏PEComa肿瘤良恶性尚无统一标准,手术切除原发灶是目前最安全、最有效、且预后良好的治疗方案[4]。为提高对该疾病的认识水平,减少临床误诊率,为临床决策提供参考,笔者回顾性分析2010—2021年在中南大学湘雅医院普通外科38例行手术治疗并经组织病理学确诊为肝脏PEComa患者的临床特点、影像学表现、病理特点、治疗及预后,现报道如下。
1 资料与方法
1.1 一般资料
女性28例,男性10例,年龄在21~66岁之间。28例于体检时发现,无临床症状。9例表现为间歇性腹胀、腹痛,1例有寒战、发热;1例合并慢性乙型病毒性肝炎。没有患者合并结节性硬化综合征或丙型肝炎病毒感染。血常规、肝功能、甲胎蛋白、糖类抗原CA19-9等结果均正常。2例在外院被诊断为肝血管瘤并经介入治疗后出现破裂出血,后于我院行手术切除治疗(表1)。38例患者共发现40个肝脏结节,肿瘤大小1.0~20.0 cm,平均(6.02±4.84)cm,其中位于右肝21个(52.5%),位于左肝17个(42.5%),位于尾状叶2个(5%)。
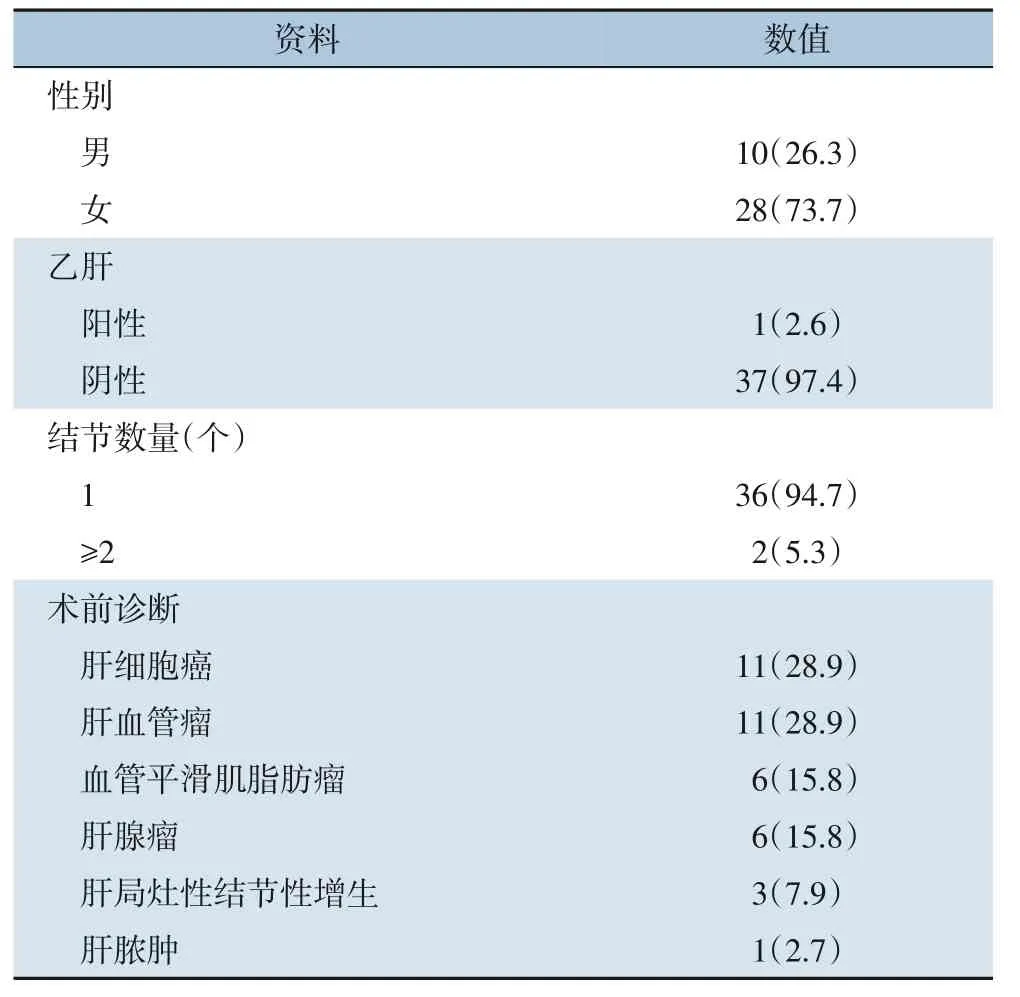
表1 38例肝脏PEComa患者临床资料[n(%)]Table 1 Clinical data of the 38 patients with hepatic PEComa [n (%)]
1.2 影像学特点
35例患者术前腹部超声检查显示病变均为实性,18例表现为高回声或中高回声的肿块;12例表现为混合回声,5例表现为低回声。23例患者术前行增强CT检查,均表现为界限清楚的肿块,增强后动脉期出现明显增强,19例在门脉期和延迟期表现为低密度(图1),4例在门脉期和延迟期仍有强化。10例磁共振成像中,6例T1加权图像低信号,T2加权图像为高信号,3例T1为高信号,T2低信号,1例显示T1和T2均为等信号。所有病例在弥散加权图像(DWI)中均表现为高信号或稍高信号。6例患者门脉期和延迟期增强减退,2例患者门脉期和延迟期仍有强化。有2例MRI显示动脉期明显强化,门静脉期和延迟期快速减退,表现为“快进快出”特点。其中1例57岁的女性患者,同时患有肝内胆管结石和胆管炎,18F-FDG PET/CT显示右肝有低密度的病灶结节,葡萄糖代谢低,胆碱成像显示病变摄取量异常增高,在术前误诊为肝细胞癌(图2)。
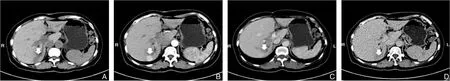
图1 肝脏增强CT三期扫描示图像 A-B:肝右后叶富血供占位性病变,直径约2.8 cm,平扫呈低密度影,动脉期病灶明显均匀强化;C-D:门脉期及延迟期病灶内造影剂消退,呈“快进快出”特点Figure 1 Enhanced three-phase CT images A-B: A space-occupying lesion with rich blood supply and a diameter of 2.8 cm in the right posterior lobe of the liver, presenting a low-density shadow on the plain scan and significant uniform enhancement in the arterial phase; C-D: Marked wash-out of the contrast agent in the portal and delayed phases, characterized by rapid entry and exit
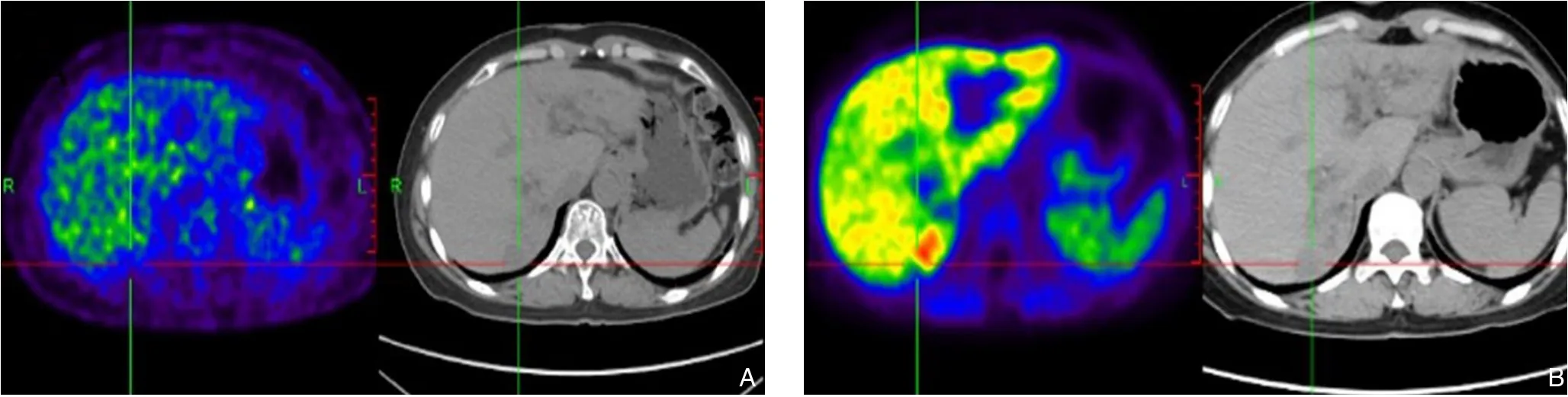
图2 18F-FDG PET/CT A:低密度的结节,低糖代谢;B:胆碱成像病灶摄取量高,考虑诊断为肝细胞癌Figure 2 18F-FDG PET/CT scan images A: A hypodense nodule with low glucose metabolism; B: Increased uptake of 18Fcholine of the lesion for considering diagnosis of hepatocellular carcinoma
1.3 治疗方法
38例均行手术治疗,包括2例被诊断为肝血管瘤并在外院接受肝动脉栓塞术治疗后发生破裂出血患者。其中14例为腹腔镜肝切除术,24例为开腹手术切除。其中1例两个结节分布于左、右肝,右肝结节采用腹腔镜肝切除术,左肝结节采用微波消融术治疗。
2 结 果
2.1 病理及免疫组织化学染色结果
38例患者均由术后组织病理学诊断为肝脏PEComa。肿瘤切面呈灰红色、灰黄色或灰白色(图3)。显微镜下,所有的肿瘤都缺乏明显的包膜,与周围的肝组织分界不清,部分有肿瘤坏死,炎症细胞浸润。成分可见成熟的脂肪细胞、异常的血管生长和上皮细胞,不同病例的成分组成数量不同(图4)。免疫组化染色各抗体表达的阳性率为:HMB-45为100%(38/38),CD34为47.4%(18/38),melan-A为44.7%(17/38),SMA为21.1%(8/38);本组16例行TFE3染色,结果均为阴性(表2)。当肿瘤有明确的恶性病理特征并存在复发和转移时,就被归为恶性PEComa[4],在34例Ki-67染色患者中,只有1例(2.9%)患者阳性率>5%。
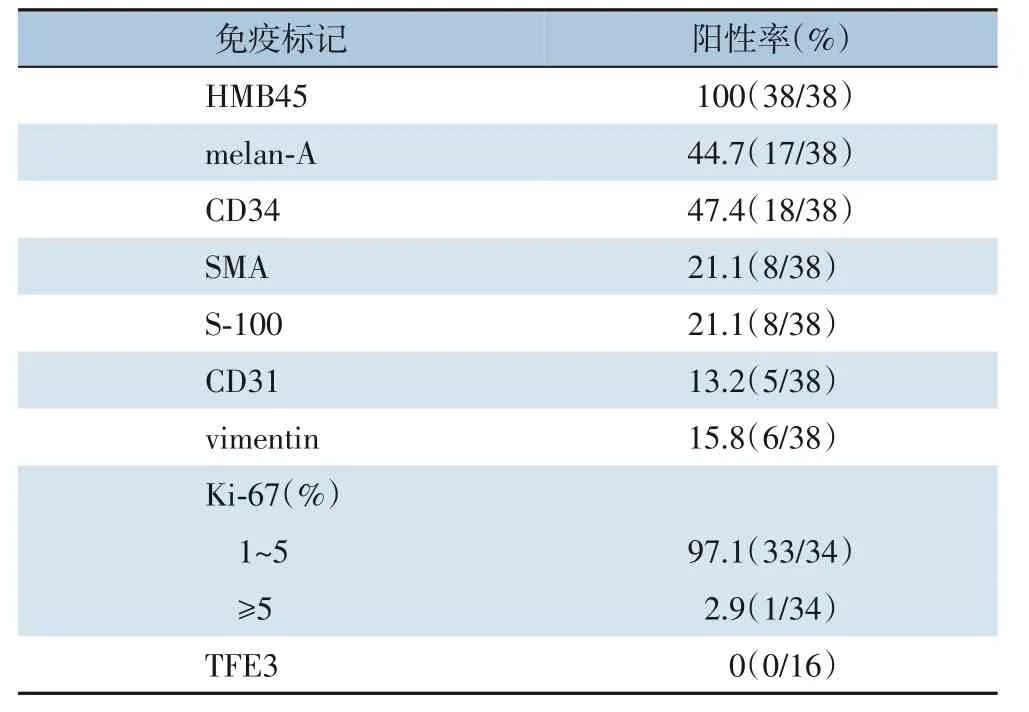
表2 38例肝脏PEComa免疫组化染色结果统计Table 2 Summary of the immunohistochemical staining of 38 cases of hepatic PEComa
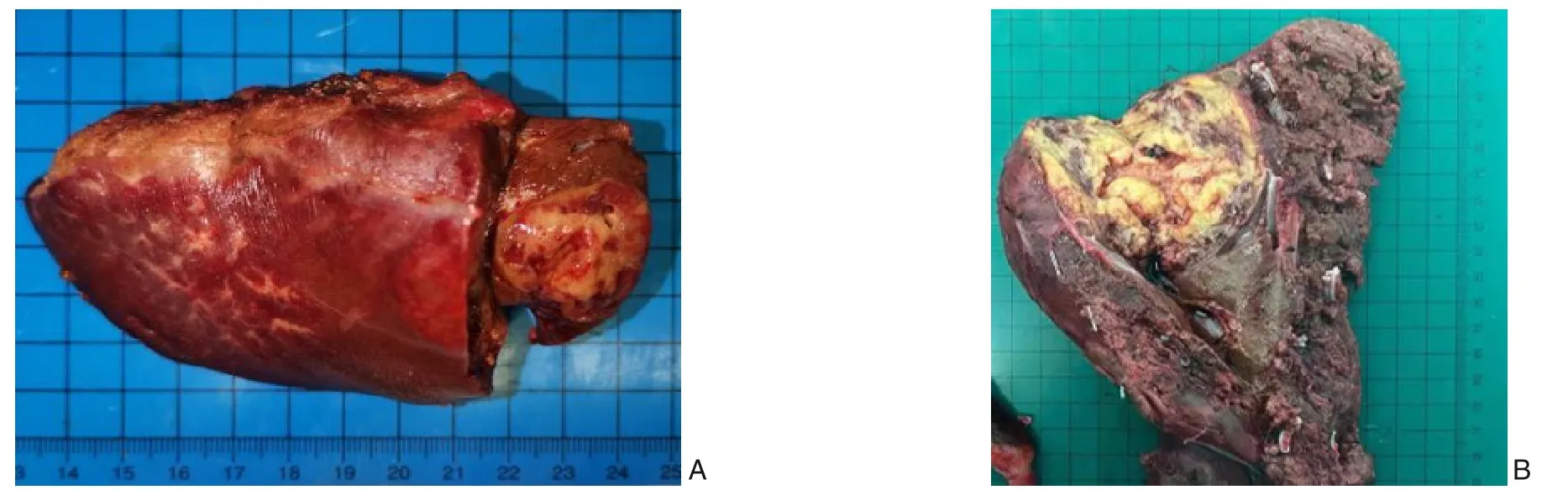
图3 术后标本 A:66岁的男性,肿瘤位于肝左外叶,行腹腔镜下肝左外叶切除;B:66岁的女性,肿瘤主要位于右后叶,行腹腔镜下右后叶切除Figure 3 Postoperative specimens A: Specimen from a 66-year-old male with a tumor in the left lateral lobe of liver undergoing laparoscopic left lateral lobectomy; B: Specimen from a 66-year-old female with a tumor mainly located in the right posterior lobe, undergoing laparoscopic right posterior lobectomy
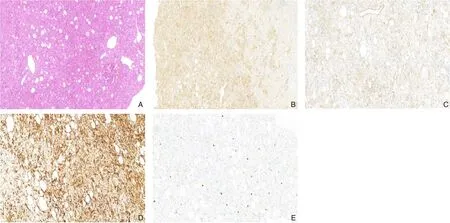
图4 组织病理学检测(×10) A:HE染色;B:HMB-45免疫组化染色;C:melan-A免疫组化染色;D:SMA免疫组化染色;E:Ki-67免疫组化染色Figure 4 Histopathological examination (×10) A: HE staining; B: Immunohistochemical staining for HMB-45;C: Immunohistochemical staining for melan-A; D: Immunohistochemical staining for SMA; E: Immunohistochemical staining for Ki-67
2.2 随访及预后
术后第1年至少3个月复查1次,复查内容包括肝胆彩超、肝功能,必要时复查肝脏CT、MRI,随后每年至少进行2次门诊复查或电话了解肿瘤有无复发和转移。34例患者获得完整随访数据(截至2021年9月9日),随访时间3~133个月,中位随访时间为60.5个月。在随访期间,有1例在术后3年死亡。余所有患者均未发现肿瘤复发或转移。
3 讨 论
PEComa是一种肝脏罕见原发肿瘤,多以病例形式报道,在女性中更为常见。本组病例中,女性28例,男性10例,绝大多数无酒精或药物相关的肝炎或肝硬化病史[5-9]。有学者[10]认为,PEComa的发病与结节性硬化综合征有关,但本组报告的患者均无结节性硬化综合征病史,可能与病例数较少有关。由于缺乏典型症状,大多数患者是偶然发现肝脏占位,部分患者以腹胀、腹痛、腹泻为首发临床表现。本组10例有临床症状,其中1例以寒战、发热为主要表现,合并有胆总管结石和胆管炎,考虑为结石并发症引起的症状,与以往报道[11]的以寒战、发热为原发临床表现的病例不同。肿瘤自发性破裂常发生在较大肿瘤[12],本研究中2例介入术后出血患者,其中1例肿瘤直径仅5.7 cm,可能与肿瘤供应血管丰富有关。目前尚无研究证明肝脏PEComa存在明确的破裂和出血的危险因素。但当肿瘤直径较大,生长位置接近肝脏表面,且肿瘤血供丰富时,不推荐介入治疗。
肝脏PEComa的影像学特征取决于肿瘤内脂肪细胞、血管周围细胞和平滑肌细胞的组成比例。由于缺乏特异性,仅凭术前影像学难以明确诊断,且容易被误诊为肝细胞癌,需要结合肿瘤标记物、肝炎病史等进行鉴别诊断。肿瘤的超声特点通常为界限清楚的高回声或混合回声的实性肿块,超声造影注射造影剂后,动脉期迅速增强并显示高信号,在门静脉期和延迟期,可表现为低回声、等回声或高回声。不同患者的超声检查结果可有很大差异[13],但动脉期多表现为高增强,这可能与大多数肝脏PEComa为富血供肿块有关。CT平扫病变常呈低密度,增强扫描时动脉期明显增强,静脉期可继续增强,而延迟扫描时,常呈等密度。一些主要由肝动脉供血的病变,在门静脉期和延迟期的增强程度明显降低,病变呈“快进快出”的表现,容易误诊为肝细胞癌。大多数肝脏PEComa在T2WI中呈高信号,而T1WI通常没有统一的特征,可呈高信号或等信号[5]。
肝脏PEComa的影像学表现缺乏特异性,明确诊断仍然需要进行穿刺活检或手术切除后组织病理学检查。良性和恶性PEComa的鉴别目前尚无统一标准,但肿瘤直径>5 cm、细胞核具有多形性、肿瘤组织存在坏死、存在血管浸润被认为是具有恶性潜能的预测因素[14]。有学者认为18F-FDG PET/CT成像可用于判断良恶性,但当肿瘤血供丰富或有炎症反应时,肿瘤亦可表现为高葡萄糖代谢[15-17],而有些病例则可呈现出与正常肝组织相同的葡萄糖代谢[18],故PET/CT判断良恶性的价值尚不明确。
免疫表型常表达黑色素细胞(HMB-45、melan-A、S-100蛋白)标志物、肌源性标志物(SMA)和血管源性标志物(CD34)。hepatocyte、AFP、CEA、GPC-3、CD10、CK7和CK19常为阴性[19]。本研究中,HMB-45、melan-A、SMA等均有较高阳性率,与文献[20-22]基本相符。其中HMB-45是最为敏感的指标,结合临床及影像学特点,可以做出更加明确诊断[23]。在子宫PEComa中,TFE3基因表达者显示HMB-45和TFE3染色强烈阳性,而melan-A和平滑肌相关的免疫标志物染色趋于弱阳性或阴性[24]。但本组16例行TFE3染色,且结果均为阴性,可能与样本量小有关,有待大样本的临床研究进一步证实TFE3与melan-A、HMB-45的免疫表达相关性。Ki-67是一种核抗体,细胞周期不同表达差异明显。一般情况下阳性率越高,其肿瘤分期越晚,肿瘤为恶性可能性越大,更容易发生转移、被膜浸润、血管侵犯[25-26]。本研究中有1例患者Ki-67阳性率>5%,但术后截至随访日期尚未发现肿瘤复发和转移,且生存状态良好,可见仅Ki-67不能确定肿瘤的良恶性状态,需要结合患者其他镜下特点综合考虑。另外,本研究共34例进行了Ki-67检测,其中33例阳性率介于1%~5%,这也从侧面证明肝脏PEComa大部分为良性特点。
目前,手术切除是肝脏PEComa首选的治疗方案,本组获得完整随访资料的病例中只有1例于术后3年发生死亡,但术后3年影响生存的原因众多,且复查过程中未发现肿瘤复发或转移,术后病理及免疫组化染色也没有提示肿瘤存在恶性可能。但绝大多数通过手术切除治疗的患者可以获得长期生存和良好的生活质量。PEComa的发生可能与结节性硬化症TSC1或TSC2基因种系突变或缺失有关。对此,有研究[27-29]采用雷帕霉素靶蛋白抑制剂(mTOR)依维莫司和西罗莫司治疗PEComa的方法,但目前尚无大样本临床研究证明mTOR在肝脏PEComa的治疗作用。另外,有研究[30-31]用动脉栓塞和射频消融治疗也取得了良好预后。对于不可行手术切除的PEComa,有学者[32]结合立体定向放射治疗(SBRT)将不可切除的肝脏PEComa转为可切除,最终行手术治疗后仍取得良好预后。对于恶性肝脏PEComa,可手术和不可手术尚无明确界限界定,转化治疗方案仍无专家共识或指南进行指导,对不可手术患者治疗方案仍需要国内外专家在临床实践中不断总结经验。
综上所述,肝脏PEComa是一种临床少见、多为良性的肿瘤。由于缺乏典型临床表现,且术前影像学诊断率漏诊及误诊率高,病理及免疫组织化学染色仍是诊断该疾病的金标准。当出现症状、良恶性难以鉴别时建议尽早手术切除。对于不可行手术治疗患者,mTOR抑制剂、SBRT、介入栓塞等可作为治疗选择,但仍需要临床进一步探索。
利益冲突:所有作者均声明不存在利益冲突。

