中国结直肠癌肝转移诊断和综合治疗指南(2023版)
中国医师协会外科医师分会,中华医学会外科分会胃肠外科学组,中华医学会外科分会结直肠外科学组,中国抗癌协会大肠癌专业委员会,中国医师协会结直肠肿瘤专业委员会,中国临床肿瘤学会结直肠癌专家委员会,中国医师协会外科医师分会结直肠外科医师委员会,中国医师协会肛肠医师分会肿瘤转移委员会,中华医学会肿瘤学分会结直肠肿瘤学组,中国医疗保健国际交流促进会转移肿瘤治疗学分会,中国医疗保健国际交流促进会结直肠病分会
第一部分 诊疗指南
肝脏是结直肠癌血行转移最主要的靶器官,结直肠癌肝转移(colorectal cancer liver metastases,CCLM)是结直肠癌治疗的重点和难点之一[1-2]。约有15%~25%结直肠癌患者在确诊时即合并有肝转移,而另15%~25%的患者将在结直肠癌原发灶根治术后发生肝转移,其中绝大多数(80%~90%)的肝转移灶初始无法获得根治性切除[3-7]。肝转移也是结直肠癌患者最主要的死亡原因[2],未经治疗的肝转移患者的中位生存期仅6.9个月,无法切除患者的5年生存率低于5%[8-9],而肝转移灶能完全切除[或可以达到“无疾病证据(no evidence of disease,NED)”状态]患者的中位生存期为35个月,5年生存率可达30%~57%[10-14]。研究表明,有一部分最初肝转移灶无法根除的患者经治疗后可以转化为可切除或达到NED状态。因此,通过多学科团队(multidisciplinary team,MDT)对CCLM患者进行全面的评估,个性化地制定治疗目标,开展相应的综合治疗,以预防CCLM的发生、提高肝转移灶手术切除率和5年生存率[15-16]。
为了提高我国CCLM的诊断和综合治疗水平,受卫生部临床重点学科项目资助(2008—2010年),中华医学会外科分会胃肠外科学组和结直肠外科学组、中国抗癌协会大肠癌专业委员会自2008年起联合编写了《结直肠癌肝转移诊断和综合治疗指南》(草案)(以下简称“指南”),以指导我国CCLM的诊断和治疗,并于2010、2013年先后进行了两次修订。2016、2018、2020年联手中国医师协会外科医师分会结直肠外科医师委员会、中国医疗保健国际交流促进会结直肠癌肝转移治疗委员会、中国临床肿瘤学会结直肠癌专家委员会、中国医师协会结直肠肿瘤专业委员会、中国医师协会肛肠医师分会肿瘤转移委员会、中华医学会肿瘤学分会结直肠肿瘤学组、中国医师协会外科医师分会等多次共同修订了《指南》。2022年再次一起总结国内外先进经验和最新进展修订本《指南》(本《指南》对CCLM的诊断、预防、外科手术和其他综合治疗提出的建议,请各地医院根据实际情况予以应用。本文中出现的推荐级别、循证医学证据分类的界定,详见附录1)。
1 CCLM的诊断与随访
1.1 CCLM的定义
按照国际共识,同时性肝转移(synchronous liver metastases,SLM)是指结直肠癌确诊前或确诊时发现的肝转移;而结直肠癌根治术后发生的肝转移称为异时性肝转移(metachronous liver metastases,MLM)[17]。本《指南》为便于诊疗策略的制定,将按照“结直肠癌确诊时合并肝转移”和“结直肠癌根治术后发生肝转移”两方面阐述。
1.2 结直肠癌确诊时肝转移的诊断常规
对已确诊结直肠癌的患者,除血清CEA、CA19-9等肿瘤标记物检查、病理分期评估外,应常规进行肝脏超声和腹部增强CT等影像检查筛查及诊断肝脏转移瘤。对于超声或CT影像高度怀疑但不能确诊的患者可加行血清AFP、肝脏超声造影和肝脏MRI平扫及增强检查[18](1a类证据,A级推荐),肝脏细胞特异性造影剂增强MRI检查对于发现<1 cm的微小病灶准确率更高,有条件时可考虑。PET/CT检查不作为常规推荐,可在病情需要时酌情应用[19-21](2a类证据,B级推荐)。
肝转移灶的经皮针刺活检仅限于病情需要时应用[22]。
结直肠癌手术中必须常规探查肝脏以进一步排除肝转移的可能[23],对可疑的肝脏结节可行术中超声检查,必要时考虑同步切除或术中活检[9](3a类证据,B级推荐)。
1.3 结直肠癌根治术后肝转移的监测
结直肠癌根治术后,应对患者定期随访[24-26],了解有无肝转移或其他远处转移的发生。⑴ 每3~6个月进行1次病史询问、体格检查、肝脏超声检查和检测血清CEA、CA19-9等适当的肿瘤标志物,持续2年,以后每6个月1次直至满5年[27](1a类证据,A级推荐),5年后每年1次。⑵ Ⅱ期和Ⅲ期的结直肠癌患者,建议每年进行1次胸/腹/盆腔增强CT扫描,共3~5年[28](1b类证据,A级推荐),以后每1~2年1次。对于超声或CT影像高度怀疑肝转移瘤但不能确诊的患者应加行肝脏MRI等检查,并建议在随访过程中保持影像检查方法的一致性。PET/CT扫描不做常规推荐。⑶ 术后1年内应进行电子结肠镜的检查,若发现异常,需在1年内复查[29-30];如无异常则推荐术后第3年复查,以后每5年1次。如果患者发病年龄<50岁或确诊Lynch综合征则应适当增加电子结肠镜的检查频度。对于结直肠癌原发灶切除术前因梗阻等原因未完成全结肠镜检查的患者,应在术后3~6个月内完成首次电子结肠镜检查[29-30](1a类证据,A级推荐)。
1.4 CCLM灶达到NED状态后的随访
CCLM灶达到NED状态后,对患者也应进行密切的随访,了解有无肝转移复发或出现其他远处转移的可能。⑴ 建议术后2年内每3个月随访血清CEA、CA19-9和其他适当的肿瘤标志物,以后第3~5年内每6个月随访1次(1a类证据,A级推荐),5年后每年1次。⑵ 术后2年内每3个月进行1次腹/盆腔增强CT扫描或肝脏MRI增强检查,必要时肝脏细胞特异性造影剂增强MRI检查。以后每6~12个月进行1次,共5年[28](1a类证据,A级推荐),5年后每年1次。不推荐常规PET/CT扫描。⑶ 其他随访内容和频次参照结直肠癌原发灶根治术后的随访进行。
1.5 结直肠癌及其肝转移的相关基因检测
1.5.1RAS检测 推荐所有CCLM患者均进行KRAS第2、3、4外显子以及NRAS第2、3、4外显子的检测[31-33]。RAS基因是否突变不仅具有预后意义[34-36],更是预测抗EGFR治疗有效性的重要生物学标记物[37-38](1a类证据,A级推荐)。其中KRASG12C突变还有助于后线治疗对靶向药物的选择。
1.5.2BRAF检测 推荐CCLM患者进行BRAFV600E突变检测[39-40],作为预后的评估指标[41-43](1b类证据,A级推荐)以及疗效预测因子,以指导治疗方案选择。
1.5.3 错配修复基因(MMR)/微卫星不稳定性(MSI)检测 推荐结直肠癌患者均进行检测[44-46](2b类证据,B级推荐),以便更精准地制定治疗策略,尤其是对免疫检查点抑制剂的应用至关重要。采用PCR+毛细管电泳法比较肿瘤组织与正常组织中微卫星序列长度的差异检测微卫星状态,是MSI检测的金标准[47-48]。免疫组化检测MMR的蛋白表达(包括MLH1、MSH2、MSH6和PMS2),因简便快捷已成为目前最常用的检测方式,可达到与PCR检测90%~95%以上的一致率[49]。另外,有经过验证合格的二代测序法(NGS)也可用于MSI检测。
1.5.4UGT1A1检测UGT1A1是伊立替康的药物代谢酶,其基因的多样性会显著影响该酶的活性。因此建议尽可能获取UGT1A1基因检测结果,据此慎重考虑伊立替康的给药剂量[50-52](2b类证据,B级推荐)。
1.5.5 HER-2检测 在标准治疗失败的转移性结直肠癌患者中抗HER-2治疗逐渐受到重视,建议转移性结直肠癌患者进行HER-2检测[53],为晚期患者后线治疗的临床决策提供依据(2b类证据,B级推荐)。
1.5.6 其他 二代测序(NGS)检测肿瘤突变负荷(TMB)[54]、DNA聚合酶epsilon和delta 1(POLE/POLD1)、神经营养因子受体酪氨酸激酶(NTRK)融合基因[55]等,均可作为潜在的预测免疫检查点抑制剂治疗或靶向药物治疗疗效的生物标志物。
结直肠癌原发灶和肝转移灶的基因状态大多无差别[56-58],对于无法获取肿瘤组织进行检测时可考虑液态活检技术(2b类证据,B级推荐)。
有研究发现基于循环肿瘤DNA(ctDNA)指导的微小残留病灶(minimum residual disease,MRD)评估可有效提示结直肠癌患者接受治疗后的治愈情况,因此MRD有助于判断预后和制定下一步治疗策略,但目前仍存在诸多困难。
2 CCLM的预防
2.1 结直肠癌原发灶根治性切除术
根治性手术切除结直肠癌病灶是迄今为止结直肠癌最有效的治愈方法[59],也是预防肝转移发生的重要环节。⑴ 结肠癌根治性手术范围包括肿瘤全部及其两端足够肠段和周围可能被浸润的组织和器官以及相关系膜、主要供应血管和淋巴引流区,具体手术方式依照肿瘤部位不同而异,但均应遵循完整结肠系膜切除(complete mesocolic excision,CME)原则。⑵ 直肠癌根治性手术范围应包括肿瘤全部及其两端足够肠段、周围可能被浸润的组织和器官以及相关的肠系膜和淋巴结。直肠中下段的肿瘤应遵循全直肠系膜切除(total mesorectal excision,TME)原则。⑶ 术中发现存在切除范围外的可疑淋巴结,应进行术中活检或切除。
2.2 结直肠癌确诊时无肝转移(及其他远处转移)的新辅助治疗
术前通过新辅助治疗杀灭未被影像学检测到的微小转移灶,可以最大程度地减少根治性手术后的远处转移[60-62]。
中低位直肠癌的新辅助治疗(注:高位直肠癌,即肿瘤下缘距肛缘12 cm以上者,其新辅助治疗参照结肠癌):⑴ 联合放化疗或放疗:建议术前诊断为T3期及以上或任何T、淋巴结阳性的直肠癌,在不伴有明显出血、梗阻症状、无穿孔以及其他远处转移等情况时应用。包括长程联合放化疗和单纯短程放疗[63-65]。近年来,局部进展期直肠癌出现新治疗模式,全程新辅助治疗(total neoadjuvant treatment,TNT)[66],将直肠癌术后辅助化疗提至术前,即术前进行新辅助化疗和同步放化疗,可获得更高的完全缓解率,有助于器官保留,还可以降低远处转移发生,改善长期生存[67](2a类证据,B级推荐)。⑵ 肝动脉和肿瘤区域动脉联合灌注化疗:对于术前分期Ⅲ期,且不伴有出血、梗阻症状或无穿孔的患者,在有条件的单位可考虑应用。5-FU(或其前体药物)并可联合奥沙利铂,经肝动脉、肿瘤区域动脉分别灌注,化疗后7~10 d施行根治性切除术。目前的临床研究表明该方案虽不能明显降期,但对Ⅲ期结直肠癌患者有预防肝转移的作用[68],建议在有条件的单位开展,不作为常规推荐。
结肠癌的新辅助治疗:结肠癌的新辅助治疗尚无明确的循证医学证据,对于术前判断为Ⅲ期的患者可考虑肝动脉和肿瘤区域动脉联合灌注化疗,以减少肝转移的发生[68],不作为常规推荐。
2.3 无转移结直肠癌患者术中门静脉化疗、腹腔化疗
对于该治疗方案的探讨目前有了一些令人鼓舞的数据[69],如能联合术后辅助化疗,将可以减少肝转移的发生。但这一结果仍需进一步临床研究证实,故不作为常规手段推荐,临床研究可关注。
2.4 无转移结直肠癌患者根治术后的辅助治疗
对于Ⅲ期结肠癌,术后辅助化疗能延长5年无病生存率及总生存率[70],因此上述结肠癌患者在手术治疗后应进行3~6个月的辅助化疗,可选择的治疗方案有:FOLFOX,CapeOX,5-FU/LV或卡培他滨单药(1a类证据,A级推荐)。pMMR/MSS/MSI-L的Ⅱ期患者如不存在复发转移高危因素(T4、组织分化差、肿瘤周围淋巴管神经侵犯、肠梗阻,或T3伴有局部穿孔、切缘不确定或阳性、淋巴结活检数量少于12个)的,术后两药联合的辅助化疗在许多临床研究中获益不显著,故建议接受临床观察和随访[71](1b类证据,A级推荐),或建议氟尿嘧啶单药治疗。但对于高危Ⅱ期患者应予以辅助化疗,方案参照Ⅲ期患者[72-73](2a类证据,B级推荐)。dMMR/MSI-H的Ⅱ期患者无论是否存在高危因素均可接受临床观察和随访,但T4患者是否需辅助化疗目前尚有争议[74]。
T3及以上和任何T,淋巴结阳性的中低位直肠癌患者如术前没有进行放化疗,术后辅助化疗或放化疗能提高3年无病生存率及降低局部复发率[75-76],但对于能否减少直肠癌肝转移方面研究有限,和辅助治疗的结合方式也需更多临床试验验证。术前接受过放疗或联合放化疗的患者,术后也应接受辅助治疗,但尚无充分的循证医学证据。
总而言之,CCLM最有效的预防方式就是规范化治疗结直肠癌。
3 MDT在CCLM诊治中的作用
对于肿瘤性疾病,MDT治疗模式是有效的手段[77-78],因此建议CCLM患者进入MDT治疗模式[79](1a类证据,A级推荐)。结直肠癌的MDT以患者为中心,成员应包括结直肠外科、胃肠外科、肝外科、肿瘤内科、放疗科、放射介入科、放射和超声影像科、病理科及其他相关专业有一定资质的医生[80]。MDT治疗模式可以减少个体医生做出的不完善决策[81],其重要作用还包括:⑴ 更精确的疾病分期[82];⑵ 减少治疗混乱和延误[83-84];⑶ 更个性化的评估体系和治疗[85];⑷ 更好的治疗衔接[86];⑸ 更高的生活质量[87];⑹ 最佳的临床和生存获益[88];⑺ 最优的卫生经济学[89-92]。
MDT根据患者的体力状况、年龄、器官功能、合并症和肿瘤的分子病理特征等进行评估,针对不同的治疗目标,给予患者最合理的检查和最恰当的综合治疗方案[80,93](1a类证据,A级推荐)。
患者全身状况较差,不适合进行高强度治疗时,建议单药(或联合靶向药物)、减量的两药方案或最佳支持治疗,以提高生活质量并尽量延长生存时间。如全身情况好转,可以再进行高强度治疗。
适合高强度治疗的患者,应依据肝转移的具体情况和是否伴有其他转移等,制定不同的治疗目标,给予个体化的治疗方案。
肝转移灶初始即可以R0切除,且手术难度不大、肿瘤生物学行为良好的患者,其治疗目的是获得治愈[94]。应该围绕手术治疗进行相应的新辅助和/或辅助治疗,以降低手术后复发的风险。肝转移灶是否可以R0切除的判断应由肝外科、肿瘤外科、影像科专家联合进行。肝转移灶可以R0切除,但手术切除难度较大时也应积极联合其他肿瘤局部毁损手段(如射频消融或/和立体定向放疗等),以达到NED状态[95]。
肝转移初始无法切除,但经过一定的治疗有望转为NED状态,且全身情况能够接受包括转移灶切除手术在内的局部治疗手段和高强度治疗的患者。这类患者的治疗目的主要是最大程度地缩小瘤体或增加残肝体积,应采用最积极的综合治疗,即转化治疗。⑴ 结直肠癌确诊时合并无法达到NED状态的肝转移:① 结直肠癌原发灶存在出血、梗阻症状或穿孔时,应先行切除结直肠癌原发病灶,继而进行系统性化疗(或加用肝动脉灌注化疗),并可联合应用分子靶向药物治疗(1b类证据,A级推荐),其中dMMR/MSI-H患者可选择免疫检查点抑制剂治疗。治疗后每6~8周进行肝脏超声检查和CT增强扫描并依据RECIST标准予以评估。临床重大决策时建议MRI平扫及增强扫描。如果肝转移灶转变成可切除或有望达到NED状态时,即予以手术治疗或手术联合其他肿瘤局部毁损手段;如果肝转移灶仍不能达到NED状态,则继续进行综合治疗。② 结直肠癌原发灶无出血、梗阻症状及无穿孔时可行系统性化疗(或加用肝动脉灌注化疗),并可联用分子靶向治疗(1c类证据,B级推荐),其中dMMR/MSI-H患者可选择免疫检查点抑制剂治疗。每6~8周评估1次,如果转移灶转化成可切除或有望达到NED状态时,即手术治疗(一期同步切除或分阶段切除原发病灶和肝转移灶)或手术联合其他肿瘤局部毁损手段;如果肝转移灶仍不能达到NED状态,则视具体情况手术切除结直肠癌原发病灶,术后继续对肝转移灶进行综合治疗。此类患者也可选择先行切除结直肠癌的原发病灶,继而进一步治疗,具体方案同上。⑵ 结直肠癌根治术后发生的无法达到NED状态的肝转移:① 采用5-FU/LV(或卡培他滨)联合奥沙利铂或/和伊立替康的两药或三药方案作为一线化疗,并可加用分子靶向治疗,或联用肝动脉灌注化疗[96](1b类证据,A级推荐),其中dMMR/MSI-H患者可选择免疫检查点抑制剂治疗[97]。对氟尿嘧啶类药物不耐受的患者可考虑使用雷替曲塞(2b类证据,B级推荐)。② 在肝转移发生前12个月内使用过奥沙利铂为基础的化疗作为辅助治疗的患者,应采用FOLFIRI方案[98];化疗结束后12个月以上发生肝转移,仍可采用FOLFOX或CapeOX化疗方案,并可加用分子靶向药物治疗,或联用肝动脉灌注化疗(3a类证据,B级推荐),其中dMMR/MSI-H患者可选择免疫检查点抑制剂治疗[97]。治疗后每6~8周检查肝脏超声、CT增强扫描予以评估,临床重大决策时建议MRI平扫及增强扫描,肝转移灶转为可切除或可以达到NED状态的患者,即应接受肝转移灶切除手术或手术联合其他肿瘤局部毁损手段,术后再予以辅助化疗;如果肝转移灶仍不能达到NED状态,则应继续进行综合治疗。
还有一部分患者,其肝转移灶可能始终无法切除或达到NED状态,但全身情况允许接受较高强度的治疗。对于这类患者是以控制疾病进展为目的进行治疗,应该采用较为积极的联合治疗。
对于结直肠癌原发灶无出血、梗阻症状及无穿孔时合并始终无法达到NED状态的肝转移灶的患者是否应该切除原发灶目前仍有争议[99]。因此,需要MDT综合考虑肿瘤和患者情况,进行个体化决策,是否切除原发灶。
4 CCLM灶的手术及其他毁损治疗
4.1 手术治疗
手术完全切除肝转移灶仍是目前能治愈CCLM的最佳方法[100-106],故符合条件的患者均应在适当的时候接受手术治疗。部分最初肝转移灶无法切除的患者经治疗后转化为可切除病灶时也应适时接受手术治疗。
4.1.1 手术适应证和禁忌证 ⑴ 适应证:是否适合手术切除的标准一直在演变,但主要应从以下3方面来判断[15,107](2a类证据,B级推荐):结直肠癌原发灶能够或已经根治性切除;根据肝脏解剖学基础和病灶范围,肝转移灶可完全(R0)切除,且要求保留足够的功能性肝组织(肝脏残留容积≥30%~40%,采用三维CT、三维数字成像技术等有助于评估残肝体积[108-109]);患者全身状况允许,没有不可切除或毁损的肝外转移病变,或仅为肺部结节性病灶,但不影响肝转移灶切除决策的患者。随着技术的进步,肝转移灶的大小、数目、部位等已不再是影响判断CCLM患者是否适宜手术的单一决定因素。另外,当前的文献资料已经将切缘不足1 cm[110-111]、可切除的肝门淋巴结转移[112-114]、可切除的肝外转移病灶(包括肺、腹腔)[114-118]等也纳入了适宜手术切除的范畴(4类证据,C级推荐)。⑵ 禁忌证[9,107,113](3a类证据,B级推荐):结直肠癌原发灶不能取得根治性切除;出现不适合局部处理的肝外转移;预计术后残余肝脏容积不够;患者全身状况不能耐受手术。
4.1.2 结直肠癌确诊时合并肝转移的手术治疗⑴ 结直肠癌原发灶和肝转移灶一期同步切除:在肝转移灶小、且多位于周边或局限于半肝,肝切除量低于60%,肝门部淋巴结、腹腔或其他远处转移均可手术切除的患者可建议一期同步切除[119-123]。有研究[124-128]认为一期同步切除肝转移灶和原发结直肠癌病灶手术的并发症和病死率可能高于二期分阶段手术,故患者的选择上应较为慎重,尤其是需要在两切口下完成的同步手术。急诊手术由于缺少完备的术前检查资料和较高的感染发生机会,不推荐原发结直肠癌和肝脏转移病灶一期同步切除[129](2c类证据,B级推荐)。⑵ 结直肠癌原发灶和肝转移灶二期分阶段切除:术前评估不能满足一期同步切除条件的患者,可以先手术切除结直肠癌原发病灶,二期分阶段切除肝转移灶,时机选择在结直肠癌根治术后4~6周;若在肝转移灶手术前进行系统性治疗,肝转移灶的切除可延至原发灶切除后3个月内进行。可根治的复发性结直肠癌伴有可切除肝转移灶的治疗按结直肠癌确诊时合并肝转移处理,但倾向于进行二期分阶段切除肝转移灶。先切除肝转移灶、再切除结直肠原发灶的“肝优先模式”(liver first approach)也已开展应用[130-133],其手术的并发症、病死率和5年生存率均与传统模式的二期分阶段切除相同[134-135](3b类证据,B级推荐)。
4.1.3 结直肠癌根治术后发生肝转移的手术治疗既往结直肠原发灶为根治性切除且不伴有原发灶复发,肝转移灶能完全切除且肝切除量低于70%(无肝硬化者),应予以手术切除肝转移灶,也可考虑先行新辅助治疗(3b类证据,B级推荐)。
诊断结直肠癌根治术后发生肝转移应当有两项以上的影像学检查依据,包括肝脏超声、增强CT及MRI等,必要时可结合PET/CT扫描以确定病变的范围和有无肝外转移,从而避免不必要的手术治疗[136]。
4.1.4 肝转移灶手术方式的选择[137-140](3b类证据,B级推荐) ⑴ 肝转移灶切除后至少保留3根肝静脉中的1根且残肝容积≥40%(同时性肝切除)或≥30%(异时性肝切除)。转移灶的手术切除应符合R0原则,切缘至少>1 mm[141-144]。⑵ 如是局限于左半或右半肝的较大肝转移灶且无肝硬化者,可行规则的半肝切除。⑶ 建议肝转移手术时采用术中超声或超声造影检查,有助于发现术前影像学检查未能诊断的肝转移病灶。⑷ 应用门静脉选择性的栓塞(PVE)或结扎(PVL)可以使肝转移灶切除术后预期剩余肝脏代偿性增大,增加手术切除的可能。此方法被用于预计手术切除后剩余肝脏体积不足30%的肝转移患者。对于那些剩余肝脏体积在30%~40%,并且接受了强烈化疗而有肝实质损伤的患者,同样也可从中得益[145-147](4类证据,C级推荐)。放射性同时门静脉和肝静脉栓塞(radiological simultaneous portohepatic vein embolization,RASPE),又称肝静脉剥夺术[148](liver venous deprivation,LVD),对比单纯门静脉栓塞和联合肝脏离断和门静脉结扎的二步肝切除术(associating liver partition and portal vein ligation for staged hepatectomy,ALPPS)[149],不仅可使残余肝迅速增生,而且并发症发生率和病死率低于ALPPS[150],具有操作简捷、创伤小、安全等优点,但目前仍需更多研究进一步评价,临床研究可关注。⑸ ALPPS可使残留肝脏的体积在较短时间内明显增大而获得更多Ⅱ期肝切除的机会,但此手术复杂,并发症及病死率均高于传统肝切除,故建议在严格选择的患者中由经验丰富的肝脏外科医师实施手术[151-152]。⑹ 肝移植对于经过肝切除、局部消融治疗、系统性化疗、介入治疗、分子靶向治疗、免疫检查点抑制剂治疗等多种方法的联合或序贯治疗仍无法达到NED状态但仍局限于肝转移的患者,可酌情谨慎选择肝脏移植[153-154]。
4.1.5 肝转移灶切除术后复发和肝外转移灶的切除 在全身状况和肝脏条件允许的情况下,对于可切除的肝转移灶术后的复发病灶,经MDT讨论后,可再次选择手术切除或其他局部治疗,文献[155-157]报道显示其手术并发症和病死率并不高于第1次肝转移灶的切除,而且可获得相同的术后生存率(3b类证据,B级推荐)。同样,在患者全身状况允许时,如果肺[157]和腹腔[158-159]等的肝外转移病灶可完全切除,也应进行同步或分阶段切除(3b类证据,B级推荐)。
4.2 可达到NED状态的肿瘤局部毁损治疗
除了手术切除肝转移灶外,有些治疗手段(如射频消融、微波消融和放射治疗)也能使病灶发生彻底毁损,所以对于手术切除难度较大的个别肝转移灶应积极联合此类手段,以使更多的患者有机会达到NED状态,提高5年生存率。
5 可达到NED状态CCLM的新辅助及辅助治疗
5.1 新辅助治疗
对可达到NED状态的CCLM患者可考虑进行新辅助治疗,主要基于以下几方面原因:⑴ 新辅助化疗提供了“窗口期”,观察有无新的无法切除的转移灶的出现,减少没有必要的手术[160];⑵ 新辅助治疗可增加R0手术的机会,增加术后残余肝脏的体积[161-162];⑶ 新辅助化疗可作为评价化疗方案敏感性的依据,指导术后化疗方案的选择[163-167];⑷ 新辅助化疗的疗效,可作为患者预后评估的1个指标[163,168];⑸新辅助化疗结合辅助化疗,可能改善接受治愈性手术患者的预后[169-170]。
新辅助治疗在应用时也应关注如下情况的发生:⑴ 化疗可能会造成肝脏损伤:如与奥沙利铂治疗相关的肝窦阻塞综合征[171-177];与伊立替康治疗相关的脂肪变性和脂肪性肝炎等[178-180],这些损害均可能增加肝切除术后的并发症[181-182]。⑵ 影像学检查消失的转移灶术中仍应积极探查[183-185],例如术中超声造影等[186],若病灶有残存,应积极切除;若病灶消失而无法精确定位者应慎重考虑是否切除[162,187]。⑶ 转移灶进展致使无法达到NED状态。
结直肠癌确诊时合并肝转移的新辅助治疗:在原发灶无出血、梗阻症状或无穿孔时,除肝转移灶在技术上切除容易且不存在不良预后因素的患者[如临床危险评分(clinical risk score,CRS)<3]外,可考虑应用新辅助治疗[15,188-190](2a类证据,B级推荐),尤其是肝转移灶体积较大、转移灶数量较多或存在原发灶淋巴结可疑转移的患者。系统性化疗的方案包括FOLFOX、FOLFIRI、CapeOX或FOLFOXIRI[191-194],可否联合分子靶向治疗目前仍有争议,同时也可以考虑联合肝动脉灌注化疗[195-197]。为减少化疗对肝脏手术的不利影响,新辅助化疗原则上不超过6个周期[72,198](1a证据,A级推荐),一般建议2~3个月内完成并进行手术[199-200]。
结直肠癌根治术后发生的肝转移的新辅助治疗:原发灶切除术后未接受过化疗的患者,或者发现肝转移12个月前已完成化疗的患者,可采用新辅助治疗(方法同上),时间2~3个月[198,201](2a证据,B级推荐)。而肝转移发现前12个月内接受过化疗的患者,一般认为新辅助化疗作用可能较为有限,宜直接切除肝转移灶,继而术后辅助治疗[188](2a类证据,B级推荐)。也可考虑更换化疗方案进行新辅助化疗[184,197],或术前联合肝动脉灌注化疗[195]。
5.2 肝转移灶切除术后的辅助治疗
建议肝转移灶完全切除的患者接受术后辅助化疗[202-204],特别是没有进行过术前化疗及辅助化疗的患者,推荐手术前后的化疗时间总长不超过6个月(2c类证据,B级推荐)。对于术前接受过肝动脉灌注化疗且有效的患者,术后也可考虑同时联合肝动脉灌注化疗[205-208]。经过术前化疗(包括联合分子靶向药物)证实有效的方案,术后如无禁忌应该作为首选的辅助治疗方案。
6 无法达到NED状态的CCLM的综合治疗
对于无法达到NED状态的CCLM的综合治疗包括系统性化疗和介入化疗、分子靶向治疗、免疫检查点抑制剂治疗以及针对肝脏病灶的局部治疗如消融治疗、无水酒精注射、放射治疗等,治疗方案的选择应基于对患者治疗前的精确评估。
部分初诊无法达到NED状态的肝转移患者,经过系统的综合治疗后,即转化治疗,可转为适宜手术切除[209-210]或达到NED状态。其术后5年生存率与初始肝转移灶手术切除的患者相似[211-212],此类患者应当采取较为积极的诱导方案,应用有效的强烈化疗,并考虑联合肝动脉灌注化疗及分子靶向药物治疗。
对于肝转移灶始终无法达到NED状态的患者,综合治疗也可明显延长中位生存期,控制疾病快速进展,明显改善生存质量[213-216]。因此,积极的综合治疗对于适合强烈治疗的晚期CCLM患者同样意义重大。
6.1 系统性化疗和肝动脉灌注化疗
化疗开始前应充分评估患者的身体状况和肿瘤分期,事先规划好患者的后续治疗和预计有严重化疗毒性反应时剂量和方案的调整。开始治疗时必须考虑患者的分类(详见“3 MDT在CCLM诊治中的作用”)、化疗的安全性以及将来手术或/和局部病灶毁损治疗的可能性。
初始化疗对于肝转移灶有潜在NED状态可能的患者进行的转化治疗至关重要。转移灶出现的早期退缩(early tumor shrinkage,ETS)更是预后的重要指标之一[217-219]。对于pMMR/MSS/MSI-L的患者,5-FU/LV(或卡培他滨)联合奥沙利铂或/和伊立替康的化疗方案具有较高的转化切除率(1b类证据,A级推荐),应该作为首选的化疗方案。化疗联合分子靶向药物可以进一步提高转化率[220-222](1b类证据,A级推荐)。现有的研究数据显示,化疗联合贝伐珠单抗有良好的疾病控制率和转化切除率[223],而RAS野生型患者还可以采用化疗联合西妥昔单抗治疗[224-225](1b类证据,A级推荐)。对于dMMR/MSI-H的患者,相较于化疗±靶向治疗,帕博利珠单抗免疫检查点抑制剂治疗可明显提高疾病控制率和转化切除率[97,226],可以作为首选。BRAF的状态是重要的预后指标,BRAFV600E突变的CCLM患者大多预后较差,有数据提示对该类患者化疗联合抗EGFR治疗的获益比较有限[227]。因此对BRAFV600E突变的CCLM患者,初始治疗采用化疗联合抗VEGF单抗也是值得考虑的选择。有数据提示,对于RAS野生型的CCLM患者,抗EGFR治疗的疗效与肿瘤部位存在相关性[210,224,228]。原发灶位于左半结肠(脾曲至直肠)肝转移患者使用抗EGFR单抗在客观缓解率和总生存上优于抗VEGF单抗,而原发灶位于右半结肠(回盲部至脾曲)肝转移患者,抗EGFR单抗在客观反应率上优于抗VEGF单抗,但总体生存不如抗VEGF单抗。以FOLFOXIRI为代表的三药化疗方案也有较高的切除转化率[229-231],在分子靶向药物无法使用且综合患者年龄、体能状况及肝功能状态等因素均适宜的情况下应该作为首选,但该方案的不良反应较多,应予以关注。目前三药化疗方案联合贝伐珠单抗的研究有了较好的临床数据[231-234],可在选择性的患者中谨慎地应用[214,230,233](2b类证据,B级推荐)。还有研究[228-229]发现三药化疗联合抗EGFR单抗比单纯三药化疗有更高的客观缓解率,能潜在提高R0切除率,改善总体生存(2b类证据,B级推荐)。
对于肝转移灶始终无法达到NED状态的患者,5-FU/LV(或卡培他滨)联合奥沙利铂或伊立替康的化疗方案是首选,也可以联合分子靶向药物治疗[160,203,214](2b类证据,B级推荐)。含奥沙利铂和伊立替康的三药化疗尽管有较高的反应率,但毒性也较大,是否应在此类患者中应用尚不明确。
诱导化疗后病情缓解或稳定,但肝转移灶仍无法R0切除时可考虑进入维持治疗(如采用毒性较低的5-FU/LV或卡培他滨单药,均可联合贝伐珠单抗)[235-239]或单独使用贝伐珠单抗[240]或暂停化疗,以降低持续高强度联合化疗的毒性反应[240-241]。
初始化疗病情进展后的化疗选择:⑴ FOLFOX(或CapeOX)方案±分子靶向治疗,如果病情进展后可以考虑改用FOLFIRI(或mXELIRI[242])方案;FOLFIRI方案±分子靶向治疗,如果病情进展可考虑改用FOLFOX(或CapeOX)方案,仍可考虑与分子靶向药物的联合[243-245]。如果病情第2次进展,可以使用瑞戈非尼[246]或呋喹替尼[247]或西妥昔单抗[248-249](未用过此类药者,仅限RAS野生型,可联合伊立替康)或曲氟尿苷替匹嘧啶(TAS-102)±贝伐珠单抗[250-251]或最佳支持治疗[62](2a类证据,B级推荐)。⑵ 5-FU/LV联合分子靶向治疗后如果病情进展,应改用FOLFOX、FOLFIRI或CapeOX(均可联合分子靶向治疗),病情再次进展时推荐瑞戈非尼或呋喹替尼或曲氟尿苷替匹嘧啶(TAS-102)或进行最佳支持治疗[252](3b类证据,B级推荐)。⑶ 已有研究[253-256]表明对于dMMR/MSI-H的CCLM患者,免疫检查点抑制剂治疗用于二线及三线治疗显示出令人鼓舞的效果。对于未使用过该类治疗的dMMR/MSI-H患者可以优先选择免疫检查点抑制剂。⑷ 对于三线失败后的治疗目前尚无标准方案。据文献报道联合抗BRAFV600E(伊立替康+抗EGFR+BRAF抑制剂,或抗EGFR+BRAF抑制剂±MEK抑制剂)的治疗方案[39-40,257-260]、抗HER-2治疗(HER-2阳性患者)[261-263]都能起到一定作用,但考虑到上述药物的适应证和可及性问题,仅建议在临床研究中谨慎使用,不做常规推荐。
对于肝转移为主的肿瘤负荷较大且药物治疗效果不明显的患者,或者难治性患者,或者不能耐受系统治疗的患者,可在适当时机联合应用肝动脉灌注化疗(HAI)、肝动脉化疗栓塞(TACE),有助于延长疾病无进展时间和总体生存期[264-266],尤其是药物洗脱微球动脉化疗栓塞(DEB-TACE),可以进一步提高疗效[267-268]。但是单独应用这些治疗并不比全身化疗更具优势[269-270]。
6.2 局部毁损治疗
对于无法手术切除的肝转移灶,应根据其位置、治疗目标、治疗相关并发症及患者自身情况,在系统性化疗基础上选择适当的局部毁损工具(如射频消融、微波消融、冷冻治疗、放射治疗等)以加强局部病灶的控制,具体应由MDT进行决策并结合患者意愿。
6.2.1 消融治疗 ⑴ 射频消融:射频消融术使用方便,安全性好[271-273],且能高效破坏肝转移灶的肿瘤细胞。对于始终无法达到NED状态的晚期结直肠肝转移患者,现有资料表明单独使用射频消融治疗肝转移的生存率仅略微高于其他非手术治疗[274-277],目前仅作为化疗无效后的治疗选择或肝转移灶术后复发的治疗。建议应用时选择肝转移灶最大直径<3 cm[278]且1次消融最多5个[15]。对于预期术后残余肝脏体积过小时,可先切除部分较大的肝转移灶,对剩余直径<3 cm的转移病灶进行射频消融。或对于一般情况不适宜或不愿意接受手术治疗的可切除CCLM患者也可以考虑射频消融治疗,但应注意避免肝外热损伤[279-280]、针道转移、感染和消融不彻底等问题。⑵ 微波消融:微波的传导不受组织干燥碳化的限制,使肿瘤内部在较短的时间内就可产生较高的温度和更大的消融带,而使肿瘤细胞的坏死更彻底[281]。与单纯化疗相比,结合微波消融治疗经过选择的不可切除的CCLM患者可以更有效地提高生存率[282-284]。⑶ 冷冻治疗:尽管冷冻治疗严格挑选的不可切除的CCLM患者在一定程度上提高了生存率[285-287],但是较高的局部复发率和并发症发生率(可达35%,包括急性呼吸窘迫综合征和弥散性血管内凝血等[288])限制了该技术的广泛应用。
6.2.2 放射治疗 对于直径不超过3 cm的肝脏寡转移灶,立体定向放射治疗(stereotactic body radiation therapy,SBRT)可以取得较好的局部控制率。SBRT是一种精确的外放疗技术,采用单次高剂量(5~30 Gy)大分割(1~5次)照射,以取得类似外科手术的效果,又称之为立体定向消融放疗(stereotactic ablative radiotherapy,SABR)。生物等效剂量(biological equralent dose,BED)与肿瘤控制率正相关,BED≥100 Gy有更高的局控率。SABR安全性较高,常见不良反应为肝功能异常[289-291]及胃肠道反应。Child-Pugh评分、胃肠道疾病史、全身治疗和肿瘤位置等需在实施SABR前评估。放射治疗计划设计时应避免危及胃肠、脊髓等器官的高剂量照射。
6.3 其他治疗方法
其他治疗方法包括选择性内放射(selective internal radiotherapy,SIRT),无水酒精瘤内注射[292]、局部放射性粒子植入和中医中药治疗等,可作为综合治疗的一部分,单独使用可能会失去其治疗意义。
第二部分 诊疗流程

图1 结直肠癌确诊时肝转移的诊断Figure 1 Diagnosis of liver metastasis at the time of diagnosis of colorectal cancer

图2 结直肠癌肝转移的预防Figure 2 Prevention of CCLM

图3 结直肠癌确诊时合并肝转移的治疗(转移灶可切除)Figure 3 Treatment of liver metastases at diagnosis of colorectal cancer (metastases can be resectable)
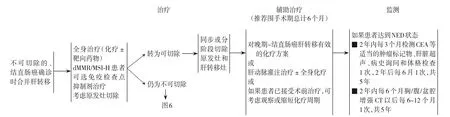
图4 结直肠癌确诊时合并肝转移的治疗(转移灶不能切除)Figure 4 Treatment of liver metastases at diagnosis of colorectal cancer (non-resectable metastases)

图5 结直肠癌根治术后发现的肝转移的治疗Figure 5 Treatment of liver metastases found after radical resection of colorectal cancer

图6 不可切除结直肠癌肝转移的治疗Figure 6 Treatment of nonresectable liver metastases of colorectal cancer
第三部分 附录
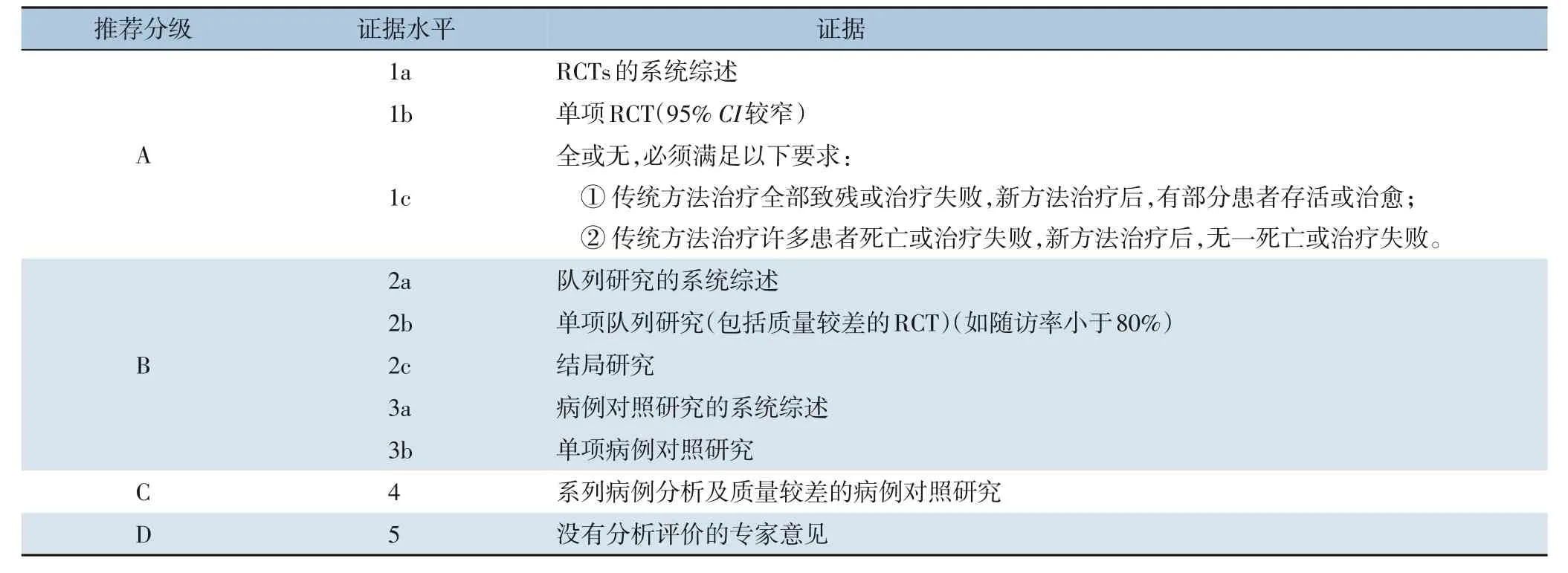
附录1 推荐级别的分类
?
附录2 结直肠癌分期

美国癌症联合委员会(AJCC)结直肠癌TNM分期系统(第八版,2017年)原发肿瘤(T)Tx T0 Tis T1 T2 T3 T4a T4b区域淋巴结(N)Nx N0 N1 N1a N1b N1c N2 N2a N2b远处转移 (M)M0 M1 M1a M1b M1c分期分组分期0 I ⅡAⅡBⅡCⅢAⅢBⅢCⅣAⅣBⅣC组织学分级(G)Gx G1 G2 G3 G4原发肿瘤无法评估无原发肿瘤原位癌:黏膜内癌(侵犯黏膜固有层)肿瘤侵犯黏膜下层肿瘤侵犯固有肌层肿瘤穿透固有肌层抵达浆膜下,或侵犯无腹膜覆盖的结直肠旁组织肿瘤穿透至脏层腹膜(包括肿瘤所致肠道严重穿孔/肿瘤经炎症区域持续浸润到达脏层腹膜表面)肿瘤与邻近器官/组织结构黏连,或直接侵犯其他器官/组织区域淋巴结无法评估区域淋巴结无转移1~3枚区域淋巴结转移 (淋巴结中的肿瘤≥0.2 mm),或存在癌结节而淋巴结阴性1枚区域淋巴结转移2~3枚区域淋巴结转移无区域淋巴结转移,但肿瘤在浆膜下、肠系膜或无腹膜覆盖的结直肠旁/直肠系膜组织中种植4枚或4枚以上区域淋巴结转移4~6枚区域淋巴结转移7枚或更多的区域淋巴结转移无远处转移有远处转移转移局限在单个器官或部位(如:肝脏、肺、卵巢,非区域淋巴结转移),无腹膜转移转移超过一个器官/部位,无腹膜转移转移至腹膜表面,伴/不伴其他器官/部位转移T Tis T1 T2 T3 T4a T4b T1/T2 T1 T3/T4a T2/T3 T1/T2 T4a T3/T4a T4b任何T任何T任何T分化程度不能被评估高度分化中度分化低度分化未分化N N0 N0 N0 N0 N0 N0 N1/N1c N2a N1/N1c N2a N2b N2a N2b N1/N2任何N任何N任何N M M0 M0 M0 M0 M0 M0 M0 M0 M0 M0 M0 M0 M0 M0 M1a M1b M1C Dukes分期—AABBBCCCCCCCC— —MAC—AB 1 B2 B2 B3 C1 C1 C2 C1/C2 C1 C2 C2 C3— —
附录3 临床危险评分(CRS)
包括以下5项参数,每符合1项计1分(0~2分为CRS低评分,3~5分为CRS高评分):
⑴ 原发肿瘤淋巴结阳性; ⑵ 同时性肝转移或原发灶切除后无病生存时间<12个月; ⑶ 肝转移肿瘤数目>1; ⑷ 术前CEA>200 ng/mL;⑸ 转移肿瘤最大直径>5 cm。
附录4 分子靶向药物简介
在无法达到NED状态的结直肠癌肝转移治疗中应用分子靶向药物已被证实安全有效[293-295],但目前的研究资料不建议多种靶向药物联合应用[296-299]。目前中国大陆范围内批准使用的分子靶向药物如下:
1 西妥昔单抗
西妥昔单抗为人鼠嵌合型的EGFR单克隆抗体,单用或联合化疗治疗结直肠癌肝转移均有良好的临床效果[300-304]。但是西妥昔单抗只对RAS野生型患者治疗有较好的效果,而在RAS基因突变型患者中应用并不提高疗效[305-307]。BRAF突变的患者获益有限,这可能与疾病的不良预后有关[303,308-311]。
目前认为可以同西妥昔单抗联合的化疗方案包括FOLFOX和FOLFIRI[228,300,312],不建议其与CapeOX或5-FU推注方案联用[311],且对于西妥昔单抗的跨线治疗是否有效仍存在争议[313]。约有3%的患者会在西妥昔单抗的给药过程中出现严重的输液反应,包括过敏性反应,应引起足够的重视。
含西妥昔单抗的方案:西妥昔单抗首次剂量400 mg/m2输注,输注时间为120 min,然后每周250 mg/m2,输注时间为120 min,+FOLFOXIRI或FOLFIRI或FOLFOX;西妥昔单抗首次剂量400 mg/m2输注,输注时间为120 min,然后每2周500 mg/m2,输注时间为120 min,+FOLFOXIRI或FOLFIRI或FOLFOX。
2 贝伐珠单抗
贝伐珠单抗为人源化的VEGF单克隆抗体,联合化疗作为不可切除的结直肠癌肝转移一线治疗有良好的效果[314-317]。同样,贝伐珠单抗在肿瘤进展后的二线治疗上疗效也得到了证实[317-321](3b类证据,B级推荐)。但贝伐珠单抗易引起出血和伤口延迟愈合,如在其治疗后需进行手术,建议手术时机选择在最后1次贝伐珠单抗使用后的6~8周[192,322-324]。
含贝伐珠单抗的方案:贝伐珠单抗5 mg/kg静脉滴注,每2周重复,+5-FU或FOLFOX或FOLFIRI或FOLFOXIRI;贝伐珠单抗7.5 mg/kg静脉滴注,每3周重复,+CapeOX。
3 瑞戈非尼
瑞戈非尼(Regorafenib)是一种口服多靶点酪氨酸激酶抑制剂(TKI),可以阻断数个促血管生成的血管内皮生长因子受体(VEGFR)、抑制与肿瘤生成和肿瘤微环境相关的多种激酶的活性。新近的临床研究表明,对于RAS野生型的转移性结直肠癌患者在初始化疗进展后应用瑞戈非尼序贯二线化疗联合分子靶向药物治疗有更好的生存获益[325],但仍需更多的临床研究证实。瑞戈非尼大部分的不良反应发生在治疗的早期阶段,主要包括手足皮肤反应、疲乏、腹泻、高血压、皮疹等,均可预测且可通过暂停给药、剂量下调及对症处理后缓解。
目前,瑞戈非尼已获批用于治疗之前接受过氟尿嘧啶、奥沙利铂和伊立替康为基础的化疗,以及既往接受过抗VEGF治疗,抗EGFR治疗(RAS野生型)的转移性结直肠癌患者[246,326]。
瑞戈非尼用法:瑞戈非尼160 mg,口服,每日1次,第1~21天,每28天重复。
4 呋喹替尼
呋喹替尼(Fruquintinib)也是一种口服酪氨酸激酶抑制剂(TKI),高度选择性抑制血管内皮生长因子受体(VEGFR)1、2和3三种亚型。呋喹替尼可抑制VEGFR磷酸化,从而抑制肿瘤血管生成,最终抑制肿瘤生长。全国多中心FRESCO研究发现对于二线或以上标准化疗失败的转移性结直肠癌患者,呋喹替尼单药治疗显著延长生存,且安全性良好,不良反应可控[247]。呋喹替尼常见的严重副作用为高血压、手足综合征和蛋白尿等。
目前呋喹替尼已获批用于既往接受过氟尿嘧啶、奥沙利铂和伊立替康为基础的化疗,以及无论既往是否接受过抗VEGF治疗或抗EGFR治疗(RAS野生型)的转移性结直肠癌患者。
呋喹替尼用法:呋喹替尼5 mg口服,每日1次,第1~21天,每28天重复。
附录5 化疗方案
1 5-FU/LV
⑴ LV 500 mg/m2静脉滴注2 h,每周1次×6;⑵ 5-FU 500 mg/m2在LV滴注开始1 h后静脉推注,每周1次×6,每8周重复;⑶ 5-FU 370~400 mg/m2+LV 400 mg/m2,每日1次×5,每4周重复。
2 卡培他滨
卡培他滨1 250 mg/m2每日2次口服,第1~14天,每3周重复。
3 FOLFOX
mFOLFOX6:奥沙利铂85 mg/m2静脉滴注2 h,第1天;LV 400 mg/m2静脉滴注2 h,第1天;5-FU 400 mg/m2静脉推注,第1天,然后1 200 mg/m2/d×2持续静脉输注(总量2 400 mg/m2,输注46~48 h)。每2周重复。
4 CapeOX
奥沙利铂130 mg/m2,第1天;卡培他滨850~1 000 mg/m2,每日2次,持续14 d。每3周重复。
5 FOLFIRI
伊立替康180 mg/m2静脉滴注30~120 min,第1天;LV 400 mg/m2与伊立替康同时输注,持续时间相同,第1天;5-FU 400 mg/m2静脉推注,第1天,然后1 200 mg/m2/d×2持续静脉输注(总量2 400 mg/m2,输注46~48 h)。每2周重复。
6 mXELIRI
伊立替康200 mg/m2,第1天;卡培他滨800 mg/m2,每日2次,持续14 d。每3周重复。
7 FOLFOXIRI
伊立替康150 mg/m2,奥沙利铂85 mg/m2,LV 400 mg/m2静脉滴注,第1天;5-FU 2 400 mg/m248 h持续滴注,第1天开始。每2周重复。
8 曲氟尿苷替匹嘧啶(TAS-102)
曲氟尿苷替匹嘧啶(TAS-102)35 mg/m²(单次不超过80 mg)口服,每日2次,第1~5天和第8~12天,每28天重复。
[曲氟尿苷替匹嘧啶(TAS-102)是一种新型口服核苷类复方制剂,其中曲氟尿苷干扰癌细胞DNA合成,抑制细胞增殖,替匹嘧啶抑制曲氟尿苷的代谢降解,维持有效血药浓度。国际多中心RECOURSE研究和TERRA研究均显示TAS-102可降低疾病进展风险和死亡风险[250-251]。常见的不良反应以骨髓抑制为主,而手足综合征、腹泻等非血液学不良反应发生率较低。目前TAS-102已获批用于既往接受过氟尿嘧啶、奥沙利铂和伊立替康为基础的化疗,以及无论既往是否接受过抗VEGF治疗或抗EGFR治疗(RAS野生型)的转移性结直肠癌患者。]
9 雷替曲塞
雷替曲塞3 mg/m2静脉输注,每3周重复。
(雷替曲塞为抗代谢类叶酸类似物,特异性地抑制胸苷酸合成酶,导致DNA断裂和细胞凋亡。目前已批准在患者无法接受联合化疗时,雷替曲塞单药用于治疗不适合5-FU/LV的晚期结直肠癌患者。主要的不良反应是对胃肠道、血液系统及肝功能的影响。)
附录6 免疫检查点治疗
帕博利珠单抗2 mg/kg,第1天,每3周重复。
纳武利尤单抗3 mg/kg,第1天,每2周重复。
特瑞普利单抗3 mg/kg,第1天,每2周重复。
信迪利单抗200 mg/次,第1天,每3周重复。
卡瑞丽珠单抗200 mg/次,第1天,每2周重复。
附录7 直肠癌的联合放化疗
放疗剂量总量45~54 Gy,采用常规分割剂量(通常为35 d),同时接受如下方案化疗:
⑴ 不伴有肝转移:卡培他滨850~1 000 mg/m2,每日2次,每周5 d。
⑵ 伴有肝转移:① 奥沙利铂每周60 mg/m2,共6周;5-FU 200 mg/m2,第1~40天。② 伊立替康50 mg/m2,第1、8、15、22天;5-FU 200 mg/m2,第1~33天。③ 奥沙利铂每周60 mg/m2,第1天;卡培他滨650 mg/m2每日2次,第1~5天,共6周。
附录8 肝动脉和结直肠肿瘤区域联合灌注化疗
奥沙利铂75 mg/m2,FUDR 650 mg/m2,丝裂霉素8 mg/m2。
采用股动脉穿刺法(Seldinger法),经动脉导管超选择插管至结直肠肿瘤主要的滋养动脉内注入化疗1/2剂量;再超选择插管至肝固有动脉或肝肿瘤的滋养动脉内注入1/2剂量。
《中国结直肠癌肝转移诊断和综合治疗指南(2023版)》修订专家名单(按姓氏拼音排序)
编写组组长:樊嘉(复旦大学附属中山医院)、顾晋(北京大学肿瘤医院)、贾宝庆(中国人民解放军总医院)、李进(同济大学附属东方医院)、秦新裕(复旦大学附属中山医院)、王锡山(中国医学科学院肿瘤医院)、许剑民(复旦大学附属中山医院)、徐瑞华(中山大学附属肿瘤医院)、叶颖江(北京大学人民医院)、张苏展(浙江大学医学院附属第二医院)、张忠涛(首都医科大学附属北京友谊医院)
编写组成员:巴一(天津医科大学附属肿瘤医院)、卜建红(中华胃肠外科杂志 )、蔡建辉(河北省人民医院)、蔡建强(中国医学科学院肿瘤医院)、蔡三军(复旦大学附属肿瘤医院)、曾珊(中南大学湘雅医院)、曾昭冲(复旦大学附属中山医院)、陈功(广州中山大学附属肿瘤医院)、陈凛(中国人民解放军总医院)、陈敏(中华消化外科杂志)、陈子华(中南大学湘雅医院)、陈宗祐(复旦大学附属华山医院)、程洁敏(复旦大学附属中山医院)、程勇(重庆医科大学附属第一医院)、池畔(福建医科大学附属协和医院)、崔滨滨(哈尔滨医科大学附属肿瘤医院)、戴广海(中国人民解放军总医院)、戴勇(山东大学齐鲁医院)、邓艳红(中山大学附属第六医院)、丁克峰(浙江大学医学院附属第二医院)、房学东(吉林大学中日联谊医院)、傅传刚(同济大学附属东方医院)、龚建平(华中科技大学附属同济医院)、郝纯毅(北京大学肿瘤医院)、何裕隆(中山大学附属第一医院)、黄忠诚(湖南省人民医院)、季加孚(北京大学肿瘤医院)、姜可伟(北京大学人民医院 )、金晶(中国医学科学院肿瘤医院)、孔大陆(天津医科大学附属肿瘤医院)、兰平(中山大学附属第六医院)、李德川(浙江省肿瘤医院)、李国立(南京军区南京总医院)、李乐平(山东省立医院)、李云峰(云南省肿瘤医院)、李志霞(首都医科大学北京同仁医院)、梁后杰(第三军医大学附属西南医院)、林锋(中山大学附属第六医院)、林建江(浙江大学医学院附属第一医院)、林小燕(福建医科大学附属协和医院)、刘洪俊(山东省立医院)、刘天舒(复旦大学附属中山医院)、刘云鹏(中国医科大学附属第一医院)、潘宏铭(浙江大学医学院附属邵逸夫医院)、潘志忠(中山大学附属肿瘤医院)、裴海平(中南大学湘雅医院)、彭涛(广西医科大学第一附属医院)、任黎(复旦大学附属中山医院)、沈琳(北京大学肿瘤医院)、宋纯(同济大学附属东方医院)、宋天强(天津医科大学附属肿瘤医院)、苏向前(北京大学肿瘤医院)、孙益红(复旦大学附属中山医院)、陶敏(苏州大学附属第一医院)、田利国(中国实用外科杂志)、童卫东(陆军军医大学大坪医院)、万德森(中山大学肿瘤医院)、汪建平(中山大学附属第六医院)、王贵英(河北医科大学第四医院)、王贵玉(哈尔滨医科大学附属第二医院)、王海江(新疆医科大学附属肿瘤医院)、王建华(复旦大学附属中山医院)、王健(复旦大学附属中山医院)、王杉(北京大学人民医院)、王新(第四军医大学西京医院)、王雅杰(上海长海医院)、王屹(北京大学人民医院)、王自强(四川大学华西医院)、韦烨(复旦大学附属中山医院)、魏东(中国人民解放军第一五〇医院)、夏锋(第三军医大学附属西南医院)、夏建国(江苏省人民医院)、夏立建(山东省千佛山医院)、谢丹(中山大学附属肿瘤防治中心)、邢宝才(北京大学肿瘤医院)、熊斌(武汉大学中南医院)、徐建明(中国人民解放军第三〇七医院)、徐农(浙江大学医学院附属第一医院)、徐烨(复旦大学附属肿瘤医院)、徐泽宽(江苏省人民医院)、徐忠法(山东省医学科学院附属医院)、杨树军(河南省肿瘤医院)、姚宏伟(首都医科大学附属北京友谊医院)、叶青海(复旦大学附属中山医院)、余佩武(第三军医大学附属西南医院)、余一祎(复旦大学附属中山医院)、袁瑛(浙江大学医学院附属第二医院)、张俊(上海交通大学医学院附属瑞金医院)、张克亮(湖北省肿瘤医院)、张卫(上海长海医院)、张小田(北京大学肿瘤医院)、张艳桥(哈尔滨医科大学附属肿瘤医院)、张有成(兰州大学第二医院)、章真(复旦大学附属肿瘤医院)、赵青川(第四军医大学西京医院)、赵任(上海交通大学医学院附属瑞金医院)、郑树(浙江大学医学院附属第二医院)、周爱萍(中国医学科学院肿瘤医院)、周波(复旦大学附属中山医院)、周俭(复旦大学附属中山医院)、周总光(四川大学华西医院)、朱德祥(复旦大学附属中山医院)
执笔人:朱德祥,任黎,许剑民
利益冲突:所有作者均声明不存在利益冲突。

