猫源支气管败血波氏菌的分离与鉴定
沈莉萍,徐锋,王晓旭,齐新永,王建
(上海市动物疫病预防控制中心,上海 201103)
支气管败血波氏菌(Bordetella bronchiseptica,B.bronchiseptica)可引起许多哺乳动物呼吸道疾病,是猫原发细菌性呼吸道疾病病原之一。临床健康猫群中的支气管败血波氏菌流行率为1%~10%,在具有呼吸道症状猫群中的分离率为21%[1]。但目前国内关于猪、兔感染该菌的报道很多,而从猫上分离到该菌的报道很少。这可能是该菌常与其他呼吸道病原,如猫杯状病毒、猫疱疹病毒、猫衣原体、猫支原体等发生混合或继发感染,再加上上呼吸道内杂菌多,菌含量少,因而忽视了对该菌的检测。管飘萍等[2]报道,在猫鼻腔拭子样品分离到该菌需6 d 时间;Van den Bossche等[3]报道,从病人的气管吸出物、支气管肺泡液、鼻咽吸出物等分离该菌也需4 d 以上。这说明该菌分离时间较长,分离较困难。2021年7 月,上海市一宠物诊所接诊了1 只6 月龄有咳嗽症状的德文猫,采集鼻拭子样品进行病原检测,结果成功分离到1 株支气管败血波氏菌,随后对分离菌株进行了药敏试验和致病性试验。
1 材料和方法
1.1 材料
哥伦比亚琼脂、胰蛋白胨大豆肉汤培养基,由美国BD 公司提供;麦康凯琼脂、三糖铁琼脂、营养琼脂、半固体动力培养基等,均由北京陆桥技术有限公司提供;脱纤维羊血,由上海科玛嘉微生物技术有限公司提供。所有培养基按说明自行配制。
GN 革兰氏阴性细菌鉴定卡(批号2411651403),由法国梅里埃公司提供;阿莫西林、氨苄西林、卡那霉素等24 种药敏纸片,由杭州滨和微生物试剂有限公司提供。猪源支气管败血波氏菌参考菌株CVCC718,来自中国兽医微生物菌种保藏管理中心。DL 2 000 DNA Marker、Taqremix等,购自宝生物工程(大连)有限公司;引物,由上海桑尼生物科技有限公司合成。体质量25~30 g ICR小鼠,购自上海斯莱克实验动物有限责任公司。
恒温培养箱(BD115),购自德国BINDER公司;二氧化碳培养箱(371),购自赛默飞世尔科技公司(Thermo);全自动微生物鉴定仪(VITEK 2 Compact),购自法国梅里埃公司;基因扩增仪(Biometra Tadvanced 96 SG),购自德国耶拿公司;荧光PCR 仪(ViiATM7 Dx),购自美国ABI 公司。猫疱疹病毒荧光PCR 检测试剂盒(批号20201213)、猫杯状病毒荧光PCR 检测试剂盒(批号20201213)、猫衣原体结膜炎荧光PCR 检测试剂盒(批号20201213),购自书扁科技(上海)有限公司;猫支原体(MF)核酸检测试剂盒(荧光PCR 法,批号21050601),购自维伯鑫公司;磁珠法病毒DNA/RNA 提取试剂盒(批号MDKI 21-01),购自美吉公司。
1.2 方法
1.2.1 病原检测 将鼻拭子样品在涡旋震荡仪上充分混合后,4 ℃ 3 000 r/min 离心5 min,取上清液,转入1.5 mL 灭菌离心管中,4 ℃保存备用。按照磁珠法病毒DNA/RNA 提取试剂盒说明书提取DNA/RNA,按试剂盒说明书分别对猫杯状病毒、猫疱疹病毒、猫衣原体、猫支原体进行荧光PCR检测。
1.2.2 细菌分离培养与鉴定 将无菌采集的猫鼻拭子样品先接种到含0.4%万古霉素的胰蛋白胨大豆肉汤培养基,36 ℃培养48 h,取10 μL 分别接种于哥伦比亚血琼脂、麦康凯琼脂,36 ℃培养48 h,挑取可疑菌落涂片镜检并纯培养;将纯培养物接种于三糖铁琼脂、半固体动力培养基,观察其培养特性。对分离的细菌纯培养物,按照GN 细菌鉴定卡操作规程操作,并在VITEK 2 Compact 全自动细菌鉴定仪上读取细菌鉴定结果。
1.2.3 药敏试验 将细菌纯培养物采用K-B 纸片法进行体外药敏试验,36 ℃培养24 h,观察结果。试验方法及判读标准,参照杭州滨和微生物试剂有限公司提供的抗生素类药敏纸片说明书。
1.2.4 支气管败血波氏菌PCR 检测 参照《猪传染性萎缩性鼻炎诊断技术》(NY/T 546—2015)中的支气管败血波氏菌引物序列合成引物,扩增长度230 bp,引物工作浓度20 pmol/L,-20 ℃冷冻保存。用煮沸法制备DNA 模板,从36 ℃过夜培养的血琼脂平板中挑取数个菌落于含100 μL ddH2O的EP 管中,100 ℃水浴10 min,12 000 r/min 离心5 min,吸取上清作为模板,置-20 ℃保存备用。PCR 反应体系25.0 μL:Taqremix 12.5 μL,上下游引物各0.5 μL,DNA 模板2.0 μL,ddH2O 9.5 μL。PCR 反应条件:预变性95 ℃ 5 min;变性94 ℃30 s,复性55 ℃ 30 s,72 ℃延伸20 s,扩增35 个循环;72 ℃延伸5 min。取8.0 μL PCR 产物用1%琼脂糖电泳,于凝胶成像系统观察结果。
1.3 致病性试验
取分离菌肉汤培养物,配制菌液浓度为6×108CFU/mL,然后将其腹腔注射ICR 小鼠2 只,注射剂量为0.2 mL/只,同时设立普通肉汤空白对照,接种后1 周持续观察小鼠临床表现。
2 结果
2.1 相关病原荧光PCR 检测
对猫鼻拭子样品提取DNA/RNA,按相应病原试剂盒说明书进行PCR 检测,结果猫杯状病毒、猫疱疹病毒、猫衣原体、猫支原体均为阴性。
2.2 分离菌株培养特性
从猫鼻拭子样品中分离到1 株细菌。该菌株菌落在哥伦比亚羊血琼脂平板上为灰白色、表面光滑、圆形、隆起、β 溶血,直径为1 mm(图1),革兰氏染色为G-杆菌;在麦康凯琼脂平板上,菌落呈圆形、光滑,对光观察呈淡蓝灰色,培养基呈琥珀色(图2);在三糖铁琼脂上,培养基斜面和底部均不变色,不产生硫化氢(图3);在半固体动力培养基上有厚菌膜,20 ℃培养分离菌沿穿刺线扩散生长,36 ℃培养则沿穿刺线不扩散生长(图4)。
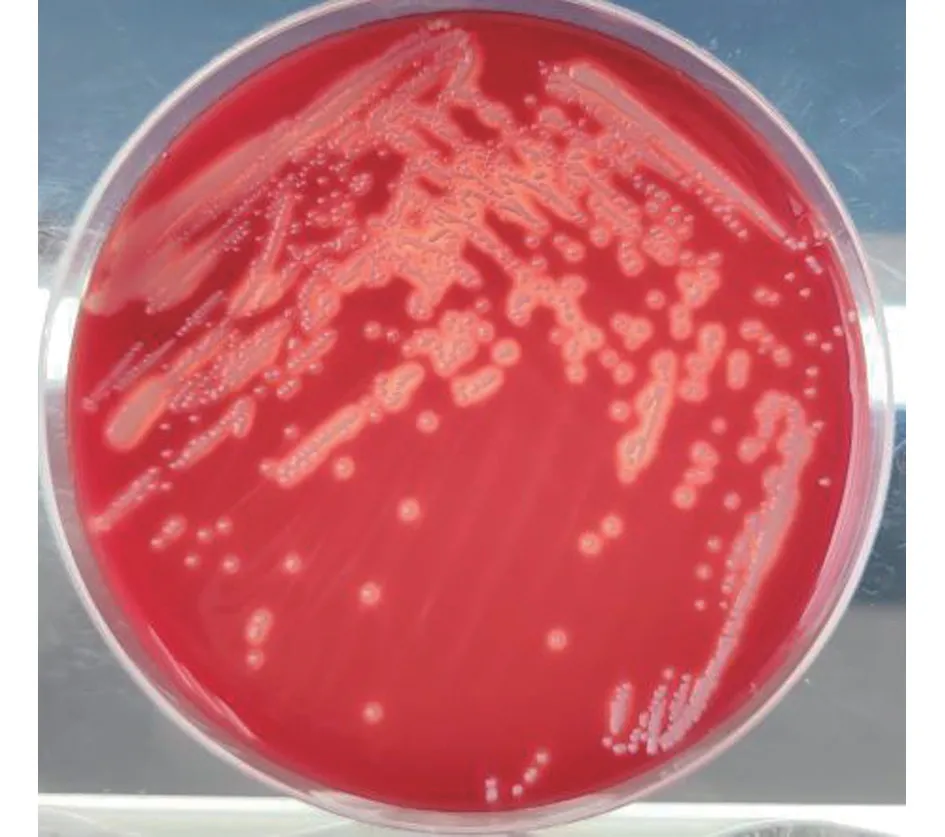
图1 分离菌株在哥伦比亚血琼脂上的菌落形态
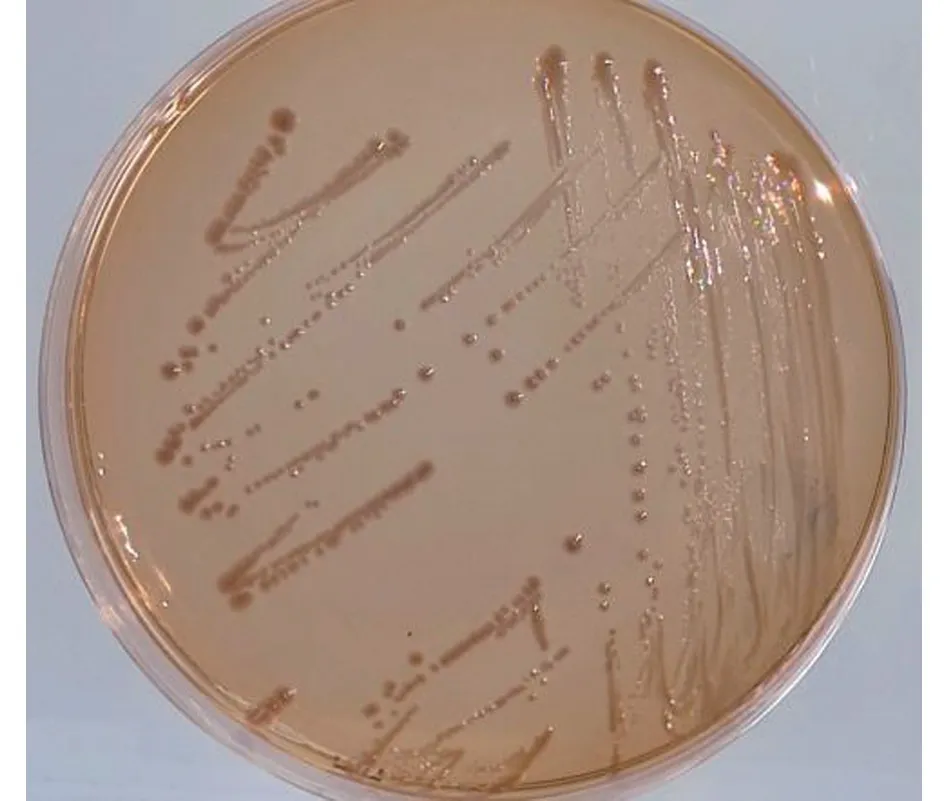
图2 分离菌株在麦康凯琼脂上的菌落形态

图3 分离菌株在三糖铁琼脂上生长情况

图4 分离菌株在半固体动力培养基上生长情况
2.3 分离菌株生化特性
分离菌在VITEK 2 Compact 全自动细菌鉴定仪上鉴定结果为支气管败血波氏菌(B.bronchiseptica),鉴定准确率为99%(表1)。

表1 支气管败血波氏菌分离株生化特性
2.4 药敏试验
分离菌株对头孢拉定、头孢西丁、头孢噻肟、氨苄西林、强力霉素、壮观霉素等9 种抗生素耐药,对阿莫西林、卡那霉素、庆大霉素、新霉素、氟哌酸、复方新诺明、美罗培南等15 种抗生素均敏感(表2)。
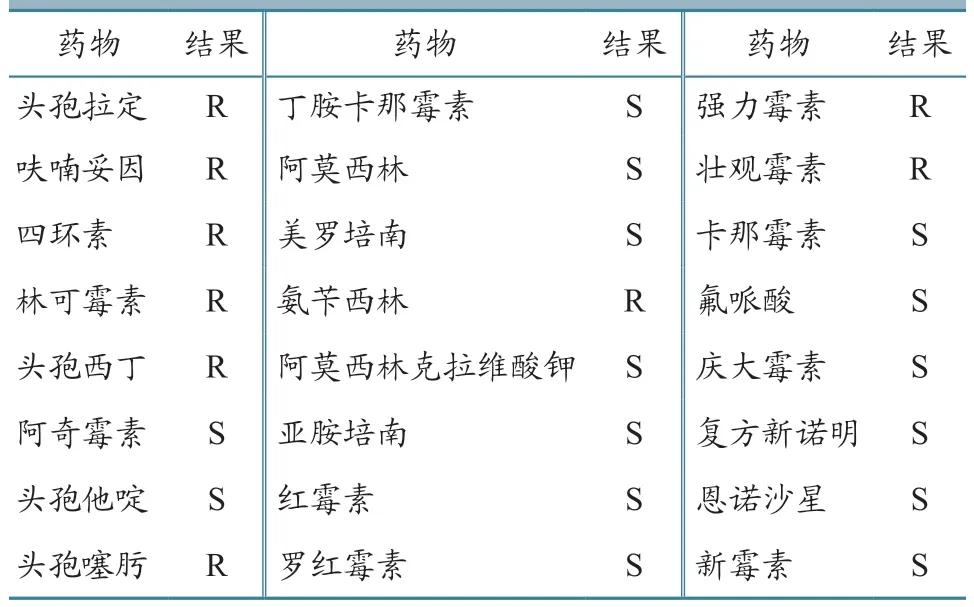
表2 支气管败血波氏菌分离株药敏试验结果
2.5 支气管败血波氏菌PCR 检测
对分离菌株进行支气管败血波氏菌PCR 检测,结果在230 bp 处出现特异性条带,为支气管败血波氏菌阳性(图5)。
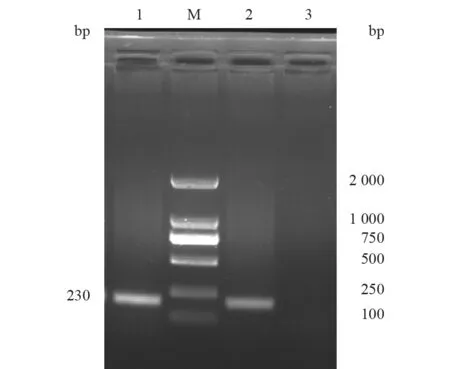
图5 猫源分离株PCR 扩增结果
2.6 致病性试验
试验鼠攻毒后3 d 内表现精神沉郁、被毛耸立、呼吸急促,行动迟缓等症状,1 周后恢复正常,未出现死亡;空白对照组正常。结果表明,该分离株的致病性并不强。
3 讨论
支气管败血波氏菌是引起猫呼吸道疾病的重要病原,也可混合或继发感染猫杯状病毒、猫疱疹病毒、衣原体、支原体等其他呼吸道病原[1]。因此,当猫发生传染性上呼吸道疾病时,应同时进行多种病原检测,以便找出病因,进行对症治疗。本研究对送检的鼻拭样品首先进行猫杯状病毒、猫疱疹病毒、衣原体、支原体等4 种病原的荧光PCR 检测,结果均为阴性,从而排除了这4 种病原感染的可能性;同时对鼻拭样品进行细菌分离鉴定,结果确定分离细菌为支气管败血波氏菌。有资料[4]表明,支气管败血波氏菌感染小鼠等实验动物,可引起急性或慢性呼吸道炎症,致病性试验也证实了分离菌符合支气管败血波氏菌的致病特性。猫不常发生咳嗽,本病例持续咳嗽1 周以上,应怀疑发生支气管败血波氏菌感染[1,5]。综合判定,引起该德文猫咳嗽的病原为支气管败血波氏菌。
猫鼻腔是一个开放的通道,鼻拭子样品中支气管败血波氏菌量少,且常有杂菌污染,加上支气管败血波氏菌生长缓慢,因而增加了支气管败血波氏菌假阴性检出的可能性。因此,最好采集猫鼻腔后部的分泌物,使用选择性培养基或小鼠传代的方法来进一步纯化细菌[6],以提高菌株分离率。因万古霉素能抑制革兰氏阳性菌生长,革兰氏阴性菌在鼻咽共生菌群中少见,本研究参考Van den Bossche等[3]发表的文章,将无菌采集的猫鼻拭子样品先接种到含万古霉素的胰蛋白胨大豆肉汤中进行增菌,再取增菌液分别接种于哥伦比亚血琼脂和麦康凯琼脂,每种培养基接种2 块平板,其中一块作浓厚涂抹接种,另一块作划线接种,36 ℃需氧培养48 h,以防漏检。本研究发现,分离菌在麦康凯琼脂平板上培养24 h 形成无色细小菌落,培养48 h 形成表面光滑,直径约1 mm 的圆形、淡粉色菌落,对光观察菌落呈淡蓝灰色,这与管飘萍等[2]描述的中等大小、粉色菌落不同。经典教材[4]显示,支气管败血波氏菌在麦康凯琼脂平板上生长的菌落周围有狭窄红色环,而本研究分离的菌株菌落周围无狭窄红色环,其原因有待于分析。
资料[4]表明,支气管败血波氏菌为专性需氧菌。此次分离的菌株在含5% CO2的条件下也能生长,但生长贫瘠,需培养48 h 以上。因此,此次分离的猫源支气管败血波氏菌并非专性需氧,这与之前资料所述不同,其原因需要进行后续研究。
资料[1]表明,强力霉素为首选治疗支气管败血波氏菌感染的药物。但本次分离菌的药敏试验结果为强力霉素耐药,因此临床实践中建议先进行药敏试验,再选择敏感药物进行治疗。
支气管败血波氏菌的毒力因子主要包括黏附素和毒素两大类[4]。管飘萍等[2]对分离的3 株猫源支气管败血波氏菌,按107~109CFU/mL 等3 种不同的菌液浓度攻毒小鼠,结果发现小鼠在72 h内均死亡;利用VFDB 数据库对基因组测序所得的蛋白质编码基因进行功能注释,预测了66种毒力相关基因。而本研究的猫源分离株只用108CFU/mL 的菌液浓度攻毒小鼠,后续应选择不同浓度的菌液进行致病性试验。Nevine等[7]报道,2011—2014年,从同一名持续咳嗽的患者痰液中分离到4 株支气管败血波氏菌,多位点序列分析(MLST)发现,4 株分离株同属于一个序列类型(ST),与最后3 个分离株相比,第1 个分离株不产生任何毒力因子。本分离株是否也不产生任何毒力因子,后续应补充进行相关毒力基因检测,以了解该菌的致病机制。
目前饲养宠物的家庭越来越多,宠物犬猫已经成为家庭的一份子,成为人们的亲密伙伴。支气管败血波氏菌可经气溶胶传播[4],可感染多种宿主[8],能在猫与人之间传播,有些猫在急性感染后可成为支气管败血波氏菌的带菌者,感染后持续排出病原菌长达数周,也可能无症状带菌,只在应激时排出病原菌[1]。Wernli等[9]在日内瓦大学医院对1993—2008年8 例确诊感染支气管败血波氏菌的病例进行调查发现,有3 例患者感染前记录过与猫有接触史,而且这些患者免疫功能低下;Registe等[10]报道了从一名囊性纤维化患者的痰液样本中分离出支气管败血波氏菌,传染源是一只患有急性呼吸道疾病的小猫;Gil Redelman-Sidi等[11]报道了一名56 岁的骨胶质母细胞瘤患者在接受替莫唑胺治疗过程中因接触了已感染支气管败血波氏菌的小猫而被诊断为支气管败血波氏菌病。因此,免疫功能低下的人感染支气管败血波氏菌的风险很高。Ducours等[12]建议,猫和老人只要感染了支气管败血波氏菌,都应进行抗生素治疗。Herman Egberink等[5]在猫支气管败血波氏菌病防治指南中建议,猫感染后即使症状轻微,也需要进行抗生素治疗。目前,由于新冠疫情防控需要,饲养犬、猫等宠物的家庭成员在密闭空间与宠物呆在一起时间长,当人与犬猫亲密接触,尤其人抵抗力下降时,发生支气管败血波氏菌感染的风险很高,这给公共卫生安全带来了极大挑战。
欧洲和美国有猫支气管败血波氏菌鼻内活疫苗。鼻内免疫接种易于实施,接种后有的猫会表现中度的暂时性打喷嚏或流出清亮的眼分泌物等症状[1]。但免疫接种不能阻止感染,只能减轻猫的临床症状。由于支气管败血波氏菌可传染给人,因此在注射活疫苗后,应将猫隔离1 周。
本研究对上海市有咳嗽症状的猫病例进行呼吸系统相关病原检测及细菌分离培养,除分离到支气管败血波氏菌外,其他病原均为阴性,因而确定该病例为支气管败血波氏菌感染;分离株致病力不强,但对免疫力低下人群具有潜在感染风险;分离菌株对首选治疗药物强力霉素产生耐药,因此临床需要选用敏感药物进行防治。本研究为猫源支气管败血波氏菌病的诊断与防治提供了参考。

