基于RNA干扰抑制油菜种皮色素合成
申 敏, 柴友荣
(1.长治职业技术学院,山西长治 046000; 2.西南大学农学与生物科技学院,重庆北碚 400700)
油菜在分类学上属于十字花科芸薹属。油菜是一种重要的食用油原料、蛋白质饲料和一种理想的生物柴油原料。它属于全球最主要的油料作物之一。中国既是油菜的主要生产国,也是主要的消费国。油菜是产油效率最高的作物之一,菜籽油是我国的传统使用油,在人民生活和我国国民经济中占有举足轻重的地位。
大量研究表明,黄籽油菜的含油量高于传统的黑籽和褐籽油菜,黄籽油菜色素少,榨出的油颜色清亮,而且种皮薄、纤维素含量低、蛋白质含量高、菜籽油富含多酚且营养价值高,所以培育高产优质黄籽品种是油菜育种界的目标[1]。油菜籽经压榨后,饼粕与食用油分离,饼粕中的大量蛋白质作为饲料营养价值非常高。近年来世界性能源危机,导致工业用油非常紧张,油菜生产为其提供了新的解决思路[2]。
甘蓝型黄籽油菜遗传背景复杂,较难稳定遗传,且目前没有天然油菜黄籽突变体。迄今为止,关于甘蓝型油菜种皮色泽在分子层面的研究报道并不多见[3],对种皮颜色合成机理还没有统一看法。类黄酮代谢是植物次生代谢中最广泛的次生代谢途径之一,绝大多数植物中含有类黄酮化合物。类黄酮主要在植物生长、发育以及抗生理逆境等方面起重要作用[4]。植物器官表面颜色主要成分是原花青素、花青素与黄酮醇。拟南芥是甘蓝型油菜的模式植物,据报道由于拟南芥中一些基因突变,导致种皮色素核心成分原花青素下降,种皮呈现透明或半透明[5]。这种由于种皮中原花青素含量的下降导致种皮呈现种胚颜色的突变,被称为透明种皮突变。
RNA干扰是指外援或内源性的双链RNA进入细胞后引起同源RNA特异性降解的现象,表现为特定基因的缺失。这在生物体内是一种普遍存在的生理机制。在后基因时代,RNA干扰正在成为一个非常有效的基因功能研究工具[6],具有特异性高、稳定性高、效性高、可稳定遗传等优点。目前主要用于植物的性状改良等方面。
拟南芥中TT2基因编码MYB蛋白,主要参与调控类黄酮代谢途径后期结构基因的表达,如BAN、DFR,从而达到调控种皮原花青素、花青素苷的积累。拟南芥tt2突变体种子显示透明种皮性状,即黄籽性状[7]。拟南芥与甘蓝型油菜同属十字花科芸薹属植物,两者基因组序列保守性非常高,许多基因功能极为相似。因此,对甘蓝型油菜TT2基因进行功能鉴定,是筛选黄籽油菜位点的重要途径,可为推动甘蓝型黄籽油菜育种进程,以及研究甘蓝型黄籽油菜种皮色泽稳定遗传提供理论基础[8]。随着人们对油菜基因组学研究的深入和RNAi技术的不断完善,RNAi在黄籽油菜的育种应用中前景更加广阔,同时也为黄籽油菜育种带来更大的科研价值和经济价值,有助于揭示芸薹属种皮色素合成机理,加速分子育种的潜力。
1 材料与方法
1.1 材料
本试验所采用的植物材料为中双10号油菜种,根癌农杆菌(Agrobacteriumtumefaciens)菌株LBA4404、植物RNA干扰平台载体为笔者所在课题组改造而成,改良型植物载体由本课题组提供,克隆载体等购自TaKaRa公司。
PCR仪、水浴锅、恒温培养箱、超低温冰箱、紫外与可见分析装置等。
EasyTaq DNA聚合酶、Pfu DNA聚合酶、DL-2000 plus DNA marker,植物DNA抽提试剂盒;植物RNA抽提试剂盒(小量);反转录PrimeScript RT reagent Kit Perfect Real Time试剂盒。
1.2 方法
1.2.1 甘蓝型油菜TT2基因RNA干扰 发苗:无菌条件下种子清水浸泡培养6~8 d的幼苗用于预培养。预培养:将10 cm左右的幼苗切为 0.5 cm 长的下胚轴切段,于培养基中光照培养48~72 h。农杆菌侵染:暗培养约2 d→转接1次(1/100体积接种量)→二次培养,培养至D600 nm=0.8~1.0左右(约6~8 h),将外植体转接于铺有无菌滤纸的共培养基上。共培养:接种完成后暗培养48 h。
共培养后的外植体浸杀农杆菌后于诱导抗性愈伤中光培养14 d以上,至长出肉眼可见的抗性愈伤。诱导出肉眼可见抗性愈伤的外植体转接于分化培养基上,根据构建载体中抗生素筛选压不同设计甘蓝型油菜TT2RNA干扰分化培养基。待外植体分化出茎后转接继代培养,光照培养直至分化长出较长的茎与叶片。再将分化出茎与叶的幼苗继代于分化根培养基中,光照培养至长出5~7条主根为止。最后水培驯化及移栽在驯化室。
1.2.1 转基因阳性植株获得 因载体构建时加入抗Basta基因,将浓度为 200 mg/L 的Basta溶液均匀涂抹于再生植株嫩叶表面,48~72 h后观察叶片的变化情况,以及再生植株是否具有Basta抗性。用DNA小量抽提试剂盒提取再生植株的基因组总DNA,经电泳和分光光度计检测DNA的质量,确保所提DNA能满足PCR扩增的要求。采用TT2基因特异引物组合F35S3N+FBTT2I,以再生植株的DNA基因组为模板检测RNA干扰转化得到的再生植株是否为转基因阳性植株。
检测程序:再生苗检测引物(F35S3N,FBTT2I)94 ℃预变性2 min;94 ℃变性 45 s,58 ℃退火 1 min,72 ℃延伸 45 s,35个循环;72 ℃再延伸 10 min,16 ℃ 10 min。
1.2.3 再生植株T1种籽粒色性状考察和千粒质量的测定 在体视显微镜下转基因阳性种子与阴性种子一同拍照。收获后的T1代种子脱粒去杂质后获得1 000粒种子,然后称质量。不足1 000粒的样本,求平均值后乘以1 000得到千粒质量。
1.2.4 种子切片观察 使用低温冷冻切片机将转基因阳性种子切为 5 mm 薄片,在荧光显微镜下观察测量种皮厚度。
1.2.5 木质素含量测定 木质素含量测定参照Morrison的方法[9],略有更改。称取干燥后种皮 1.0 g,加入95%乙醇中匀浆,上离心机离心后将沉淀物用95%乙醇冲洗3次,再使用乙醇、正己烷配比后的混合液冲洗3次后,使其缓慢干燥。取干燥后材料0.10 g,溶于0.5 mL 25%溴乙酰冰醋酸溶液中,高温恒温水浴一段时间。加NaOH终止反应。再加入冰醋酸和羟胺盐酸,使用冰醋酸作为定容液定容至10 mL,多次离心后取上清液,用紫外分光光度计测定吸光度D值。按回归方程y=0.086 3x+0.088计算种皮中木质素的含量,其中,y为280 nm下的D值,x为种皮木质素的百分含量[10]。
1.2.6 原花青素含量测定 原花青素含量采用香草醛-盐酸法测定:(1)配制显色试剂:A为1%香草醛,B为8%盐酸溶液,显色液为A ∶B=1 ∶1。现用现配。(2)提取物中原花青素含量的测定:种皮匀浆粉碎后,用70%乙醇反复冲洗提取后离心获得上清液定容,从定容液中取1 mL显色分析。(3)分光光度剂测定原花青素含量:取样液1 mL,加入显色剂5 mL,摇匀避光放置,在低温水浴锅中水浴 30 min,取出在500 nm波长下测定其吸光度,按照标准曲线算出样品中原花青素的含量。(4)绘制标准曲线:配制原花青素标准溶液,用乙醇溶解原花青素标样,浓度为0.6 mg/mL,分别取1、2、3、4、5 mL,定容至10 mL,分别从定容液中取 1 mL 加入5 mL显色剂。同样在低温水浴后测得吸光度,绘制标准曲线[11]。(5)计算原花青素百分含量[11]。
1.2.7 转基因植株基因表达分析
1.2.7.1 RNA提取、纯化及反转录 使用华舜公司的植物组织RNA抽提试剂盒,要求提取再生阳性植株的总RNA贮存于-80 ℃。
根据试剂盒指导将提取的总RNA反转录为cDNA。反转录程序为37 ℃ 15 min;85 ℃ 5 s;放于-20 ℃保存或者直接检测cDNA质量。
1.2.7.2 定量Q-PCR检测转基因植株TT2基因抑制水平 分别以野生型甘蓝型油菜和阳性转基因油菜的cDNA为模板,同时采用定量PCR法以引物组合(FBnTT2A,RBnTT2A)检测转基因中TT2基因的表达情况。
2 结果与分析
2.1 RNA干扰材料获得
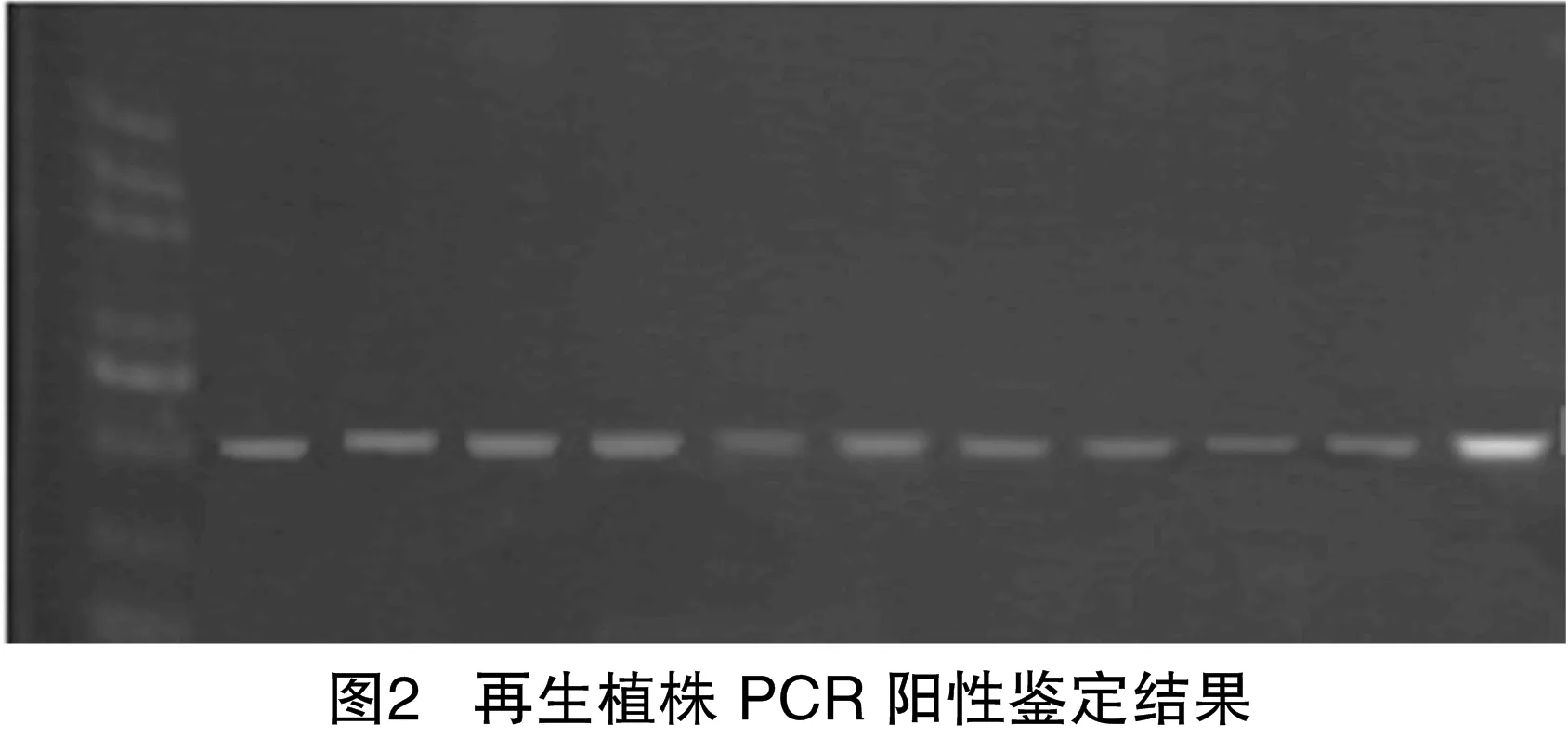
使用浓度为200 mg/L Basta溶液分别涂抹于再生植株嫩叶表面进行抗Basta筛选,48~72 h后观察叶片的变化。转基因植株中载体片段含Basta抗性基因,植株嫩叶有损伤但可自愈;野生植株叶片完全不抗Basta,叶片出现枯萎死亡(图1)。初步筛选阳性转基因植株。对再生植株进行PCR 阳性鉴定,扩增条带为466 bp,与目标条带一致(图2),共筛选到25株阳性转基因苗。

2.2 转基因材料表型鉴定
通过对比发现,RNA干扰转基因植株种皮颜色变浅,呈现红棕色或红褐色(图3)。表明RNA干扰抑制种皮色素合成,色素积累减少,推测种皮中类黄酮代谢途径基因表达抑制。通过对比还发现,种子个体明显变小,千粒质量下降,结实率降低。转基因阳性植株千粒质量 (2.332 g)比野生型植株(2.910 g)平均低0.578 g。阳性植株结实率(37.92%)比野生型植株(54.4%)低16.48百分点。表明RNA干扰技术可能影响种子内容物积累,影响种子结实率与千粒质量。

2.3 种子冷冻切片
为研究RNA干扰TT2基因对种皮的影响,对转基因阳性植株收获种子进行石蜡冷冻切片。荧光显微镜下发现转基因RNA干扰阳性苗种皮厚度明显降低,栅栏组织稀疏。阳性植株种皮厚度均值(44.56 μm)比野生型植株种皮厚度(45.77 μm)低1.21 μm(图4)。表明RNA干扰技术影响种皮厚度,对栅栏层组织形成有影响。

2.4 木质素含量分析
由表1可知,转基因材料种皮木质素含量均值(16.35%)比野生型材料(20.42%)低4.07百分点。表明沉默TT2基因会影响种子种皮中木质素含量。苯丙烷途径包括类黄酮途径和木质素代谢途径,TT2的缺失可能影响到木质素代谢途径中下游靶基因的表达,进而影响种皮中木质素的含量。

表1 木质素含量测定
2.5 原花青素含量分析
由表2可知,转基因植株种皮原花青素含量均值(5.47%)比野生型植株原花青素含量(7.42%)低1.95百分点。花青素特异性积累在内种皮,拟南芥研究表明,AtTTG2基因功能失活后会导致拟南芥种皮由野生型的深褐色种子转变为透明种皮(黄籽)。TT2、TT8、TTG1这3个转录子共同调控幼种中几个类黄酮结构基因在内种皮的表达。这与前面的种皮颜色考察结论一致,进一步证明RNA干扰沉默TT2基因影响种皮色素合成。

表2 原花青素含量测定
2.6 TT2基因组织表达特异性分析
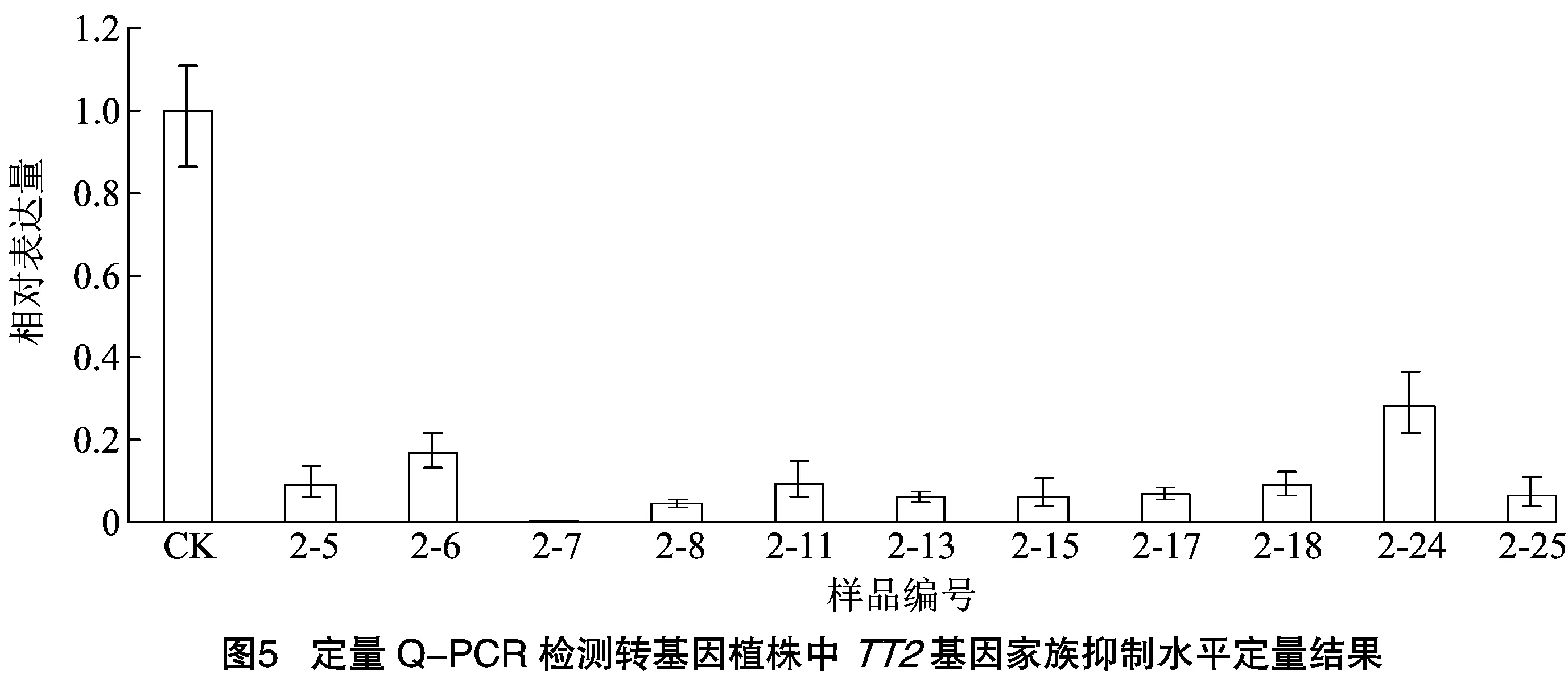
甘蓝型油菜TT2基因在油菜幼种中特异性表达,取花后15 d的幼种,提取RNA反转录得到cDNA,采用荧光定量PCR检测TT2基因表达情况。实时定量PCR检测TT2基因表达结果(图5)显示,转基因阳性植株TT2基因整体表达下调,在个别阳性植株内出现TT2基因表达接近沉默。表明RNA干扰技术可以作为一种有效抑制或关闭目标基因的沉默技术。
3 讨论
TT2基因编码R2R3-MYB蛋白,是调控发育中种子原花青素积累的关键因子,种子特异表达,转录出现在内皮层,主要影响种皮色素沉积和种坯发育[10],决定类黄酮生物合成酶BAN基因的正确表达,影响原花青素生物合成与转运。
本研究采用基因沉默方法,RNAi是由双链RNA介导的特异基因沉默现象,是一种转录后水平基因沉默技术,相对于反义和共抑制技术,沉默效率更高。RNA干扰引发mRNA降解,这种方法可用做于开启或关闭目标基因。在拟南芥与水稻这些模式植物中,RNA干扰技术被用来研究基因功能和产生新的表型[10]。干扰片段在300~500 bp之间的干扰效果最好[11],甘蓝型油菜中TT2基因片段为466 bp。RNAi效率比反义RNA高得多,且稳定性好。植物界基因家族干扰现象很普遍[12-13],RNAi既可用于对不同成员进行分别沉默,也可用于对整个家族进行有效沉默。
本研究使用课题组构建好的工程菌株转化中双10号,得到转基因阳性植株。在转化过程中培养基2周更换1次[14],可以缩短遗传转化周期,减少有毒代谢物质的积累,防止抗生素筛选压失效,减少假阳性苗出现[15]。
本研究表明,RNAi基因沉默TT2基因,导致甘蓝型油菜种皮颜色变浅,种子变小,饱满度减少,结实率降低。分子层面上抑制TT2基因的表达,甚至直接关闭目标基因表达。种皮切片显示,所有转基因阳性植株种皮变薄,栅栏组织疏松,这与TT2基因在种子内种皮特异性表达预测结果[16-17]一致。种皮原花青素含量降低,说明TT2基因缺失导致种皮中色素积累减少,颜色变浅。木质素含量降低,表明木质素代谢途径作为苯丙烷通路的分支受到TT2基因缺失的影响[18],可能与TT2基因调控的下游靶基因关闭有关[19]。这与黄籽与黑籽油菜的区别相一致。
原花青素是油菜种皮黑褐色色素的主要成分,种皮色素越少,种皮颜色更透明,油菜籽初榨油品质更好,色泽更清澈[20]。菜籽饼中色素越低,木质素含量越低,抗营养剂就越少,菜籽油和饼粕的经济价值更高。饼粕蛋白质含量越高,营养成分越容易被动物吸收,为动物成长提供更多的能量。目前世界能源紧张,黄籽油菜高产油量可以提供生物柴油缓解能源危机。通过现代基因工程方法抑制油菜种皮色素积累,阻断类黄酮代谢途径,得到低木质素、低纤维素、低种皮色素和高产优质、稳定遗传的黄籽油菜,具有较高的研究价值和经济价值。RNA干扰作为植物功能基因组研究与发展是一种非常有潜力的技术。构建特异RNA干扰载体沉默甘蓝型油菜种皮色素基因表达为加快黄籽油菜的分子育种进程提供依据[21],将来可更多运用在一些物种提高营养品质、综合品质和抗病抗虫等方面。

